T细胞免疫识别研究进展
2010-07-13吴玉章
吴玉章
T细胞免疫识别研究进展
吴玉章
400038 重庆,中国人民解放军免疫学研究所
免疫识别是疫苗设计的基础。T 细胞免疫识别是预防性疫苗、治疗性疫苗(含负调疫苗)发展的基础。通过 T 细胞受体(T-cell antigen-receptor,TCR)的信号转导的特征是依赖于对表位多肽的限制性识别。所谓限制性是指对呈递多肽(peptide,P)的 MHC 等位基因编码分子(MHC-encoded restricting element,R)的特异性识别(图 1)。这种对 P 和 R 的同时特异性识别方式使得 T 细胞能区分来自细胞内的分子(P)和细胞关联分子,其形成的进化机制可能与病毒感染相关。自从明确 TCR识别的配体是 PR 复合物以来,在 TCR-PR 相互作用机制上就存在两种观点:“altered-self”(改变自我)和“dual recognition”(双重识别)。其中,“altered-self”又称为“Interaction-antigen model”、“New antigen determinant (NAD) model”、“Standard model”(标准模型)、“Single recognitive-multiple receptor model”(单一识别多受体模型)。以上两个模型目前单一识别多受体模型没有被推翻。而双重识别模型因为:①解释的是细胞相关抗原(而非特指胞内抗原);②把 P 和 R 视为各自独立但相联系的靶,但后来证实 P 结合在 R 的多肽结合槽中。因而该模型失去生命力。
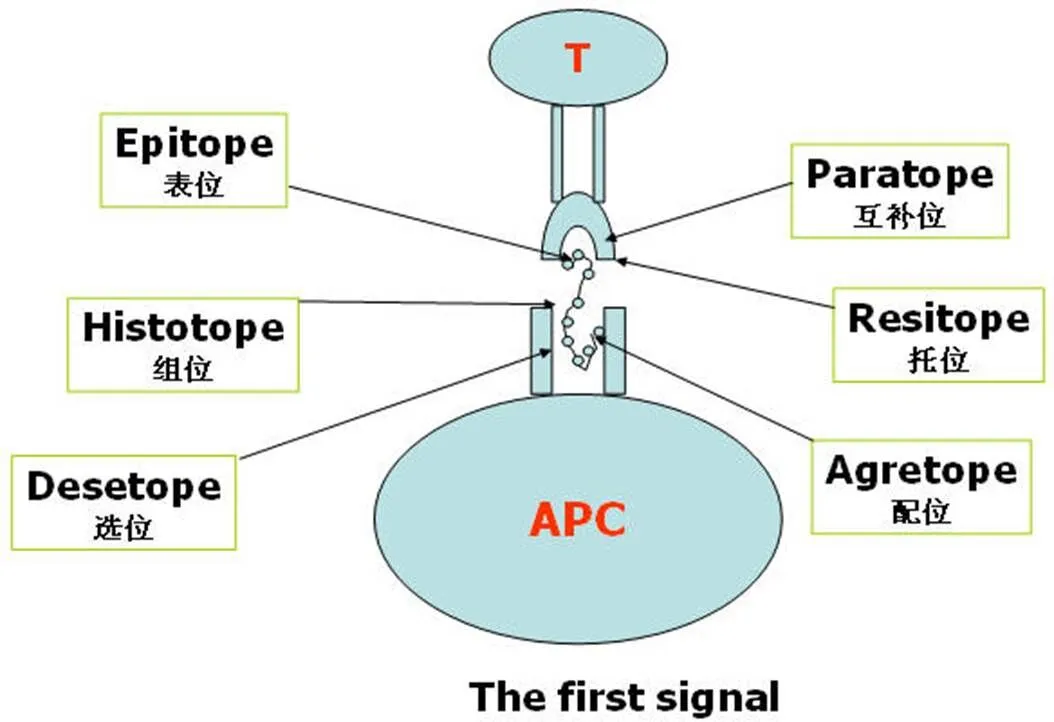
图 1 TCR 识别 PR 复合物,至少有三对配体-受体参与:epitope-papratope、agretope-desetope、resitope-histotope
在单一识别多受体模型里,把 TCR 的配体视为由 MHC 等位基因产物(R)和多肽组成的新的抗原决定簇,这类似于 B 细胞受体(B-cell antigen-receptor,BCR)识别单个结合位点。这个模型指导下的研究得出了不少有价值的结论,如 TCR 分子单个位点的占位水平决定着传入 T 细胞信号质的不同(像阳性选择与阴性选择)。这一模型的缺陷是没能充分显示 MHC 等位基因特异性识别,其中最有力的质疑是存在对于同一受体,却因为占位水平不同而向同一细胞提供不同性质信号的现象。
针对单一识别多受体模型的上述问题,2003 年 Cohn[1]提出了“三位模型”(Tritope model),又称为“多重识别单受体模型”(Multirecognitive- single receptor model)。该模型通过区分开 P 和 R 的识别深化了 TCR 信号的认识。P 被认为是特异性信号,R 被认为是 PR 复合物中形成三维结构或功能稳定的组分。在一个给定的免疫系统中,P 被通过体细胞突变而形成的随机抗-P 库特异性识别;R 则被非随机的胚系选择形成的抗-R库特异性识别;TCR 则整合了 2 种识别信号传入 T 细胞。三位模型假设单一受体只能给细胞传导单一信号。信号的阅读取决于细胞的分化状态。单个受体具有三个识别位点。最终配体的特异性结合必须加和为单一信号(即一个受体—一个信号)。在 TCR 就是把这些结合及相互作用(图 1)加和为一种信号给T 细胞。
1 三位模型的基本假设
⑴每个 VT(variable region of the TCR,VT)基因识别 R 上的 1 个等位基因特异性决定簇(allele-specific determinant on R,a)和1个非可变区的决定簇(invariant determinant on R,i)。TCR 对 a 和i 的识别称为抗-R 且是胚系选择。在每一种属 a 的总数与其编码 a 的不同 VT基因片段数相等。
⑵R上的 a 和i 是 R 类(class)特异性的(如aI,aII,iI,iII)。
⑶其分子对接模式是 TCR 的VαVβ(the variable domain encoded in the Tα-locus,Vα;the gene locus encoding the α–subunit of the TCR,Tα;the variable domain encoded in the Tβ-locus,Vβ;the gene locus encoding the β–subunit of the TCR,Tβ)能与PR在2 个相对的信号转导方向相互作用,其中一个亚基识别a,另一个亚基识别i,与另两个R 上结合多肽结构域或亚基成对位。
⑷抗-P 位点由CDR3α-CRD3β 或者说 (NJ) α-(NDNJ)β 互补形成。抗-P 位点是体细胞选择形成的,而抗-R 则是胚系选择形成的。
⑸对于给定的一个TCR,其两种可能的信号转导模式(方向)是在胸腺中选择的(阳性选择),这使得P-抗P 相互作用在限制性识别中的信号转导中成为必须;与此相反,未经过这一选择的信号转导引起同种异体反应,这一反应信号仅由抗-RA(allo-R, nonself alleles of R,RA)启动,而不需要P-抗-P 参与或者说是P 非特异性的。这暗示信号转导必须由TCR 的两种非结合构象转变来的共同构象中间状态引发。
⑹抗-P 位点是在基因重排形成的,有两种可能构象和由Dβ-阅读框决定。每种构象与信号转导的可能性相对应:阳性选择后限制性识别是以P-抗-P 依赖的方式,而阳性选择本身是P-抗-P 非依赖方式。
⑺P-抗-P 依赖的TCR-PR相互作用引起的限制性反应由构象变化引发:或P 非特异性TCR-PR 相互作用引起的同种异体反应由>或>的构象变化介导。在这两种情况都是关键的信号转导构象中间状态。
⑻TCR 与配体相互作用为T 细胞输送独特的信号,这一信号的解读决定于细胞不同分化状态。所以TCR 是一个“单受体”(一个受体一种信号)。
⑼功能不同的抗-P 和P 表位库的大小数目约105以下。
⑽进化选择决定了锚固P 于R 上的氨基酸残基。锚固位点是在MHC 等位基因决定簇(a)。
2 三位模型概要
TCR 能以 2 种结合模式(信号转导方向)与 PR 结合。胸腺阳性选择出来的模式是介导[P-抗-P]依赖的限制性识别;与此相对应的是未经胸腺阳性选择的模式-介导非[P-抗P]依赖的同种异体反应。同种异体识别不是进化选择的直接结果,因为它没有功能,只是限制性识别机制的副产品。
以上两种信号转导模式是这样产生的:
每个 VT基因片段特异性识别 R 上的 2 个决定簇:识别 MHC 等位基因特异性 a 决定簇和非可变区的i 决定簇。其中 Vα 基因片段定义了识别位于 R 的 W 结构域(或亚基)上 a 决定簇的结合位点,而 Vβ 基因片段定义了 R 的 E 结构域(或亚基)上 a 决定簇的结合位点。这属于胚系基因选择结果。
i 决定簇是 R 的 W 或 E 结构域(或亚基)上标志。Vα 基因片段负责识别 W 结构域(或亚基)的决定簇:aW 和 iW;Vβ 基因片段负责识别 E 结构域(或亚基)的决定簇:aE 和 iE。因此,只存在 2 种信号转导模式:Vα(aW)→ Vβ(iE)或Vβ(aE)→Vα(iW)(见图2、图3)。
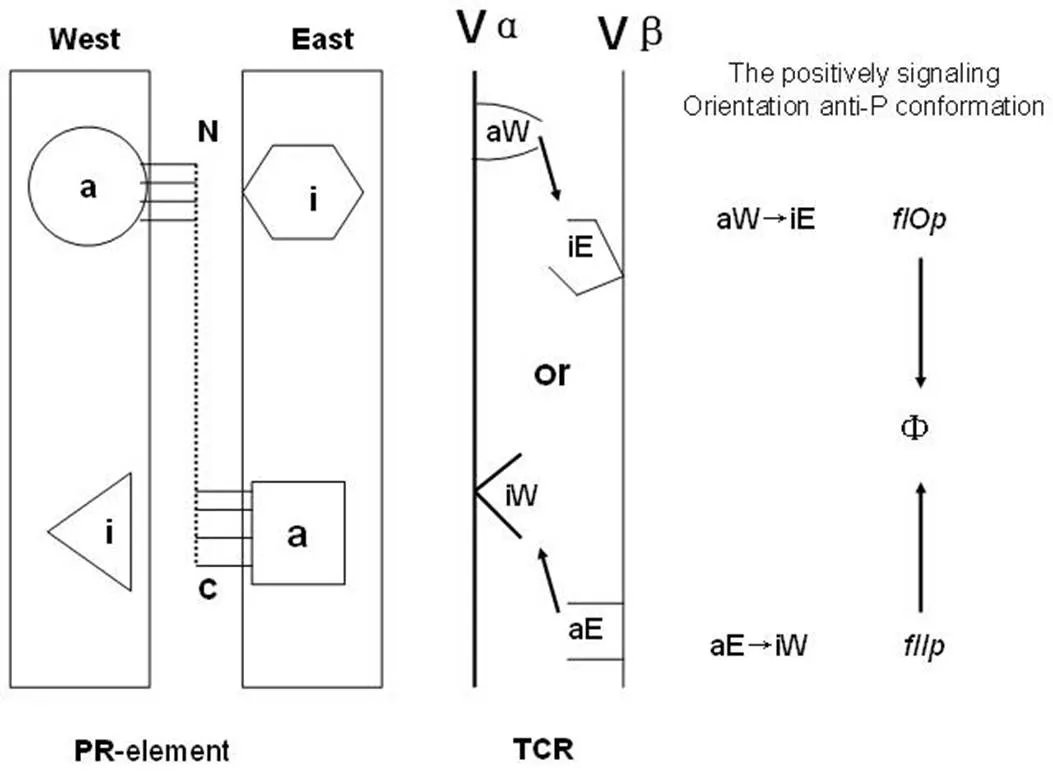
图 2 TCR 信号转导模式及其与构象变化的关系示意[2]
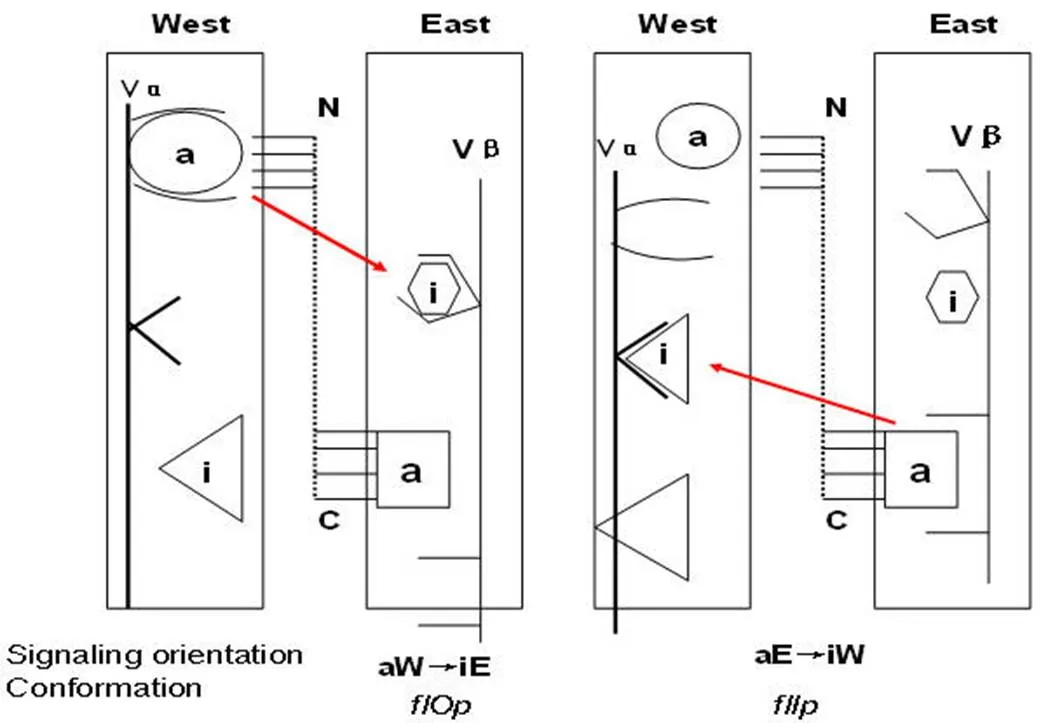
图 3 TCR 与 PR 相互作用后的2种信号转导模式示意[2]

表 1 2 种TCR-PR 信号转导模式和信号转导要求的关系(与图2 互参)
既然i 决定簇是非可变区决定簇,就必须考虑i 决定簇在两类 R,即 RI(class I restricting element,RI)和 RII(class II restricting element,RII)的分布。如果i 决定簇是 RI 或 RII 类特异性,Vα 基因必须能识别[aWI,iWI]或[aWII,iWII],相应的 Vβ 基因必须能识别[aEI,iEI]或[aEII,iEII]。如果是这样,新生儿大概一半的 VαVβ 是有功能的,即能与 R 对接Vα(aWI,iWI)Vβ(aEI,iEI)和Vα(aWII,iWII)Vβ(aEII,iEII),另一半无功能的VαVβ 在胸腺中被忽视而消亡;如果 iW 和 iE 决定簇在 RI 和 RII 是同一决定簇,那么新生儿所有 VαVβ 应当是功能性的。后者相当于没有i 决定簇,TCR 与 a 决定簇的相互作用就足够与 TCR 充分对接,这似乎不大可能,况且最近也推断出了 R 的类的 i 决定簇。
限制性识别、反应的模式是胸腺阳性选择的结果。不论在那种识别模式,限制性反应都依赖 P-抗 P 相互作用,也就是说是P特异性的。但是阳性选择和同种异体反应不需要P-抗 P 的参与(P 非特异性的)。这提示抗-P 位点在阳性选择后以2 种构象中的一种表达功能。其最终结果是对于任何给定的 TCR 分子都存在信号传递方面的不对称性:抗-P 依赖的阳性选择后的限制性识别与抗-P 不依赖的非阳性选择后的同种异体识别。
3 三位模型的进一步解释和修正
为了实现限制性识别,TCR 与 PR 对接首先是[a+c-a](combining site (c) on VTfor a,c-a)然后以对位方式[i+c-i](combining site (c) on VTfor i,c-i)并暴露抗-P 位点。如果[P-抗-P]没有结合上则 TCR 从 PR 解离。这里 TCR 通过i 和 a 与 R 相互作用是必须的以暴露抗-P 位点。[R-抗-R]相互作用表明细胞一定在处理胞内病原,而[P+抗-P]相互作用才启动给 T 细胞的信号(单一受体)。这就是三位模型与标准模型的不同之处:三位模型正确加和了 P 和 R 对识别的贡献,标准模型则认为[PR]相互作用后形成新的复合表位与 TCR 单一位点结合,且 TCR 的占位水平决定了多个可能信号的一种会传给某一特定 T 细胞(多受体)。
3.1 抗-P结合位点
前已述及:TCR 两种不同的信号转导模式与抗-P 构象相关,我们把抗-P 的这两种构象称为 flIp 和 flOp(图2,表1)。flIp 和 flOp 是由 Dβ 阅读框决定的。由于基因重排发生在阳性选择以前,阳性选择就必须定义构象与信号转导模式之间的关系。
在信号转导模式 aW → iE,如果抗-P 位点构象是 flOp,则 TCR 就被阳性选择;在信号转导模式 aE → iW,如果抗-P 位点构象是 flIp,则 TCR 也是被阳性选择。在与 P 相互作用下,抗-P 的构象就转换为通常的信号转导构象状态 Φ,实现信号传导。Φ 是从 flOp 或 flIp 转换来的中间构象状态。
3.2 关于阴性选择
胸腺细胞通过3 个过程“整肃”:
⑴“忽略死亡”(death-by-neglect)。不能识别或不能对接RT(the restricting element mediating positive selection in thymus,RT)的oT[T-cells prior to positive selection (CD4+ CD8+),oT],即没有经过阳性选择的这群细胞会死亡。
⑵限制性识别自身多肽[PSRT](self-peptide,PS)导致凋亡。
⑶任何在限制性识别中具有不正确或不适当构象的 TCR,在阳性选择前或阳性选择中通过与RT的相互作用而被删除,这是[P-抗P]非依赖性的。
假设i 决定簇是 R 类特异性的。那么新生儿 50% 左右的 oT 细胞因为不能与R对接而失去功能。剩下的又有 50% 因为构象错误或不适当而被删除,这样只有 25%(50% × 50%)的细胞进入阳性选择。大约20% 的被阳性选择。所以总体上5%(25% × 20%)的新生儿oT 细胞被阳性选择出来。通过PsRT的抗原特异性删除只占了总体oT 细胞的万分之五(1% × 5%)。最后就只有 5% 的oT 细胞会成为功能性 iT 细胞(T-cell after positive selection,iT)布防在外周。
3.3 关于阳性选择
阳性选择的结果是:
⑴最大化功能性限制性识别的细胞。
⑵建立严格的效应细胞功能与R类识别的关系:eTc(cytotoxic effector T-cell,eTc)是 RI 限制性,eTh(effector helper T-cell,eTh)是 RII 限制性。
⑶清除双重 RT限制性 TCR 和双重 RT限制性细胞,因为这些细胞表达 2 种 TCR(1 Vα + 2 Vβ或1 Vβ + 2 Vα)。
3.3.1 信号通路 以H-2a小鼠为例说明:oT 细胞具有约1 600 种VαVβ 组合(~20 Vβ × ~80 Vα)。有两种可能需要考虑:i 决定簇在RI 和RII 相同(或没有i 决定簇);i 决定簇在RI 和RII 不同(i 决定簇是R 类特异性的)。其差别是前者外周iT 细胞有一半是同种反应性的;后者则所有的外周血iT 细胞是同种反应性的。
与标准模型不同,在三位模型认为[P+抗-P]不参与阳性选择(即非P 特异性的)、但阳性选择的iT 细胞参与限制性识别时则需要[P+抗-P]信号(P特异性的)。考虑到Dβ 基因选择的flOp 或flip 构象,对接信号转导方向为aW → iE[即Vα(aW)Vβ(iE)]的oT 细胞必须是flOp 构象以被阳性选择;如果是flIp 构象则被删除(非P 特异性阴性选择)。与此相反:对接信号转导方向为aE → iW [即Vβ(aE)Vα(iW)]的oT 细胞必须是flIp 构象以被阳性选择,如果是flOp 构象则被删除(非P 特异性阴性选择)。假定i 决定簇是R 类特异性的,在H-2a小鼠有4 群功能T细胞(图4)。

图 4 在H-2a 小鼠阳性选择后的4 群iT 细胞
3.3.2 信号 在三位模型中,oT 细胞的阳性选择只有R-抗-R信号启动而没有P-抗P 信号参与。这就需要胸腺介导阳性选择的细胞被通知结合oT 细胞传导阳性选择信号。这样就建立了R 类的功能关联及限制特异性。
一种机制是TCR 作为R 的配体、R 作为TCR 的受体,其相互作用结果是胸腺细胞给oT 细胞信号,反过来,被告知在与R的相互作用下分化为iTc 或iTh。
鉴于oT 细胞不知道限制特异性,它就必须具备向下分化为iTc 或iTh 之一的能力。胸腺选择细胞应能够送出选择作用是RI 还是RII 的不同信号,oT 细胞则应具备2 种不同的受体以接受RI 或RII 来的信号。可能胸腺细胞向oT 细胞转导信号是通过CD4 或CD8。
3.4 关于同种反应性
同种反应性生理状态下没有功能,所以也不需要、也不是通过直接选择获得。三位模型认为对 RA(allo-R)的耐受或反应都不是 P 特异性的。R 是 T 细胞的特殊抗原,它们不需要处理成多肽才成为信号转导的配体。
同种反应有 3 个特性需要解释:
⑴同种反应和限制性反应涉及的 R 等位基因相同。同种反应是 R 等位基因特异性的,这就象在限制性识别一样。
⑵同种反应频率高。对于一个给定的 allo-R 等位基因,大约 1% 的阳性选择后限制性识别的T 细胞会反应。这与[PR]限制性识别只有万分之一 T 细胞有很大反差。
⑶限制性识别的 R 类限制性与效应细胞功能关系很严格。在同种反应这一关系也同样严格。
三位模型对这 3 个现象的解释是:
胚系编码的(Vα+Vβ)识别 R 等位基因,胚系编码的(Vα+Vβ)是VT基因形成的单一库,以[P+抗-P]非特异性的方式参与同种反应,这就决定了同种反应的高频性,也决定了同种反应与限制性识别同样严格受R 等位基因限制。
所有 TCR 在阳性选择后,功能转变为限制性识别,这是合适识别模式(信号转导方向)依赖的。如果识别模式是另一种则具有可能介导同种反应潜能。但是,如果这种潜能直接变成同种反应性,则 R 类与效应细胞功能关系会放松、变得不严格。有 2 种解释:
⑴假定i 决定簇是 R 类特异性的:iEI、iwI、iEII、iWII。在这种情况下,只有与 R 的 a 和i 相配的 TCR 能对接 R。也就是 2 种组合 Vα(aWI,iWI)Vβ(aEI,iEI)或Vα(aWII,iWII)Vβ(aEII,iEII)是功能性的、是同种反应性的、也是 R 类特异性的。这种解释提示大概半数的从头选择的 TCR 不能经过阳性选择并被 die-by-neglect。任何在不充分的同种反应可能因 I 类和 II 类 R 分子间的顺式相互反应的叠加或 V-基因片段编码的某些信号的混合所导致。
⑵假定i 决定簇是 R 类共有的或i 决定簇根本不存在。阳性选择授予 R 类表型功能:eTc 是 RI 限制性的、eTh 是 RII 限制性的。这依赖于 eTc 表达 CD8、eTh 表达 CD4。所有oT细胞的TCR都具有经过阳性选择的潜能,但只有一半是同种反应性的。任何不充分的同种反应可能是 CD4、CD8 介导效应不充分所致。
阳性选择建立起 P 特异性的限制性识别。在aW → iE 信号转导方向,VαVβ 与抗-P 是 flOp 构象,需要 P 的信号才能传入细胞。但在另一信号转导方向 aE → iW,因为是 flIp 构象或引起 flOp → Φ → ‘flIp’ 的构象变化,当 allo-R 参与后,就不依赖[P-抗-P]而向细胞内传入信号。这表明 TCR 的 2 种对接方式不对称。这种不对称适应在缺少[P-抗-P]情况下引发同种反应所需要的构象改变。
构象变化flOp → Φ → ‘flIp’(或相反)的重要性有:①在阳性选择,oT 细胞表达的构象与选择方向相反(aW → iE 是flip 或aE → iW 是flOp)就被删除。大约有 50% 通过 TCR 选择的 T 细胞在阳性选择中被删除是通过这种构象变化实现的;②表达 2 种 TCR 的细胞(1Vα+2Vβ 或1Vβ+ 2Vα)将被删除。因为同一个信号方向可能被选择,但在相反信号方向被删除。
应区分同种反应性(alloreactivity)与同种限制性(allorestriction)。同种限制性是指 P 特异性识别是在同种等位基因决定簇伴随下给 T 细胞输送信号;而同种反应性则仅是通过特异识别同种等位基因决定簇就输送信号给 T 细胞,不需要抗-P 位点的参与。
同种反应细胞不能从阳性选择而来。可能通过胸腺外的一种古老方式而不需要 oT 细胞选择而成熟。同种限制性细胞在个体是没有功能意义的,但在实验中可通过给予强抗原性[PRA]选择压力而激发其同种限制性。但这些实验没能同种反应性细胞是否抗-P 依赖。
3.5 a,i,c-a 和 c-i 位点的拓扑学
ii 决定簇在每类R 都在固定位置。为了使 TCR 同时能结合 a 和i,a 就必须处在 TCR 折叠后可及的位置。对于一个大的 VT 基因库有1 000种 VαVβ,每种都能与 R 以两种结合模式(限制性识别和同种反应)中的任何一种对接,那么 TCR-R 的相互作用都需要固定的 a 和 i 结合的拓扑。进一步还需要有需要[P-抗P]信号的限制性识别模式和不需要[P-抗P]信号的限制性识别模式的同种反应的拓扑。也就需要有上述 2 种模式、flOp、flIp 两种构象的非对称性。在阳性选择后,不管是 flOp 构象还是 flIp 构象,TCR 不但需要 RT 选择性参与也需要[P-抗-P]作用以启动能传导信号的 Φ 构象。
构象转换的具体细节是重要的。在不需要[P-抗P]信号的情况,[RT-抗-RT]的亲和力应足够低以允许快速解离。为什么在没有[P-抗P]信号,allo-R(RA)的作用能转导信号?如果构象和模式适合限制性识别(见表1,图2),[RT+抗RT]相互作用是低亲和力的,如果aW → iE 方向是flOp 构象,aE → iW 方向是flIp 构象,加上[P-抗P]相互作用,配合[RT+抗RT]作用,则使构象进入Φ 状态,从而形成低解离的稳定的[TCR-PR]结合状态。这里[P+抗P]的参与使得低亲和力的[RT+抗RT]相互作用转变为高亲和力的[TCR-PR]结合状态。如果构象和模式不适合限制性识别(见表1,图 2),既aW → iE 方向是flIp 构象,aE → iW 方向是flOp 构象,[RA+抗RA]诱导[P+抗P]非依赖性的Φ 构象转变和稳定的[TCR-RA]结合。
3.6 关于Φ
⑴Φ 的半衰期
[P-抗P]主导的限制性识别会形成足够长时相 Φ 构象状态以便进行下一步-与靶形成突触。这是相对缓慢的过程,即使只有少数 TCR 参与也能工作。与此不同,同种反应是[P-抗P]非依赖的,flOp → Φ → ‘flIp’ 或 flIp → Φ →‘ flOp’ 构象转变会产生 Φ 构象状态,进一步通过 2 种方式中的 1 种进入下一步。第一,半衰期很短但通过数目众多 TCR 的参与而得到补偿;第二,形成假构象,‘flIp’(pseudo-flIp)、‘flOp’(pseudo-flOp),形成的 Φ 构象状态就时间长,这样半衰期就类似于[P-抗P]主导的那样长。
⑵T 细胞阅读Φ构象状态而启动信号转导
有 2 种可能:每种构象变化都能被胞膜内侧直接阅读;构象变化使 TCR 形成多聚物而被细胞内侧阅读。
TCR 与 PR 的结合获得 Φ 构象状态可能直接或在 TCR-CD3 复合物形成后,将信号传递到 CD3 并激活 CD3 通路传递信号。目前还没有跨膜传递构象信号的证据,已有的证据支持第 2 种可能。
3.7 关于抗P 库
抗P 库是体细胞生成并随机识别自我与非我。原则上每个阳性选择的VαVβ 对都可能成为抗-P 库。表位有~105,抗-P 库也是~105,这是个“封顶”的库。
R 结合约 10 个 AA 的肽。每个肽有 2 个进化选择,而获得固性残基的2 个锚:1 个是结合在 N 末端的 W 结构域或亚基,另 1 个是结合在 C 末端的 E 结构域或亚基。抗-P 识别的肽序列库应与每个 R 相当,但不依赖于 R 识别的锚固性残基种类。假定识别 5 个氨基酸残基能定义 1 个表位,且 20 个可能氨基酸替换时只有一半导致产生功能不同表位,就可推算 T 细胞功能不同的表位库就在~105数量级,起码不多于 106,不少于104。这个表位库被含~105不同功能抗-P 库所识别。从基因多样性计算,如果抗-P 是 (NDNJ)β 和 (NJ)α 互补形成,那么组合就有 Jα × DβJβ × 30,组合就在~105数量级。
抗-P 库实际应该包括激动剂和阻断剂。一种给定的 TCR 的激动剂可被看作另外一个TCR 的阻断剂。但是阻断剂又不明显引起 Φ 构象状态。结合 R、不结合抗-P,与结合 R 而不被 TCR 识别这 2 种情况不能很好区别,这是 iT 细胞通常有的情况。现在还不清楚阻断剂是不是激动剂的竞争性抑制剂,如果阻断剂能特异性结合抗-P 位点又不启动构象变化,那么激动剂和阻断剂在正常的稳定多肽负载状态的意义就成为重要的问题。
目前免疫识别机制包括多肽与 R 的结合和 TCR 的识别,使得病原体在识别这一环节逃逸的概率很小,可能病原体逃逸是颠覆了效应细胞功能,通过抗原非特异性方式颠覆了多肽呈递机制,或者使免疫细胞功能失活。也必然有少数病原体在识别环节逃逸,不能被抗-P 识别或者不能提供 R 结合的多肽。选择性压力依然存在,况且从来不会完美。
三位模型解释了为什么体细胞突变对抗体多样极端重要,但对 TCR 库却没有贡献。在已经“封顶”的抗-P库,任何特异性的突变只会变成已经存在的另一种特异性,突变不会带来新东西。
3.8 关于区分自我(self,S)-非我(non-self,NS)
给定表位库~105、每种动物 T 细胞系统表达 105不同蛋白,每种蛋白在胚系都表达,也就都表达了整个表位库。那么,区分S-NS 的基础是什么?
“自我”是自动生成的 PSRT复合物。通过进化选择,其中只有一部分自动生成的PR 复合物是作为“自我”的PSRT。S 必须有个PSRT在细胞膜表面表达密度的域值。如果 1% 的 P 库是自身(Ps),那么 1 × 103的 P 是 S,9.9 × 104的 P 是 NS。S 的密度域值不但与耐受有关,也与反应有关。为了应对细胞内病原(ns),必须在细胞表面有超过域值密度的[PnsRT](nonself-petide,Pns)。
以病毒为例,免疫系统只能在细胞膜上的病毒多肽足够高密度多肽时(即超过域值)才会反应。进化的压力会让病毒保持低于域值的密度。病毒会借用细胞内的合成机器复制,如果复制过快,则细胞膜上病毒多肽密度会升高并活化 iT 细胞。诱导生成的效应 T 细胞(effector T-cell,eT)可能需要同样密度域值启动效应功能。而在自身免疫则密度域值要低一些。实验研究发现,效应细胞的密度域值比耐受或活化的密度域值低一些。病原体表位也会是内源生成多肽库的一部分,密度在域值以下则是耐受状态。这样看来效应细胞的密度域值就是一个进化相关的两难选择:域值低于自身免疫则在清除病原时有可能引起自身免疫;域值与耐受接近则不容易引起自身免疫,但病原体已经不是早期阶段了。这个矛盾在肿瘤也存在。
iT 是区分自我-非我的惟一阶段。eT 细胞是免疫效应的惟一阶段。因为 iT 和 eT 分别与其相应靶细胞作用,前面述及的信号转导都适合于这2 个分化阶段的细胞,不同的是这 2 种分化状态细胞对 TCR-PR 相互作用的信号解读。
3.9 所提出的构象转换逻辑
为什么有 2 种信号转导模式(aW → iE 和aE → iW)?
进化选择使得 RII 的 W 和 E 亚基互补识别表位的概率很高。VαVβ 识别单一的 RII 亚基是必须的,Vα 识别 RII 的 W 亚基上的等位基因特异性决定簇,Vβ 识别 RII 的 E 亚基上的等位基因特异性决定簇,功能优化就要求 TCR 在 2 个方向(2 种模式)与 R 结合:Vα(aW)→ Vβ(iE)或Vβ(aE)→ Vα(iW)。
为什么 2 种结合模式(信号转导)方向需要 flOp 和flIp 两种起始构象?
一个受体只转导一种信号。这种信号必须由与 TCR 相互作用而形成的构象而引发。每种结合模式的相应构象 flOp 和 flIp 必须能够在[P-抗-P]参与后转换为共同构象 Ф,后者启动限制性识别反应。
同种反应性是 TCR 与 R 相互作用的结果:识别模式(信号转导方向)和构象不协调。阳性选择去除不协调构象有其单独机制。
[1] Cohn M. The tritope model of restrictive recognition by TCR. Trends Immunol, 2003, 24(3):127-131.
[2] Cohn M. The Tritope Model for restrictive recognition of antigen by T-cells I. What assumptions about structure are needed to explain function? Mol Immunol, 2005, 42(12):1419-1443.
2009-10-15
10.3969/cmba.j.issn.1673-713X.2010.02.001
