尖晶石LiCoxMn2-xO4的电化学阻抗谱分析
2010-07-05崔永丽谭晓晓庄全超
崔永丽,谭晓晓,庄全超
(中国矿业大学材料科学与工程学院,江苏徐州 221116)
尖晶石LiMn2O4在循环过程中的容量衰减较快,特别是高温循环性能较差,阻碍了其进一步应用[1]。通过掺杂稳定LiMn2O4的尖晶石结构,可解决循环容量下降的问题[2]。
Co能在尖晶石 LiCoxMn2-xO4中以三价形式存在,可提高掺杂 LiMn2O4中Mn的平均氧化态,抑制Jahn-Teller畸变;且Co3+的半径与Mn离子相近,掺杂后不会导致晶格过度扭曲而使稳定性下降。本文作者用Co3+掺杂,对尖晶石LiMn2O4进行改性,并通过电化学阻抗谱(EIS)深入理解Li+在Co掺杂改性LiMn2O4中的交流阻抗行为。
1 实验
1.1 正极材料LiCoxMn2-xO4的制备
用溶胶-凝胶法制备 LiCoxMn2-xO4(x=0.1、0.2、0.3和 0.4)。 将 C6H8O7◦H2O(上海产,AR)、Co(NO3)2◦6H2O(上海产,AR)、C4H6MnO4◦4H2O(上海产,AR)和 Li2CO3(上海产,AR)按物质的量比2(2-x)∶2x∶2(2-x)∶1放入烧杯中,加入适量的蒸馏水溶解。将烧杯放入水浴锅中,加热至80℃,加入氨水(徐州产,25%~28%)调节 pH值至6~7,发生较剧烈反应,同时搅拌至形成胶状固体。将胶状固体在100℃下烘干12 h,再在350℃下灼烧2~3 h,冷却后,在玛瑙碾钵中研磨,得到前驱体。将前驱体转入坩埚,在马弗炉中、750℃下灼烧24 h,自然冷却后,研磨、过200目筛,备用。
1.2 电极的制备
将制备的 LiCoxMn2-xO4或商品 LiMn2O4(东莞产)、导电剂炭黑(上海产)和AGP-3石墨(深圳产)按质量比 80∶12∶3混匀,在80℃下真空(真空度为0.1 MPa,下同)烘干12 h;将0.01 mm厚的铝箔(深圳产)依次用超纯水和丙酮(徐州产,99.5%)超声波清洗10 min,自然晾干,备用。
将聚偏氟乙烯(美国产)与N-甲基吡咯烷酮(上海产,AR)按质量比 1∶15混合后,以 2 000 r/min的转速搅拌1 h,超声溶解30 min,将烘干后的混合物加入,再以2 000 r/min的转速搅拌1 h,得到正极浆料,并立即均匀涂覆到处理后的铝箔上。将涂膜后的电极片在鼓风干燥箱中、60℃下干燥4 h,再在120℃下真空烘干12 h,然后以15 M Pa的压力压制5 min,移入充满氩气的手套箱中,备用。
1.3 实验电池的组装和性能测试
在充满氩气的手套箱中组装CR2032型扣式实验电池。双电极电池以金属锂片(天津产,99.9%)为负极,Celgard 2300膜(美国产)为隔膜;三电极电池以金属锂片为参比电极和对电极。在2XZ-2B电池测试仪(深圳产)上进行充放电测试,电流为0.5 mA,电压为3.30~4.30 V;在CHI660B电化学工作站(上海产)上进行测试,用Zview软件模拟 EIS谱。
2 结果与讨论
2.1 充放电性能
实验电池的首次充放电曲线见图1。
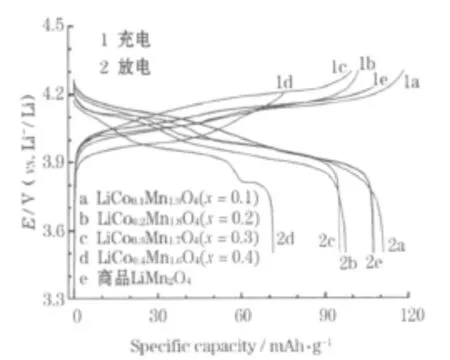
图1 实验电池的0.1 C首次充放电曲线Fig.1 0.1 C initial charge-discharge curves of experimental cells
从图1可知,尖晶石LiCo0.1Mn1.9O4的首次充放电曲线上均存在两个明显的电位平台,高电位平台在4.05~4.20 V处,低电位平台在3.80~4.00 V处,与纯 LiMn2O4中Li+的脱出和嵌入分两步[3]进行一致,也进一步证明Co掺杂未改变LiMn2O4的晶体结构。随着 x的增加,充放电曲线上的两个平台逐渐融合,几乎观察不到Li+的两步脱出和嵌入。商品化的LiM n2O4也存在两个较明显的充放电平台,充放电曲线与 x=0.2、0.3时接近。随着 x的增加,首次充电比容量逐渐减小。文献[4]认为,这可能是因为随着掺杂量的增加,在一定程度上改变了尖晶石LiMn2O4的三维隧道空间结构,结构的改变也影响了循环性能。
商品 LiM n2O4、合成的 LiCoxMn2-xO4(x=0.1、0.2)的循环性能见图2。
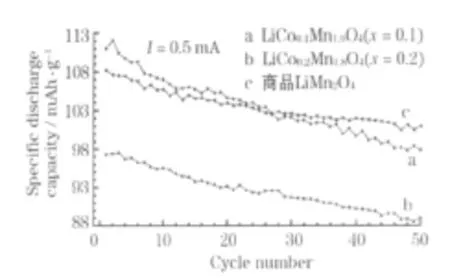
图2 商品 LiMn2O4、合成的 LiCoxMn2-xO4(x=0.1、0.2)的循环性能Fig.2 Cycle performance of commercial LiMn2O4,synthesized LiCoxM n2-xO4(x=0.1,0.2)
从图 2可知,当 x=0.1时,首次和第 50次循环的放电比容量分别为112.0 mAh/g、97.8 mAh/g,容量保持率为88.3%;当 x=0.2时,首次和第50次循环的放电比容量分别为 97.4 mAh/g、89.0 mAh/g,容量保持率为91.8%;商品LiMn2O4首次和第50次循环的放电比容量分别为108.2 mAh/g、100.9 mAh/g,容量保持率为 92.5%。LiCo0.1Mn1.9O4的比容量高于商品 LiMn2O4,但循环性能略差;LiCo0.2Mn1.8O4的循环性能接近商品LiMn2O4,但比容量偏低。
2.2 EIS研究
2.2.1 EIS谱的基本特征
室温下,LiCo0.1Mn1.9O4(即x=0.1)正极首次充电过程中的 EIS谱见图3。
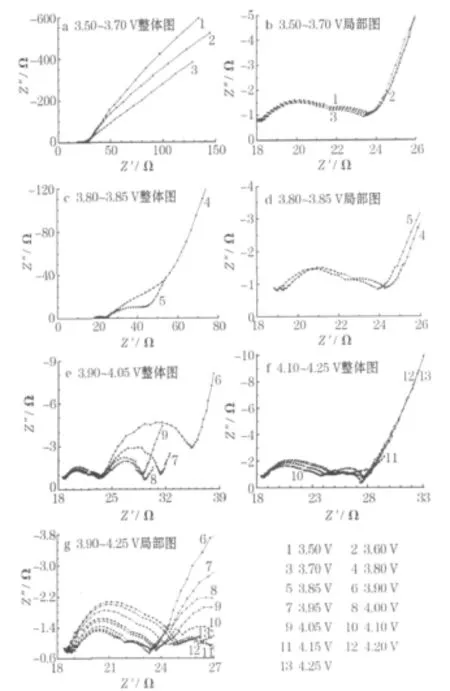
图3 LiCo0.1Mn1.9O4正极首次充电过程中的EIS谱Fig.3 EIS plots of LiCo0.1Mn1.9O4cathode in initial charge process
从图3可知,室温下LiCo0.1Mn1.9O4正极的首次充电过程中,3.50 V时的EIS谱由高频区域1个拉长的半圆、中频区域的一段小圆弧和低频区域的斜线等3部分组成。随着电极电位的提高,中频区域圆弧的半径减小,至3.85 V时变为一个较完整的半圆。这与文献[5]的结果一致:高频区域的半圆与固体电解质相界面(SEI)膜的形成有关,中频区域的半圆与电荷传递过程有关,低频区域的斜线反映了Li+在固体中的扩散,更低频率的部分反映了Li+在晶格中的累积。
从图3还可发现,在电极电位进一步升高的过程中,高频区域压扁拉长的半圆从3.80 V时开始分裂为1个半圆和1段圆弧;至3.85 V时,EIS由完全相互分离的4个部分组成:高频区域(>103Hz)的1个半圆(HFA)、中高频区域(103~10 Hz)的 1段圆弧(HMFA)、中频区(10~1 Hz)的半圆(MFA)及低频区域(<1 Hz)的直线。3.90 V时,HFA和HMFA发生部分重叠,至3.95 V时,HFA和HMFA又重新融合为一个拉长压扁的半圆。这个独特的现象很少见[6]。随着电极电位继续升高,MFA的半径增大,逐渐变为圆弧。上述现象表明,掺杂后的尖晶石正极EIS图的高频区域压扁拉长的半圆由两个半圆重叠而成,包含两个时间常数;在大多数情况下,这两个时间常数不能分离成两个独立的半圆[6],因此文献[5]将其仅归因于Li+在SEI膜中的迁移是不全面的。庄全超等[7]证实,在LiCoO2正极充放电过程中,EIS谱的HMFA与LiCoO2的电子电导率有关。虽然掺杂尖晶石与 LiCoO2的导电机理不同,但都是半导体,且在Li+嵌脱过程中,电子电导率都会随电极电位的升高或降低可逆地增大和减小[8],因此,HMFA可能与材料的电子电导率有关。
2.2.2 等效电路
根据以上实验结果,对尖晶石LiCo0.1Mn1.9O4正极首次充放电过程通过等效电路(见图4a)用Zview软件进行模拟,结果见图4b。
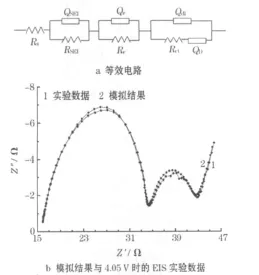
图4 LiCo0.1Mn1.9O4正极首次充放电过程中EIS的等效电路及模拟结果Fig.4 Equivalent circuit of EIS for LiCo0.1Mn1.9O4cathode in initial charge-discharge process and simulating results
图4a中,Rs代表欧姆电阻,RSEI、Re以及 Rct分别代表SEI膜的电阻、电子传输电阻和电荷传递电阻,SEI膜的电容CSEI、电子电阻的相关电容 Ce、双电层电容 Cdl以及扩散阻抗分别用恒相角元件(CPE)的SEI膜膺电容 QSEI、电子传输膺电容 Qe、双电层膺电容 Qdl和与扩散相关的膺电容QD来表示。
从图4b可知,实验数据曲线与拟合曲线重叠得较好,各等效电路参数的拟合误差都小于15%。
2.2.3 充放电过程EIS的等效电路分析
室温下,尖晶石 LiCoxM n2-xO4(x=0.1、0.2)正极在首次充放电过程中的 RSEI见图5。
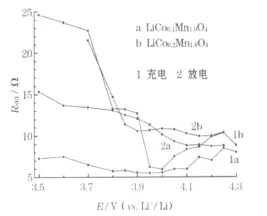
图5 LiCoxMn2-xO4(x=0.1、0.2)正极在首次充放电过程中的RSEIFig.5 Resistance of SEI film(RSEI)of LiCoxMn2-xO4(x=0.1,0.2)cathode in initial charge-discharge process
从图5可知,x=0.1时,在首次充电过程中3.95 V以上及首次放电过程中在3.85 V以上,RSEI随电极电位的变化改变很小,说明SEI膜主要由电极和电解液接触过程中电极活性材料与电解液组分之间的自发反应形成,充放电过程对SEI膜的影响不大,与吕东生等[9]用粉末微电极测试的结果一致,也说明电极大小对SEI膜电阻的形成影响不大。在充电过程中,当电极电位在3.95~3.70 V时,SEI膜的阻抗逐渐增大;在3.70 V以下,SEI膜阻抗基本保持不变。在放电过程中,当电极电位在3.85 V左右时,SEI膜阻抗迅速增大。文献[3]认为,SEI膜阻抗在3.95 V附近增大可能是由于Li+嵌入过程中,尖晶石正极材料颗粒膨胀,导致尖晶石型晶体结构发生畸变造成的。此外,x=0.1时,放电过程的RSEI比充电过程大,即Li+的脱出比嵌入更容易,造成了容量衰减。
从图5可知,x=0.1、0.2时,在充放电过程中 RSEI随电极电位的变化总体上表现为随电极电位升高而降低,与纯相尖晶石LiMn2O4正极首次充放电过程中的 RSEI[10]相比较高,表明Co掺杂会导致电极界面SEI膜阻抗增大。与 x=0.1相比,x=0.2时充放电的 RSEI值相差不大,重合性较好,表现为不可逆容量较小,电化学可逆性较好。这进一步说明,x=0.2时具有相对较好的电化学性能。
室温下,尖晶石 LiCoxM n2-xO4(x=0.1、0.2)正极在首次充放电过程中的 Re见图6。
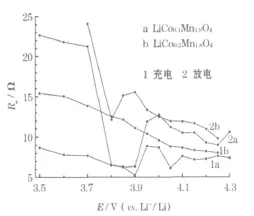
图6 LiCoxMn2-xO4(x=0.1、0.2)正极在首次充放电过程中的ReFig.6 Electron transfer resistance(Re)of LiCoxMn2-xO4(x=0.1,0.2)cathode in initial charge-discharge process
从图6可知,在室温下,Re总体表现为在充电过程中随着电极电位的升高而减小,在放电过程中随着电极电位的降低而增大,与文献[6]报道的纯尖晶石LiM n2O4在嵌脱锂过程中电子电导率会可逆地增大和减小基本一致,进一步证实中高频区域的半圆应归属于材料的电子性能。与 x=0.1相比,x=0.2时 Re重合性较好,即电化学可逆性较好,与RSEI的变化规律一致。
室温下,尖晶石 LiCoxMn2-xO4(x=0.1、0.2)正极在首次充放电过程中的 Rct见图7。
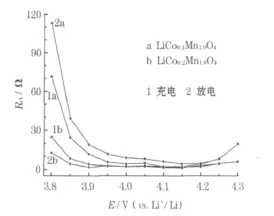
图7 LiCoxMn2-xO4(x=0.1、0.2)正极在首次充放电过程中的RctFig.7 Charge transfer resistance(Rct)of LiCoxMn2-xO4(x=0.1,0.2)cathode in initial charge-discharge process
如假定不存在嵌入电极的Li+之间和Li+与嵌锂空位之间的相互作用,Rct与嵌锂度 x的关系如式(1)[6]所示。
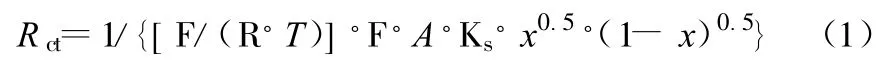
式(1)中,F为法拉第常数,R为气体常数,T为热力学温度,Ks为标准速率交换常数,A为具有电活性的电极表面积。
从式(1)可知,当 x→0或1时,Rct快速增大,当 x→0.5时,Rct减小,即在充放电过程中,Rct随电极电位升高表现为先减小,后增大。图7中,室温下 Rct随电极电位的变化均与式(1)基本相符,证实中频区域半圆是与电荷传递过程相关的半圆。在3.90~4.10 V,Rct几乎不随电极电位的变化而改变,是由于存在嵌入电极的Li+之间和Li+与嵌锂空位之间的相互作用。与 x=0.1相比,x=0.2时 Rct更大,原因可能是 x较大时有微量杂质相,导致Li+传递受阻。
3 结论
采用溶胶-凝胶法合成尖晶石LiCoxMn2-xO4(x=0.1、0.2、0.3和0.4),少量的掺杂对尖晶石结构的影响不大;但随着Co掺杂量 x的增加,正极材料的循环性能均有所提高,但首次放电比容量下降,同时也逐渐改变了尖晶石三维隧道空间结构。
尖晶石LiCo0.1Mn1.9O4正极材料EIS的高频区域拉长压扁的半圆由两个半圆重叠而成,分别归属于Li+通过SEI膜的迁移和尖晶石LiMn2O4材料的电子电导率;EIS的等效电路分析结果表明,首次充放电过程中,在3.95~3.70 V,SEI膜阻抗增大,可能是Li+嵌入过程中,尖晶石正极材料颗粒膨胀,导致尖晶石型晶体结构发生畸变造成的。随着电极电位的升高,电子传输电阻 Re总体减小,电荷传递电阻Rct先减小,后增大。
[1]WEI Min(卫敏),LU Yan-luo(路艳罗),YANG Wen-sheng(杨文胜),et al.锂离子二次电池锰系正极材料[J].Chemistry(化学通报),2002,(8):516-526.
[2]YAN Li-yun(严立云).锂离子电池正极材料LiMn2O4的合成与表征[D].Changchun(长春):Jinlin University(吉林大学),2005.
[3]ZHUANG Quan-chao(庄全超),FAN Xiao-yong(樊小勇),XU Jin-mei(徐金梅),et al.尖晶石锰锂氧化物电极首次脱锂过程的EIS研究[J].Acta Physico-Chimica Sinica(物理化学学报),2006,22(2):234-238.
[4]Park S B,Shin H C,Lee W G,et al.Improvement of capacity fading resistance of LiM n2O4by amphoteric oxides[J].J Power Sources,2008,180(1):597-601.
[5]Aurbach D,Gamolsky K,Markovsky B,et al.The study of surface phenomena related to electrochemical lithium intercalation into LixMOyhost materials(M=Ni,Mn)[J].J Electrochem Soc,2000,147(4):1 322-1 331.
[6]ZHUANG Quan-chao(庄全超),WEI Tao(魏涛),WEI Guo-zhen(魏国祯),et al.尖晶石LiM n2O4中锂离子嵌入脱出过程的电化学阻抗谱研究[J].Acta Chimica Sinica(化学学报),2009,67(19):2 184-2 192.
[7]ZHUANG Quan-chao(庄全超),XU Jin-mei(许金梅),FAN Xiaoyong(樊小勇),et al.LiCoO2正极电子和离子传输特性的EIS研究[J].Chinese Science Bulletin(科学通报),2007,52(2):147-153.
[8]Nishizawa M,Ise T,Koshika H.Electrochemical in situ conductivity measurements for thin film Li1-xMn2O4spinel[J].Chem Mater,2000,12(5):1 367-1 371.
[9]LU Dong-sheng(吕东生),LI Wei-shan(李伟善).尖晶石锂锰氧化物锂离子嵌脱过程的交流阻抗谱研究[J].Acta Chimica Sinica(化学学报),2003,61(2):225-227.
[10]ZHUANG Quan-chao(庄全超).锂离子电池电极界面特性研究[D].Xiamen(厦门):Xiamen University(厦门大学),2007.
