白羊草真叶愈伤组织诱导和植株再生
2010-06-18于娜董宽虎
于娜,董宽虎
(1.山西省林业职业技术学院 园林系,山西 太原 030009;2.山西农业大学 动物科技学院,山西 太谷 030801)
白羊草真叶愈伤组织诱导和植株再生
于娜1,董宽虎2
(1.山西省林业职业技术学院 园林系,山西 太原 030009;2.山西农业大学 动物科技学院,山西 太谷 030801)
在已建立白羊草无菌苗体系基础上,采用7日龄真叶为外植体,进行组织培养,目的在于建立更多受体材料,完善白羊草植株再生体系。结果表明,在愈伤诱导阶段KT的作用明显,其与2,4-D的交互作用优于ABA与2,4-D,也高于单独使用2,4-D,在2,4-D 1.0 mg◦L-1+KT 0.5 mg◦L-1时诱导率最大,达到93.45%;分化阶段6-BA 0.1 mg◦L-1与NAA 0.04-0.06 mg◦L-1的激素组合中分化率差异不明显;12 d左右产生丛生芽,以先长芽,后长根的方式开始发育,3~4周形成绿色分化植株,即可炼苗后移栽,植株生长良好。
白羊草;真叶;胚性愈伤;植株再生
白羊草(Bothriochloa ischaemum)是禾本科孔颖草属多年生草本植物[1],是优良的牧草和水土保持植物,具有固土保水,生活力强,高产耐牧、耐践踏,适口性强等优点,是饲用价值较高的放牧型禾本科草类之一,广泛分布于我国暖温带落叶阔叶林地带,是控制水土流失和维持丘陵山地的原生态平衡的重要草种[2,3]。
目前关于白羊草组培再生体系的研究较少,仅20世纪90年代肖辅珍等[4]分别以白羊草成熟胚和幼穗为外植体进行了愈伤诱导,继代增殖转至无激素培养基诱导再生植株,转至之前愈伤组织的生长状态直接影响再生植株的诱导频率。本研究在以白羊草成熟胚为外植体材料,成功建立植株再生体系的基础上[5],以真叶切段作为材料,进行了不同诱导培养基对真叶切段愈伤组织形成和再生苗分化条件的研究,以期为白羊草再生体系的建立提供更多受体材料,并建立愈伤组织形成和植株再生的试验体系。
1 材料与方法
1.1 材料
供试的白羊草种子2006年10月采自山西省太谷县凤山,海拔1100 m,植被为喜暖灌草丛类草地,建群种为白羊草(Bothriochloa ischaemum),千粒重0.6975 g[6]。
1.2 方法
1.2.1 白羊草真叶的预处理
选择结构完整、完全成熟的白羊草种子,人工拨去外稃,用无菌水浸泡10 min,去除杂质并使其沉淀,接着用75%酒精浸泡30 s,无菌水冲洗3次,然后用0.1%二氯化汞溶液消毒15 min,期间不断摇动,再用无菌水冲洗3~4次后滤纸吸干水渍。灭菌过的成熟种子接种于仅含琼脂不含任何生长调节剂的培养基上,培养温度(25±2)℃,光照强度2000~3000 lx,光周期为16 h◦d-1,7 d后用消毒刀镊截取真叶(长度1.0~1.5 cm),接种于诱导愈伤培养基上(见表1),30 d后比较不同诱导培养基上外植体的出愈数。
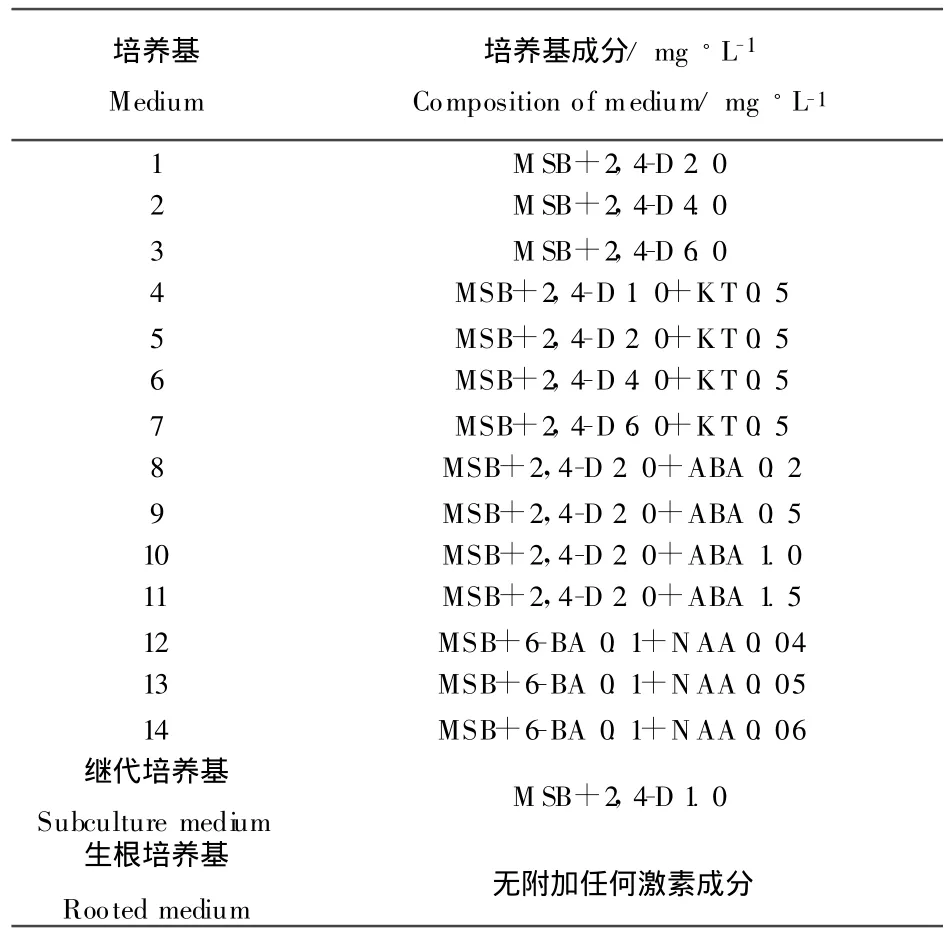
表1 真叶外植体的培养基及成分Table 1 Medium and composition of hypocotyls explant
1.2.2 愈伤组织的诱导
将切取的真叶接种到附加不同浓度2,4-D(2,4-二氯苯氧乙酸)、ABA(脱落酸)、KT(激动素)激素组合1~11号的11种愈伤诱导培养基上,每瓶25个真叶,重复3次,置于(25±2)℃,完全黑暗条件下诱导产生愈伤组织,30 d后统计出愈率。将诱导出的愈伤组织在继代培养基上进行增殖和继代培养。
1.2.3 愈伤组织的分化及移栽
将继代培养后的愈伤组织转至附加不同浓度组合6-BA(6-苄基腺嘌呤)、NAA(萘乙酸)的 12~14号分化培养基中,培养温度(25±2)℃,光照强度2000~3000 Lx,光周期16 h◦d-1的光照条件下进行愈伤组织的分化培养,30 d后统计分化率,待苗长到7 cm以上时,转移到不含任何附加成分的培养基上诱导根的形成。待根系长至10 cm左右时,去掉三角瓶盖,内加少许水,炼苗3 d后完全洗去附在根上的培养基,晾干水分后移栽至菜园土:腐殖质:沙土1∶1∶1的花盆中,在温室条件下生长。
1.2.4 数据处理
出愈率=产生愈伤组织块数/接种种子数×100%
分化率=出芽愈伤数/接种愈伤数×100%
1.2.5 基本培养基
本试验以MSB培养基加3%蔗糖,加5%琼脂粉制备基础培养基,pH值调至5.8,在121℃条件下灭菌20 min。在基本培养基上附加不同水平的激素。
MSB培养基:MS无机盐+B5有机成分
2 结果与分析
2.1 不同诱导培养基对愈伤组织诱导的影响
2.1.1 不同2,4-D浓度对愈伤组织诱导的影响
图1可看出,单独使用2,4-D时差异性显著,以2.0 mg◦L-1时诱导率最高,且愈伤生长较快,多浅黄色,质地比较致密。说明2,4-D是真叶外植体诱导愈伤的一个重要因素。
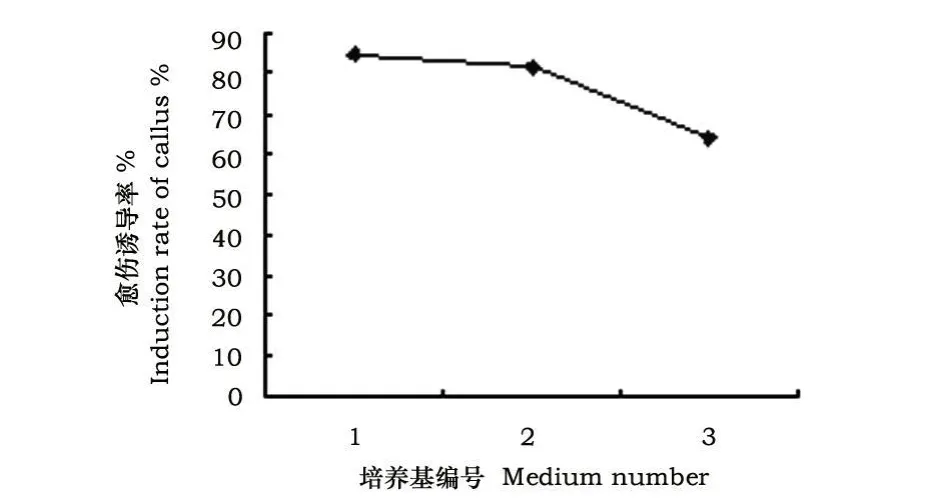
图1 不同2,4-D浓度对愈伤诱导率的影响Fig.1 Effect of callus induction under different 2,4-D
2.1.2 不同KT浓度对愈伤组织诱导的影响
由图2可看出,在含适量KT的诱导培养基中,随着2,4-D浓度由1.0 mg◦L-1逐渐上升至6.0 mg◦L-1,愈伤诱导率差异不明显,以4号培养基诱导率最大,达到93.45%,说明KT也是诱导的主要因素。
2.1.3 不同ABA浓度对愈伤组织诱导的影响
由图3可看出,2,4-D和ABA的组合中,保持2,4-D浓度不变,ABA浓度在0.2~1.5 mg◦L-1范围内变化时,差异不显著,诱导率最高只达到40.28%,明显低于KT和2,4-D的激素组合,以及单独使用2,4-D的诱导培养基。说明2,4-D在所设范围内,ABA任一水平下愈伤组织诱导率差异不显著,表明ABA对提高愈伤组织的诱导率可能不是一个重要因子。
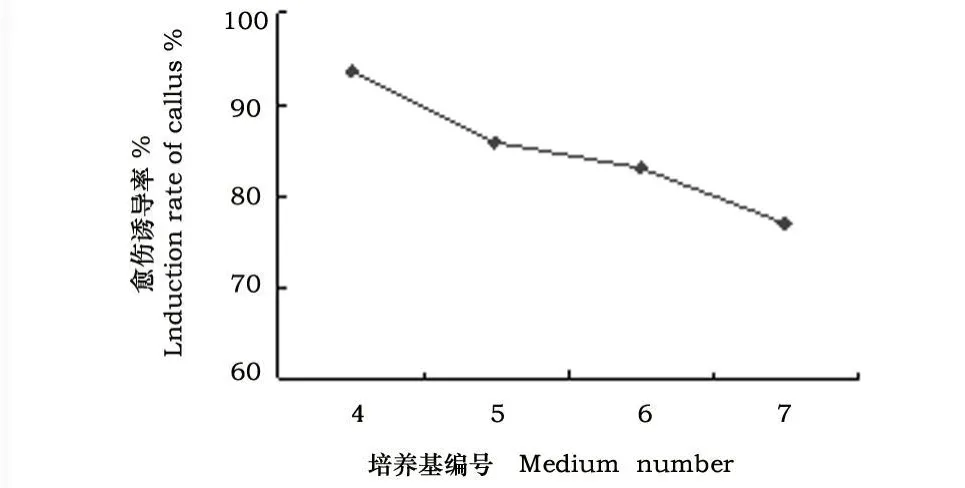
图2 不同KT浓度对愈伤诱导率的影响Fig.2 Effect of callus induction under different KT

图3 ABA浓度对愈伤组织诱导率的影响Fig.3 Effect of callus induction under different ABA
试验中采用单独使用2,4-D,KT和2,4-D、ABA与2,4-D的激素组合诱导愈伤组织。结果表明,在单独使用2,4-D时诱导愈伤差异显著,加入KT后,交互作用要大于单独使用2,4-D,如图1、图2。ABA与KT两者作用亦有差别,从图2、图3可以看出含有KT的培养基组合愈伤诱导率要明显高于含ABA的激素组合。从愈伤质量看,在单独使用2,4-D的培养基上愈伤生长较与KT、ABA组合的培养基效果好。
2.2 白羊草愈伤组织的继代
愈伤组织在诱导培养30 d后,由于多为非胚性愈伤,而且出愈伤的部位一般在叶基部,紧密包裹着伤口(见图5.C),所以需要先在超净工作台上,无菌条件下用消毒过的刀镊剥离愈伤组织,然后再继代到继代培养基上,实现非胚性愈伤向胚性愈伤转化,提高胚性愈伤组织发生率。
本试验中白羊草成熟胚的胚性愈伤组织只能在形成松软的非胚性愈伤之后,通过降低培养基中2,4-D的浓度,使致密或疏松的颗粒中胚性愈伤组织发生率提高。(见图5.D)。
2.3 白羊草愈伤组织的分化
继代一周后接种到分化培养基上。每5 d观察一次,第5~7 d可以观察到愈伤组织有绿色芽点出现,两周后可以观察丛生芽产生(见图5.E),真叶愈伤组织上的分化芽无种子愈伤组织丛生化明显,通常一个愈伤上的丛生芽只分化一个不定芽(见图5.F)。以先长芽,后长根的方式开始发育。三周左右能观察到愈伤已增长至2~3 cm,且无菌苗快长至三角瓶口,一个月后大约可长至20 cm左右,同时根系发达,即可炼苗后移栽,植株生长良好。(见图5.G)。其间只有少数分化植株未长出根,同时少量愈伤有褐化现象,只需将未分化出根的小苗转入无任何激素的培养基中即可生根。由图5可知,在12~14号分化培养基中,分化率差异不显著,在13号培养基中达到最高,为38.88%。
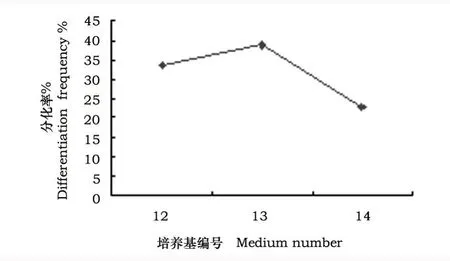
图4 不同分化培养基对愈伤分化的影响Fig.4 Effect of differention under different media
3 讨论与结论
本研究首次以白羊草7日龄的真叶为外植体,诱导出大量愈伤组织。试验发现,愈伤组织基本都发生在真叶靠近下胚轴端的切口,这与倪德祥用甜叶菊的茎段培养所发现的规律相一致[7]。这就是我们在生物学上所说的器官发生全息规律。试验表明,白羊草下胚轴端在离体培养时其器官发生的部位及数量、频率的梯度变化都遵循生物全息规律。因此,用白羊草真叶切段进行离体培养时,选用其形态学下端切段较好。这与郝建国在小麦叶基诱导愈伤中发现的现象一致[8]。
愈伤组织的诱导和分化是组织培养的两个关键问题,我们主要靠包括生长素和细胞分裂素的使用及不同的使用比例来调节,它们的不同组合及含量直接影响到对培养物的培养。Zhang等[9]和田文忠[10]指出,禾本科植物愈伤组织诱导,2,4-D通常是起决定作用的植物生长调节物质。施加外源2,4-D可以促进植物细胞生长素含量提高,从而诱导胚性细胞的发生。ABA在禾本科植物的组织和细胞培养中的作用越来越引起人们的注意。Bhasharan等[11]和张栋等[12]在研究中提到了ABA促进禾本科胚性愈伤的诱导。米庆莉等[13]指出,ABA的存在可以抑制胚芽和胚根的生长,有利于愈伤吸尘,同时,也增加了愈伤致密度和颗粒状的程度,提高了愈伤的质量。本试验中却发现,ABA的诱导效果远不及KT,差异极显著。说明对于白羊草真叶来说,KT的诱导作用优于ABA。
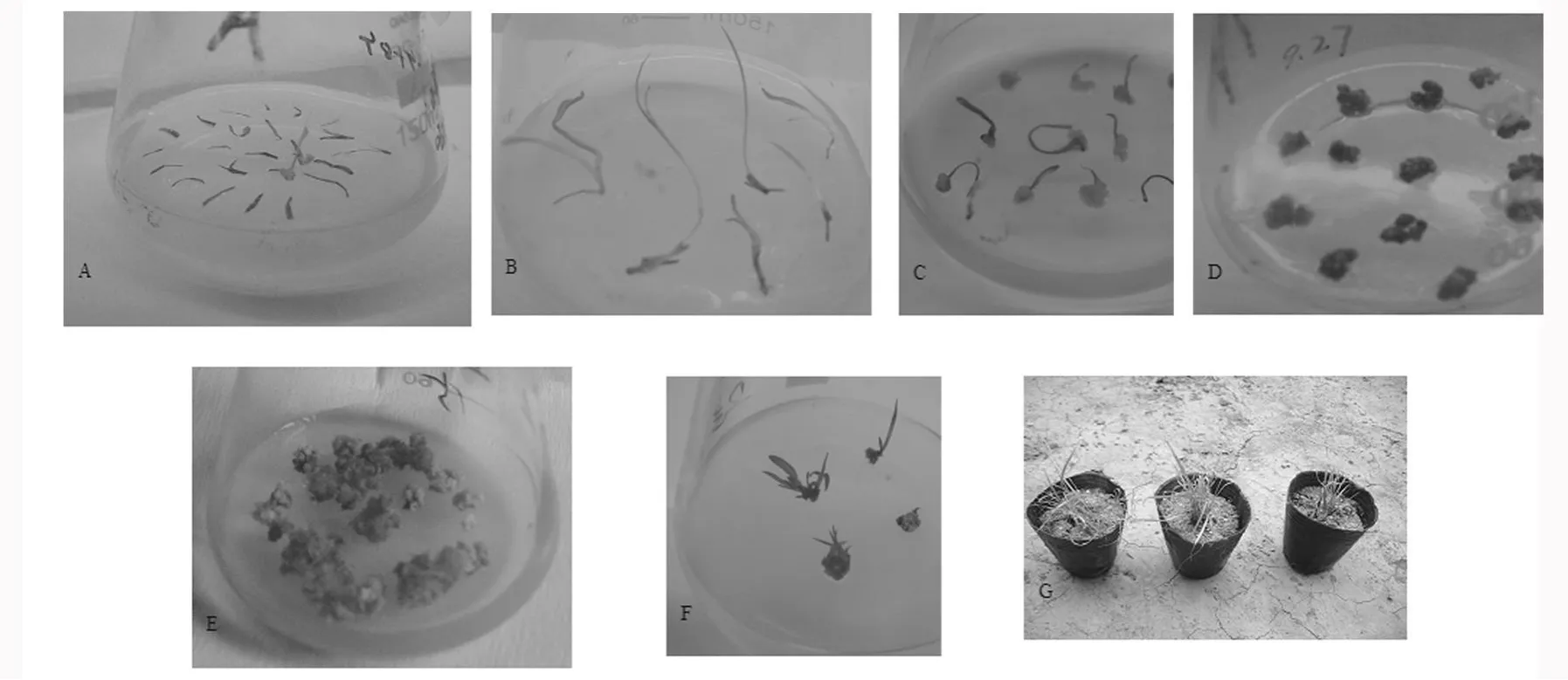
图5 白羊草植株再生过程Fig.5 The course of plant regeneration in Bothriochloa ischaemum
真叶胚性愈伤组织的诱导率相对较高,尤其是在继代后,使愈伤组织状态有了明显的改善,结构变得致密,颜色更加鲜艳,表面更为干燥,说明继代有助于胚性愈伤组织的形成。但将其接种分化培养基后,随着接种时间延长,一个月后愈伤质量下降,由以前鲜黄、颗粒状、易碎的胚性愈伤组织转变为灰黄色、表面潮湿、松散无结构的愈伤组织,加之通常一个愈伤上的丛生芽只分化一个不定芽,致使分化率下降。所以分化阶段激素的选择及组合有待进一步研究。
和以前的实验相比,在相同的分化培养基上,成熟种子分化率很高,说明相同种类的激素配比对同一植物的不同器官组织培养有不同的效果,也就是同一材料的不同外植体在相同的培养条件下培养时,其再生能力也存在差异。
在白羊草植株再生体系的建立过程中,无菌苗移栽入土是一个重要过程,由于生活环境的改变,势必会造成生理功能上的紊乱而导致因此死亡。因此定植前的炼苗非常重要,通过逐步降低空气湿度,延长通风时间以提高其抗逆性,才可得到较高的成活率。
[1]时永杰,孙晓萍.幼穗的组织培养[J].草业科学,1998,(12):19-20.
[2]董宽虎.山西白羊草草地生产性能种群生态位及草地培育的研究[D].北京:中国农业大学,2004,1-2.
[3]许庆方,董宽虎.温性灌草丛建群种——白羊草[J].草原与草坪,2004,(3):20-23.
[4]肖辅珍,王景林.从白羊草成熟胚和幼穗培养诱导再生植株[J].首都师范大学学报(自然科学版),1996,(17):76-78.
[5]于娜,董宽虎.白羊草成熟胚组织培养及植株再生体系的建立[J].草地学报,2008,16(5):466-469.
[6]黄锋华,董宽虎.白羊草灌丛草地植物量及优势种牧草营养动态研究[J]草原与草坪,2007,(02):14-17.
[7]倪德祥.生物全息律在植物组织培养中的应用初探。张颖清主编,全息生物学研究[C].济南:山东大学出版社,1985,36-43.
[8]郝建国,贾敬芳.小麦叶基切段愈伤组织的诱导和植株再生[J].西北大学学报(自然科学版),2003,4(33):489-491.
[9]Zhang L J,Cheng L M,Xu N,et al.Efficient transfo rmation of tobacco by ultrasonication[J]Bio.Technology,1991,9:996-997.
[10]田文忠.提高粕稻愈伤组织再生频率的研究[J].遗传学报,1994,21(1):215-221.
[11]Bhaskaren S,Smithr H.Regeneration in cereal tissue culture:a review[J].Crop Sci,1990,30:1328-1336.
[12]张栋,陈季楚.ABA,NAA诱导水稻胚性愈伤组织的研究[J].实验生物学报,1995,28(3):230-234.
[13]米庆莉,何锶洁.籼稻及粳稻对基因枪转化反应的差异及提高转化频率的研究[J].农业生物技术学报,1998,6(2):263-268.
Callus Induction and Plant Regeneration from Hypocotyls ofBothriochloa ischaemum
YU Na1,DONG Kuan-hu2
(1.Department of Landscape;Shanxi Forestry Vocational Technical college;Taiyuan Shanxi 030009;2.College of Animal Science and Veterinary Medicine,Shanxi Agricultural University,Taigu Shanxi 030801,China)
An initiatory efficient protocolin vitroplant regeneration from 7d old hypocotyls ofBothriochloa ischaemumwith various hormone combinations on callus induced and plant regeneration.The results showed that the callus induced KT is marked,and KT mixture with 2,4-D is better than ABA and 2,4-D,and 2,4-D only.The frequency of callus induction reached 93.45%in the callus induction medium supplemented with 1.0 mg◦L-12,4-D and NAA 0.5 mg◦ L-1.When the callus was transfered to the medium containing 6-BA0.1 mg◦L-1and NAA0.04-0.06 mg◦L-1the shoots differentiated.
Bothriochloa ischaemum;Hypocotyls;Embryogenic callus;Plant regeneration
S336
A
1671-8151(2010)01-0061-04
2009-11-20
2009-12-10
于娜(1979-),女(汉),山西阳城人,硕士,主要从事草地资源与草地管理等方面的研究。
董宽虎,教授,博士生导师。Tel:0354- 6287552;E-mail:dongkuanhu@126.com
国家科技支撑计划项目(2007BAD56B01)
(编辑:杨忠义)
