N+离子注入选育高转化15α-羟基左旋乙基甾烯双酮雷斯青霉菌株的研究
2010-06-05邱强,杜连祥
离子注入技术作为一种特殊的物理化学复合诱变源,自1986年余增亮等将其应用于生物学以来,在生物批种改良领域已取得了丰硕成果[1]。作为一种新的诱变源,低能离子注入和常规的辐射诱变及化学诱变有着明显的差异,常规的辐射诱变仅仅是利用能量交换,化学诱变考虑的也只是分子基团的交换,而低能离子注入生物体时同时存在能量交换、能量沉积、质量沉积及电荷交换四大效应。由于注入离子的电荷数、质量数、能量、剂量的组合不同,可以提供众多的诱变条件,使离子注入诱变具有突变谱宽、突变率高的特点,从而可以筛选到符合生产要求、能够提高产量的突变体[2,3]。
15α-羟基左旋乙基甾烯双酮是合成孕二烯酮(Gestodene)的重要中间体[4],其核心技术是在左旋乙基甾烯双酮的C15位上连接一个α-羟基[5],而雷斯青霉是对左旋乙基甾烯双酮进行C15α位羟化的常用菌株[6,7]。
作者采用N+离子注入技术对雷斯青霉(Penicilliumraistrickii)ATCC 10490进行诱变处理,以期得到适于工业生产的高转化率突变株,并考察该技术在霉菌选育方面的应用价值。
1 实验
1.1 菌种
雷斯青霉(Penicilliumraistrickii)ATCC 10490,美国菌种保藏中心。
1.2 培养基
固体培养基(g·L-1):麦芽提取物 20,葡萄糖 20,蛋白胨 1,琼脂粉 20,pH值自然。
液体培养基(g·L-1):葡萄糖 30,玉米浆 10,NaNO32,KH2PO41,K2HPO40.5,MgSO40.5,FeSO40.02,KCl 0.5,pH值自然。
1.3 雷斯青霉孢子悬液的制备
在无菌条件下,挑取雷斯青霉菌种沙土孢子适量,均匀接种在斜面培养基表面。置于28℃恒温培养5~7 d。取新鲜的雷斯青霉孢子斜面一支,加入10 mL无菌生理盐水,洗脱孢子,移入装有灭菌玻璃珠的三角瓶内,振荡30 min,双层纱布过滤,得到无菌丝体的孢子悬液。调整孢子浓度为1×107个·mL-1,取上述单孢子悬浮液0.1 mL,均匀涂布于90 mm的灭菌培养皿中间区域,无菌风吹干。
1.4 低能离子注入
将含有雷斯青霉孢子的培养皿放入低能加速器(离子注入机)靶室,打开培养皿盖,靶室抽真空。用能量为30 keV的不同剂量的N+离子束进行注入。用1 mL无菌生理盐水洗脱,适当稀释后涂布在平板培养基上,于28℃培养2 d,用于单菌落的挑选和存活率的计算。

1.5 左旋乙基甾烯双酮15α-羟化实验
孢子斜面用无菌水制成孢子悬浮液,浓度为1.5×107个·mL-1,按3%接种量接入装有50 mL发酵培养基的250 mL三角瓶中,置于28℃、180 r·min-1的摇床上培养42 h后,按3‰的投料量加入左旋乙基甾烯双酮和6%的甲醇,继续转化培养120 h。
1.6 分析检测
不同时间取500 μL发酵液于离心管中,加入等体积乙酸乙酯萃取30 min,12 000 r·min-1离心5 min,取上清液100 μL,挥干乙酸乙酯,加入1000 μL甲醇溶解,用高效液相色谱法进行检测。高效液相色谱条件:C18柱(4.6 mm×250 mm),流动相为甲醇∶水(80∶20),流速1 mL·min-1,检测波长241 nm。
2 结果与讨论
2.1 离子注入诱变对雷斯青霉存活率和突变率的影响(图1、图2)
由图1可知,设定靶室抽真空时菌株的存活率为100%,随着N+注入剂量增加,存活率呈现较明显的先降后升再降的“马鞍型”变化趋势,这种特有的变化被认为是能量、动量作用下的损伤效应和质量、电荷作用下的保护和刺激综合作用的结果。
由图2可知,N+注入剂量为50×1014ions·cm-2时正突变率最高,达14.5%,恰好在“马鞍型”区域内。超过50× 1014ions·cm-2后,菌株突变率继续增加,而正突变率明显下降,这可能是因为,随着N+注入剂量的增大,DNA和生物膜等损伤严重导致。
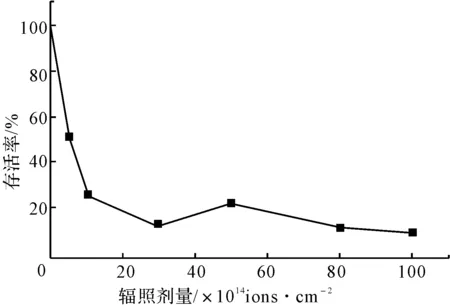
图1 N+辐照的存活效应

图2 N+离子注入对菌株突变率及正突变率的影响
2.2 离子注入诱变对雷斯青霉菌落形态的影响
考察了N+注入剂量为50×1014ions·cm-2时菌株的变化情况,结果见图3。
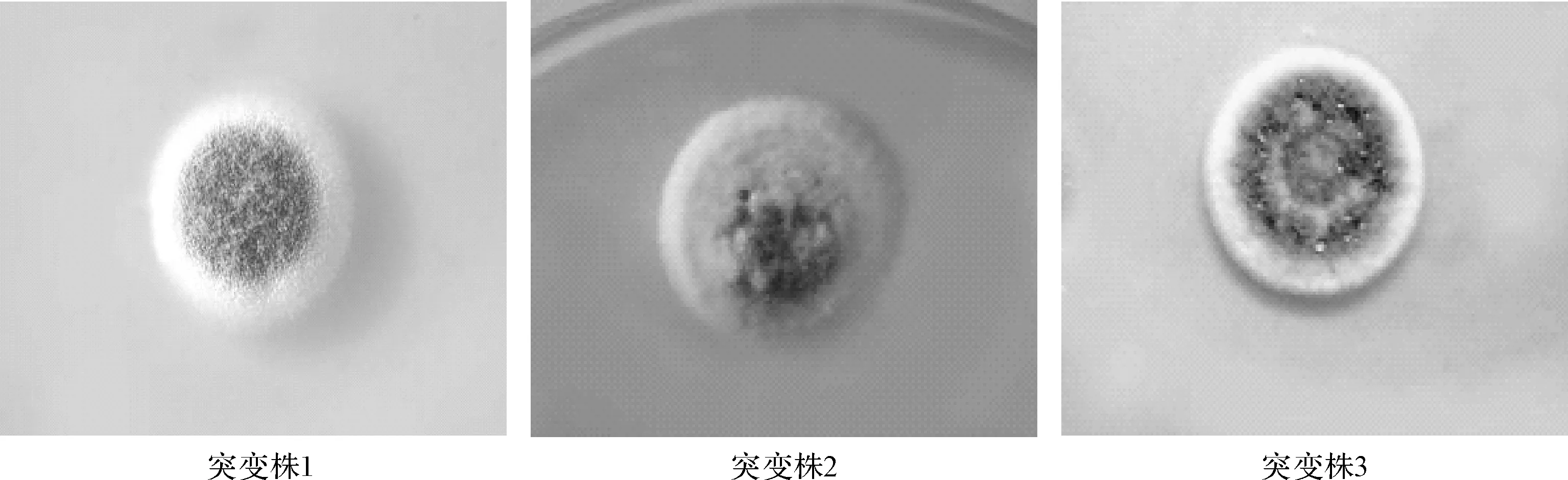
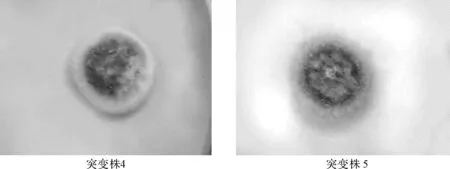
图3 离子注入诱变后雷斯青霉的菌落形态
由图3可知,在50×1014ions·cm-2N+剂量下出现了5种不同菌落形态。摇瓶转化实验表明,3株突变株(突变株1、3、4)的转化率高于出发菌株。其中突变株1转化率最高,其单菌落形态较大,菌丝体呈白色,且生长旺盛,孢子呈深绿色且量大,菌落平整,无褶皱,边缘整齐,明显不同于其它突变株。由此可见,可以通过菌落形态的差异初步判断转化率可能较高的菌株,为雷斯青霉提供了良好的初筛方法。
在液体培养基中,突变株1的孢子发芽时间要比出发菌株短,摇瓶培养12 h时,可以观察到孢子发芽后菌丝较出发菌株更长,继续摇瓶培养至24 h时,突变株1的菌丝球量明显高于出发菌株,说明其对营养成分的利用更迅速,生长速度快于出发菌株,见图4。

图4 出发菌株与突变株1的菌丝照片
出发菌株和突变株1的生长曲线见图5。
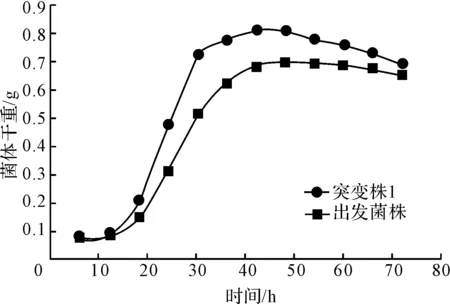
图5 出发菌株与突变株1的生长曲线
由图5可知,突变株1的对数期较短,孢子接种后42 h菌体量达到最大值,较出发菌株提前5 h达到稳定期。
2.3 高转化率菌株的分离
将突变株1进行平板分离纯化,挑选10株进行摇瓶转化实验,结果如表1所示。
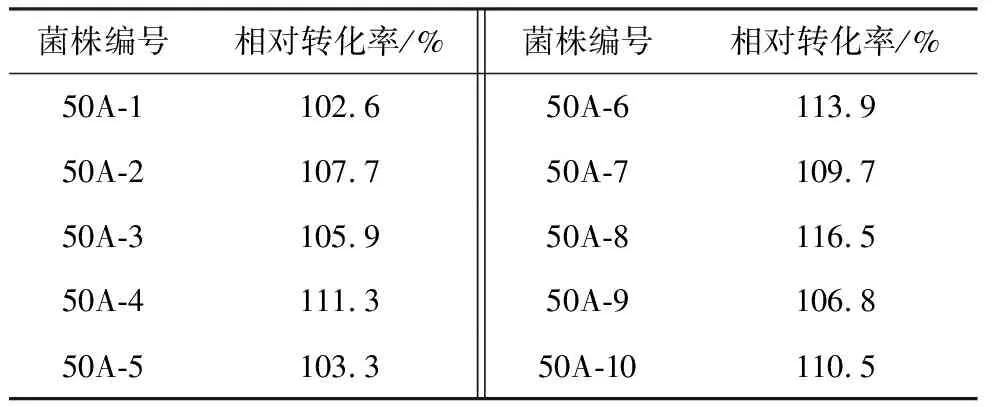
表1 突变株1分离纯化菌株转化性能
由表1可知,其转化率均高于55%,其中突变株50A-8的转化率达到62.7%。
2.4 突变株的稳定性实验
对转化性能最好的突变菌株50A-8连续传代,考察其遗传稳定性。结果表明,该菌株的遗传性能比较稳定。传代至第8代时,转化率为61.4%,第9代为61.2%。
3 结论
雷斯青霉孢子经N+离子注入技术诱变后,其存活率呈典型的“马鞍型”曲线,最适N+注入剂量为50×1014ions·cm-2,在该剂量下呈现出不同的菌落形态,从其中菌丝生长旺盛、孢子量较大的菌落中筛选到一高转化率突变株50A-8,该突变株对左旋乙基甾烯双酮的转化率可达62.7%,为出发菌株的1.16倍,且遗传稳定性良好。
参考文献:
[1] 余增亮.离子束与生命科学一个新的研究领域[J].物理,1997,26(6):333-338.
[2] 袁成凌,余增亮.低能离子束在生物技术中的应用研究[J].中国生物工程杂志,2003,23(4):57-61.
[3] 陈宇,林梓鑫,张峰,等.离子注入微生物的生物效应研究[J].中国抗生素杂志,1998,23(6):415-419.
[4] Schlosser D,Irrgang S,Schmauder H P.Steroid hydroxylation with free and immobilized cells ofPenicilliumraistrickiiin the presence ofβ-cyclodextrin[J].Applied Microbiology and Biotechnology,1993,39(1):16-20.
[5] Irrgang Sylke,Schlosser Dietmar,Fritsche Wolfgang.Involvement of cytochrome P-450 in the 15α-hydroxylation of 13-ethyl-gon-4-ene-3,17-dione byPenicilliumraistrickii[J].Steroid Biochem Mol Biol,1997,60(5):339-346.
[6] Irrgang S,Schlosser D,Schmauder H P.The steroid 15α-hydroxylase ofPenicilliumraistrickiiI 477 is inducible[J].Biotechnology Letters,1992,14(1):33-38.
[7] Schlosser D,Irrgang S,Schmauder H P.Morphological characterization of microenc apsulatedPenicilliumraistrickii477[J].Acta Biotechnologica,1993,13(2):123-129.
