聚乙二醇对溶菌酶热变性过程影响的DSC研究
2010-06-05王莉衡,钦传光
我国著名生物化学家吴宪教授早在1931年就首先提出了蛋白质变性的概念[1],作为从分子水平阐明生命奥秘的中心课题之一,蛋白质去折叠的研究一直受到生物化学、生物物理学和结构生物学领域研究工作者的关注[2,3]。在蛋白质变性过程中,维系其空间结构的次级键被破坏,伴随着焓、熵的显著变化[4,5]。研究蛋白质在不同条件下的变性过程,对于理解具有一定氨基酸序列结构的多肽链如何逐步卷曲形成具有特定空间结构的蛋白质分子具有重要意义[6,7]。
细胞体系极其复杂,细胞内含有大量可溶或者不可溶的大分子物质,如多糖、蛋白质、核酸等,它们以不同的浓度而存在[8~10],这些不同种类的大分子物质占据了细胞总体积的20%~30%,大多数的生命化学反应正是在这种极其拥挤的环境体系中完成的。 但长期以来蛋白质去折叠的研究均是在简单的缓冲体系——稀溶液中进行的。简单的稀溶液并不能真实反映胞内蛋白质的去折叠过程。因此,模拟细胞内的环境,尽可能地在接近真实的细胞体系中进行体外研究十分必要,近几年已有相关的报道[11~15]。一些高分子聚合物,如聚乙二醇(PEG)和葡聚糖等常被用作拥挤试剂模拟细胞内的环境,进而改善蛋白质的生物活性[16~18]或药物的利用程度[19]。
作者以PEG2000、PEG4000、PEG6000、PEG20 000作为拥挤试剂,利用DSC研究了聚乙二醇对溶菌酶热变性过程的影响。
1 实验
1.1 试剂及仪器
溶菌酶为冻干粉末,Genview公司;其余试剂均为国产分析纯。实验用水为去离子蒸馏水,所有试样溶液均用缓冲溶液配制。
日立U-3310型紫外可见分光光度计,Hitachi公司;Micro-DSCⅢ型微量热仪,法国Setaram公司。
1.2 方法
将溶菌酶溶于不同质量浓度(0~350 g·L-1)的PEG溶液中,酶的浓度均为0.5 mmol·L-1。用微量热仪记录各样品的热转变曲线,仪器工作温度范围253~393 K,温度精确度10-4K,热流精度10-4mW,升温速率在0.01~1.2 K·min-1范围内无级可调。实验设定升温速率为0.15 K·min-1。实验取Tm为变性温度,ΔH为变性焓。
酶浓度通过用紫外可见分光光度计测定280 nm下的吸光度值而计算得到。
2 结果与讨论
2.1 聚乙二醇对溶菌酶变性温度的影响
分别考察了不同浓度PEG2000、PEG4000、PEG6000、PEG20 000对溶菌酶热变性时变性温度Tm的影响,结果见表1。
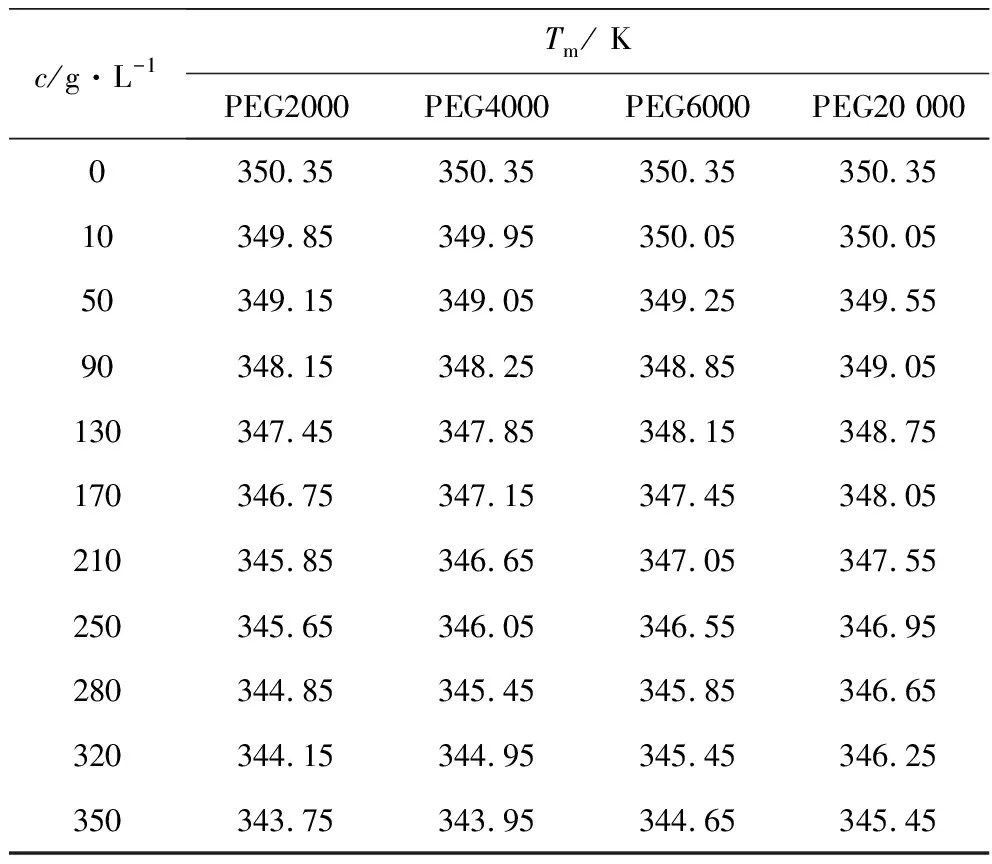
表1 溶菌酶在不同PEG及浓度下的变性温度
由表1可以看出,热变性时溶菌酶的变性温度Tm随着PEG质量浓度的增加而降低,且Tm值与PEG的分子质量息息相关。当用PEG2000作为拥挤试剂时,其Tm值变化最大,由350.35 K降至343.75 K;当用PEG20 000作为拥挤试剂时,其Tm值变化最小,由350.35 K降至345.45 K。在同一质量浓度下,溶菌酶的Tm与PEG的分子质量成正比关系,即PEG的分子质量越大,变性温度Tm越高。对于同一分子质量的PEG 来说,变性温度Tm与PEG的质量浓度(c)基本呈线性关系,且线性度较好,R2值均大于0.9910。
PEG2000:Tm=-0.1842c+350.019R2=0.9926
PEG4000:Tm=-0.1670c+350.064R2=0.9910
PEG6000:Tm=-0.1535c+350.200R2=0.9950
PEG20 000:Tm=-0.1316c+350.284R2=0.9946
2.2 聚乙二醇对溶菌酶变性焓的影响
分别考察了不同浓度PEG2000、PEG4000、PEG6000、PEG20 000对溶菌酶热变性时变性焓ΔH的影响,结果如表2所示。
由表2可以看出,整个实验中PEG的分子质量及质量浓度对变性焓ΔH的影响较小,ΔH维持在(515.95±28.75) kJ·mol-1之间,基本为一定值。
3 结论
探讨了拥剂试剂PEG及浓度对溶菌酶热变性过程的影响。结果表明,变性温度Tm随着PEG质量浓度的增加而降低,且基本呈线性关系。在同一质量浓度下,Tm的大小与PEG的分子质量成正比关系,即PEG的分子质量越大,变性温度Tm越高。整个实验中PEG的分子质量及质量浓度对变性焓ΔH的影响较小,ΔH维持在(515.95±28.75) kJ·mol-1之间,基本为一定值。
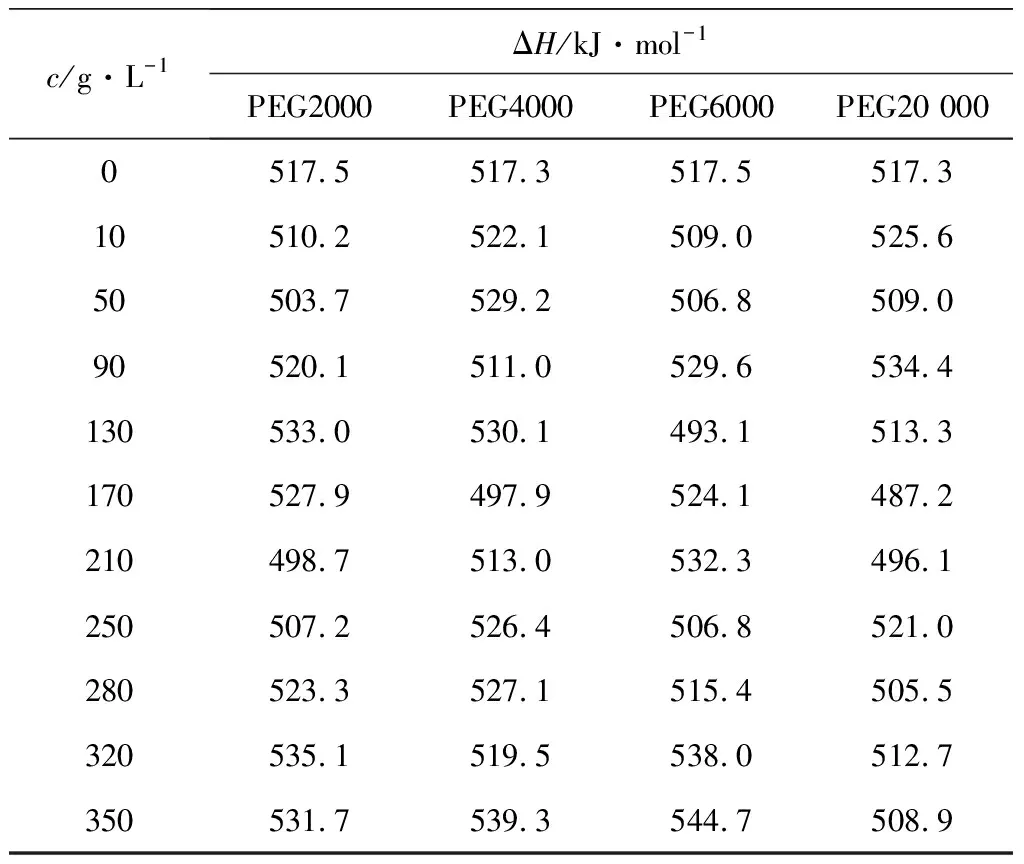
表2 溶菌酶在不同PEG及浓度下的变性焓
参考文献:
[1] Wu H.Studies on denaturation of proteins..A theory of denaturation[J].Chin J Chem,1931,5:321-344.
[2] Baker T A.Protein unfolding.Trapped in the act[J].Nature,1999,401(6748):29-30.
[3] Makhatadze G I.Thermodynamics of protein interactions with urea and guanidinium hydrochloride[J].J Phys Chem B,1999,103(23):4781-4785.
[4] 方盈盈,胡新根,于丽,等.溶菌酶热变性的DSC研究[J].物理化学学报,2007,23(1):84-87.
[5] Murphy K P,Bhakuni V,Xie D,et al.Molecular basis of co-operactivity in protein folding.Ⅲ.Structural identification of cooperative folding units and folding intermediates[J].J Mol Biol,1992,227(1):293-306.
[6] Michnik A,Drzazga Z,Kluczewska A,et al.Differential scanning microcalorimetry study of the thermal denaturation of haemoglobin[J].Biophys Chem,2005,118(2-3):93-101.
[7] 商志才,易平贵,俞庆森,等.环丙沙星与牛血清白蛋白的结合反应[J].物理化学学报,2001,17(1):48-52.
[8] Dogan J,Lendel C,Härd T.Thermodynamics of folding and binding in an affibody:Affibody complex[J].J Mol Biol,2006,359 (5):1305-1315.
[9] Nasrollah R G,Azadeh E H,Mohsen N G.Effect of polyamines on the structure,thermal stability and 2,2,2-trifluoroethanol-induced aggregation ofα-chymotrypsin[J].Int J Biol Macromol,2007,41(5):597-604.
[10] Salvetti G,Tombari E.The endothermic effects during denaturation of lysozyme by temperature modulated calorimetry and an intermediate reaction equilibrium[J].J Phys Chem B,2002,106 (23):6081-6087.
[11] Ellis R J,Minton A P.Cell biology:Join the crowd[J].Nature,2003,425(6953):27-28.
[12] Jiang M,Guo Z H.Effects of macromolecular crowding on the intrinsic catalytic efficiency and structure of enterobactin-specific isochorismate synthase[J]. J Am Chem Soc,2007,129(4):730-731.
[13] Michael P,Loren S,Pernilia W S.Macromolecular crowding increases structural content of folded proteins[J]. FEBS Lett,2007,581(26):5065-5069.
[14] Du F,Zhou Z,Liang Y.Mixed macromolecular crowding accelerates the refolding of rabbit muscle creatine kinase:Implications for protein folding in physiological environments[J]. J Mol Biol,2006,364(3):469-482.
[15] Maria T M Z,Alejandro M V,Francisco J M,et al.EscherichiacoliAspP activity is enhanced by macromolecular crowding and by both glucose-1,6-bisphosphate and nucleotide-sugars[J]. FEBS Lett,2007,581(5):1035-1040.
[16] Middaugh C R,Tisel W A,Haier R N,et al.Determination of the apparent thermodynamic activities of saturated protein solutions[J].J Biol Chem,1978,254(2):367-370.
[17] Laurent T C.Enzyme reactions in polymer media[J].Eur J Biochem,1971,21(4):498-506.
[18] Harris J M.Poly(ethylene glycol) Chemistry:Biotechnical and Biomedical Applications[M].New York:Plenum Press,1992:11-12.
[19] Verheyen S,Blaton N,Kingrt R,et al.Pharmaceutical performance of solid dispersions containing poly (ethylene glycol) 6000 and diazepam or temazepam[J].J Therm Anal Cal,2004,76(2):405-416.
