大孔树脂分离纯化苦参总黄酮提取工艺研究
2010-06-04谢燕贤深圳市宝安区石岩人民医院深圳市518000
谢燕贤(深圳市宝安区石岩人民医院,深圳市 518000)
中药苦参(Sophora fiavescens)又名山槐子,为豆科植物苦参的干燥根,苦参提取液中的化学成分主要分为生物碱和黄酮两大类。近年来对它研究的重点多在生物碱上,对其中的黄酮类成分研究较少,到目前为止,已从苦参根中共分离得到了44种异戊烯基黄酮类化合物,具有健胃、利尿、消炎、止泻和驱虫等多种生物活性功能[1]。一系列从苦参中分离出的含异戊烯基的苦参黄酮在体外对一些人肿瘤细胞株有细胞毒活性,例如有效于人白血病 HL-60、K562,小鼠白血病 L1210[2]等等。苦参总黄酮提取液对细菌的抑制活性研究表明。对革兰阳性金葡菌有较强的抑制作用,对革兰阴性菌大肠杆菌的抑制作用较弱。其原因可能与细胞壁的结构组分不同有关。苦参黄酮粗提液还对啤酒酵母、产黄青霉、黑曲霉都有抑制作用[3]。
本文采用大孔吸附树脂的分离的技术提取苦参中的总黄酮。利用AB-8型、HPD-100型、HPD-101型、HPD-400型、HPD-417型、HPD-450型、HPD-600型7种大孔吸附树脂,采用静态、动态吸附法及吸附动力学试验分离纯化苦参总黄酮的性能进行了对比,筛选七种树脂中最适于分离纯化苦参总黄酮的树脂。有关研究如下。
1 材料和方法
1.1 仪器和试剂
岛津UV-2401分光光度计;赛多利斯电子天平;树脂型号为AB- 8型、HPD-100型、HPD-101型、HPD-400型、HPD-417型、HPD-450型、HPD-600型;芦丁对照品(中国药品生物制品检定所提供,批号1115382-200301);其他试剂均为分析纯。
1.2 树脂预处理[4]
取上述各型号大孔树脂,用一定体积分数乙醇浸泡24 h,充分溶胀,用适当体积分数的乙醇洗至出液加适量蒸馏水无白色浑浊现象,再用蒸馏水洗至无醇备用。即可。
1.3 苦参药液的提取
称取一定量的苦参干燥药材,用90%乙醇,水浴回流提取3次,合并提取液,减压浓缩至无醇味,加蒸馏水溶解,即得苦参样品液。
1.4 树脂的选择
准确称取上述准备的大孔树脂湿树脂各5 g,置具塞磨口三角瓶中,加入苦参样品液25 mL,25℃恒温振荡24 h,过滤、保留滤液,用蒸馏水洗涤树脂,再将树脂浸泡在70%乙醇中,25℃恒温振荡24 h解吸,测定各液中总黄酮的浓度。
2 含量测定方法[5]
2.1 芦丁标准曲线的制备
精确称取芦丁对照品14.6 mg,置50 mL量瓶中,加70%乙醇溶解,定容至 50 mL,摇匀,配成 292 μg·mL-1的标准溶液,备用。精密吸取对照品溶液 0、2、4、6、8、10mL、分别置于25 mL容量瓶中,分别加70%乙醇至10 mL,精密加入5%亚硝酸钠溶液 l mL,混匀,静置。精密加入10%硝酸铝溶液 l mL,摇匀后静置,精密加入4%氧氧化钠溶液10 mL,再加70%乙醇至刻度,摇匀,放置 15 min.以第一管做空白在波长 510 m处测定吸光度,以对照品浓度为横坐标,吸光度为纵坐标绘制标准曲线,结果见表1。
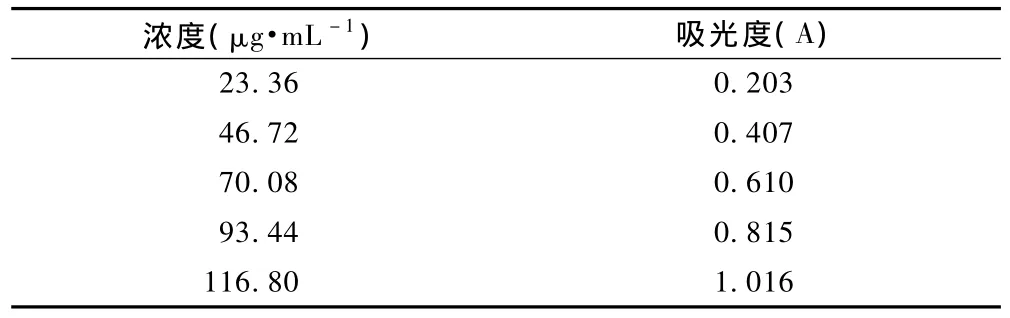
表1 芦丁对照品标准曲线Tab 1 Standard curve ofrutoside control
上述数据以浓度为横坐标,以吸光度为纵坐标,进行回归,得回归方程:Y=0.020 5X+0.007 8,r=0.999 8。结果表明,本品在 23.36 ~116.80 μg·mL-1范围内,浓度与吸光度线性关系良好。
2.2 苦参提取液总黄酮的测定方法
参照文献报道,目前已知从苦参根中共分离得到了多种黄酮类化合物,所以其总黄酮含量的测定以芦丁为对照品进行测定。方法为,取待测样品2份,减压浓缩至干浸膏,取干浸膏用乙醇溶解,按“标准曲线的制备”项下方法,测定、并计算样品中总黄酮的含量。
3 树脂吸附实验

表2 不同树脂对苦参总黄酮的吸附和解吸能力Tab 2 Adsorption and desorption of different resins on total flavonoids in Sophora Flavescens
3.1 树脂对苦参总黄酮的选择性
通过计算公式:吸附量 =V(C0-C1)/M、吸附率 =[(C0-C1)/C0]×100%、解吸量 =C2×V/M、解吸率 =[C2/(C0-C1)]×100%(式中C0为吸附前样液中黄酮浓度,C1为吸附后上清液中黄酮浓度,C2为解吸液中黄酮浓度,V为样液体积,M为湿树脂质量)。研究了7种树脂对苦参总黄酮的选择吸附性,结果见表2。
结果显示,HPD-101型大孔树脂对苦参总黄酮的吸附和解吸能力都最大,所以采用HPD-101型号为苦参总黄酮的提取富集树脂。
3.2 静态吸附等温线的建立
准确称取5 g HPD-101湿树脂于具塞三角瓶中,加一定浓度的料液各25 mL,于18℃、25℃、30℃下静态吸附,每隔2 h取样1.0 mL,测定各个时段取样液中总黄酮浓度,绘制静态吸附等温线。根据静态吸附实验,24 h树脂完全达到吸附平衡,计算出吸附量 q。q=V0(C0-C1)/M,(q为吸附量,mg·g-1为湿树脂;C0为初始黄酮溶液浓度 mg·mL-1,C1为黄酮溶液的平衡浓度 mg·mL-1,M为湿树脂的质量 g)。以吸附时间为横坐标,吸附量为纵坐标,绘制吸附等温线如图1。
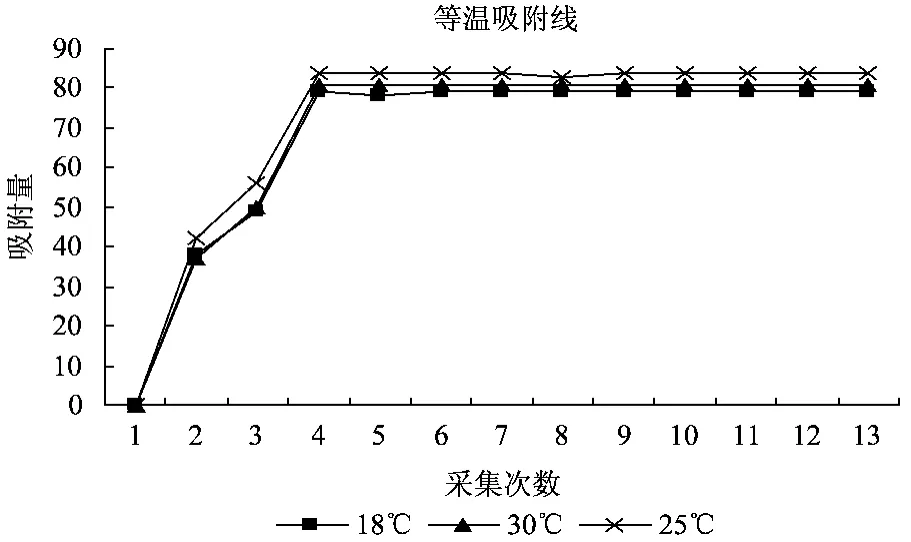
图1 HPD-101对苦参总黄酮的吸附等温线Fig 1 Adsorption isotherm of HPD-101 on total flavonoids in Sophora Flavescens
从图1可以看出,HPD-101型树脂在25℃时的苦参总黄酮吸附效果最好,温度过高或过低树脂的平衡吸附量均下降。
3.3 静态吸附动力学曲线的建立
准确称取5 g HPD-101型树脂于具塞三角瓶中,加一定浓度的料液各25 mL,于25℃下静态吸附,每隔2 h取样1.0 mL,测定各个时段取样液中总黄酮浓度,绘制吸附等温线。吸附动力学特征反映的是随时间的延长,树脂对样品分子吸附量的变化趋势。经过i次取样后,总黄酮浓度C与吸附量q之间的关系可用下式表示:q=Σ (Ci-1-Ci)(V0-0.5i)/m(i=1 - n),(q为吸附量,mg·g-1湿树脂;C 为总黄酮浓度,mg·mL-1;m为湿树脂的质量g)。以吸附时间 h为横坐标,剩余浓度Ci为纵坐标绘制动力学曲线,如图2。

图2 25℃时HPD-101型树脂对苦参总黄酮吸附动力学曲线Fig 2 Adsorption dynamics curve of HPD-101 on total flavonoids in Sophora Flavescens at 25℃
从图2可以看出,HPD-101树脂对总黄酮的吸附量在4 h内较大,吸附速度快,在4~6 h内吸附速度慢,在6 h后速度趋于平缓,在6 h时达到最大吸附。因此静态吸附6 h即可达到吸附饱和。
3.4 动态吸附实验
分别称取HPD-101树脂25 g 4份,湿法装入4根3 cm×50 cm 色谱柱中。选择 4 个浓度药液(1.0、2.0、3.0、4.0 mg·ml-1),加入量依次为 300、250、200、150 mL ,以 1.0 mL·min-1的上样速度、70%乙醇洗脱,洗脱液定容至500 mL,测定总黄酮含量后浓缩,烘干,并称重洗脱物,见表3。
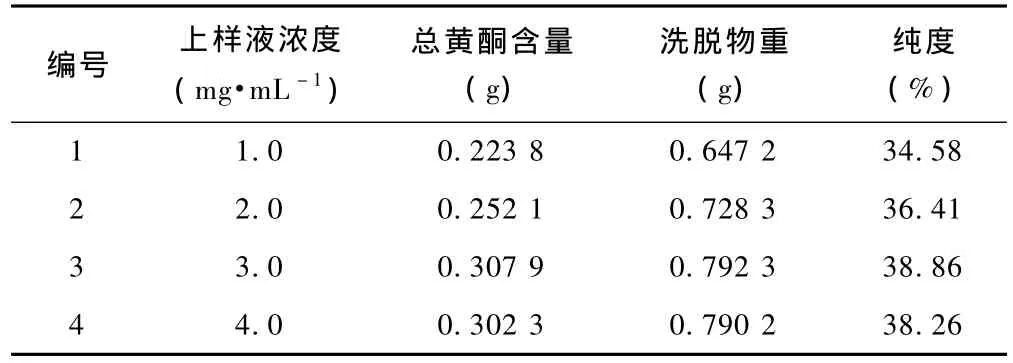
表3 苦参动态吸附实验考察结果Tab 3 Dynamic adsorption experiment onSophora Flavescens
从表2可以看出,上样液浓度为3.0 mg·mL-1时,洗脱的总黄酮量最大,纯度最高,浓度过高或过低都对总黄酮的洗脱量有影响。
3.5 静态解吸条件选择
称取20 g HPD-101型树脂于烧杯中,加入一定浓度的料液100 mL,静态吸附24 h,滤出树脂,过滤后按质量平均分成10份,分别置于10个锥形瓶中,各加入 10%、20%、30%,40%、50%,60%,70%,80%,90%,100%的乙醇溶液,静态解吸24 h。抽滤,并用各自的洗脱剂冲洗树脂,合并入滤液,置于100 mL的量瓶中,得到洗脱液,测定各自的总黄酮含量,并计算解吸量。洗脱效果见图3。
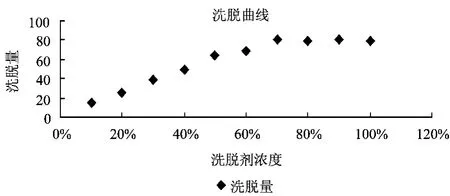
图3 不同醇度的洗脱剂对总黄酮解吸量的影响Fig 3 Effects of different ethanol concentration of eluting agents on desorption amount of total flavonoids
从图3可以看出,当醇度达到70%时,解吸量达到最大,因此可以选择70%的乙醇作为洗脱剂。
4 讨论
中药水提液通常采用醇沉法来进行精制,尽管醇沉法具有澄清药液、减少服用量等优点,但也存在许多不足,如总固形物和有效成分损失严重,乙醇损耗量大、生产成本高,生产周期长,安全性差等等。大孔吸附树脂是近年来新发展起来的精制技术,在医药领域中广为应用,是提取精制中草药中水溶性有效成分的一种有效方法。本文采用HPD-101大孔树脂分离技术提取苦参中的总黄酮。旨在探索一条适用于中药提取的新方法。
通过研究证明,苦参以90%乙醇为溶剂,水浴回流提取3次,总黄酮能得到较好的提取效果。经过静态、动态吸附实验、吸附等温线的建立、吸附动力学曲线的建立、解吸条件优化,研究了七种树脂对苦参总黄酮的选择吸附性,研究表明HPD-101树脂对苦参总黄酮具有较好的选择吸附性和解吸能力,当洗脱剂醇度达到70%时,解吸量达到最大。
[1]唐 诩,许东晖,梅雪婷,等.26种黄酮类天然活性成分的药理研究进展[J].中药材,2003,26(1):46.
[2]赵玉英,王 郇,雷黎明,等.苦参黄酮类成分的研究[J].植物学报,1993,35(4):304.
[3]张庆平.苦参总黄酮超临界CO2萃取及其抑菌作用的研究[J].海峡药学,2009,21(7):46.
[4]高红宁,金万勤,郭立玮.微滤 -大孔树脂法精制苦参中氧化苦参碱和苦参总黄酮[J].西北药学杂志,2001,19(1):12.
