反相高效液相色谱法测定氯沙坦钾片的溶出度
2010-06-01刘睿斌刘俊敏
高 红,刘睿斌,刘俊敏
(重庆科瑞制药有限责任公司研发中心,重庆 400060)
氯沙坦钾(losartan potassium)是由美国默克公司开发的常用的抗高血压药,是第一个非肽类血管紧张素Ⅱ受体拮抗剂,氯沙坦钾片是一种作用持续稳定、耐受性良好、安全的治疗轻、中度原发性高血压的药物[1]。国外文献未查到氯沙坦钾片质量标准,国内现有的质量标准(新药转正标准)中采用分光光度法检查其片剂溶出度。本试验建立了高效液相色谱(HPLC)法测定氯沙坦钾片的溶出度方法,现报道如下。
1 仪器与试药
Waters高效液相色谱仪,2996检测器,Empower色谱工作站;1601型紫外分光光度计;梅特勒-托利多XS电子天平。氯沙坦钾对照品(批号为100597-200501,含量为100.0%,中国药品生物制品检定所);氯沙坦钾片(重庆科瑞制药有限责任公司,批号为080201);甲醇为色谱纯;其他为分析纯。
2 方法与结果
2.1 紫外分光光度(UV)法[2]
取本品,照溶出度测定法[2005年版《中国药典(二部)》附录第二法[3]附录73],以水900 mL为溶剂,照UV法[2005年版《中国药典(二部)》附录A][3]附录22,在256 nm的波长处分别测定吸光度。计算出每片的溶出量。
2.2 反相高效液相色谱(RP-HPLC)法
2.2.1 色谱条件
色谱柱:Inertsil ODS-3 柱(250 mm ×4.6 mm,5 μm);流动相:甲醇-水(含0.05 mol/L磷酸二氢钾,用磷酸调pH至3.2,64∶36);检测波长:250 nm;柱温:室温;流速:1.0 mL/min;进样量:10 μL。理论塔板数按氯沙坦钾峰计算应不低于4 000。高效液相色谱图见图1。

图1 高效液相色谱图
2.2.2 溶液制备
精密称取氯沙坦钾对照品0.011 g,置100 mL量瓶中,加水溶解并稀释至刻度制成每1 mL含55 μg的溶液,即得对照品溶液。照溶出度测定法[2005年版《中国药典(二部)》附录第二法][3],以水900 mL为溶剂,转速为50 r/min,依法操作,经45 min时,取溶液,滤过,即得供试品溶液。
2.3 方法学考察
检测波长选择:称取样品适量,加水溶解制成约含氯沙坦钾55 μg/mL的溶液,按[2005年版《中国药典(二部)》附录ⅣA UV法][3]在190~400 nm波长范围测定吸光度。由其紫外吸收光谱图可见,样品溶液在上述范围内无最大吸收峰,228及250 nm波长处出现较平坦肩峰,为与含量及有关物质测定波长一致,故选择250 nm作为检测波长。
线性关系考察:精密称取氯沙坦钾对照品0.011 43 g,加水制成质量浓度为0.114 3 mg/mL的贮备液,分别精密吸取1.0,3.0,5.0,7.0,9.0 mL,置10 mL量瓶中,加水制成每1 mL中含氯沙坦钾 11.43,34.29,57.15,80.01,102.87,114.3 μg 的溶液,依次进样测定,以氯沙坦钾对照品质量浓度为横坐标、峰面积为纵坐标绘制标准曲线,回归方程为 A=13 911.545 C+6 367.589,r=0.999 9(n=6)。结果表明氯沙坦钾质量浓度在 11.43~114.3 μg/mL范围内与峰面积线性关系良好。
精密度试验:精密称取质量浓度为57.15 μg/mL的对照品溶液,重复进样测定峰面积。结果的 RSD为0.19%(n=6)。
稳定性试验:将质量浓度为0.55 mg/mL的供试品溶液在室温放置,分别于配制后的 0,1,2,3,4,8 h时进样测定。结果峰面积的RSD为0.36%(n=6),表明供试品溶液在8 h内稳定。
加样回收试验:取已知含量的样品6份(约82 mg),精密称定,置250 mL量瓶中,分别加入约14,22,28 mg的氯沙坦钾对照品各2份,加水溶解并稀释至刻度,摇匀,滤过,精密量取续滤液5 mL,置10 mL量瓶中,加水稀释至刻度,摇匀,依法测定,按外标法计算含量,计算回收率。结果见表1。
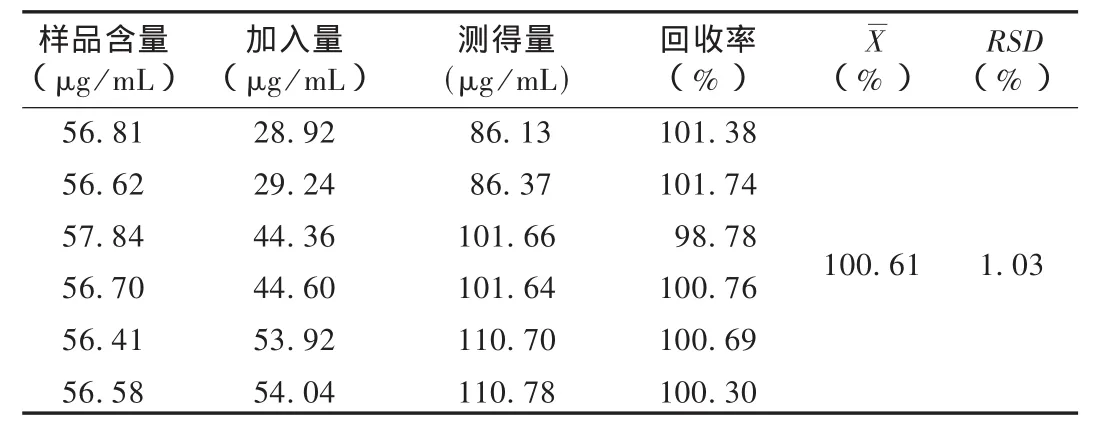
表1 氯沙坦钾加样回收试验测定结果(n=6)
色谱峰纯度检查:根据Waters色谱工作站的色谱峰纯度理论以及其Empower PDA软件,计算样品的氯沙坦钾色谱峰的纯度,纯度角(Purity Angle)为 0.116,纯度阈值(Purity Threshold)为 0.304,二者较小,且前者小于后者,表明被测成分氯沙坦钾峰光谱均匀,纯度较高。
2.4 溶出度结果比较
用《国家药品标准·新药转正标准》(第37册)中的UV法分别在 5,10,20,30,45,60 min 时取样测定,再用 RP-HPLC 法测定样品在上述时间段的溶出情况,结果见表2。可见,用RP-HPLC法代替标准中的UV法是可行的。
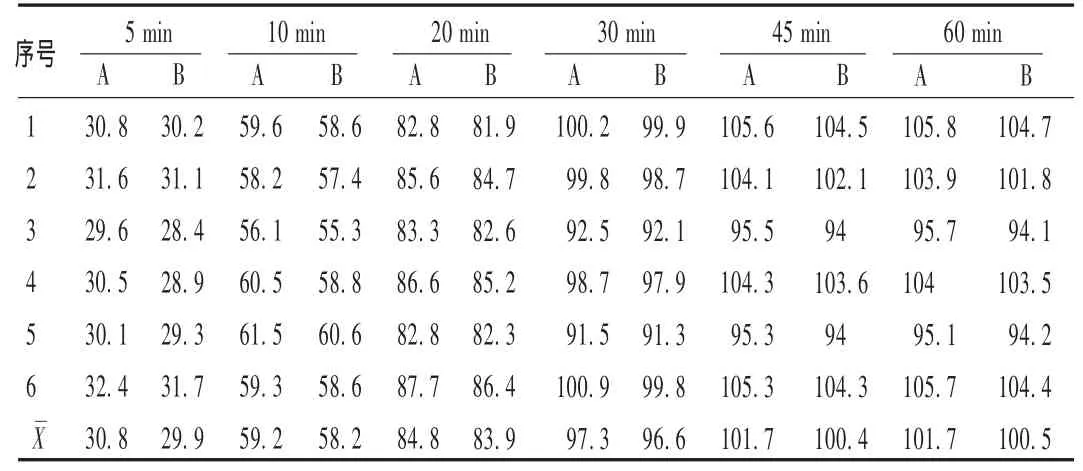
表2 溶出度测定曲线测定结果
3 讨论
在现行药品质量标准中,一方面,检测波长采用256 nm,既不是最大吸收,又不是肩峰吸收,测定误差相对较大,而本试验建立的RP-HPLC法,改测定波长为肩峰吸收250 nm,与含量及有关物质测定波长一致;另一方面,过滤后的样品需稀释后测定,而改为RP-HPLC法时则不需要稀释,简化了操作,减少了测定误差,结果更准确。
采用RP-HPLC法测定氯沙坦钾片的溶出度,方法简便,结果准确,重现性好,对今后该品种的质量标准的进一步完善提供了很好的参考。
[1]曾群英,麦炜颐.氯沙坦治疗轻中度原发性高血压病的临床研究 (附57 例报告)[J]. 新医学,1999,30(6):317.
[2]WS1-(X-144)-2003Z,国家药品标准·新药转正标准[S].
[3]国家药典委员会.中华人民共和国药典(二部)[M].北京:化学工业出版社,2005.
