基于常规实验室检查的良恶性胸/腹水鉴别诊断模型研究
2010-05-30张和陈朋果祝金泉吕农华
张和,肖 波,陈朋果,祝金泉,陈 江,吕农华
(南昌大学第一附属医院消化内科,江西省消化疾病研究重点实验室,江西南昌330006)
胸/腹水是常见临床病证,可分为良性和恶性两类。两类胸/腹水的鉴别既是诊断的基础,也是制定治疗方案的前提,但部分胸/腹水良恶性质的鉴别诊断至今仍困扰着临床医生[1]。目前胸/腹水的良恶性质鉴别诊断主要依赖脱落细胞学检查,尽管简单易行、特异性好,但其敏感性低[2],人们在不断地改进[3-5]。另一方面,也一直在寻找新的诊断方法[6],以弥补细胞学检查的不足,但单项指标常不能取得满意的诊断效率[7,8],而多项指标联合检测因过于复杂而临床应用受限[4,9]。近年来,随着计算机信息技术在医学中的应用不断推进,数据挖掘技术在医学中的应用受到重视[10],为胸/腹水的鉴别诊断开辟了新的途径[11-13]。为此,本研究尝试通过Logistic回归分析筛选出对胸/腹水的良恶性质具有鉴别诊断价值的常规实验室指标,并建立数学诊断模型,探索恶性胸/腹水的诊断新方法。
1 资料与方法
1.1 研究对象及诊断标准 南昌大学第一附属医院2001-2007年诊断明确的胸/腹水住院的316例患者,男173例,女143例,年龄15-86岁,平均 51.0岁。其中良性胸/腹水175例,恶性胸/腹水141例。良性积液包括肝硬化失代偿期103例,结核性胸膜炎30例,结核性腹膜炎29例,其他病因13例。恶性积液包括肺癌43例,卵巢癌22例,胃癌22例,肝癌14例,原发癌灶不明19例,其他少见恶性肿瘤21例。
符合下列条件之一者诊断为恶性胸/腹水:(1)胸/腹水脱落细胞学检查发现肿瘤细胞;(2)手术组织病理学诊断为恶性肿瘤;(3)医学影像学检查发现占位性病变并经穿刺活组织检查证实为恶性肿瘤;(4)综合影像学发现(占位病变)和其他资料临床诊断为恶性肿瘤并经随访证实。不具备上述条件之一者诊断为良性胸/腹水。
1.2 资料收集 收集患者入院后首次测定的血细胞分析(血红蛋白、红细胞、白细胞、血小板)、肝功能(谷丙转氨酶、谷草转氨酶、总胆红素、结合胆红素、血清总蛋白、血清白蛋白、谷氨酰转肽酶、碱性磷酸酶)、血钠、血钙、血沉、胸/腹水常规及生化检查结果(外观、有核细胞计数、Rivalta试验、蛋白定量、乳酸脱氢酶)、血清肿瘤标志物检测结果(CEA、CA19-9、CA125、AFP、SF)、胸/腹水脱落细胞学和染色体检查结果、影像学检查结果(B超、CT、MRI、X线片)、病理检查结果。
1.3 数据分析及统计学处理 采用SPSS 13.0软件进行数据分析。以患者的病因诊断为因变量(良性=0,恶性=1),以上述各项实验室检查的单项结果为自变量,进行单因素二值Logistic回归分析(定性指标阴性赋值为0,阳性赋值为1;定量指标使用实测值),观察各单项检查对良性与恶性胸/腹水的鉴别诊断价值;选择有诊断价值的指标进行多因素后向逐步二值Logistic回归分析,筛选具有独立诊断价值的指标,并得到多元Logistic回归方程及其对每个病例的类别概率预测值,根据后者绘制受试者工作特征(ROC)曲线,确定最佳判别界值,获得所建数学模型对两组病例的判别诊断结果,并计算数学模型对诊断恶性胸/腹水的敏感度、特异度、准确度、阳性预测值、阴性预测值。
2 结果
2.1 各单项指标单因素Logistic回归分析 结果显示下列指标对良性与恶性胸/腹水的鉴别诊断有意义(P=0.000-0.018):血细胞分析的全部4项指标,肝功能检查中的总胆红素和结合胆红素,血钙,胸/腹水常规与生化检查中的是否血性积液、蛋白定量、乳酸脱氢酶和 Rivalta试验,肿瘤标志物中的CEA和CA125,其余指标无鉴别诊断价值(P=0.059-0.994)。同时分析了脱落细胞的细胞学和染体两项特殊检查。详见表1。

表1 胸/腹水患者常规实验室检查的各单项指标单因素Logsitic回归分析结果
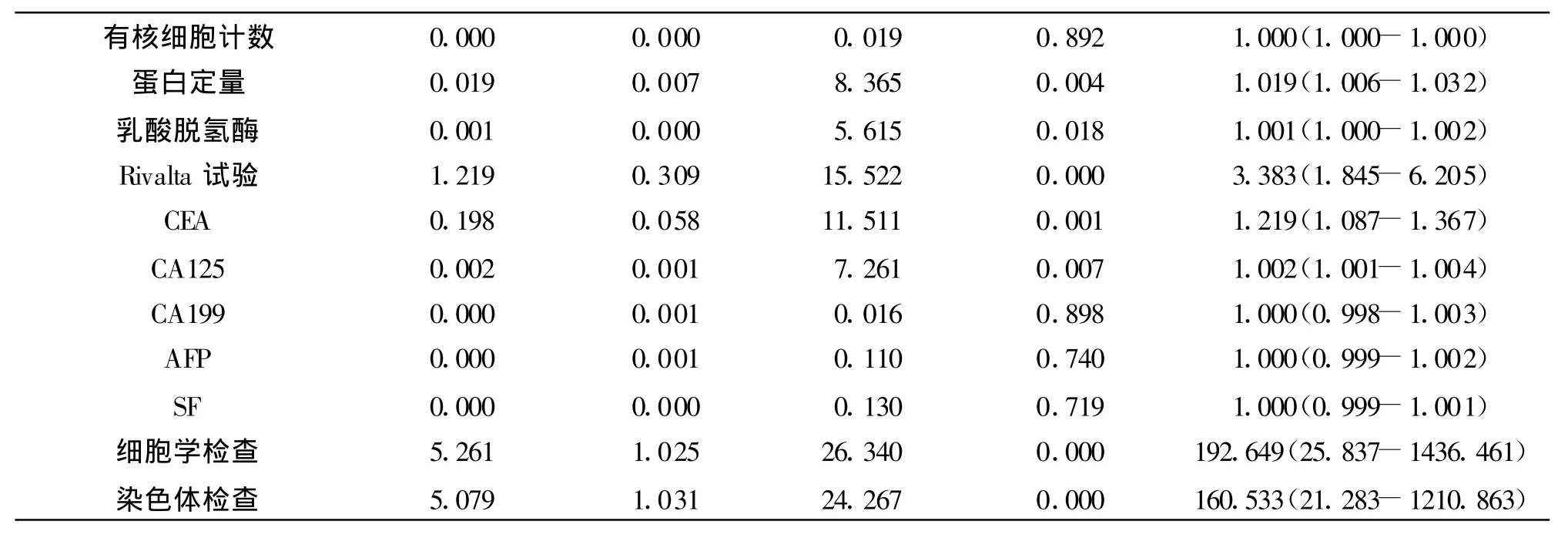
有核细胞计数 0.000 0.000 0.019 0.892 1.000(1.000-1.000)蛋白定量 0.019 0.007 8.365 0.004 1.019(1.006-1.032)乳酸脱氢酶 0.001 0.000 5.615 0.018 1.001(1.000-1.002)Rivalta试验 1.219 0.309 15.522 0.000 3.383(1.845-6.205)CEA 0.198 0.058 11.511 0.001 1.219(1.087-1.367)CA125 0.002 0.001 7.261 0.007 1.002(1.001-1.004)CA199 0.000 0.001 0.016 0.898 1.000(0.998-1.003)AFP 0.000 0.001 0.110 0.740 1.000(0.999-1.002)SF 0.000 0.000 0.130 0.719 1.000(0.999-1.001)细胞学检查 5.261 1.025 26.340 0.000 192.649(25.837-1436.461)染色体检查 5.079 1.031 24.267 0.000 160.533(21.283-1210.863)
2.2 常规实验室检查的各单项指标对良性与恶性胸/腹水的诊断价值 在单因素Logistic回归分析中,上述有鉴别诊断意义的各单项指标对良性胸/腹水的诊断符合率为39.4%-89.0%,平均59.3%,对恶性胸/腹水的诊断符合率为31.4%-83.9%之间,平均62.6%,总诊断符合率为49.3%-69.4%,平均60.5%(表2)。同时分析了细胞学和染体两项特殊检查的诊断符合率。
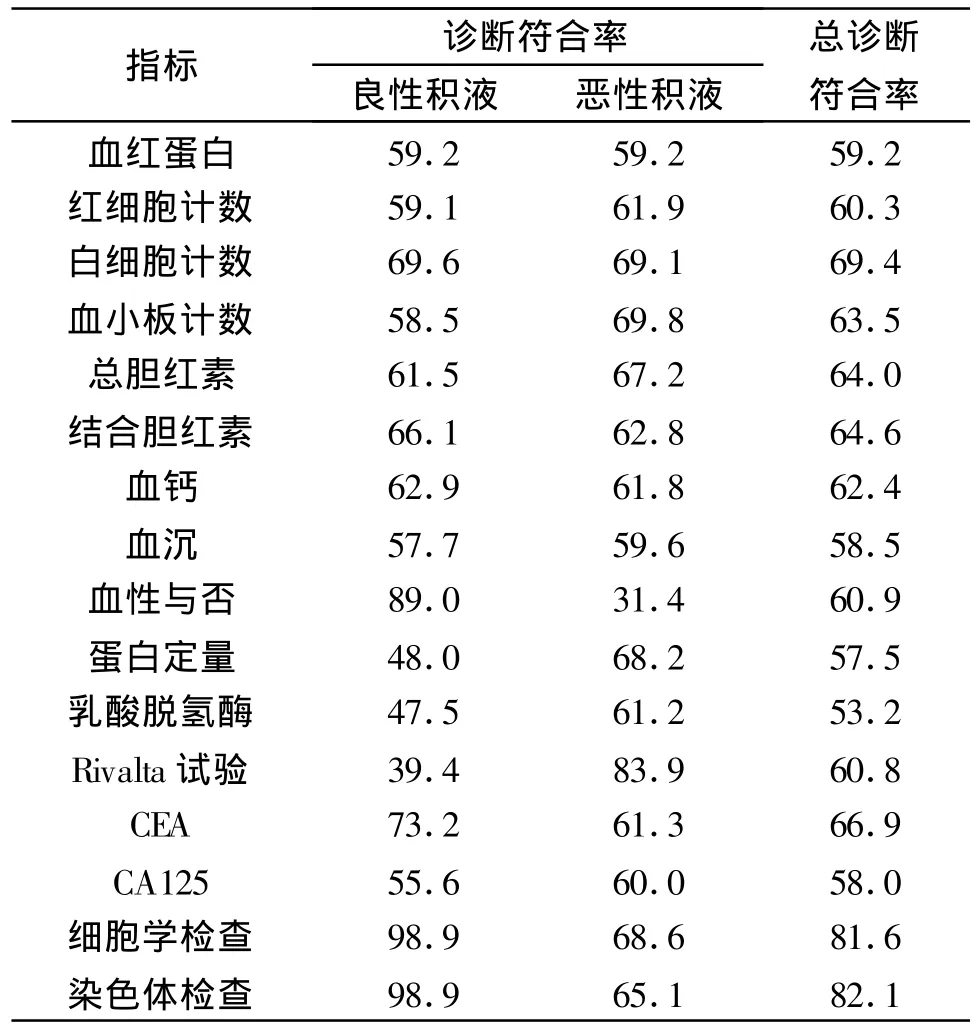
表2 单项常规实验室检查指标对良性与恶性胸/腹水的诊断符合率
2.3 常规实验室指标的多因素Logistic回归分析进入回归方程的指标有4项,即血白细胞计数(WBC)、血总胆红素(TBIL)、Rivalta试验(RIVALTA)和血清CEA(表3)。求得的Logisitic回归方程为:
Logit(P)=-3.420+0.148WBC-0.015TBIL+2.598RIVALTA+0.246CEA

表3 胸/腹水患者常规实验室指标的多因素Logistic回归分析结果
2.4 诊断模型对恶性胸/腹水的诊断效率 将所建立的回归方程变形为求概率值的表达式(诊断模型),回代计算各例的良恶概率预测值,绘出ROC曲线(图 1),曲线下面积为0.886(95%CI 0.822-0.949;P=0.000),求得最佳的诊断界值为0.53,大于或等于该界值的病例判为恶性胸/腹水,否则判为良性。诊断模型以及细胞学和染色体检查对恶性胸/腹水的诊断效率见表4。

图1 基于常规实验室检查4个单项指标的Logistic回归模型诊断恶性胸/腹水的ROC曲线图
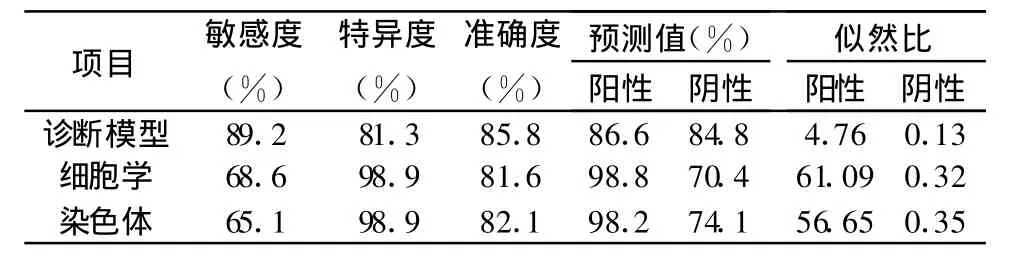
表4 数学诊断模型、细胞学和染色体检查对恶性胸/腹水的诊断效率
3 讨论
借助现代统计学和计算机技术进行数据挖掘,应用多项指标建立数学模型,是诊断学发展的一个重要趋势,促进了由定性诊断向定量诊断过渡,也为资料的综合利用和再利用提供了有效途径。Kamath等[14]以血清胆红素、凝血酶原国际标准化率、肌酐及病因类型建立起终末期肝病模型(MELD),成为目前评定终末期肝病严重程度的客观、实用模型,被美国器官共享网络正式启用作为器官分配的评定依据。我们采用常规临床实验室检测结果也建立起预测效果良好且简单易行的肝硬化食管静脉曲张破裂出血患者住院期间死亡预测模型[15]。Neves等[11]从临床、放射影像学和实验室检查中筛选出5项指标建立Logistic回归模型,诊断结核性胸水的敏感度和特异度均在95%以上。Esquerda等[12]应用决策树模型鉴别胸水的性质(渗出液或漏出液)取得了良好的效果,优于经典的方法。
本研究结果显示,半数左右的常规临床实验室检查中的单项对良恶性胸/腹水的鉴别诊断有一定的价值,但准确度均在70%以下。因此,单项检查结果对胸/腹水良恶性质的鉴别诊断价值有限。通过多因素Logistic回归分析,筛选出WBC、TBIL、RIVALTA和CEA建立回归方程变形为数学模型,对良恶性胸/腹水的鉴别诊断价值明显提高,准确度达到85.8%,高于脱落细胞学检查(81.6%)或染色体检查(82.1%)。
脱落细胞学和染色体检查是目前常用也是主要的诊断恶性积液的特殊检查,多数报道认为有较好的特异性,但敏感性低[16,17]。本研究对脱落细胞学检查和染色体检查的单因素Logistic回归分析结果显示,两者对良性积液的诊断符合率良好,达到98%以上,但对恶性积液的诊断符合率却不理想,不到70%,准确度只有80%左右。细胞学检查操作较简单,脱落细胞涂片染色后光镜下观察即可,但要求检查者有丰富的细胞学诊断经验,较基层的医疗单位难以开展。染色体检查操作较复杂,需要脱落细胞培养处理和染色体制片。因此,细胞学和染色体检查在良恶性积液鉴别诊断均有其局限性。
肿瘤标志物检测对良恶性胸/腹水的鉴别诊断价值近来有不少报道,多数认为有一定的鉴别诊断价值[18,19]。本研究显示,单项血清肿瘤标志物的鉴别诊断价值有限。在5种临床常用标志物中,CA199、AFP和 SF均无价值,只有CEA和CA125有一定的诊断价值(准确度分别为66.9%和58.0%),但与常规检查中有诊断价值的单项相比并无优势。因此,血清肿瘤标志物检测对胸/腹水良恶性质的鉴别诊断价值需要进一步评估。
新近李承彬等[20]报道,以血清与胸/腹水的白蛋白差值和CEA、LDH、ADA的比值为变量,采用与本研究相似的方法建立数学模型,对良恶性胸/腹水的鉴别也取得了较好的诊断效率。本研究与李承彬等报道不同,采用常规的临床检验指标建立数学模型,因简单易行而更具有实用价值,可在较基层的医院开展。同时,本研究也为如何充分利用常规实验室检查数据来诊断疾病开辟了一条值得探索的途径。
本数学模型虽有较好的诊断价值,但尚待更高的诊断效率以更好地满足临床要求。因此,有必要进行前瞻性研究,以进一步完善诊断模型,并验证其诊断价值。
[2]Oyafuso MS,Longatto Filho A,Bortolan J,et al.Cytological diagnosis of serous effusions in a cancer hospital in Brazil[J].Pathologica,1996,88(2):128.
[3]Pereira TC,Saad RS,Liu Y,et al.The diagnosis of malignancy in effusion cytology:a pattern recognition approach[J].Adv Anat Pathol,2006,13(4):174.
[4]Metzgeroth G,Kuhn C,Schultheis B,et al.Diagnostic accuracy of cytology and immunocytology in carcinomatous effusions[J].Cytopathology,2008,19(4):205.
[5]He DN,Zhu HS,Zhang KH,et al.E-cadherin and calretinin as immunocytochemical markers to differentiate malignant and benign serous effusions[J].World J Gastroenterol,2004,10(16):2406.
[6]Mohanty SK,Dey P.Serous effusions:diagnosis of malignancy beyond cytomorphology.An analytic review[J].PostgradMed J,2003,79(936):569.
[7]Braunschweig R,Guilleret I,Delacretaz F,et al.Pitfalls in TRAP assay in routine detection of malignancy in effusions[J].Diagn Cytopathol,2001,25(4):225.
[8]Zhang KH,Cao F,Fu QB,et al.Detection of mRNAs of GA733 genes by RT-PCR in exfoliated cellsof pleural and peritoneal effusions and its clinical values[J].InternMed,2007,46(18):1489.
[9]Passebosc-Faure K,Li G,Lambert C,et al.Evaluation of a Panel ofMolecularMarkers for the Diagnosis of Malignant Serous Effusions[J].Clin Cancer Res,2005,11:6862.
[10]陈 明.医学数据挖掘综述[J].医学信息,2008,21(1):19.
[11]Neves DD,Dias RM,Cunha AJ.Predictive model for the diagnosis of tuberculous pleural effusion[J].Braz J Infect Dis,2007,11(1):83.
[12]Esquerda A,Trujillano J,López de Ullibarri I,et al.Classification tree analysis for the discrimination of pleural exudates and transudates[J].Clin Chem Lab Med,2007,45(1):82.
[13]Antonangelo L,Vargas FS,Seiscento M,et al.Clinical and laboratory parameters in the differential diagnosis of pleural effusion secondary to tuberculosis or cancer[J].Clinics,2007,62(5):585.
[14]Kamath PS,Wiesner RH,Malinchoc M,et al.A model to predict survival in patients with end-stage liver disease[J].Hepatology,2001,33(2):464.
[16]雷振之.胸液良恶性鉴别的实验室检查新进展[J].中国实用内科杂志,2002,22(1):2.
[17]岑 岭.染色体检查对良恶性胸(腹)水的鉴别价值[J].临床检验杂志,2004,22(6):422.
[18]李建刚,吉志固,朱自力,等.6种肿瘤标志物检测恶性胸腹水的临床价值[J].肿瘤基础与临床,2008,21(13):242.
[19]Trapé J,Molina R,Sant F.Clinical evaluation of the simultaneous determination of tumormarkers in fluid and serum and theirratio in the differential diagnosis of serous effusions[J].Tumour Biol,2004,25(5-6):276.
[20]李承彬,王文清.数学模型运用于多指标联合鉴别胸腹水性质[J].临床检验杂志,2008,26(2):146.
