流式细胞术分析ITP巨核细胞分化发育异常的初步研究
2010-05-30张海燕屈晨雪王建中张晓辉付海霞袁家颖
张海燕,屈晨雪,王建中*,张晓辉,付海霞,汪 润,袁家颖
(1.北京大学第一医院检验科,北京100034;2.北京大学人民医院 血液科)
特发性血小板减少性紫癜(ITP)是临床出血性疾病的常见病和多发病,患者血小板显著减少,严重者出现自发性出血并可危及生命。最新的研究表明,ITP的发病不仅与抗血小板自身抗体导致的血小板破坏过多有关,还与自身抗体介导的巨核细胞发育异常和CD8+T细胞抑制巨核细胞凋亡密切相关[1]。诸多体外试验已证实,ITP患者的血浆能明显抑制巨核细胞的生成和成熟度是导致其血小板生成减少的重要因素[2]。然而,到目前为止,对于ITP患者体内骨髓巨核细胞在分化发育过程中的变化,尤其是对不同DNA倍体巨核细胞功能蛋白表达的研究了解甚少。本研究主要通过建立人骨髓流式巨核细胞分析的临床实用新方法,初步探讨ITP患者巨核细胞在体内复杂环境中数量与糖蛋白表达水平的变化,进一步阐明ITP的发病机制,从而为ITP的实验诊断及治疗提供依据。
1 资料与方法
1.1 研究对象
15例骨髓移植健康供者作为对照组(NOR),女性5例,男性9例,年龄20-55岁;37例ITP,其中初发患者29例和治疗后未缓解患者8例,男性9例,女性28例,年龄15-81岁。所有病例均符合ITP临床诊断标准[3];11例继发性血小板减少症(ST组),其中6例白血病骨髓移植后,5例其他病因引起的ST(甲状腺机能减退症1例,巨幼细胞性贫血2例,类风湿性关节炎1例,再生障碍性贫血1例)。
1.2 仪器和试剂
FACSCalibur流式细胞仪(美国 BD公司);HERMLE-Z383K型离心机(德国HERMLE公司);异硫氰酸荧光素(FITC)标记的抗血管性血友病因子(vWF)多克隆抗体 (美国AbD公司);别藻青蛋白(APC)标记的CD41a单克隆抗体(美国BD公司);FITC标记的抗CD42a单克隆抗体(美国BD公司);APC标记的抗P-选择素(CD62P)单克隆抗体(美国BD公司);标准微球(CaliBRITE beads)(美国BD公司);碘化丙锭(PI)(美国Sigma公司);Percoll细胞分离液(美国GE公司);透膜液(PERM)(美国BD公司);OLYMPUS显微镜等。
1.3 方法
1.3.1 标本采集 骨髓穿刺液2 ml,加入含EDTA(终浓度为1.5 mg/ml)的抗凝管中。
1.3.2 巨核细胞计数 取3 μ l抗凝骨髓液涂片,用瑞-姬染液染色,光学显微镜低倍镜下计数3 μ l骨髓液涂片中全部巨核细胞的数量,并在油镜(1000×)下确认。
1.3.3 巨核细胞分离富集 用等渗的Percoll和磷酸盐缓冲液(PBS)将骨髓中有核细胞数量调整至20×106个,并将其Percoll密度调至1.020 g/mL,将配好的1.020 g/mL骨髓液缓缓加在2 ml密度为1.055 g/ml Percoll分离液上方,然后再加入2 ml PBS,400 g离心20 min,吸取Percoll分离液上面的灰白色细胞层,移至另一个试管中,加1.5倍体积的PBS,300 g离心10 min,弃上清。留取细胞沉淀待用。
1.3.4 巨核细胞的免疫荧光染色 将富集好的巨核细胞悬液用PBS调成(2-3)×106/ml,加入透膜液 500 μ l,混匀 ,室温放置 10 min,加入2 mL PBS 450 g,离心 5 min。弃上清。分别加入 CD41a-APC 5 μ l、vWF-FITC 5 μ l、CD62P-APC 5 μ l,混匀 ,室温下避光 20 min。加2 ml PBS,100 g离心7 min。弃上清。加入RNase 100 μ l,放入37℃水浴箱中孵育30 min。将细胞悬液调整 500 μ l左右,加入 5 mg/ml PI染色后上流式细胞仪检测。
1.3.5 流式细胞仪检测 运用标准微球(CaliBRITE beads)校准流式细胞仪光路、电压及补偿。采用侧向角散射光(SSC)和糖蛋白标记的荧光强度(CD41a-SSC,vWF-SSC)作图,获取 500 000-1 000 000个细胞。在CD41a-PI、vWF-PI双参数散点图中,分别以CD41a、vWF阳性信号设门后分析巨核细胞DNA倍体分布百分率和不同倍体各种糖蛋白的表达水平,后者以相对荧光强度表示蛋白表达量,相对荧光强度为各种糖蛋白表达阳性细胞的荧光强度除以其阴性细胞的荧光强度。
1.4 统计学分析
三组巨核细胞的绝对数量、巨核细胞DNA倍体百分率、糖蛋白CD41a、vWF、CD62P在各个DNA倍体上的表达量用均数(¯x)±标准差(S)表示。采用SPSS 13.0统计软件进行分析,首先进行正态性检验和方差齐性检验;满足单因素方差分析条件进行单因素方差分析,然后进行Multiple Comparisons LDS两组之间分析;否则采用多个独立样本的非参数检验,然后进行两个独立样本的非参数检验,比较两组之间的差异。P<0.05为差异有统计学意义。
2 结果
2.1 三组人群静脉血血小板数量(PLT)与骨髓涂片巨核细胞的绝对数量
结果显示ITP组和ST组的PLT与对照组相比明显降低,差异有统计学意义(P<0.01)。三组之间骨髓巨核细胞绝对数量的差异无统计学意义(P>0.05),结果见表1。
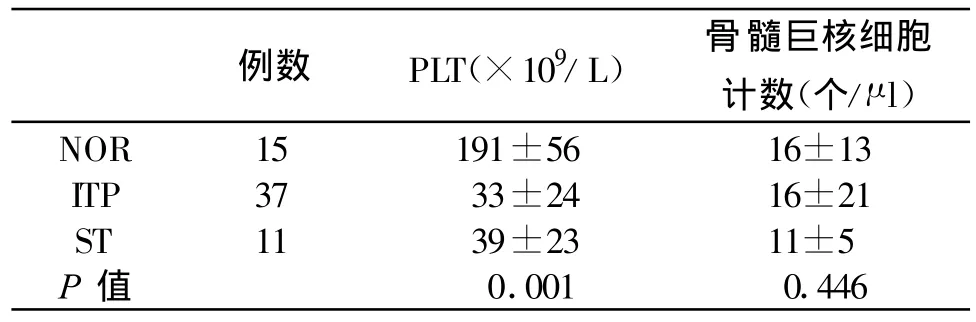
表1 三组人群血小板数量与骨髓巨核细胞绝对数量比较
2.2 骨髓富集前后巨核细胞DNA倍体比较
富集和未富集的骨髓标本同时标记CD42a-FITC和PI,流式细胞仪分别检测两种标本,收获500 000个细胞,以CD42a-PI双参数作图分析巨核细胞DNA倍体,比较富集前后DNA倍体。结果显示未富集标本中巨核细胞少,DNA倍体分布不明显;富集后巨核细胞比例显著增多,且倍体分布明显、清晰。其中1例对照标本未富集时,巨核细胞约占0.06%;富集后巨核细胞占1.02%;增多了17倍。
2.3 两种标志物分析巨核细胞DNA倍体和蛋白表达量水平比较
以vWF-SSC或CD41a-SSC收获骨髓巨核细胞,vWF或CD41a阳性设门R1。以vWF-PI做图分析巨核细胞(R1)中各倍体的分布百分率,同时分析各倍体的vWF或CD41a的表达量。ITP组分别以vWF和CD41a设门时,各倍体巨核细胞百分率与对照组无差异(P>0.05)。ST组以 vWF设门,在 4N、8N时,DNA倍体百分率高于ITP组和对照组,差异有统计学意义(P<0.05)。以CD41a设门,16N时,ST组明显低于对照组和ITP组,差异有统计学意义(P<0.05)。见表2,表3。

表2 用vWF设门三组巨核细胞在各个倍体百分率比较
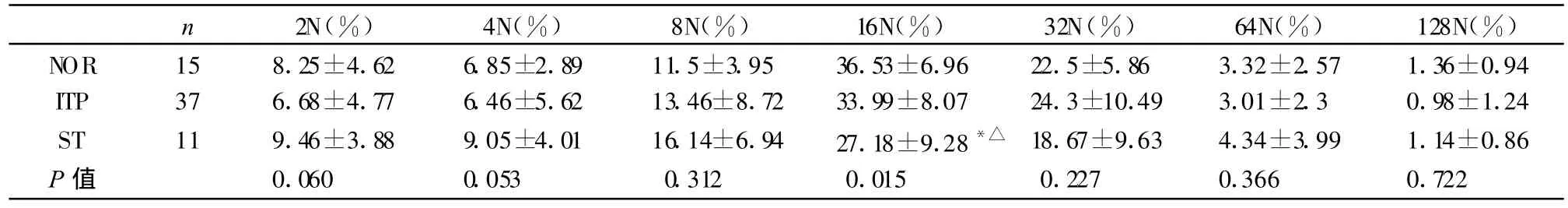
表3 用CD41a设门三组巨核细胞在各个倍体百分率比较
2.4 巨核细胞CD41a、vWF及CD62P在各倍体巨核细胞的表达水平
对照组骨髓巨核细胞CD41a、vWF、CD62P表达量随DNA倍体的增加而升高,32N达峰值。ITP组骨髓巨核细胞CD41a表达量在 2N、4N、8N、16N、32N、64N等倍体明显高于对照组,差异有统计学意义(P<0.01);而与ST组相比,ITP组巨核细胞的CD41a表达量增高,但差异无统计学意义(P>0.05)。ITP组骨髓巨核细胞的vWF表达量低于对照组,在32N时差异有统计学意义(P>0.05)。ITP组骨髓巨核细胞的vWF表达量低于对照组,高于ST组,但差异没有显著性(P>0.05),仅在32倍体时的差异有显著意义(P=0.018)。各倍体巨核细胞CD62P的表达量在三组之间均无显著性差异(P>0.05)。三组数据比较见表4、表5、表6。

表4 三组人群巨核细胞CD41a表达量比较
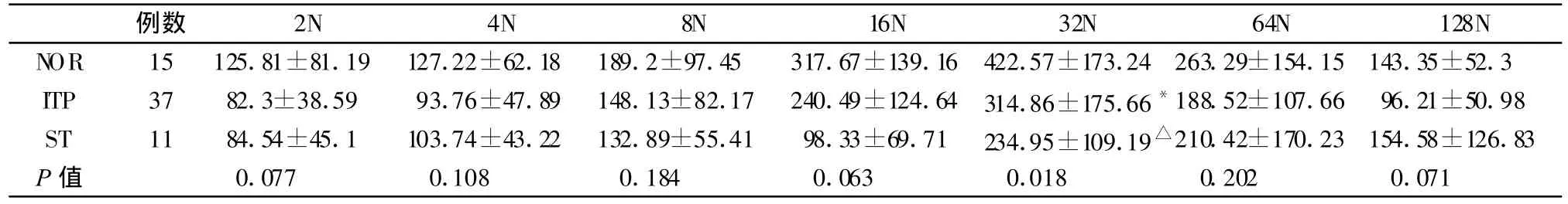
表5 三组人群巨核细胞vWF表达量比较
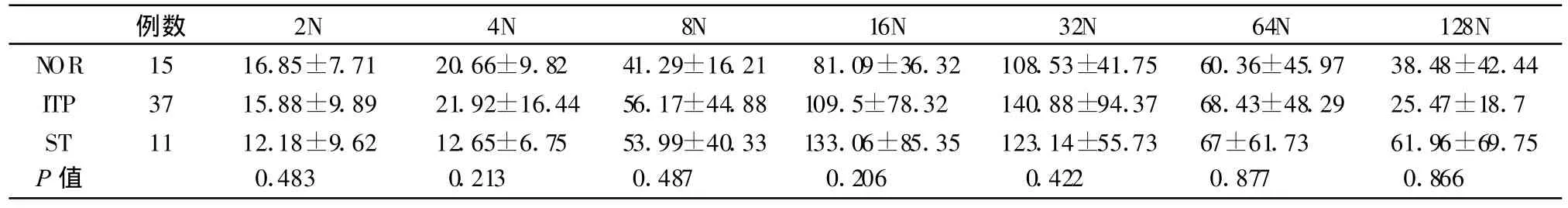
表6 三组人群巨核细胞CD62P表达量比较
3 讨论
传统的ITP发病机制主要是由于患者体内的自身抗体与血小板结合,导致血小板被单核巨噬细胞系统过度破坏而导致血小板减少。然而,抗体介导的血小板减少并不能解释所有ITP患者血小板减少的病因:①并非所有ITP患者的血浆/血清能引起正常人血小板减少;②血小板自身抗体只能在50%-70%的ITP患者中检测到;③部分患者病情的缓解与体内抗体的水平无相关性。这些均提示ITP患者体内可能还存在其他引发血小板减少的机制[1]。
由于巨核细胞在骨髓中所占比例极低(占骨髓有核细胞的0.05%),以前的大多数文献报道主要都是用体外培养巨核细胞株的研究。本研究采用Percoll密度梯度离心法富集巨核细胞,克服了巨核细胞数量少的缺点。结果显示富集后巨核细胞数量增加可达17倍,而且更易看到其多倍体性;未富集标本巨核细胞的数量较少,倍体分布也不明显。富集前后相比,DNA倍体分布相似,无明显的差异[4]。
在ITP患者中,针对CD41a(GPIIb/IIIa)的自身抗体最常见,故试验中选择了糖蛋白CD41a和对幼稚巨核细胞更敏感的vWF作为观察指标[5]。此外标记时,采用透膜后标记CD41a,这样能同时标记巨核细胞膜表面及胞质中CD41a分子,更加全面反映巨核细胞CD41a的合成水平,也排除了在低倍体2N、4N时血小板粘附的影响,使巨核细胞的识别更加特异。
体外研究发现部分自身抗体阳性ITP患者的血浆的确能抑制巨核细胞生成的数量和成熟度;骨髓检查显示多数患者骨髓巨核细胞计数不增多,甚至减少。可能是自身抗体抑制了巨核细胞的生成[6,7]。
正常巨核细胞倍体分布是以16倍体为主,其次是8倍体和32倍体。16N约占50%,大于16N和小于16N的倍体约占50%。本研究对照组的巨核细胞DNA倍体分布基本正常。ITP组巨核细胞的倍体分布与对照组基本相同,各倍体巨核细胞数量并无差异(P>0.05)。分析其原因可能是ITP时抗血小板糖蛋白自身抗体与巨核细胞结合后,仅对巨核细胞蛋白表达产生影响,而对细胞DNA未产生影响,因此DNA倍体分布不发生偏移[4]。此外,本研究显示ST组在4N、8N时巨核细胞数量明显高于对照组和ITP组(P<0.05),这可能是因为该组近50%的标本来自白血病骨髓移植后血小板减少,患者幼稚巨核细胞较多,从而造成了4N和8N增多,而16N减少。
CD41a是巨核细胞合成的与血小板聚集功能相关的糖蛋白,生理状况下随着巨核细胞DNA倍体的增加而表达增高。本次试验中发现:ITP患者各个倍体巨核细胞的CD41a表达规律与对照组相同,但在巨核细胞发育的整个阶段(2N-64N)中,ITP患者CD41a表达量明显高于正常人(P<0.05),其原因可能是ITP时机体产生的抗CD41a的自身抗体使血小板CD41a被单核巨噬细胞系统破坏[8,9],机体为了维持其正常的血小板聚集功能而使巨核细胞合成更多的CD41a,以满足血小板功能需要。从实验结果看这种代偿从原始巨核细胞阶段开始,贯穿巨核细胞发育整个过程。因此,可以推测ITP时,骨髓巨核细胞为了代偿其功能而发生糖蛋白CD41a表达的异常。同时ITP患者CD41a表达量也高于ST组,但无显著性差异(P>0.05),究其原因可能是由于ST组标本例数偏少所致无统计学意义;也可能是ST患者巨核细胞也会代偿地产生更多的CD41a,但是不如ITP那么强。
vWF是血管内皮细胞和骨髓巨核细胞合成的一种糖蛋白[10],vWF的表达量在对照组随着巨核细胞倍体增加而升高,但ITP患者巨核细胞的vWF表达量低于对照组,尤其在高倍体(32N)减低更显著(P<0.05)。电镜检查发现ITP时患者骨髓巨核细胞线粒体和内质网肿胀,形成胞质内空泡增多等[11],可能使巨核细胞质中vWF的合成受到影响;由于成熟巨核细胞vWF合成量是不成熟巨核细胞的7.5倍[12],故ITP时高倍体的巨核细胞vWF合成减少更明显。继发性血小板减少症巨核细胞vWF合成也有降低,可能主要是该组中用一半是骨髓移植后患者,骨髓还处于抑制阶段,故vWF合成较少。
CD62P是巨核细胞内α颗粒膜糖蛋白,在ITP组各倍体巨核细胞的CD62P表达量与对照组比较并无明显变化,这与形态学观察到的巨核细胞内颗粒减少不尽一致。由于CD62P在巨核细胞内质网中合成后被运输到高尔基体中成熟,再跨高尔基体网络分类,最后被运输到α颗粒[13]。在未成熟的巨核细胞中,CD62P和vWF是共定位的[14],因此两者在三组人群低倍体巨核细胞的表达均没统计学意义;而在成熟的巨核细胞中,CD62P和vWF在定位在不同的α颗粒[14],CD62P在三组人群之间没有统计意义,可能提示CD62P所存在的α颗粒是正常的,或者巨核细胞质中CD62P的合成的总量是正常的。vWF在高倍体巨核细胞(32N)中显著减低,提示ITP时成熟巨核细胞合成vWF的总量减低,或所存在的α颗粒可能存在异常。
综上所述,本研究建立了流式细胞术分析人骨髓巨核细胞倍体和糖蛋白表达水平的新方法,并使其有了临床可用性。同时探讨了ITP疾病状态下骨髓巨核细胞分化发育过程中DNA倍体和糖蛋白表达量的变化,表明ITP患者骨髓巨核细胞的数量和DNA倍体并未受到影响,但功能蛋白的合成却有显著变化,尤其是与血小板聚集和粘附功能相关的糖蛋白CD41a在绝大多数不同倍体的巨核细胞中合成显著增高,vWF在高倍体成熟巨核细胞中合成明显降低,CD62P维持在正常水平,为进一步阐明ITP的发病机制、诊断与治疗等研究提供了重要的实验依据。
致谢:北京道培医院武平、童春荣大夫,北京大学第一医院血液内科尹悦大夫为骨髓标本采集提供了帮助,在此一并致谢!
[1]侯 明,秦 平.特发性血小板减少性紫癜的发病机制[J].内科理论与实践,2008,3(2):96.
[2]Mcmillan R.The pathogenesisof chronic immune thrombocytopenic purpura[J].Semin Hematol,2007,44(4 Suppl 5):S3.
[3]侯 明.成人特发性血小板减少性紫癜诊断治疗专家共识[J].中华血液学杂志,2009,30(9).
[4]Tomer A,Friese P,Conklin R,et al.Flow cytometric analysis of megakaryocytes from patients with abnormal platelet counts[J].Blood,1989,74(2):594.
[5]Tomer A.Human marrow megakaryocyte differentiation:multiparameter correlative analysis identifies von Willebrand factor as a sensitive and distinctive marker for early(2N and 4N)megakaryocytes[J].Blood,2004,104(9):2722.
[6]Leven R M.Differential regulation of integrin-mediated proplatelet formation and megakaryocyte spreading[J].J Cell Physiol,1995,163(3):597.
[7]Leven R M,Tablin F.Extracellular matrix stimulation of guinea pig megakaryocyte proplatelet formation in vitro is mediated through the vitronectin receptor[J].Exp Hematol,1992,20(11):1316.
[8]吴 煦,王建中,李传保,等.流式免疫微球芯片技术分析特异性血小板自身抗体[J].中华检验医学杂志,2008,31(1):32.
[9]Mcmillan R.Antiplatelet antibodies in chronic immune thrombocytopenia and their role in platelet destruction and defective platelet production[J].Hematol Oncol Clin North Am,2009 23(6):1163.
[10]谢 飞,审校王鸿利.血管性血友病因子研究进展[J].国际检验医学杂志,2006,27(7):622.
[11]Houwerzijl E J,Blom N R,van der Want J J,et al.Ultrastructural study shows morphologic features of apoptosis and para-apoptosis in megakaryocytes from patients with idiopathic thrombocytopenic purpura[J].Blood,2004,103(2):500.
[12]Schick P K,Walker J,Profeta B,et al.Synthesis and secretion of von Willebrand factor and fibronectin in megakaryocytes at different phases of maturation[J].Arterioscler Thromb Vasc Biol,1997,17(4):797.
[13]Blair P,Flaumenhaft R.Platelet alpha-granules:basic biology and clinical correlates[J].Blood Rev,2009,23(4):177.
[14]Zingariello M,Fabucci M,Bosco D,et al.Differential localization of P-selectin and von Willebrand factor during megakaryocyte maturation[J].Biotech Histochem,2009:1.
