组织多肽特异性抗原检测在非小细胞肺癌中的临床意义
2010-05-30魏民
魏 民
(濮阳市油田总医院病理科,河南濮阳457001)
近年来,非小细胞肺癌的发病率逐年增高,寻找理想的肿瘤标记物直接关系到非小细胞肺癌患者的早期发现和生存时限。其中组织多肽特异性抗原(tissue polypeptide specific antigen,TPS)是一种与肿瘤细胞DNA合成相关联、反映肿瘤细胞活性的标志物,在多种肿瘤及其各个阶段均有较高表达,其血清水平可反映肿瘤细胞增殖分裂的情况,有助于观察治疗效果和预测早期复发。我们通过检测48例非小细胞肺癌患者血清中TPS的水平,以探讨其在非小细胞肺癌中的临床意义。现报告如下。
1 资料与方法
1.1 一般资料
本研究选择自2005年6月-2009年6月在我院住院治疗的非小细胞肺癌患者48例,其中男33例,女15例,年龄38-75岁,年龄>60岁 21例,≤60岁27例,平均年龄56.2岁;所有患者均经活检病理组织学证实为原发性非小细胞肺癌,其中鳞状细胞癌23例,腺癌25例;临床分期Ⅰ-Ⅱ19例,Ⅲ-Ⅳ29例;纵隔淋巴结转移22例;手术20例;化疗37例。肺部良性疾病组选择肺结核瘤、肺炎性假瘤、肺错构瘤、肺脓肿等患者30例,男20例,女 10例,年龄29-71岁,平均53.8岁。健康对照组选择正常健康献血员40例,男27例,女13例,年龄 25-55岁,平均年龄46.3岁。
1.2 检测方法
所有实验组和对照组受检者均于早晨空腹状态下采外周静脉血5 ml,经离心处理后分离血清,置-80℃冰箱中保存待测。避免反复冻融。TPS检测采用酶联免疫吸附法(ELISA)进行。试剂盒均购自瑞典BEKI Diagnostics AB公司,使用Labsystems Multiskan Ascent酶标仪和WZQ-1型微量振荡器。按照试剂盒说明书进行操作。终止反应后450 nm测定吸光度值,绘制标准曲线并计算样品浓度值,当血清TPS浓度大于1 200 U/L时,用稀释液倍比稀释血清标本后再按上述方法测量。
1.3 统计学处理
应用SPSS13.0统计软件进行数据处理,计量资料采用均数±标准差(±s)表示,阳性率以百分数表示,组间比较采用t检验和χ2检验进行分析。正常值上限以健康人血清平均值加1.96倍标准差确定。P<0.05表明差异有统计学意义。
2 结果
2.1 不同组别血清TPS浓度测定
非小细胞肺癌组血清TPS浓度明显高于健康对照组和肺良性疾病组,差异有统计学意义(P<0.05)。而肺部良性疾病组与健康对照组相比,差异无统计学意义(P>0.05)。
表1 不同组别血清 TPS浓度(±s)和阳性率

表1 不同组别血清 TPS浓度(±s)和阳性率
注:与正常对照组和良性疾病组比较,*P<0.05
组别 n TPS浓度(U/L)阳性率(%)健康对照组 40 62.75±18.36 5.0(2)肺良性疾病组 30 80.24±21.35 16.67(5)非小细胞肺癌组 48 385.67±83.14* 85.42*(41)
2.2 血清TPS浓度与非小细胞肺癌不同临床特征的关系
由表2可见,非小细胞肺癌患者中TPS的浓度水平和阳性率在男性和女性之间,≤60岁和>60岁之间,鳞癌和腺癌之间,有无纵隔淋巴结转移之间的比较,差异无统计学意义(P>0.05)。但临床分期为Ⅲ-Ⅳ期的患者的TPS浓度和阳性率较Ⅰ-Ⅱ期病人明显增高,差异有统计学意义(P<0.05)。且TPS在手术前后和化疗前后的差异具有统计学意义(P<0.05)。
3 讨论
组织多肽特异性抗原(TPS)是细胞角蛋白18含有的抗原决定簇M3的可溶性活性片段,相对分子量为45×103,在正常组织细胞中含量很少,但在上皮来源的肿瘤和转移瘤中呈高度表达,尤其是在肿瘤细胞增殖活跃期间,TPS高表达并大量入血,可以更好地体现肿瘤的生物学行为,直接反映肿瘤细胞增殖分裂的情况[1]。许多研究显示,TPS对肿瘤的早期诊断、预测复发和转移、评价预后等方面具有独特的价值,主要可用于乳腺癌、卵巢癌、前列腺癌、胃肠道肿瘤和肺癌等的诊断方面,尤其与肺癌密切相关且非常敏感,并代表肿瘤增殖特性,同时可作为检测治疗反应的主要指标,已被国外学者广泛应用于肺癌的诊断、疗效观察和预后判断[2]。
表2 血清 TPS浓度(±s)与非小细胞肺癌不同临床特征之间的关系
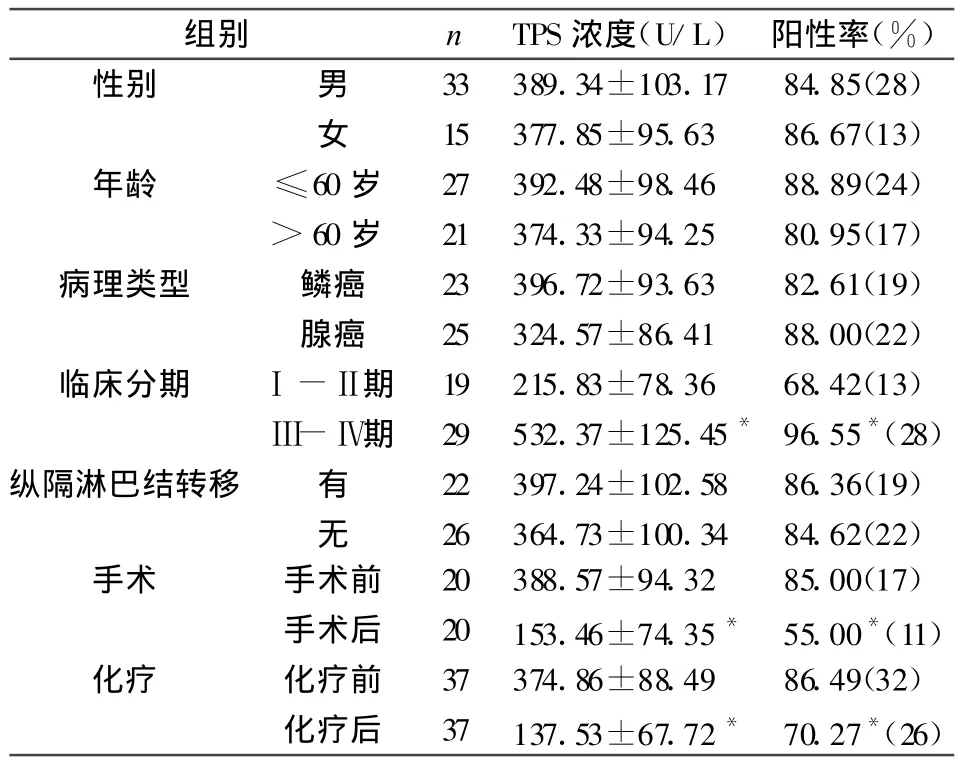
表2 血清 TPS浓度(±s)与非小细胞肺癌不同临床特征之间的关系
注:不同分期、手术前后、化疗前后比较,*P<0.05
组别 n TPS浓度(U/L)阳性率(%)性别 男 33 389.34±103.17 84.85(28)女 15 377.85±95.63 86.67(13)年龄 ≤60岁 27 392.48±98.46 88.89(24)>60岁 21 374.33±94.25 80.95(17)病理类型 鳞癌 23 396.72±93.63 82.61(19)腺癌 25 324.57±86.41 88.00(22)临床分期 Ⅰ-Ⅱ期 19 215.83±78.36 68.42(13)Ⅲ-Ⅳ期 29 532.37±125.45*96.55*(28)纵隔淋巴结转移 有 22 397.24±102.58 86.36(19)无 26 364.73±100.34 84.62(22)手术 手术前 20 388.57±94.32 85.00(17)手术后 20 153.46±74.35* 55.00*(11)化疗 化疗前 37 374.86±88.49 86.49(32)化疗后 37 137.53±67.72* 70.27*(26)
我们在研究中发现,非小细胞肺癌患者血清中TPS的阳性率及其表达水平均较高,显著高于健康对照组人群和肺良性肿瘤疾病患者。这与其他文献[3]报道均一致,进一步证实,TPS可用于鉴别肺部占位性病变的良恶性质。虽然良性疾病患者的TPS水平较健康人群偏高,但经分析并无统计学意义。在研究中通过分析TPS水平与非小细胞肺癌患者的性别、年龄、病理类型、纵隔淋巴结转移和临床分期等临床特征的关系可知,虽然表现为男性偏高,鳞癌患者偏高和≤60岁患者偏高的倾向,但是并无显著差异,说明其与年龄、性别、病理类型等无明显相关性。随着非小细胞肺癌临床分期逐渐趋于晚期,TPS的浓度和阳性率也逐渐升高,说明患者分期越晚,肿瘤细胞增殖越活跃,则TPS水平也越高,与罗荣城[4]等的报道相一致,血清TPS水平能够反映非小细胞肺癌患者疾病的严重程度。本实验中TPS对于纵隔淋巴结转移的预测未得出有意义的结论,对其他远处转移的预测尚待进一步的研究。在本研究中,手术前和化疗前的患者血清TPS浓度较高,经过手术和化疗治疗后,TPS水平明显下降,统计分析差异具有显著性,说明手术和化疗具有有效清除和降低病人体内活性肿瘤细胞的作用,监测TPS有助于判断治疗效果。
总之,血清中TPS的浓度高低可以反映肿瘤细胞的分裂和增殖活性,可以反映疾病的严重程度,并能用于判定手术和化疗的治疗效果,是一个较为特异的监测指标。但是在健康人群中也有一定的假阳性率,目前发现,有很多因素可以影响血清中的TPS水平,比如年龄、妊娠、月经、肾功能情况、炎性病变等[5]。因此,在临床上,应结合其他影响因素综合分析。同时,可以联合其他相关肿瘤标志物(如CEA、NSE等)进行检测,提高诊断的准确性和特异性。
[1]Huang F,Wang XL,Yang L,et al.Clinical value of combined determination of serum and pleural effusion level of CEA,CYFRA21-1,TPS in the diagnosis of lung cancer[J].Xi Bao Yu Fen Zi Mian Yi Xue Za Zhi,2008,24(4):370.
[2]Nider C,Andratschke N,Jeremic B,et al.Comparison of serum growth factors and tumor markers as prognostic factors for survival in non-small cell lung cancer[J].Anticancer Res,2003,23(6D):5117.
[3]李雅莉,赵立群,张娟妮,等.肺癌患者血清及支气管肺泡灌洗液和胸腔积液中TPS水平检测及其临床意义的研究[J].肿瘤防治杂志,2005,12(6):453.
[4]罗荣城,张军一,何本夫,等.血清TPS检测对于肺癌的临床应用价值[J].临床肿瘤学杂志,2004,9(2):118.
[5]Tramonti G,Ferdeghini M,Donadio C,et a1.Renal function and serum concentration of five tumor markers(TATI,SCC,CYFRA21-1,TPA and TPS)in patients without evidence of neoplasia[J].Cancer Detect Prev,2000,24(1):86.
