长春碱对RAW264.7细胞增殖和分泌一氧化氮的影响
2010-05-22南华大学附属南华医院衡阳市421002
仇 燕(南华大学附属南华医院,衡阳市 421002)
长春碱(Vinblastine,VBL)是一种二聚吲哚类生物碱,属于长春碱类化合物。长春碱于1958年从长春花中提取出来,1970年后被广泛应用于临床肿瘤的治疗中,具有良好的抑制多种恶性肿瘤生长的作用,用于如何杰金氏病、绒毛膜上皮癌、急性白血病、乳腺癌和口咽部癌等的治疗中[1]。有关长春碱的研究虽报道较多,但有关其在免疫学方面的研究罕见报道。固有免疫是免疫系统的第一道防护线,而巨噬细胞在固有免疫应答中起着重要的作用[2]。故笔者以巨噬细胞(RAW264.7细胞)增殖和分泌一氧化氮(NO)等细胞行为变化为靶点,研究长春碱对其的影响,以为筛选和开发新型免疫调节药提供新策略。
1 材料
1.1 试药
脂多糖(LPS)、二甲基亚砜(DMSO)、MTT、碘化丙啶(PI)、抗β肌动蛋白单克隆抗体(Anti-beta-actin mAb)、抗鼠细胞周期蛋白B1单克隆抗体(Anti-mouse cyclin B1 mAb)、辣根过氧化酶标志的羊抗鼠IgG(HRP-goat Anti-mouse IgG)和长春碱(批号:V1377,纯度:≥96%)均由美国Sigma公司提供;DMEM培养基低糖(干粉)和胎牛血清均由美国Gibco-BRL公司提供;Griess检测试剂盒(美国Promega公司);凯基Super ECL检测液(南京凯基生物科技发展有限公司);其它试剂均为国产分析纯。
1.2 细胞
RAW264.7细胞系购自武汉大学典型培养物保藏中心。
1.3 仪器
680型酶标仪、PowerPac Basic型电泳仪(美国Bio-RAD公司);FACSCalibur流式细胞仪(美国Becton Dickinson公司);IX70倒置显微镜(日本Olympus公司);2300型CO2细胞培养箱(美国Sheldon公司);SW-CJ-IF型洁净工作台(苏州净化设备厂);Megafuge 1.0R型低温离心机(德国Herculeus公司)。
2 方法
2.1 细胞培养
取RAW264.7细胞于DMEM培养基中培养至对数生长期,用 0.25%胰酶消化液消化,离心(125 r·min-1,5 min,20℃),调整细胞密度为每升5×108个,并接种于96孔细胞培养板,每孔定容200 μL,于37 ℃、5%CO2培养箱培养24 h。
2.2 MTT法检测长春碱对RAW264.7细胞增殖的影响
试验分为对照组(含0.01%DMSO的DMEM 10 μL)和实验组,即长春碱低、中、高浓度(50、100、150 μmol·L-1)组。取“2.1”项培养24 h后的细胞,每孔加入10 μL不同浓度的VBL(终浓度分别为50、100、150 μmol·L-1),每一浓度设3个复孔,于37℃、5%CO2培养箱培养48 h。每孔加入20 μL MTT工作液,于37 ℃、5%CO2培养箱孵育4 h,离心(300 r·min-1,5 min),吸掉上清液体,每孔加入100 μL DMSO,振荡器上振荡10 min,酶标仪540 nm波长检测吸光度(A)值,并计算细胞相对抑制率。细胞相对抑制率=(1-实验组A均值/对照组A均值)×100%。
2.3 流式细胞术检测细胞周期分布
试验分组和药物的处理同“2.2”项,48 h后收集细胞,用冷的磷酸盐缓冲溶液(PBS)洗涤,离心(125 r·min-1,5 min,4℃),用300 μL PBS重悬(含10%普通级小牛血清),加入700 μL冷无水乙醇,4℃固定30 min,冷PBS重悬洗涤细胞2次,加入300 μL PI染液(含RNase),避光15 min,立即进行流式细胞术检测,并以ModFit软件分析,拟合计算各时相细胞的百分比。
2.4 Western blot法检测cyclin B1的表达情况
试验分组和药物的处理同“2.2”项,48 h后收集细胞,PBS洗涤2次,裂解,离心,收集上清液,即细胞总蛋白,用二喹啉甲酸(BCA)法定量蛋白,调正蛋白浓度,用等量蛋白和蛋白上样缓冲液混合,煮沸,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),电泳后转硝酸纤维素膜(NC膜),依次孵抗体,即抗鼠细胞周期蛋白B1单克隆抗体和辣根过氧化酶标志的羊抗鼠IgG,用ECL检测液发光,并显影定影,最后用Quantity one分析软件计算条带灰度。
2.5 Griess试剂盒检测NO分泌
试验分为对照组、LPS 组、LPS+长春碱(50、100、150 μmol·L-1)组。取“2.1”项培养24 h 后的细胞,每孔加10 μL 不同浓度的长春碱(终浓度分别为50、100、150 μmol·L-1),每一浓度设3个复孔,于37℃、5%CO2培养箱孵育4 h,加入LPS(终浓度10 mg·L-1)继续培养。24 h后,按照试剂盒说明书操作并制备NO标准曲线,用校准曲线确定试验各组NO的分泌量。
2.6 统计学分析
3 结果
3.1 长春碱对RAW264.7细胞增殖的影响
MTT法检测RAW264.7细胞增殖的结果详见表1。
根据MTT的工作原理,A值与活细胞数量成正比。从表1中可以看出,随着长春碱浓度的升高,A值逐渐下下降,说明RAW264.7细胞的增殖受抑程度增强,具有浓度依赖性(P<0.05或P<0.01)。
表1 各组细胞相对抑制率结果(,n=3)Tab 1 Relative inhibition of cells in each group(,n=3)

表1 各组细胞相对抑制率结果(,n=3)Tab 1 Relative inhibition of cells in each group(,n=3)
与对照组比较:*P<0.05,#P<0.01vs.control group:*P<0.05,#P<0.01
A组别对照组长春碱50 μmol·L-1组长春碱100 μmol·L-1组长春碱150 μmol·L-1组3.010±0.0952.512±0.066*1.933±0.048#1.150±0.017#细胞相对抑制率/%—16.535.861.8
3.2 长春碱对RAW264.7细胞细胞周期的阻断
流式细胞术检测长春碱对RAW264.7细胞细胞周期阻断的结果详见表2。
表2 各组细胞周期时相分布情况(,n=3)Tab 2 Distribution of cycle phases of cells in each group(,n=3)
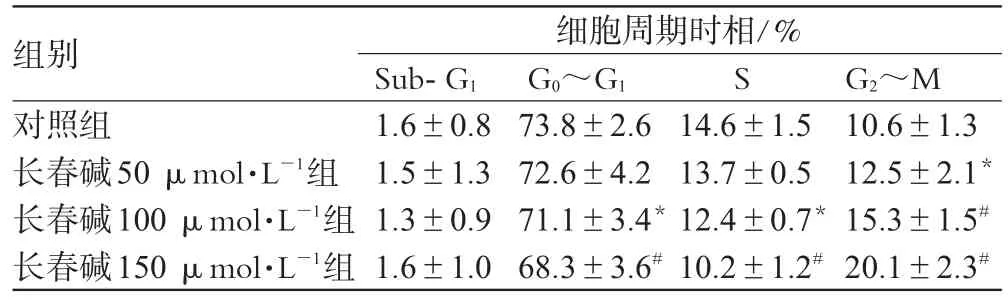
表2 各组细胞周期时相分布情况(,n=3)Tab 2 Distribution of cycle phases of cells in each group(,n=3)
与对照组比较:*P<0.05,#P<0.01vs.control group:*P<0.05,#P<0.01
从表2中可见,随着长春碱浓度的升高,G2~M期细胞呈浓度依赖性增加,而G0~G1期和S期细胞则逐渐减少(P<0.05,P<0.01)。
3.3 长春碱对RAW264.7细胞表达cyclin B1的影响
Western blot法检测长春碱对RAW264.7细胞表达cyclin B1影响的结果详见图1。用Quantity One分析软件对图1进行灰度计算,并与β-actin比较,得到半定量结果,详见表3。
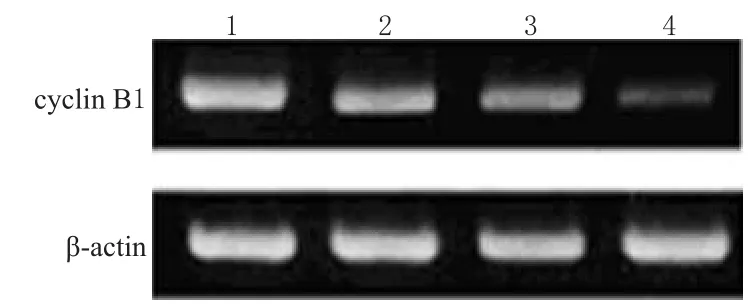
图1 各组细胞表达cyclin B1情况1.对照组;2.长春碱 50 μmol·L-1组;3.长春碱 100 μmol·L-1组;4.长春碱 150 μmol·L-1组Fig 1 Expression of cyclin B1 in each group1.control group;2.50 μmol·L-1vinblastine group;3.100 μmol·L-1 vinblastine group;4.150 μmol·L-1vinblastine group

表3 各组细胞表达cyclin B1的半定量结果Tab 3 Semi-quantitative analysis of the expression of cyclin B1 in each group
从图1和表3可见,对照组cyclin B1的条带最明显,其条带灰度比值为1.21,经50 μmol·L-1、100 μmol·L-1和150 μmol·L-1长春碱作用后,cyclin B1蛋白条带变浅,条带灰度比值也相应减少,并具有浓度依赖性。
3.4 长春碱对RAW264.7细胞分泌NO的影响
将一系列不同浓度的标准品与测定的对应A值作标准曲线,并进行直线相关回归分析,得出NO量(Y)与A值的回归方程为Y=0.024+0.009A(r=0.998)。将不同组样品测得的A值代入该直线回归方程中,即得到相应的NO量,结果详见表4。
表4 各组细胞NO分泌量结果(,n=3)Tab 4 Result of NO secretion of cells in each group(,n=3)

表4 各组细胞NO分泌量结果(,n=3)Tab 4 Result of NO secretion of cells in each group(,n=3)
与对照组比较:※P<0.01;与LPS组比较:*P<0.05,#P<0.01vs.control group:※P<0.01;vs.LPS group:*P<0.05,#P<0.01
NO分泌量/nmol·L-1 1.70±0.3220.38±3.15※15.21±2.36*12.56±1.98#7.12±2.87#组别对照组LPS组LPS+长春碱50 μmol·L-1组LPS+长春碱100 μmol·L-1组LPS+长春碱150 μmol·L-1组
从表4可见,经LPS刺激,RAW264.7细胞大量分泌NO(P<0.01);但随着长春碱浓度的升高,LPS刺激的RAW264.7细胞分泌NO的量逐渐减少,并具有浓度依赖性(P<0.05或P<0.01)。
4 讨论
微管骨架是一个动态网络,由微管蛋白的结合与分离维持细胞的动态变化,如细胞的分裂和增殖[3]。多年的研究表明,长春碱通过与微管蛋白二聚体结合,抑制纺锤体的形成,使细胞分裂停滞在M期,从而最终抑制肿瘤细胞的生长[4]。本研究将长春碱作用于RAW264.7细胞,MTT检测结果表明,长春碱具有抑制RAW264.7细胞增殖的作用;而PI染色检测细胞周期分布的结果进一步表明,长春碱使RAW264.7细胞停滞于G2~M期,这恰好与前人的研究结果[4]相一致。
细胞周期是由细胞周期蛋白(cyclin)和细胞周期蛋白依赖性激酶(CDK)共同驱动的。不同类型的cyclin随细胞周期进程在不同的时相出现,依次激活相应的CDK,驱动细胞完成由G1→S→G2→M的转换,然后被降解[5]。在众多cyclin中,cyclin B1在推动细胞进入G2~M期中起着关键性的作用。研究表明,cyclin B1从G1晚期开始表达,到G2后期达到高峰,M期中期被迅速降解。其高峰时活性最佳,并激活CDK1,推动细胞进入G2~M期[6]。本研究Western blot法结果表明,长春碱具有抑制RAW264.7细胞表达cyclin B1的作用。这可能是长春碱使RAW264.7细胞细胞周期停滞于G2~M期,抑制RAW264.7细胞增殖的分子机制之一。
NO是一种气体信号分子,能够进入细胞内,直接作用于相关酶,引起细胞的快速反应[7]。RAW264.7细胞来源于小鼠的巨噬细胞系,而巨噬细胞通过分泌细胞因子和吞噬异物,在天然免疫应答中起着重要的作用。被激活的巨噬细胞能够分泌NO,而NO是巨噬细胞发挥吞噬功能的基本条件。随着NO的减少,巨噬细胞的吞噬功能也相应地减弱[8]。本研究Griess试剂盒检测结果显示,长春碱能显著抑制LPS刺激的RAW264.7细胞分泌NO,并具有浓度依赖性。这暗示着长春碱不但能够抑制RAW264.7细胞的增殖,还能抑制RAW264.7细胞的生物学功能。
本研究证明长春碱不但能抑制RAW264.7细胞表达cyclin B1,使细胞周期停滞于G2~M期,从而抑制了RAW264.7细胞的增殖,而且还能抑制LPS刺激的RAW264.7细胞分泌NO,影响RAW264.7细胞的生物学行为。这不但丰富了长春碱的药理作用内容,还为将其开发成为免疫抑制药物提供了试验依据,故具有重要的临床应用和社会经济意义,但其具体机制有待进一步的研究。
[1]马 彦.长春碱类抗肿瘤药物的研究进展[J].中山大学研究生学刊(自然科学医学版),2004,25(3):30.
[2]Ji Z,Tang Q,Zhang J,et al.Immunomodulation of RAW 264.7 macrophages by GLIS,a proteopolysaccharide from Ganoderma lucidum[J].J Ethnopharmacol,2007,112(3):445.
[3]Devred F,Tsvetkov PO,Barbier P,et al.Stathmin/Op18 is a novel mediator of vinblastine activity[J].FEBS Lett,2008,582(17):2484.
[4]Sui M,Fan W.Combination of gamma-radiation antagonizes the cytotoxic effects of vincristine and vinblastine on both mitotic arrest and apoptosis[J].Int J Radiat Oncol Biol Phys,2005,61(4):1151.
[5]邓守恒,孙各琴,陈崇宏,等.硒化壳聚糖对NB4细胞的周期阻断及与阿霉素的协同作用[J].中国药房,2007,18(10):741.
[6]Li R,Tang XL,Miao SY,et al.Regulation of the G2/M phase of the cell cycle by sperm associated antigen 8(SPAG8)protein[J].Cell Biochem Funct,2009,27(5):264.
[7]王金发.细胞生物学[M].北京:科学出版社,2003:219.
[8]Gopinath VK,Musa M,Samsudin AR,et al.Role of nitric oxide in hydroxyapatite-induced phagocytosis by murine macrophage cell line(RAW264.7)[J].Arch Oral Bio,2006,51(4):339.
