赖诺普利聚乙烯醇微粒的制备及其质量评价Δ
2010-11-22吴俊珠金拓大理学院药学院大理市671000上海交通大学药学院上海市200240
吴俊珠,金拓(1.大理学院药学院,大理市671000;2.上海交通大学药学院,上海市200240)
赖诺普利聚乙烯醇微粒的制备及其质量评价Δ
吴俊珠1,2*,金拓2#(1.大理学院药学院,大理市671000;2.上海交通大学药学院,上海市200240)
目的:制备赖诺普利聚乙烯醇微粒并评价其质量。方法:以聚乙烯醇为载体,采用喷雾干燥法制备赖诺普利聚乙烯醇微粒。考察制剂的形态、粒径、跨度、载药量、包封率和体外溶出度。结果:所制赖诺普利聚乙烯醇微粒为近球形,表面有孔,平均粒径为17.29μm,跨度为0.88,载药量为31.40%,包封率为94.20%,30min时体外累积溶出百分率达90%以上。结论:该制剂制备工艺简单,重复性好,质量检测指标合格。
赖诺普利;聚乙烯醇;微粒;喷雾干燥法;制备;质量评价
赖诺普利(Lisinopril,LIS)是第3代血管紧张素转化酶抑制剂(ACEI),临床用于高血压和心力衰竭的治疗。目前,心血管疾病的治疗和二级预防常常需要多种药物联合使用[1],但由此可致患者用药的顺应性较差,而开发携带、使用方便的复方剂型可解决此问题。为使LIS与其它活性成分(尤其是液体鱼油)制备复方制剂时有良好的稳定性,笔者以理化性质较稳定、生物相容性好的聚乙烯醇(Polyvinyl alcohol,PVA)为载体[2]制备LIS-PVA微粒(LIS-PVA-MP)。PVA-MP的制备有多种方法:以醋酸乙烯为原料,采用乳化-聚合-水解-交联的方法制备交联度不同双层结构的小球(PVA beads)[3,4];或以PVA为原料,采用乳化-物理交联法[2]以及乳化-化学交联法[5]制备微球;或采用喷雾干燥法制备载药微粒[6]。本研究中笔者采用喷雾干燥法制备LIS-PVA-MP,通过正交试验考查处方、工艺对载药微粒粒径、形态、载药量、包封率的影响,并进行体外溶出试验,为该复方制剂的研究提供基础。
1 材料
1.1 仪器
OPDT-8喷雾干燥机(上海大川原干燥设备有限公司);2102PC型紫外可见分光光度计(美国Unico公司);高效液相色谱(HPLC)仪,包括LC-10AT VP泵、SPD-10AVP紫外检测器(日本岛津公司);pH S-3TC数显pH计(上海天达仪器有限公司);KQ-100DB型数控超声波清洗器(昆山市超声仪器有限公司);S-2150型扫描电镜(日本Hitachi公司);CIS 100粒度粒形分析仪(荷兰Ankersmid仪器有限公司);RCZ-6B1型药物溶出度仪(上海黄海药检仪器有限公司)。
1.2 试药
赖诺普利(批号:050912,纯度:98.2%)及赖诺普利精制品(批号:050912,纯度:99.91%)均由大洋化工有限公司提供;己烷磺酸钠(国药集团化学试剂有限公司,含量:≥98.0%);PVA(Mr:13000~23000,醇解度:87%~89%;Mr:31000~50000,醇解度:87%~89%;Mr:85000~124000,醇解度:87%~89%)购自美国Aldrich公司;磷酸二氢钾、磷酸、氢氧化钠、盐酸为分析纯,液体石蜡为化学纯,乙腈为色谱纯。
2 方法与结果
2.1 分析方法建立
2.1.1 检测波长的选择。以0.1mol·L-1盐酸(以下简称溶剂)为溶剂,制备浓度为100μg·mL-1的LIS溶液及400μg·mL-1的PVA溶液,以溶剂为空白,在紫外可见分光光度计上200~400nm波长范围内进行扫描,结果LIS在215nm波长附近处有最大吸收峰,而PVA在此波长处几乎无吸收,故选择215nm为检测波长。
2.1.2 色谱条件。色谱柱:Shim-Pack VP-ODS(150mm×4.6mm,5μm);流动相:乙腈-pH 2.5磷酸盐缓冲液(含0.0053mol·L-1己烷磺酸钠)=20∶80;流速:0.5mL·min-1;检测波长:215nm ;柱温:55℃;进样量:20μL。
2.1.3 系统适用性。在上述色谱条件下,以0.1mol·L-1盐酸为溶剂,制备LIS精制品溶液、供试品溶液(按“2.3.4”项下方法制备),分别取上述2种溶液及空白样品溶液(取微粒处方用量的PVA,按供试品溶液制备方法制备)各20μL进样,记录色谱。结果,PVA对主药测定无干扰。3种溶液色谱见图1。

图1 高效液相色谱图A.精制品溶液;B.供试品溶液;C.空白样品溶液Fig 2 HPLC chromatographyA.reference substance solution;B.samples solution;C.blank sample solution
2.1.4 线性范围与最低检测限。精密称定LIS精制品10mg,用溶剂约50mL溶解,转移至100mL容量瓶中,溶剂稀释至刻度,摇匀,得精制品贮备液a。精密吸取50mL贮备液a置于100mL容量瓶中,用溶剂稀释至刻度,摇匀,得贮备液b。分别精密吸取1.0、2.0、3.0、4.0、5.0mL贮备液b置于10mL容量瓶中,用溶剂稀释至刻度,摇匀,配制一系列不同浓度的LIS溶液。在上述色谱条件下,分别取20μL进样,每个浓度重复进样3次,以LIS峰面积平均值(A)对其浓度(C)回归,得回归方程:A=30217C+13774(r=0.9998),结果,LIS检测浓度在5~100μg·mL-1范围内线性关系良好,最低检测限为8ng(信噪比S/N=3)。
2.1.5 精密度试验。日内精密度:取20μg·mL-1精制品溶液,连续重复进样6次,其峰面积RSD=0.84%。日间精密度:3d内分别制备20μg·mL-1精制品溶液,重复进样6次,其峰面积RSD=1.36%。
2.1.6 回收率试验。分别精密称取LIS精制品10.0、11.0、10.4mg,按1∶3配比精密加入PVA,混匀,得3份模拟微粒,分别置于烧杯中,加入溶剂约50mL,60℃水浴加热5min,完全溶解,转移至100mL容量瓶中,溶剂稀释至刻度,摇匀。再对每份溶液继续分别精密吸取0.5、5.0mL置于10mL容量瓶中,溶剂稀释至刻度,摇匀,共制备低、中、高浓度的9份溶液,按上述色谱条件进样,记录峰面积,计算回收率,结果样品的平均回收率为100.3%,RSD=1.0%(n=9),符合含量测定要求。
2.1.7 重复性试验。取同一批号的LIS-PVA-MP,分别精密称定5份,按“2.3.4”项下操作制备供试品溶液及对照液,按上述色谱条件进样,记录峰面积,以外标法计算微粒含药量及载药量(%),结果微粒中LIS平均载药量为39.62%,RSD=1.56%。
2.1.8 稳定性试验。将供试品溶液置于冰箱中4℃保存,分别于0、2、6、8、12、24h 取样,按上述色谱条件进样,6次所得峰面积的RSD=0.66%,表明样品溶液于4℃保存在24h内基本稳定。
2.2 LIS-PVA-MP制备工艺
称取PVA加入适量去离子水,水浴加热溶解,放冷后加入LIS,搅拌使之溶解制备含药料液,采用进风温度185℃、出风温度95℃,旋风分离器压力0.65kPa,喷雾干燥法制备LISPVA-MP。
2.3 正交试验优化LIS-PVA-MP的处方与工艺
2.3.1 正交试验设计。据初步试验结果,选择对微粒粒径、分布、形态、载药量和包封率有影响的4个因素,每个因素取3个水平,采用L9(34)正交设计表安排试验,因素及水平见表1。

表1 因素水平表Tab 1Factors and levels
2.3.2 粒径及分布测定。取适量LIS-PVA-MP,加入约5mL轻质液体石蜡,超声波分散10min,用粒度粒形分析仪测定平均粒径、D10、D50、D90,并由此计算跨度=(D90-D10)/D50。
2.3.3 微粒形态的观察。取适量LIS-PVA-MP分散于导电胶表面,喷金后,采用扫描电镜观察其形态。根据颗粒的圆整度、表面凹陷程度、粘连程度对各微粒评分。评分标准:球形+++(3),近球形++(2),不规则形(0);无凹陷++++(4),略有凹陷+++(3),凹陷较多++(2),不规则形(0);颗粒无粘连+++(3),颗粒轻微粘连++(2),颗粒粘连较多(1),颗粒呈条状丝状(0)。
2.3.4 载药量与包封率的测定。取LIS-PVA-MP适量精密称定,置于烧杯中,加入溶剂约50mL,60℃水浴加热5min,完全溶解,放冷,转移至100mL容量瓶中,溶剂稀释至刻度,摇匀,0.45μm滤膜过滤,取续滤液作为供试品溶液;同时配制LIS对照液,按上述色谱条件,分别取供试品溶液及对照液各20μL进样,记录峰面积,外标法计算含量。按微粒中LIS的百分含量(%,W/W)计算载药量,根据实际药物含量与理论药物含量比值的百分率计算包封率(EE%)。
2.3.5 正交试验结果与分析。采用综合评分法优化处方、工艺,按评分标准:S1=(10/平均粒径)×2,S2=(2/跨度)×2,S3=(载药量/10)×2,S4=(包封率/10)×2,S5=形态评分×2,Y=S1+S2+S3+S4+S5。正交试验的9次试验结果见表2。

表2 正交试验结果Tab 2 Results of orthogonal test
以A、B、C、D因素分别为自变量X1、X2、X3、X4,以Y为因变量,采用Excel电子表格进行多元曲线回归,得回归方程:Y=-29.876+0.00031959X1+127.09X2- 1.9436X3+1.5712X4(r=0.9355),标准误差S=2.4403,F=7.0087>F0.05(4,4)=6.3882,回归具有显著性(α=0.05)。
根据回归方程,当X1取31000、X2取0.05、X3取0.33(1∶3)、X4取40时,总分Y最高,即A2B3C3D3。然而,考虑到实际的试验中,料液中PVA的浓度不宜太高,否则制得的微粒易发生粘连,LIS-PVA投料比也不宜取最小,否则载药量过小。因此,根据实际情况,本试验中取A2B2C2D3为优化结果。
2.3.6 优化条件验证。按A2B2C2D3条件制备3批微粒,分别测定粒径、跨度、粒径分布,考查微粒形态(结果评为9分),并测定载药量与包封率,相关结果见表3、图2、图3。

表3 3批微粒各项指标测定结果Tab 3 Index determination of 3batches of LIS-PVA-MP

图2 微粒扫描电镜图(×1000)Fig 2 Scanning electron micrograph(×1000)
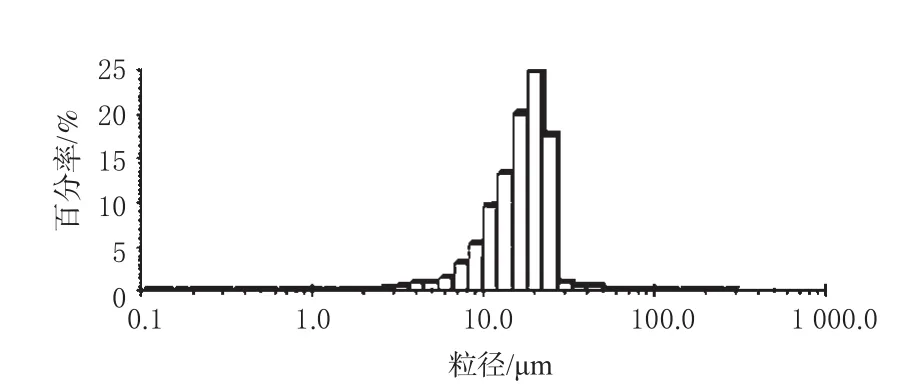
图3 微粒的粒径分布图Fig 3 Distribution of particle size of LIS-PVA-MP
由图2可见,LIS-PVA-MP为近球形,表面有孔、略有凹陷。按评分标准为验证试验的产品微粒打分,结果Y=48.82。将验证试验的自变量代入回归方程,可求得预测值y=45.72,预测范围为 y±U0.05×S,查表U0.05=1.960,预测范围为(40.94,50.50)。优化后的实际得分为48.82,高于前9个试验号的得分,并在预测范围内,与预测值之间的偏差为6.78%。
2.4 LIS-PVA-MP体外溶出度考察
对验证试验制得的3批微粒,各称取约相当于LIS 10mg的微粒装于胶囊壳中,放入沉降篮内,根据《美国药典》28版(简称USP 28)[7]LIS片溶出度测定方法,分别在0、5、10、15、20、30、40、50、60、75min 时各取5mL,并向溶出杯内补加溶出介质5mL,采用“2.1.2”所述色谱条件测定,计算累积溶出百分率(n=3),结果见图4。

图4 LIS-PVA-MP体外溶出曲线(n=3)Fig 4 Dissolution curves of LIS-PVA-MP(n=3)
图4 表明,微粒15min时溶出50%左右,30min溶出达90%以上,40min可达98%以上,其释药规律符合Weibull方程:lnln[1/(1-F(t))]=1.6841ln(t-1.05)-4.7517(r=0.9990),T50=14.57min,Td=17.85min。
3 讨论
3.1 色谱条件的确立
基于USP 28LIS片含量测定方法,以本文所述色谱系统,色谱柱为Shim-Pack VP-ODS,其他条件按USP 28进行测定。结果主峰拖尾严重,无法达到其规定的标准。通过单因素考查,调整流动相pH值、柱温、流速,可获得适宜保留时间,改善LIS的峰形和拖尾,这与Bouabdallah 和Kocijan等[8,9]的报道一致。最终确立了条件相对温和的流动相pH 2.5、柱温55℃、流速0.5mL·min-1的色谱条件,理论塔板数按LIS计算为1903,拖尾因子为1.3,符合USP 28对该片剂的规定。
3.2 喷雾干燥法制备LIS-PVA-MP
根据PVA、LIS的性质以及料液喷雾干燥的效果,确定进风温度为185℃,出风温度为95℃。雾化器转速对微粒形态、大小影响很大,其低于36Hz时,粒径大、分布宽,微粒易发生粘连,故选择在36~40Hz作进一步考查。
通过单因素考查,采用醇解度为87%~89%,Mr为13000~23000、31000~50000、85000~124000的PVA制备LIS-PVA-MP,发现PVA Mr对微粒大小、形态影响较大,Mr为85000~124000的PVA含药料液由于黏度大不能很好地被雾化,干燥过程中易形成丝状、条状物,故选择的Mr为13000~23000、31000~50000采用正交试验作进一步考查。PVA浓度对微粒大小、形态影响也较大,6%PVA料液所得微粒发生粘连,表面变形严重;此外随浓度增大,载药量、包封率略有增加,但趋势并不显著。投药比对微粒载药量、包封率有较大影响,随投药比增大,载药量增大,但包封率降低。
由初步试验的结果,对各主要因素的水平作适当调整后进一步安排了正交试验进行优化。按优化的参数制备LIS-PVA-MP,结果其粒径和粒径分布适当,有比较满意的载药量、包封率及体外溶出速度,且制备工艺简单,重复性好。
[1] Wald NJ,Law MR.A strategy to reduce cardiovascular disease by more than 80%[J].BMJ,2003,326(7404):1419.
[2] Jin T,Pennefather P,Lee PI.Lipobeads:a hydrogel anchored lipid vesicle system[J].FEBS Letters,1996,397(1):70.
[3] Kim CJ,Lee PI.Synthesis and characterization of suspension-polymerized poly(vinyl alcohol)beads with coreshell structure[J].Journal of Applied Polymer Science,1992,46(12):2147.
[4] Kim CJ,Lee PI.Composite polyvinyl alcohol beads for controlled drug delivery[J].PharmaceuticalResearch,1992,9(1):10.
[5] 赵大庆,谭金权.聚乙烯醇微粒的制备与研究[J].中国新药杂志,2005,14(2):181.
[6] Ozmen L,Langrish TAG,Gipps EM.Spray drying pharmaceutical products for nasal delivery:The effects of feed solution properties and operating conditions on particle size and density——Heat and Mass Transfer Australasia Proceedings of the Sixth Australasian:Heat and Mass Transfer Conference[C].New York:Begell House,1998:427.
[7] The United States Pharmacopeial Convention.The United States Pharmacopeia[S].USA:Rockville,2005:1139.
[8] Bouabdallah S,Trabelsi H,Bouzouita K,et al.Reversed-phase liquid chromatography of lisinopril conformers[J].J Biochem Biophys Methods,2002,54(1~3):391.
[9] Kocijan A,Grahek R,Kocjan D,et al.Effect of column temperature on the behaviour of some angiotensin converting enzyme inhibitors during high-performance liquid chromatographic analysis[J].J Chromatogr B,2001,755(1~2):229.
Preparation and Quality Evaluation of Lisinopril Polyvinyl Alcohol Particles
WU Jun-zhu(School of Pharmacy,Dali University,Dali 671000,China)
WU Jun-zhu,JIN Tuo(School of Pharmacy,Shanghai Jiaotong University,Shanghai 200240,China)
OBJECTIVE:To prepare lisinopril-loaded polyvinyl alcohol(PVA)particles(LIS-PVA-P)and establish its quality control method.METHODS:LIS-PVA-P was prepared by spray-drying process with PVA as carrier.The preparation was detected in terms of morphology,particle size,span,drug-loading capacity,encapsulation and in vitro dissolution.RESULTS:The preparation assumed sphere with porous surface.The average particle size was 17.29μm while drug-loading capacity 31.40%,encapsulation 94.20%,Span was 0.88,90%of the drug loads were released within 30min.CONCLUSION:The preparation process is simple,good in repeatability and qualified in quality.
Lisinopril;Polyvinyl alcohol;Particles;Spray-drying process;Preparation;Quality evaluation
R943;R972
A
1001-0408(2010)09-0825-04
2009-04-09
2009-09-25)
