苯丙氨酸衍生物的合成、18F标记及其生物学评价
2010-05-16马云川苏玉盛许荆立陈玉蓉齐传民
彭 程,马云川,苏玉盛,贺 勇,许荆立,陈玉蓉,齐传民
(1.北京宣武医院PET中心,北京 100053;2.北京师范大学 化学学院,放射药物化学教育部重点实验室,北京 100875)
代谢显像是分子核医学研究领域最为成熟的技术之一,目前已广泛应用于临床诊断。其中最重要的代谢显像剂为18F-脱氧葡萄糖(18F-fluorodeoxyglucose,18F-FDG)[1]。18F-FDG 为评价化疗效果提供了一种无创检查方法[2]。氨基酸是人体必需的营养物质,同样可用作代谢显像剂,天然酪氨酸经过放射性标记后,输送至脑,参与脑内蛋白质的合成,因此可作为脑显像剂,如,2-18F-氟-L-酪氨酸[3]。国内外也有很多关于合成脑肿瘤代谢显像剂2-(4-(2-氟乙氧基)酪氨酸(2-(4-(2-fluoroethoxy)tyrosine,18F-FET)的报道[4-7]。18F-FET是天然氨基酸的类似物,不参与蛋白质合成,肿瘤细胞对其吸收由L型氨基酸转运系统调控[8]。4-18F-L-苯丙氨酸、3-18F-3-丙基酪氨酸和O-18F-丙基酪氨酸等[9-10]经过分子结构修饰后也可用于PET显像研究。而芳香脂肪酸作为一类潜在的正电子肿瘤显像剂已经有了许多研究[11-14]。本研究拟将4-(2-羟基乙氧基)苯甲酸引入苯丙氨酸后进行18F标记,并观察其在荷S180瘤昆明小鼠体内的生物分布,初步探讨其PET显像剂的可能性。
1 实验材料
1.1 主要仪器及试剂
Bruker-400 MHz-Advance核磁共振仪:德国Brucker公司;WIZARD 1470型γ计数器:美国PE公司;Alltech高效液相分析仪、RM-905a放射性活度计:中国计量科学研究院;储磷屏分析系统(Perkin Elmer Storage Phosphor System Cyclone Plus):美国 Perkin Elmer公司;LEICACM190型冷冻切片机:美国 Waters公司;Nicolet 360型红外光谱仪:美国Nicolet公司;HP1100 HPLC-MSD型质谱仪:美国惠普公司;Pekin-Elemer 240-C元素分析仪、Grace Alltech高效液相色谱分析柱(5μm,250 mm×4.6 mm):美国Perkin Elmer公司。
1.2 动物模型
昆明小鼠:80只,清洁级,体重18~20 g,北京大学动物部提供;S180瘤细胞:北京大学动物部。在小鼠左前肢注射约0.2 mL 5.0×105个S180瘤细胞,7~10 d后,瘤体体积长至0.5~1 cm3时进行动物实验。
2 实验方法
2.1 4-(2-氟乙氧基)苯甲酰基苯丙氨酸甲酯,MFBPA)的合成与18F标记
2.1.1 MFBPA的合成
MFBPA的合成路线示于图1。
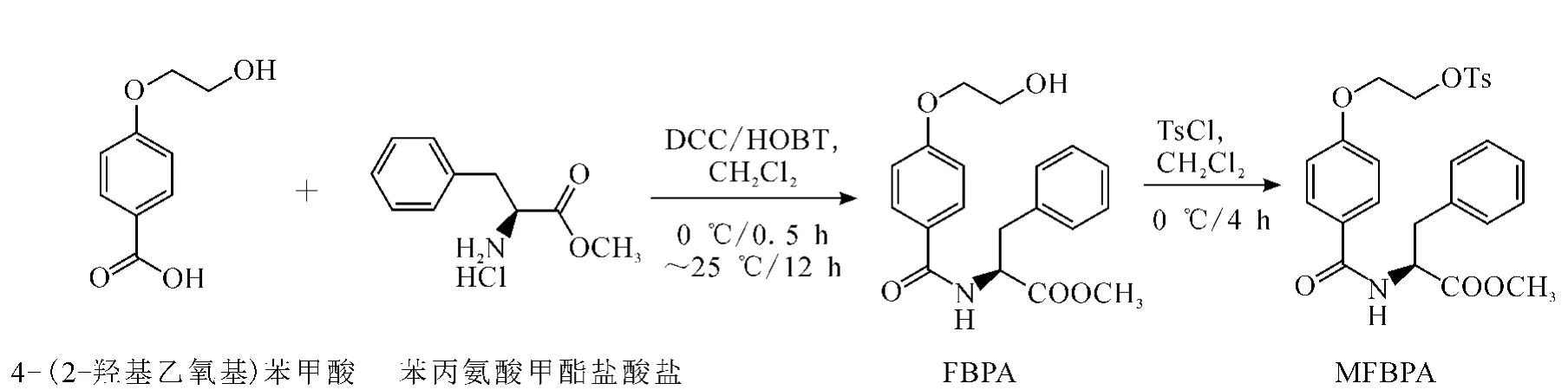
图1 MFBPA的合成路线
将 0.182 g 4-(2-羟基乙氧基)苯甲酸(1 mmol)与0.269 g苯丙氨酸甲酯盐酸盐溶于二氯甲烷中,冰浴下,加入0.206 g二环己基酰亚胺(1 mmol),0.135 g HOBT(1 mmol),搅拌反应0.5 h。恢复到室温反应,继续搅拌过夜。薄层硅胶色谱(TLC)监测反应。反应完全后,抽滤掉反应液中的沉淀物,真空低温旋蒸去溶剂,柱层析分离提纯,得到白色固体为N-(4-(2-羟基乙氧基)苯甲酰基)苯丙氨酸甲酯(FBPA)[15]。将0.497 g FBPA(1 mmol)、0.380 g对甲苯磺酰氯(2 mmol)、0.024 g 4-二甲氨基吡啶(0.2 mmol)和0.101 g三乙胺(1 mmol)加入冰浴下的无水二氯甲烷溶液中,搅拌反应4 h,柱层析分离提纯,即得N-4-(2-氟乙氧基)苯甲酰基苯丙氨酸(MFBPA,O)。采用1H NMR、13C NMR和MS对FBPA进行结构鉴定。
2.1.2 MFBPA的18F标记
MFBPA的18F标记反应示于图2。
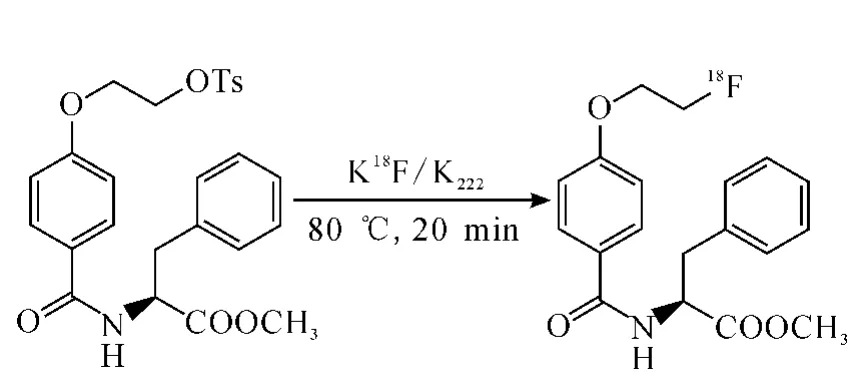
图2 MFBPA的18 F标记反应
3 mg K2CO3(0.022 mmol)和15 mg K222淋洗QMA柱得到的K18F/K 222混合水溶液,在氮气保护下,油浴加热到120℃,加入0.5 mL乙腈,共加入3次,共沸除去反应体系中的少量水分,加入5 mg MFBPA(0.01 mmol),在80 ℃乙腈溶液中反应20 min。使用0.22μm过滤头过滤后,使用半制备型HPLC进行分离提纯。收集到的标记产品除去溶剂,灭菌处理后用生理盐水稀释备用。HPLC分析放化纯度,洗脱条件:V(乙腈)∶V(水)=70∶30,流速:1 mL/min。采用1H NMR、13C NMR,MS对18F-MFBPA 进行结构鉴定。
2.2 18F-FBPA的合成
18F-FBPA的合成的合成路线示于图3。
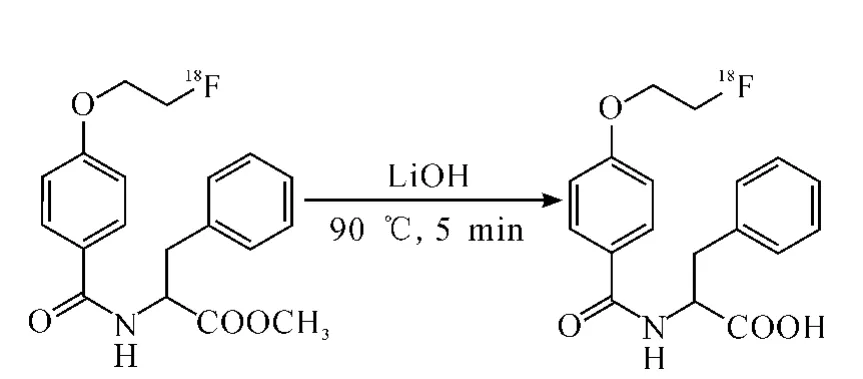
图3 18 F-FBPA合成路线
18F-MFBPA在含10 mg LiOH(0.42 mmol)的V(甲醇)∶V(水)=10∶1甲醇水溶液中,90℃反应5 min后,恢复至室温,加入1 mol/L HCl(0.24 mL)调反应液p H至7,得到18F-FBPA溶液。HPLC分析其放化纯度。真空低温旋去溶剂,用生理盐水稀释,备用。采用1H NMR,13C NMR,MS对18F-MFBPA进行结构鉴定。
2.3 脂水分配系数
分别取0.1 mL,p H 7.418F-MFBPA和18FFBPA的PBS溶液,加入1.9 mL PBS溶液和2 mL正辛醇,充分振荡混合,离心,静置,取水相和有机相各0.1 mL,测定其放射性计数,计算脂水分配系数。
2.4 18 F-MFBPA和18F-FBPA的体外稳定性
取少量18F-MFBPA和18F-FBPA分别与生理盐水和96%的乙醇溶液混合,室温静置,分别于1 h和2 h取少量18F-MFBPA和18F-FBPA分别与乙腈和DMF溶液混合,60℃温浴30 min,用HPLC检测其放化纯度。
取少量标记样品溶液混合在小鼠血清中,37℃下温育1 h和2 h,取部分溶液经Sep-Pak C18固相萃取柱,2 mL乙腈洗涤,合并淋洗液,用HPLC检测其放化纯度。
2.5 18 F-MFBPA和18F-FBPA的体内稳定性
分别随机选取5只荷S180瘤昆明小鼠,经尾静脉注射1.85 MBq18F-MFBPA或18F-FBPA,注射后60 min断颈处死。分别取血和尿液样本,血液样本立刻以13 200 r/min离心5 min,然后加入0.8 mL PBS(10 mmol,p H 7.4),0.16 mL甲醇,0.04 mL氯仿洗涤。相同条件下再次离心,每个样品两次离心液合并后过Sep-Pak C18固相萃取柱。尿液样本直接用1 mL PBS稀释后过Sep-Pak C18固相萃取柱。用2 mL水和2 mL乙腈(1%TFA)分别洗涤。真空低温旋去溶剂后,再用1 mL PBS溶解,HPLC检测其放化纯度,分析标记产物在体内的稳定性。
2.6 18 F-MFBPA、18 F-FBPA、18 F-FDG 和18 FFET在荷S180瘤鼠体内的生物分布
将20只荷S180瘤昆明小鼠,随机分为4组,每组5只。分别经尾静脉注射0.1 mL(0.296~0.37 MBq)18F-MFBPA 和18F-FBPA,0.1 mL(0.37 MBq)18F-FDG 和18F-FET,并于注药后5、30、60、120 min分别将各组小鼠断颈处死 ,迅速解剖取出心 、肝 、脾、肺 、肾 、胃 、大肠 、小肠 、肌肉 、血液 、脑 、肿瘤等组织,称湿重,用 γ计数器测量计数,计算各脏器的放射性摄取率(%ID·g-1)以及肿瘤与肌肉、肿瘤与血、肿瘤与脑的放射性摄取比(T/NT)。
3 结果与讨论
3.1 结构鉴定
3.1.1 FBPA的结构鉴定
IR(KBr,cm-1):ν3 340,1 741,1 626,1 605,1 497,1 357,1 261,1 172,1 220,1 017,936,765;1H NMR(CDCl3,500 MHz):δ7.83(d,2H,J=8.1 Hz,Ar-H),7.67(d,2H,J=8.5 Hz,Ar-H),7.36(d,1H,J=7.9 Hz,Ar-H),7.31(t,2H,J=7.1 Hz,Ar-H),7.29(d,2H,J=5.7 Hz,Ar-H),7.14(d,2H,J=7.0 Hz,Ar-H),6.80(d,2H,J=8.6 Hz,Ar-H),6.48(d,1H,J=7.3 Hz,NH),5.09(m,1H,J=5.8 Hz,CHCOOCH 3),4.40(t,2H,J=4.5 Hz,CH2CH 2OTs),4.20(t,2H,J=4.7 Hz,CH2CH2OTs),3.78(s,3H,COOCH3),3.27(dq,2H,J=5.7 Hz,CH 2Ph),3.01(s,3H,Ts-CH 3);13C NMR(CDCl3,125 MHz)δ:172.17,166,11,150.77,145.08,135.92,129.91,129.35,128.88,128.63,128.01,127.19,126.89,114.34,67.83,65.52,53.49,52.42,37.96,21.67;Anal.calcd for C26 H27 NO7 S:C,62.76;H,5.47;N,2.82;Found:C,62.84;H,5.78;N,2.95。该结果表明,所合成化合物为目标产物。
3.1.218F-MFBPA的结构鉴定
IR(KBr,cm-1):ν3 333,1 741,1 626,1 605,1 538,1 504,1 257,1 224,1 176,1 068,839;1H NMR(CDCl3,500 MHz):δ 7.73(d,2H,J=8.7 Hz,Ar-H),7.31(d,2H,J=7.3,Ar-H),7.29(d,2H,J=7.3,Ar-H),7.26(d,2H,J=7.3,Ar-H),7.15(d,2H,J=7.1 Hz,Ar-H),6.96(d,2H,J=8.7 Hz,Ar-H),6.53(d,1H,J=7.3 Hz,NH),5.10(q,1H,J=5.6 Hz,—CHCH 2Ph),4.84~4.75(dt,2H,2J HF=47.3 Hz,—CH2CH2F),4.30~4.24(dt,2H,3J HF=27.7 Hz,CH2CH2F),3.79(s,3H,COOCH 3),3.27(dq,2H,J=5.8 Hz,—CH 2Ph);19F NMR(CDCl3,400 MHz):-224.167(J=27.7 Hz,CH2CH2F),-224.292(J=47.4 Hz,CH2CH2F);13CNMR(CDCl3,125 MHz)δ:172.19,166.20,161.23,135.93,129.36,128.95,128.63,127.19,126.79,114.43,82.36,81.01,53.49,52.40,37.97;MS-EI:m/z=345.14(found:345.13);Anal.calcd for C19H20FNO4:C 66.08,H 5.84,N 4.06;found:C 65.90,H 5.64,N 4.07。该结果表明,所合成化合物为目标产物。
3.1.318F-FBPA的结构鉴定
IR(KBr,cm-1):ν3 547,3 387,3 242,1 746,1 626,1 608,1 510,1 007,927;1H NMR(DMSO-D6,500 MHz):δ8.58(d,1H,J=8.0,NH),7.79(d,2H,J=8.7,Ar-H),7.31(d,2H,J=7.3,Ar-H),7.26(t,2H,J=7.5 Hz,Ar-H),7.17(t,1H,J=7.0 Hz,Ar-H),7.02(d,2H,J=8.5 Hz,Ar-H),4.81~4.70(d-t,2H,J=47.8,3.6 Hz,CH2CH2F),4.33~4.25(d-t,2H,J=30.2,3.6 Hz,CH2CH2F),4.58(m,1H,J=8.65,4.3 Hz,CH),3.16(dq,2H,J=4.3 Hz,—CH2 Ph);13C NMR(DMSO-D6,125 MHz)δ:173.26,165.77,160.51,138.15,129.19,128.97,128.12,126.37,126.29,113.93,82.81,81.16,67.24,67.05,54.12,36.21;MS-EI:m/z=241.08(found:241.13)。该结果表明,所合成化合物为目标产物。
3.2 18 F-MFBPA和18 F-FBPA的标记率和放化纯度
18F-MFBPA的标记率为23%~41%。18FMFBPA和18F-FBPA经HPLC分析放化纯度均>99%。18F-MFBPA和18F-FBPA与19F标准对照品通过 HPLC分析检测,对应化合物保留时间相同,高效液相分离提取的标记化合物均为目标物。
3.3 18F-MFBPA和18F-FBPA的稳定性
经过HPLC分析,18F-MFBPA在血清中和体内代谢测试中水解为18F-FBPA,体外稳定性良好,2 h内没有脱氟或分解现象。18F-FBPA体内外均显示良好稳定性。
3.4 脂水分配系数
经过测定计算后,18F-MFBPA和18F-FBPA的脂水分配系数分别为0.94和-0.58。
3.5 生物分布
18F-MFBPA 、18F-FBPA 、18F-FDG 和18FFET在荷S180瘤鼠体内的生物分布及 T/NT分别列于表1~表8。
分析表1和表 3可知,18F-MFBPA和18FFBPA在各脏器组织中均有较高的初始放射性摄取。5 min时,18F-MFBPA在肝、肾的放射性摄取分别为 2.97±0.70%ID/g和 4.89±0.78%ID/g,而18F-FBPA 为11.45±1.05%ID/g和6.90±0.84%ID/g;60 min时,18F-MFBPA在肝、肾内的代谢率分别为83%和89%,18F-FBPA为95%和83%。18F-MFBPA和18FFBPA在肝和肾中的清除速度较快的。在肿瘤中的吸收代谢相对比较缓慢。比较18F-MFBPA和18F-FBPA发现,作为羧酸的18F-FBPA更容易在血液中清除。至120 min时,18F-FBPA依然在大肠、小肠的吸收值较高。经过多次平行试验,结果表明,该标记化合物在肠内的代谢速度也很慢,具体原因正在研究中。
表1 18 F-M FBPA在荷S180瘤鼠体内的生物分布n=5)
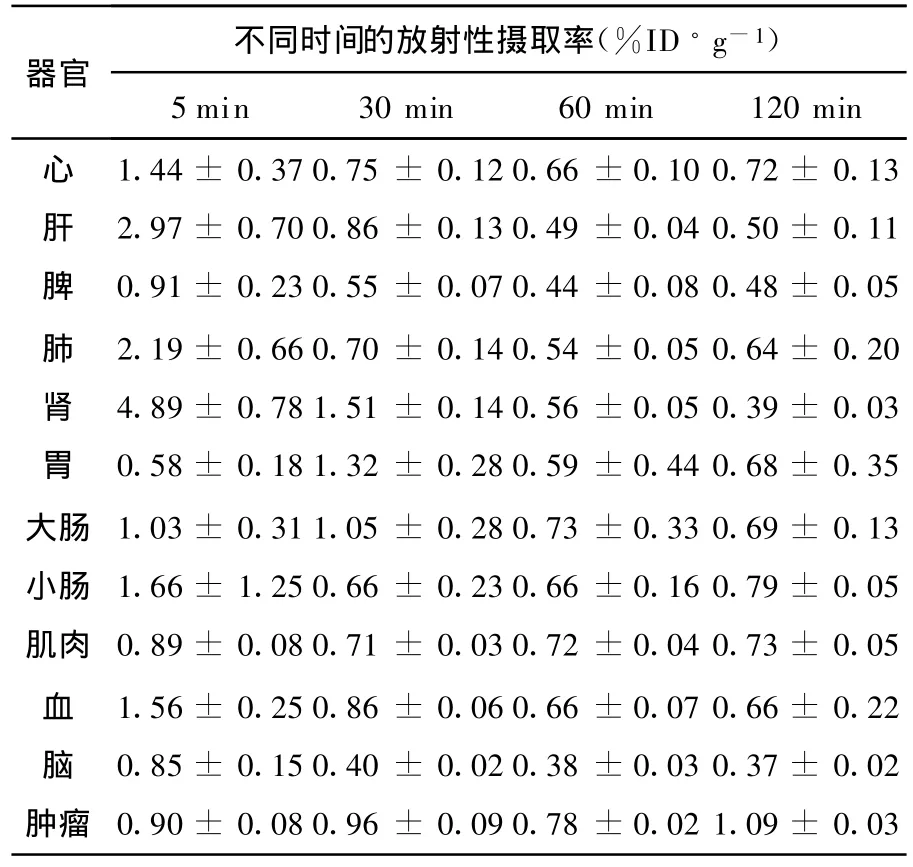
表1 18 F-M FBPA在荷S180瘤鼠体内的生物分布n=5)
器官不同时间的放射性摄取率(%ID·g-1)5 min 30 min 60 min 120 min心 1.44±0.37 0.75±0.12 0.66±0.10 0.72±0.13肝 2.97±0.70 0.86±0.13 0.49±0.04 0.50±0.11脾 0.91±0.23 0.55±0.07 0.44±0.08 0.48±0.05肺 2.19±0.66 0.70±0.14 0.54±0.05 0.64±0.20肾 4.89±0.78 1.51±0.14 0.56±0.05 0.39±0.03胃 0.58±0.18 1.32±0.28 0.59±0.44 0.68±0.35大肠 1.03±0.31 1.05±0.28 0.73±0.33 0.69±0.13小肠 1.66±1.25 0.66±0.23 0.66±0.16 0.79±0.05肌肉 0.89±0.08 0.71±0.03 0.72±0.04 0.73±0.05血 1.56±0.25 0.86±0.06 0.66±0.07 0.66±0.22脑 0.85±0.15 0.40±0.02 0.38±0.03 0.37±0.02肿瘤 0.90±0.08 0.96±0.09 0.78±0.02 1.09±0.03
表2 18 F-MFBPA在荷S180瘤鼠体各时间点肿瘤与主要脏器的T/NT,n=5)

表2 18 F-MFBPA在荷S180瘤鼠体各时间点肿瘤与主要脏器的T/NT,n=5)
时间/min T/NT肿瘤与血 肿瘤与肌肉 肿瘤与脑5 0.57 1.01 1.06 30 1.11 1.35 2.40 60 1.18 1.08 2.05 120 1.65 1.49 2.95
表3 18 F-FBPA在荷S180瘤鼠体内的生物分布,n=5)

表3 18 F-FBPA在荷S180瘤鼠体内的生物分布,n=5)
器官不同时间的放射性摄取率(%ID·g-1)5 min 30 min 60 min 120 min心 3.30±0.10 0.82±0.21 0.80±0.04 0.77±0.09肝 11.45±1.05 1.32±0.47 0.50±0.03 0.47±0.05脾 1.54±0.01 0.66±0.11 0.54±0.10 0.50±0.05肺 4.01±0.44 0.91±0.31 0.60±0.05 0.59±0.06肾 6.90±0.84 4.54±0.92 1.13±0.16 0.52±0.03胃 1.34±0.07 1.93±0.05 1.28±0.31 0.62±0.06大肠 2.05±0.12 2.06±0.51 1.15±0.25 1.18±0.19小肠 8.53±0.34 1.26±0.37 1.18±0.22 1.25±0.15肌肉 1.73±0.02 1.14±0.09 0.64±0.06 0.33±0.08血 6.46±0.03 1.07±0.17 0.65±0.04 0.56±0.03脑 0.39±0.06 0.29±0.03 0.34±0.01 0.35±0.01肿瘤 1.63±0.07 1.42±0.03 0.95±0.05 0.70±0.02
表4 18 F-FBPA在荷S180瘤鼠体各时间点肿瘤与主要脏器的T/NT,n=5)

表4 18 F-FBPA在荷S180瘤鼠体各时间点肿瘤与主要脏器的T/NT,n=5)
时间/min T/NT肿瘤与血 肿瘤与肌肉 肿瘤与脑5 0.25 0.94 4.18 30 1.33 1.25 4.89 60 1.46 1.48 2.79 120 1.25 2.12 2.01
表5 18 F-FDG在荷S180瘤鼠体内的生物分布(,n=5)
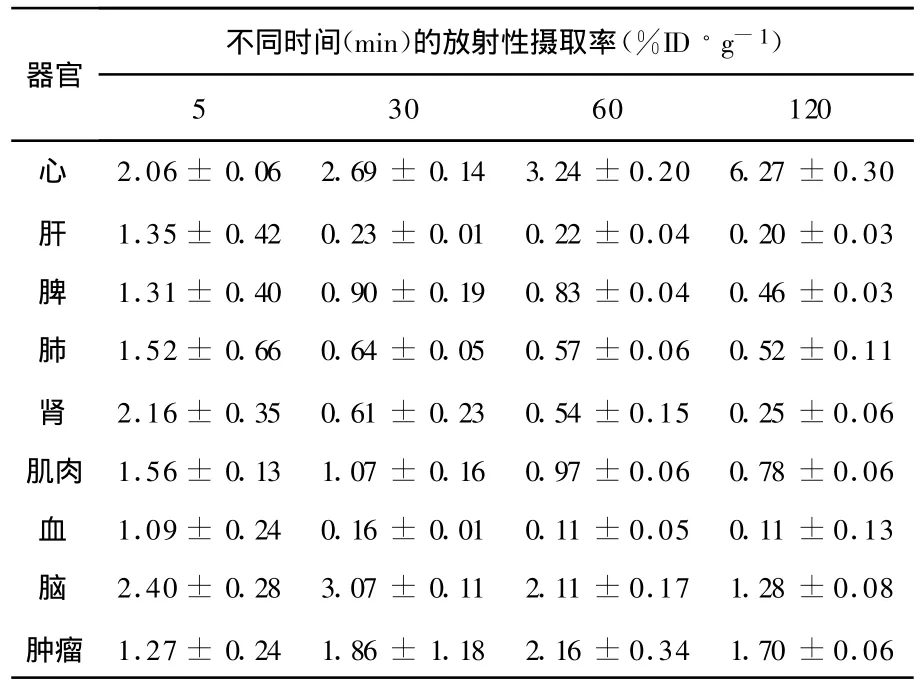
表5 18 F-FDG在荷S180瘤鼠体内的生物分布(,n=5)
器官不同时间(min)的放射性摄取率(%ID·g-1)5 30 60 120心 2.06±0.06 2.69±0.14 3.24±0.20 6.27±0.30肝 1.35±0.42 0.23±0.01 0.22±0.04 0.20±0.03脾 1.31±0.40 0.90±0.19 0.83±0.04 0.46±0.03肺 1.52±0.66 0.64±0.05 0.57±0.06 0.52±0.11肾 2.16±0.35 0.61±0.23 0.54±0.15 0.25±0.06肌肉 1.56±0.13 1.07±0.16 0.97±0.06 0.78±0.06血 1.09±0.24 0.16±0.01 0.11±0.05 0.11±0.13脑 2.40±0.28 3.07±0.11 2.11±0.17 1.28±0.08肿瘤 1.27±0.24 1.86±1.18 2.16±0.34 1.70±0.06
表6 18 F-FDG在荷 S180瘤鼠体内各时间点肿瘤与主要脏器的T/NT,n=5)

表6 18 F-FDG在荷 S180瘤鼠体内各时间点肿瘤与主要脏器的T/NT,n=5)
时间/min T/NT肿瘤与血 肿瘤与肌肉 肿瘤与脑5 1.17 0.81 0.53 30 11.38 1.75 0.61 60 19.47 2.23 1.02 120 15.85 2.20 1.33
由表5可见,18F-FDG在肿瘤的摄取随时间而升高,在60 min时,其肿瘤吸收摄取值达到2.16±0.34%ID/g。由表6可以看出,18F-FDG显示出较好的肿瘤与血和肿瘤与肌肉的T/NT,分别为2.23和19.47。与表3比较可见,与18FFDG吸收趋势不同,18F-FBPA在小鼠体内迅速被吸收,初始组织生物分布较高,随时间逐步清除。18F-FDG作为葡萄糖类的代谢显像剂具有多个羟基结构,在恶性肿瘤细胞中的摄取逐渐积聚。而18F-FBPA虽然没有18F-FDG的吸收摄取结果明显,但迅速的初始体内分布,使其具有良好的相对吸收时相点,因此,本工作选择静脉注射60 min作为显像的最佳时间。
比较表7和表3可知,18F-FET相对18FFBPA在肿瘤有较高的吸收,在体内的各个组织中的代谢比较缓慢,血液的清除速率较低。在60 min时,18F-FET在荷瘤鼠模型中肿瘤与肌肉和肿瘤与血的 T/NT分别为1.23和1.10。18F-FBPA肿瘤与肌肉和肿瘤与血的 T/NT分别为1.48和1.46。
表7 18 F-FET在荷S180瘤鼠体内的生物分布(,n=5)
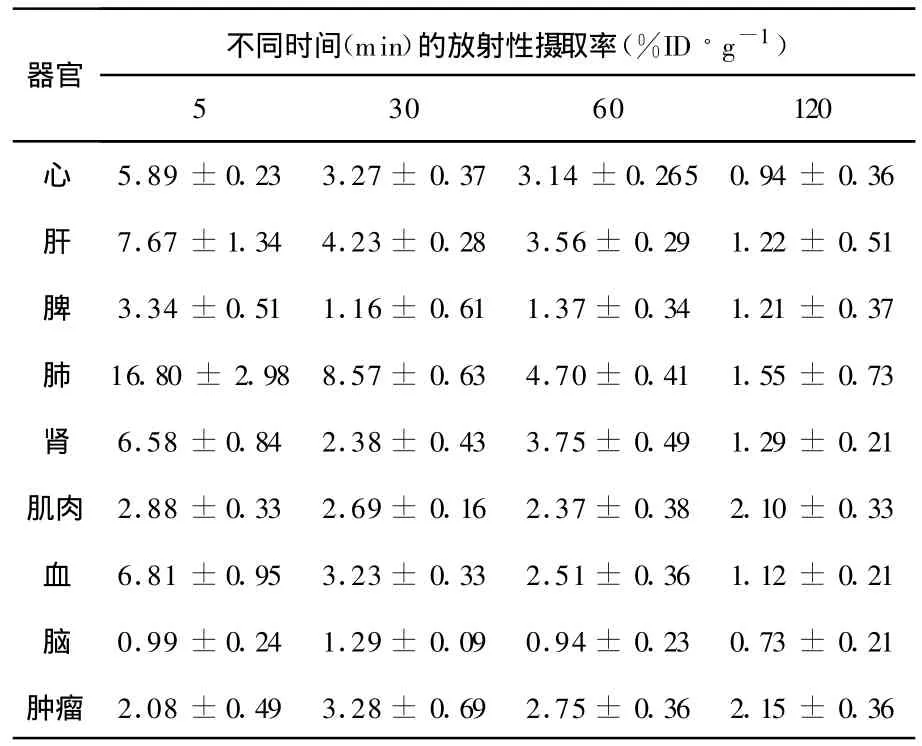
表7 18 F-FET在荷S180瘤鼠体内的生物分布(,n=5)
器官 不同时间(min)的放射性摄取率(%ID·g-1)5 30 60 120心 5.89±0.23 3.27±0.37 3.14±0.265 0.94±0.36肝 7.67±1.34 4.23±0.28 3.56±0.29 1.22±0.51脾 3.34±0.51 1.16±0.61 1.37±0.34 1.21±0.37肺 16.80±2.98 8.57±0.63 4.70±0.41 1.55±0.73肾 6.58±0.84 2.38±0.43 3.75±0.49 1.29±0.21肌肉 2.88±0.33 2.69±0.16 2.37±0.38 2.10±0.33血 6.81±0.95 3.23±0.33 2.51±0.36 1.12±0.21脑 0.99±0.24 1.29±0.09 0.94±0.23 0.73±0.21肿瘤 2.08±0.49 3.28±0.69 2.75±0.36 2.15±0.36
表8 18 F-FET在荷 S180瘤鼠体各时间点肿瘤与主要脏器的T/NT(,n=5)
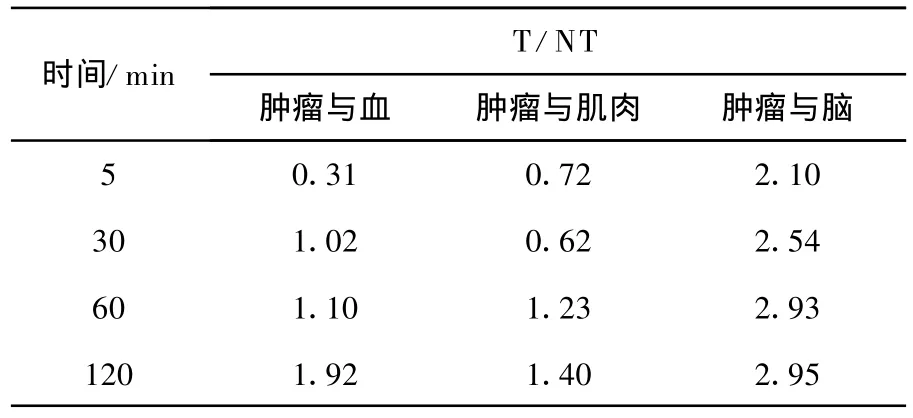
表8 18 F-FET在荷 S180瘤鼠体各时间点肿瘤与主要脏器的T/NT(,n=5)
时间/min T/NT肿瘤与血 肿瘤与肌肉 肿瘤与脑5 0.31 0.72 2.10 30 1.02 0.62 2.54 60 1.10 1.23 2.93 120 1.92 1.40 2.95
18F-FDG和18F-FET的比较分析显示,虽然18F-FBPA在肿瘤组织中的摄取没有18F-FDG和18F-FET明显,但因其良好的初始摄取、清除速率快以及稳定性较好等优点,值得进一步研究。
4 结 论
本研究合成了MFBPA并标记得到18FMFBPA及其水解产物18F-FBPA,对其性质进行了初步的研究,其中18F-FBPA放化纯度高,稳定性好,在肿瘤组织中有明显摄取。与目前临床常用显像剂18F-FDG、18F-FET的荷瘤鼠生物分布比较,结果显示,18F-FBPA有进一步研究的价值。18F-FBPA在结构优化、转运机制、药代动力学以及PET显像等方面评价研究正在进行中。
[1] 王荣福.分子核医学应用研究发展[J].中国临床医学影像杂志,2008,19(8):585-590.
[2] 叶招明.FDG PET对骨肉瘤新辅助化疗疗效评估的初步研究[J].中国骨科杂志,2007,27(9):699-704.
[3] Kiichi Ishiwata.A comparative study on protein incorporation of l-[methyl-3H]methionine,l-[1-14C]leucine and l-2-[18F]fluorotyrosine in tumor bearing mice[J].Nucl Med&Bio,1993,20(8):895-899.
[4] 刘占峰.同位素标记氨基酸的应用研究进展[J].核技术,2004,27(9):681-686.
[5] 唐刚华.O-(2-18F-氟代乙基)-L-酪氨酸的全自动合成[J].核化学与放射化学,2003,25(1):40-44.
[6] 王明伟.O-(2-18F-氟代乙基)-L-酪氨酸的新合成路线及其生物学评价[J].中华核医学杂志,2006,26(4):238-240.
[7] Wster HJ.Synthesis and radiopharmacology of O-(2-[18F]fluoroethyl)-L-tyrosine for tumor imaging[J].J Nucl Med,1999,40:205-212
[8] 李靖轩.O-(2-[18F]氟乙基)-L-酪氨酸的研制[D].北京:北京原子能科学研究院,2004.
[9] Hideo Tsukada.Evaluation of D-isomers of O-18F-fluoromethyl,O-18F-fluoroethyl and O-18F-f luoropropyl tyrosine as tumor imaging agents in mice[J].Eur J Nucl Med Mol Imaging,2006,33(9):1 017-1 024.
[10]Byung Seok Moon.Syntheses of F-18 labeled fluoroalkyltyrosine derivatives and their biological evaluation in rat bearing 9L tumor[J].Bio&Med Chem Let,2007,17:200-204.
[11]Engelhard HH.Inhibitory effects of phenylbutyrate on the proliferation,morphology,migration and invasiveness of malignant glioma cells[J].J Neuro Oncology,1998,37:97-108.
[12]Harrison LE.Phenylacetateinhibits isoprenoid biosynthesis and suppressed growth of human pancreatic carcinoma[J].Surgery, 1998,124:541-550.
[13]Melichar B,Ferrandina G.Growth inhibitory effects of aromatic fatty acids on ovarian tumor cell lines[J].Clin Cancer Res,1998,4:3 069-3 076.
[14]Jonson,SD.Investigations into tumor accumulation and peroxisome proliferator activated receptor binding by F-18 and C-11 fatty acids[J].Nucl Med&Bio,2002,29:211-216.
[15]汪铭.基于氨基酸的18F放射性标记前体的合成与19F代反应[D].北京:北京师范大学化学学院,2006.
