整合素αⅤβ3非肽类小分子拮抗剂的设计及其在肿瘤显像中的研究进展
2010-07-18张春丽王荣福
李 玲,张春丽,王荣福
(北京大学 第一医院核医学科,北京 100034)
放射性核素标记的肿瘤特异性高表达受体拮抗剂在肿瘤的早期发现、早期诊断中已经发挥出独特的优势,同时也在肿瘤的靶向治疗方面也显示出一定的应用价值。研究证明,整合素αⅤβ3受体在多种肿瘤表面和新生血管内皮细胞中有高表达,且对肿瘤血管生成起着重要作用。肿瘤血管生成是肿瘤生长、转移过程中不可缺少的生物过程,有研究表明如果没有新生血管生成,肿瘤的生长不超过1~2 mm。因此,针对整合素αⅤβ3拮抗剂的研究对肿瘤的早期诊断及靶向治疗具有重要意义。
1 整合素αⅤβ3及其RGD肽类配体
1.1 整合素αⅤβ3及其在肿瘤血管生成中的作用
整合素是细胞黏附分子家族的重要成员之一,是由α和β两条链通过非共价键连接而成的异源二聚体跨膜糖蛋白,主要介导细胞与细胞、细胞与细胞外基质(Extracellular Matrix,ECM)之间的相互黏附,并介导细胞与ECM之间的双向信号传导,在很多重要的生理过程中起重要作用。迄今为止,已发现18种不同的α亚基和8种β亚基,组成了24种整合素[1-2]。
其中 ,整合素 αⅤβ3是由 αⅤ亚基(CD51,相对分子质量150 000)和β3亚基(CD61,相对分子质量105 000)形成的跨膜异二聚体糖蛋白,能识别配体分子中的精-甘-天冬序列(A rg-Gly-Asp,RGD),这类配体包括玻璃粘连蛋白(V itronectin,VN)、纤维粘连蛋白(Fibronectin,FN)、血小板反应蛋白-1(Throm bospodin,TSP-1)和范德华因子(Von Willibrand's Factor,vWF)等,故又名VN受体。αⅤβ3可以表达于多种细胞类型,包括破骨细胞、血管平滑肌细胞、内皮细胞等,还可表达于多种肿瘤细胞膜表面,如卵巢癌、神经母细胞瘤、乳腺癌、黑色素瘤等[3],在多种活动过程中与含RGD肽的配体结合,参与肿瘤的血管生成、侵袭转移,炎症、伤口愈合和凝血等生理和病理过程。
αⅤβ3在静止的内皮细胞基本不表达,而在新生血管生成时的内皮细胞上大量表达,并可能通过参与内皮细胞的激活和迁移、介导内皮细胞增殖、抑制内皮细胞凋亡、参与碱性成纤维细胞生长因子(Basic Fibroblast Grow th Factor,bFGF)及血管内皮生长因子(Vascu lar endothelial G row th Factor,VEGF)诱导的血管生成、诱导环加氧酶产生等过程,在肿瘤血管生成中发挥重要作用[4]。
目前,针对整合素αⅤβ3的抑制剂有单抗类、解聚素、肽类及非肽类小分子拮抗剂等[2]。
1.2 整合素αⅤβ3的 RGD肽类配体
整合素αⅤβ3在肿瘤血管生成中起到重要作用,因此,为寻找早期发现肿瘤和抑制肿瘤生长的新方法,整合素αⅤβ3配体及小分子拮抗剂的研究成为肿瘤研究的热点之一。目前,研究主要集中于两个方面,一方面是对RGD肽类配体的研究,如线性RGD肽、环状RGD肽及 RGD肽的多聚体等多种形式RGD肽类整合素配体。其中已有一些含RGD肽序列的环肽进入临床试验。此外,通过RGD肽结构的模拟或受体-配体结合的构效关系等方法设计出了一系列非肽类小分子拮抗剂,包括异噁唑啉类、吲哚类、2-苯氮杂类和Azacarba衍生物等[5]。
大多数线性 RGD肽对整合素受体亲和力较低,且易被蛋白酶降解,体内稳定性差,其生物活性和显像结果并不理想。对含RGD肽结构的分子进行修饰与改造,可提高配体分子的稳定性、亲和性、特异性及靶向性,增加肿瘤摄取并延长其在肿瘤组织的滞留时间,以达到更好的显像和治疗效果。进一步研究发现,环形结构的肽较线性肽稳定,有更高的亲和性、受体特异结合性。刘红洁等[6]的研究结果显示,放射性核素131I标记的cyclo(-Cys-A rg-Gly-Asp-T ry-Cys-)可使小鼠黑色素瘤B16清晰显像。二硫键成环的NC100692对αⅤβ3受体有很高的亲和力(K d=0.01 nm ol/L),其99Tcm标记物已成功应用于人体肿瘤血管生成的显像研究[7-8]。而环五肽cyclo(-RGDfV-),其 IC50=2.3 nmol/L,已作为抗肿瘤药物(Cilengitide,EMD 121974)进入临床二期研究[9-10]。此外,在环形RGD肽结构上引入糖基[11]、亲水性四肽、聚乙二醇[12]等进行修饰,不仅有利于放射性核素的标记,还可改善生物利用度,增加肿瘤组织的摄取。而通过形成多聚体亦可提高RGD肽对整合素受体的结合率和选择性,提高分子成像的靶向亲和性。Chen等[13]通过在RGD肽二聚体的谷氨酸氨基上引入4-18F苯合成18F-FB-E[c(RGDyK)]2(y=OH)进行胶质母细胞瘤小动物PET显像和放射自显影,结果显示,二聚体具有快速血浆清除率,肿瘤组织摄取亦很快,30 m in后即达(6.79±0.05)%ID/g。与单体相比,在所有的时间点,二聚体RGD肽都有明显高的肿瘤摄取(P<0.001)。Li等[14]应用64Cu分别标记 DOTARGD四聚体和八聚体,用于人胶质瘤大鼠模型的成像。结果显示,八聚体探针较四聚体对αⅤβ3具有更高的亲和性和特异性(50%抑制浓度分别为10 nmol/L和35 nmo l/L);八聚体探针的肿瘤摄取率也明显高于四聚体。
2 整合素αⅤβ3的非肽类小分子拮抗剂的设计
根据受体-配体结合的X射线晶体衍射、NMR结构研究以及组合化学、计算机辅助药物设计等技术,可设计出一系列αⅤβ3受体的小分子拮抗剂。目前主要通过肽类模拟和计算机辅助药物设计得到新的小分子拮抗剂。
2.1 肽类模拟
对RGD肽的结构进行模拟设计得到的非肽类小分子拮抗剂的主要结构示于图1。由图1可知,模拟设计得到的非肽类小分子拮抗剂主要由三部分组成:一端为类似精氨酸末端胍基的部分,可为胍基或者类似的碱基,如2-氨基吡啶、四氢-1、8-二氮杂萘等;另一端为类似天冬氨酸残基部分的羧基,一般为β-取代丙酸;中间为连接羧基与胍基的部分,其距离与RGD肽中的距离相近。另外,在环五肽4位氨基酸残基的位置引入环状结构有利于与αⅤβ3的结合[5]。根据中间连接部分结构的不同,还可将其分为:以哌嗪(闭合的二元胺结构)、哌啶(闭合的一元胺结构)、γ-内酰胺(五元含氮环结构)、苯并多元杂环(桥环结构)和烷基酰胺等为中间连接部分的化合物[15]。这些非肽分子的结构与电性分布,其活性、选择性和稳定性比RGD肽更好,将成为主要的αⅤβ3受体拮抗剂。

图1 模拟设计得到的RGD肽的结构
2.2 计算机辅助药物设计
在计算机辅助药物设计广泛应用的基础上,研究者们主要通过建立药效团和直接分子对接的方法获得更多新的高亲和力和高选择性非肽类小分子拮抗剂。
2.2.1 建立药效团的间接药物设计方法
通过对已知肽类配体及非肽类小分子拮抗剂结构的分析可知,进行自动分子对接等方法可建立药效团,再根据药效团各元素及其空间距离对小分子数据库进行搜索,获得具有相似结构的小分子拮抗剂。
Marinelli等[16]应用自动分子对接的方法,对已知结构并具有高的分子多态性和抑制作用的肽类及非肽类整合素αⅤβ3拮抗剂进行对接实验,探讨配体-受体结合的构效关系,得出了可以反映配-受体结合的五点药效团模型,其空间构型示于图2,该模型与配-受体识别结合过程的5个因素有关:1)化合物中羧基氧原子与受体金属离子依赖性粘附位点(Metal Ion-dependent A dhesion Site,MIDAS)区中的 Ca2+络合;2)化合物中胍基或胍基类似集团与受体(α)-A sp218或(α)-Asp150形成盐桥;3)化合物中芳环结构与受体侧链(β)-Ty r122产生T形作用;4)化合物中NH基上的氢原子与受体骨架(β)-A rg216形成氢键;5)化合物中羰基与受体(β)-A rg214胍基结构产生氢键作用。
Moitessier等[17]通过对具有较高亲和力和选择性的RGD肽的结构进行分析,得出对配体受体结合起重要作用的集团为含羧酸盐的负电区域(a),胍基类似的正电集团(b)以及连接这两个带电集团的疏水中心(c),由此得出三点药效团模型,其空间构型示于图3。他们还用该三点药效团模型与X射线晶体衍射得出的受体结构进行自动对接和分子动力学研究,证实了该药效团的有效性。
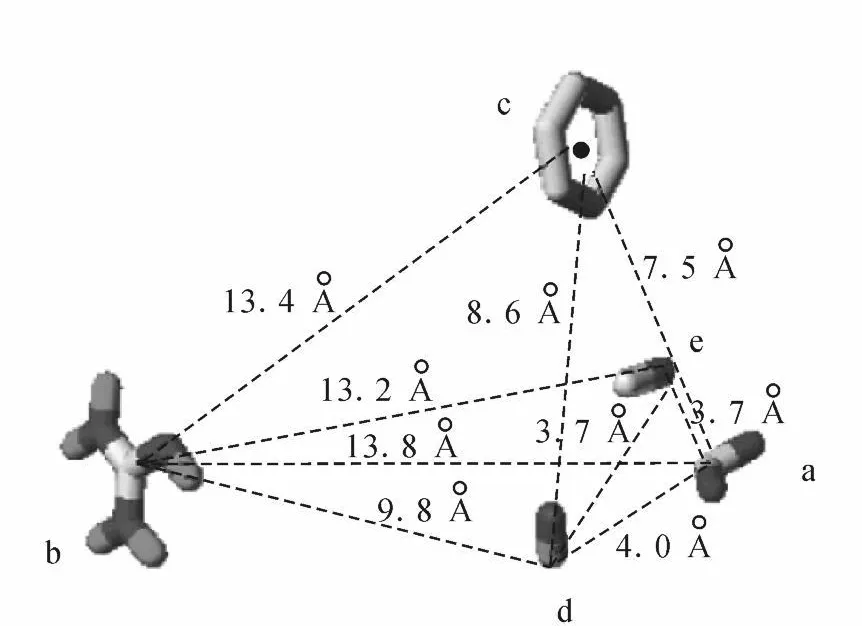
图2 Marinelli等设计的五点药效团模型的空间构型

图3 Moitessier等设计的三点药效团模型的空间构型
Dayam等[18]用Catalyst软件包选择了3大类小分子化合物作为训练集,得到了10个药效团,用包含638个已知整合素αⅤβ3受体拮抗剂的数据库验证所建立的药效团模型,选出具有最佳分辨力的药效团模型,其空间构型示于图4。此后,又用该药效团对含有600 000个化合物的小分子库进行3D搜索,得到 832个化合物。根据结构新颖性原则,选择了29个化合物进行结合实验,得到4个显示高亲和力的化合物。对其中的一种活性化合物进行构效研究,发现了两种高亲和力的小分子,这些小分子可被偶联于紫杉醇,所形成的化合物可直接作用于αⅤβ3阳性的转移性肿瘤细胞。
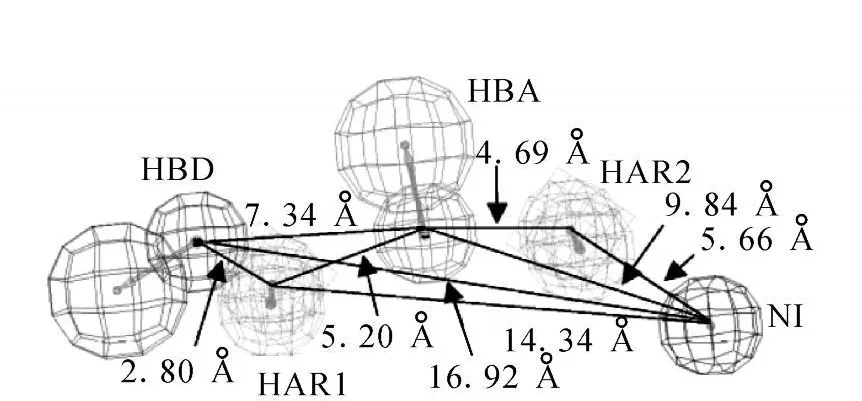
图4 Dayam等设计的药效团模型的空间构型
程刚英等[19]选择了对αⅤβ3受体具有较高抑制活性(IC50<110 nmol/L)的4个类型(分别以酰胺、哌嗪、哌啶、γ-戊内酰胺为中间连接基)的30个化合物为训练集,利用Catalyst软件构建了整合素αⅤβ3受体选择性拮抗剂药效团模型,其空间构型示于图5。他们又在数据库中寻找具有活性的母体结构,对母体结构进行修饰改造及类药性分析,得到了新的预测活性较高且易于合成的先导化合物。
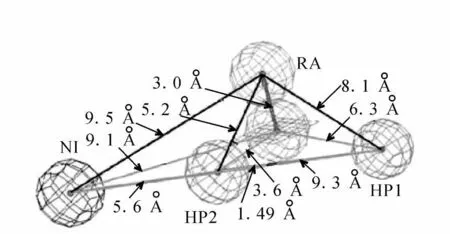
图5 程刚英等设计的药效团模型的空间构型
对比图2~图5可以看出,4种用不同方法设计出的最佳药效团虽存在一定的不同之处,但均含有疏水中心、芳环及负电集团等药效元素,且各药效元素之间的距离相似。利用药效团进行分子筛选可得到较多具有高亲和力的小分子,进一步的研究仍在进行中。
2.2.2 分子对接法直接药物设计
分子对接法(Docking)是基于受体结构的直接药物设计最常用的方法,是直接将小分子与受体进行模拟结合,通过计算,预测两者间的结合模式和亲和力,对受体-配体结合进行三维构效关系研究,优化先导化合物以实现全新药物设计,并获得结构新颖的靶向药物,包括DOCK、A utodock、FlexX 等。
Casiraghi[20]和Feuston[21]等分别用DOCK方法研究了RGD三肽中插入氨基环戊酸结构和非肽类小分子配体与αⅤβ3受体的结合机制,以指导新化合物的设计与优化;Marinelli等[16]用7类9个已知的αⅤβ3受体配体(包括肽类和非肽类配体、光学异构体)与受体进行对接,研究了配体与受体结合的构效关系,证明配体与受体的极性基团的相互作用和氢键作用对两者的结合力起着关键作用,且AutoDock计算出的结合能与实验测得的IC50或Ki有很好的一致性,并发现有两种可能的受体结合模式,其能量相差约8.4 kJ/mo l。
Raboisson等[22]用 DOCK方法对吲哚类αⅤβ3受体拮抗剂进行了三维构效关系研究,并以此为依据,设计出3个新型化合物,通过生物活性测定得到亲和力和选择性最高且能通过口服给药的αⅤβ3受体拮抗剂3(3-吡啶基)-3-[4-[2-(5,6,7,8-四氢[1,8]萘啶-2)乙基]吲哚-1]丙酸。该药物对αⅤβ3受体的IC50为0.50 nm ol/L,对αⅡbβⅢa受体的 IC50>1 μmol/L。
纪庆等[23-24]基于整合素αⅤβ3受体的胞外区及与配体复合物的三维晶体结构确定结合位点,用DOCK 4.0程序对小分子库进行筛选,并进行生物活性测试,得到了一类靶向整合素αⅤβ3的全新的先导化合物。挑选出得分高的前1 000个化合物,按化学特性和类药性的不同将化合物分类,从每一类中挑选出得分高的代表性化合物,最终选择50个化合物进行生物学活性测定。通过活性测定,得到7个化合物具有抑制细胞黏附活性(对 VN的半数抑制浓度IC50为38.5~180.4 μmol/L),其中3,4-二氯苯基双胍活性最高(对VN 的IC50为 38.5μmol/L),此即为靶向整合素αⅤβ3受体的一类新型先导化合物——取代苯基双胍类化合物。他们在研究中还通过分子图像学方法分析了取代苯基双胍类化合物与αⅤβ3受体之间的作用模式以及电荷分布,找到了其作用的关键位置和基团。结果显示,取代苯基双胍类化合物的双胍部分以“舒展”的方式伸入金属离子依赖性结合位点中,并能够与受体Glu220形成稳定的氢键。
在计算机辅助药物设计中,药效团的构建和分子对接法的联合使用,可获得更多高选择性、高亲和力的小分子拮抗剂,再经过进一步体内外实验筛选有望获得新的高效小分子拮抗剂,应用于肿瘤的显像与治疗。
3 放射性核素标记的整合素αⅤβ3非肽类小分子拮抗剂在肿瘤显像和治疗方面的应用
研究表明,18F、64Cu、99Tcm和111In标记的环RGD肽类在各种肿瘤鼠模型中均可表现出选择性的肿瘤摄取[25-27],且18F-Galacto-RGD已成为第一个进入临床试验的以整合素αⅤβ3为靶点的肿瘤显像剂,在恶性黑素瘤的临床试验中表现出好的生物学分布及特异性靶点识别[28];最近亦用于胶质母细胞瘤的临床试验,且可成功识别表达αⅤβ3胶质母细胞瘤[29]。虽然,RGD肽类虽已被证明具有成为肿瘤显像药物的潜力,但目前还没有一种放射性药物在具有高肿瘤摄取和滞留的特性的同时在非肿瘤组织摄取很少。而肽类模拟及非肽类拮抗剂对αⅤβ3具有很高的亲和力和选择性,这就意味着这类分子能在将非肿瘤组织的摄取降到最低的同时把放射性核素输至肿瘤组织,从而使其具有应用于肿瘤早期诊断显像和靶向治疗的潜力。
H arris TD等[30]的研究证明,给荷瘤小鼠尾静脉注射111In-TA 120(TA 120为吲哚类RGD肽模拟分子),2 h后表现出高肿瘤摄取(12.9%ID/g),24 h时的摄取仍高达9.25%ID/g;内脏摄取虽低于二聚体环肽,但肾脏摄取仍较高,24 h时为7.5%ID/g。而喹诺酮类RGD肽模拟分子TA 138用111In标记后,由尾静脉注入荷瘤小鼠体内,2 h后肿瘤摄取可达9.39%ID/g,肿瘤与非肿瘤的放射性摄取比(T/NT)如下:血液17.5、肌肉 17.1、肝脏 4.83、肾脏 4.04 、骨 6.01。且111In-TA 138表现出肿瘤清除慢,在静脉注射24 h后降至3.46%ID/g。较RGD肽类分子具有更好的T/NT。
目前,此类研究仍多集中于发现及设计具有更高亲和力和特异性的整合素αⅤβ3非肽类小分子拮抗剂,对于已经发现的高亲和力的小分子尚未进行进一步的动物体内显像及应用实验,这将成为今后实验研究的重点之一。
4 整合素αⅤβ3非肽类小分子拮抗剂在肿瘤显像和治疗方面的应用前景
通过 RGD肽类模拟、计算机辅助药物设计,可得出大量具有高选择性、高亲和力αⅤβ3小分子拮抗剂,再经过进一步体内外实验,可选择出适于使用放射性核素标记、易于清除的小分子拮抗剂,对肿瘤组织进行显像。亦可将治疗用放射性核素(如131I)或者抗肿瘤药物结合于高特异性、高亲和力、具有类药性的小分子拮抗剂上,将具有治疗效果的核素或抗肿瘤药物输送至靶点,用于肿瘤的靶向治疗。通过深入研究,整合素αⅤβ3小分子拮抗剂必将在肿瘤的显像及临床治疗方面发挥重要作用。
[1] Beer AJ,Schw aiger M.Imaging of integrin alphavbeta3 exp ression[J].Cancer Metastasis Rev,2008,27(4):631-644.
[2] Liu ZF,Wang F,Chen X.IntegrinαⅤβ3-targeted cancer therapy[J].D rug Development Research,69(6):329-339.
[3] Dijkgraaf I,Boerman OC.Radionuclide imaging of tumor angiogenesis[J].Cancer Biother Radiopharm,2009,24(6):637-647.
[4] 黄云鹏.整合素αⅤβ3在肿瘤血管生成中的作用[J].中国肿瘤,2007,16(1):35-38.
[5] 张春丽,杨铭,王荣福.RGD肽与整合素αⅤβ3受体结合的构效关系及放射性标记配体的设计[J].肿瘤学杂志,15(1):76-81.
[6] 刘红洁,王荣福,张春丽,等.131-I标记RGD环肽在荷瘤小鼠体内分布与显像研究[J].中国医学影像技术,2008,24(1):131-133.
[7] Edwards D,Jones P,Haram is H,et al.99mTc-NC100692——a tracer for imaging vitronectin receptors associated w ith angiogenesis:a preclinical investigation[J].Nucl Med Biol,2008,35(3):365-375.
[8] Roed L,Oulie I,McParland BJ,et al.H uman urinary excretion of NC100692,a RGD-pep tide for imaging angiogenesis[J].Eur JPharm Sci,2009,37(3-4):79-83.
[9] Raguse JD,Gath HJ,Bier J,et al.Cilengitide(EMD 121974)arrests the grow th of a heavily pretreated highly vascularised head and neck tumour[J].OralOncol,2004,40(2):228-230.
[10]Ruoslahti E,Pierschbacher MD.A rg-Gly-Asp:a versatile cell recognition signal[J].Cell,1986,44(4):517-518.
[11]Wester HJ,Schottelius M,Scheidhauer K,et al.Comparison o f radioiodinated TOC,TOCA and Mtr-TOCA:the effect of carbohyd ration on the pharmacokinetics[J].Eur J Nucl Med Mol Imaging,2002,29(1):28-38.
[12]Chen X,Hou Y,TohmeM,etal.Pegy lated A rg-Gly-Asp pep tide:64Cu labeling and PET imaging of brain tumor alphavbeta3-integrin expression[J].JNuclMed,2004,45(10):1 776-1 783.
[13]Chen X,Tohme M,Park R,et al.Micro-PET imaging of alphavbeta3-integrin exp ression with18F-labeled dimeric RGD pep tide[J].Mol Imaging,2004,3(2):96-104.
[14]Li ZB,Cai W,Cao Q,et al.64Cu-labeled tetrameric and octameric RGD peptides for small-animal PET of tumor alpha(Ⅴ)beta(3)integrin expression[J].JNucl Med,2007,48(7):1 162-1 171.
[15]倪广惠,姜凤超.整合素αⅤβ3拮抗剂的研究进展[J].药学学报,2006,41(7):577-582.
[16]Marinelli L,Lavecchia A,Gottschalk KE,et al.Docking studies on alphaⅤbeta3 integrin ligands:pharmacophore refinement and im p lications for d rug design[J].J Med Chem,2003,46(21):4 393-4 404.
[17]Moitessier N,H enry C,Maigret B,et al.Combining pharmacophore search,automated docking,and molecu lar dynam ics simu lations as a novel strategy for flexible docking.Proof of concep t:docking of arginine-g lycine-aspartic acid-like compounds into the alphaⅤbeta3 binding site[J].J Med Chem,2004,47(17):4 178-4 187.
[18]Dayam R,Aiello F,Deng J,et al.Discovery of smallmolecule integrin alphavbeta3 antagonists as novel anticancer agents[J].J Med Chem,2006,49(15):4 526-4 534.
[19]程刚英,倪广惠,姜凤超.整合素αⅤβ3受体拮抗剂药效团模型的研究[J].药学学报,2009,44(4):379-385.
[20]Casiraghi G,Rassu G,Auzzas L,et al.G rafting am inocyclopentane carboxy lic acids onto the RGD tripeptide sequence generates low nanomolar alphaⅤbeta3/alphaⅤbeta5 integrin dual binders[J].J Med Chem,2005,48(24):7 675-7 687.
[21]Feuston BP,Culberson JC,Duggan ME,et al.Binding model for nonpep tide antagonists of alpha(Ⅴ)beta(3)integrin[J].JMed Chem,2002,45(26):5 640-5 648.
[22]Raboisson P,Desjarlais RL,Reed R,et al.Identification of novel short chain 4-substituted indoles as potent alphaⅤbeta3 antagonist using structurebased drug design[J].Eur JMed Chem,2007,42(3):334-343.
[23]纪庆,周圆,彭晖,等.整合素αⅤβ3小分子抑制剂的设计及活性测定[J].中国医学科学院学报,2007,29(3):347-352.
[24]Zhou Y,Peng H,Ji Q,et al.Discovery of small molecu le inhibitors of integrinαⅤβ3through structure-based virtual screening[J].Bioorg Med Chem Lett,2006,16:5 878-5 882.
[25]Chen X,Park R,Tohme M,et al.MicroPET and autoradiographic imaging of breast cancerαⅤ-integrin expression using18F-and64Cu-labeled RGD pep tide[J].Biocon jugate Chem,2004,15(1):41-49.
[26]Janssen ML,Oyen WJ,Dijkgraaf I,et al.Tumor targeting with radio labeled alpha(Ⅴ)beta(3)integrin binding pep tides in a nudemouse model[J].Cancer Res,2002,62(21):6 146-6 151.
[27]Janssen M,Oyen WJ,Massuger LF,et al.Comparison of a monomeric and dimeric radiolabeled RGD-peptide for tumor targeting[J].Cancer Biother Radiopharm,2002,17(6):641-646.
[28]Beer AJ,Haubner R,GoebelM,et al.Biodistribution and pharmacokinetics of the alphaⅤbeta3-selective tracer18F-galacto-RGD in cancer patients[J].JNuclMed,2005,46(8):1 333-1 341.
[29]Schnell O,K rebs B,Carlsen J,et al.Imaging of integrin alpha(v)beta(3)expression in patients withmalignant glioma by[18F]Galacto-RGD positron em ission tomography[J].Neuro Oncol,2009,11(6):861-870.
[30]Harris TD,Kalogeropoulos S,Nguyen T,et al.Design,synthesis,and evaluation of radiolabeled integrin alphaⅤ beta3 receptor antagonists for tumor imaging and radiotherapy[J].Cancer Biother Radiopharm,2003,18(4):627-641.
