4-甲基咪唑双膦酸的合成及其99Tcm标记
2010-07-18翟好真罗世能林建国夏咏梅
翟好真,罗世能,王 燕,邱 玲,林建国,夏咏梅
(1.江南大学 化学与材料工程学院,江苏无锡 214122;2.江苏省原子医学研究所,卫生部核医学重点实验室,江苏省分子核医学重点实验室,江苏无锡 214063)
有关研究[1-3]表明,双膦酸盐类药物在预防恶性肿瘤骨并发症和降低乳腺癌患者死亡率方面有重要作用。2003年,Reid[4]确定了双膦酸盐类药物在预防骨质疏松症方面的作用。双膦酸盐类药物的研发经历了三代:第一代是以氯屈膦酸盐为代表;第二代是以帕米膦酸二钠为代表的含氮双膦酸盐,其抑制骨吸收的作用优于第一代药物;第三代包括具有杂环结构的含氮双膦酸盐唑来膦酸和含氮不含环状结构的伊班膦酸,作用强度和疗效较第二代明显提高,尤其是唑来膦酸盐类,因其能特异性地作用于骨骼,对于癌症骨转移患者及恶性肿瘤引起的高钙血症患者有突出疗效[5]。
近年来,核医学有了突飞猛进的发展,尤其是在医学显像方面,出现了一大类具有放射性骨显像作用的药物,相比传统的医学显像技术具有早诊断、早治疗的优点。99Tcm标记亚甲基双膦酸盐是目前临床上应用最广泛的一类放射性骨显像剂[6],但其在体内清除较慢,给药后需要3~4 h显像。99Tcm标记唑来膦酸盐类是目前疗效和显像效果综合应用较好的一类药物,国内外有多项相关报道[7-12]。本研究拟以4-甲基咪唑为原料,合成 1-羟基-2-(4-甲基-1H-咪唑基)-乙烷-1,1-双膦酸(M4 IDP),并对其进行99Tcm标记,探讨最佳标记条件,测定标记物体外稳定性,为后期的生物学分布和显像实验做基础。
1 主要实验材料
Yanadimoto型熔点仪:日本YANACO公司;VARIO ELⅢ型元素分析仪:德国elementar公司;傅里叶变换红外光谱仪:Bruker光谱仪器公司;WatersPlatform ZMD4000型质谱仪:美国Waters公司;Bruker AM400型核磁共振仪:Bruker光谱仪器公司;PackardCobra型自动γ计数器:美国 Victoreen公司;4-甲基咪唑:上海瀚鸿化工科技有限公司。99Tcm:740 GBq/L,江苏省江原医院。其余化学试剂均为国产分析纯。
2 实验方法
2.1 1-羟基-2-(4-甲基-1H-咪唑基)-乙烷-1,1-双膦酸(M4 IDP)的合成
M4IDP的合成路线示于图1[7-10]。采用IR、MS及1H NMR对图1中化合物Ⅱ、Ⅲ、Ⅳ进行结构鉴定。
2.1.1 2-(4-甲基-1H-咪唑基)乙酸乙酯(Ⅱ)的合成 在150 m L的三口烧瓶中加入8.2 g 4-甲基咪唑(Ⅰ)(0.1mol)、8.4 g KOH(0.15mol)、13.8 g K2CO3(0.1 mo l)、0.7 g四丁基溴化铵(2mmol)和75m LCH 2 Cl2,室温搅拌0.5 h后,将11.2m L溴乙酸乙酯(0.1mol)缓慢滴入,回流反应8 h后过滤,滤饼用40 m L CH2Cl2洗涤2次,滤液用 150 m L饱和NaCl溶液洗涤,分层,有机相用无水Na2SO4干燥,之后蒸馏除去溶剂,得到10.6 g棕褐色粘稠液体,即2-(4-甲基-1H-咪唑基)乙酸乙酯(Ⅱ)。
2.1.2 2-(4-甲基-1H-咪唑基)乙酸(Ⅲ)的合成在250m L三口烧瓶中加入8.4 g(0.05mol)
2.1.1节所得Ⅱ、100 m L蒸馏水和1 m L浓盐酸,加热回流反应8 h后,加入2 g活性炭回流脱色0.5 h,之后热过滤得浅褐色水溶液,蒸馏去除溶剂得浅褐色粘稠状液体,向其中加入丙酮,搅拌后有固体析出,抽滤,干燥,之后用异丙醇重结晶得到白色固体6.1 g,即2-(4-甲基-1H-咪唑基)乙酸(Ⅲ)。

图1 M4IDP的合成路线
2.1.3 1-羟基-2-(4-甲基-1H-咪唑基)-乙烷-1,1-双膦酸(Ⅳ)(M4IDP)的合成 在250 m L三口烧瓶中加入5.6 g(10.04 mol)2.1.2节所得Ⅲ,40m L氯苯和8m L质量分数为85%的H 3 PO4,混匀,混合物加热至100℃,搅拌反应 0.5 h,之后将温度降至65℃时,缓慢滴加入10.4 m L三氯化磷(约 0.5 h滴加完毕),继续升温至100 ℃,反应 3 h,冷却,加入 50 m L 9 mol/L的盐酸回流反应6 h,冷却,将反应液倒入冷乙醇中,有固体析出,抽滤,干燥,用水重结晶,得白色固体3.4 g,即为目标终产物M4IDP(Ⅳ)。
2.2 99Tcm-M4IDP的制备
取250 mg M4 IDP,用0.1 mol/L NaOH 溶液溶解,之后加水稀释至5m L,配制成50 g/L的钠盐溶液,pH约6,备用。
将10 mg SnCl2·2H2O用10 m L 1 mol/L的盐酸溶解,配制成1 g/L的SnCl2·2H2 O盐酸溶液,备用。
在西林瓶中加入双膦酸钠盐溶液和SnCl2·2H2O的盐酸溶液,用0.2 mol/L pH 6的磷酸盐缓冲溶液(PBS)调节混合液的pH,再向其中加入37 MBq Na99TcmO4洗脱液,充分混匀,反应,即得99Tcm-M4IDP。
2.3 标记率及放化纯度的测定
用纸层析法测定99Tcm-M4 IDP的标记率。取新华一号纸作为纸层析支持物,展开剂为V(丙酮)∶V(水)=2∶1,展开约 10 min后取出晾干,重复操作 3次,计算99Tcm-M4IDP、99TcmO2、99TcmO-4的 Rf分别为 0.2~0.4 、0、0.9~1.0,用γ计数器测各组分的放射性计数,计算标记率。
由于放化纯度在某种程度上与标记率相当,标记物未经进一步纯化[13]。
2.4 标记条件的优化
2.4.1 反应时间对标记率的影响 取12个西林瓶,用移液器向每个瓶中加入0.1 m L M4 IDP钠盐溶液和0.1m L 1g/L的SnCl2·2H 2O溶液,用pH 6的PBS溶液调节体系pH约为6,向每个瓶中加入37 MBq Na99TcmO4洗脱液,总体积控制为约2m L,每个反应瓶分别在室温下反应 5、10、15、20、25、30、35、40、45、50、55、60min。用纸层析法测标记率。
2.4.2 pH对标记率的影响 取5个西林瓶,用移液器向每个瓶中加入0.1 m L M4IDP钠盐溶液和0.1m L SnCl2·2H2O溶液,用pH 6的PBS溶液调节每个瓶中的pH 分别为 4、5、6、7和 8,再向每个瓶中分别加入 37 MBq的Na99TcmO4洗脱液,总体积控制在约2 m L,室温反应30min。用纸层析法测标记率。
2.4.3 SnCl2·2H 2O用量对标记率的影响取10个西林瓶,用移液器向每个瓶中加入0.1m L M4 IDP钠盐溶液,再分别加入含0.005、0.01、0.03、0.05、0.08、0.10、0.12、0.15、0.20和0.25m g SnCl2·2H2O的水溶液,之后用pH 6的PBS溶液调节每个瓶中的pH约为6,再向每个西林瓶中加入37 MBq Na99TcmO4洗脱液,总体积控制在约2m L,室温反应30 min。用纸层析法测标记率。
2.4.4 配体用量对标记率的影响 取12个西林瓶,用移液器向每个瓶中分别加入含 1.0、1.5 、2.0 、2.5 、3.0 、3.5 、4.0 、4.5 、5.0 、6.0 、8.0和10.0mg M4IDP钠盐溶液,0.1 m L 1.0 g/L SnCl2·2H 2O溶液,用PBS溶液调每瓶中体系pH约为6,再向每个西林瓶中加入37 MBq Na99TcmO4洗脱液,总体积控制在约2 m L,室温反应30m in。用纸层析法测标记率。
2.5 99Tcm-M 4 IDP的体外稳定性测定
将最佳标记条件下新制备的99Tcm-M4IDP置于室温(25℃)下,分别于 0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0、4.5 、5.0、5.5、6.0 h 时取样测定放化纯度,考察99Tcm-M4 IDP在室温下的稳定性。
3 结果与结论
3.1 M4IDP和主要中间体的表征
2-(4-甲基-1H-咪唑基)乙酸(Ⅲ):产率为54.8%,白色固体。mp:153~156℃;IR(KBr),σ/cm-1:3 328,1 644,1 603,1 450。ESI-MS(m/z):139(M)。1H NMR(500 MHz,DMSO):δ9.06(s,1H,CH ring),δ7.45(s,1H,CH ring),δ5.14(s,2H,CH 2 COOH), δ2.22(s,3H,CH3),[同分异构体:δ9.00(s,1H,CH ring),δ7.42(s,1H,CH ring), δ5.10(s,2H,CH2COOH),δ2.22(s,3H,CH3)] 。 C6H8N2O2元素分析值(计算值):C:51.38%(51.42%),H:5.67%(5.75%),O:22.95%(22.83%),N:19.99%(19.99%)。
1-羟基-2-(4-甲基-1H-咪唑基)-乙烷-1,1-双膦酸(Ⅳ):产率 29.7%;白色固体。m p:227~231 ℃;IR(KBr),σ/cm-1:3 398,3 200,2 930,2 875,1 665,1 620,1 448,1 245。ESI-MS(m/z):285(M-)。1H NMR(500 MHz,DMSO):δ7.54(s,1H,CH ring), δ6.86(s,1H,CH ring),δ4.30(s,2H,NCH2),δ2.01(s,3H,CH3),[同分异构体:δ7.78(s,1H,CH ring),δ6.57(s,1H,CH ring), δ4.30(s,2H,CH2COOH),δ2.14(s,3H,CH3)]。C6H12N2O7P2元素分析值(计算值):C:25.19%(25.19%),H:4.18%(4.23%),O:39.11%(39.14%),N:9.83%(9.79%)。
当咪唑环1N上有氢时,氢原子可以在两个氮原子间迁移,C-4和C-5是等同的,存在两个互变异构体,这两个互变异构体无法分离,化合物(Ⅲ)的1H NMR谱中显示C-4与C-5的同分异构体的比例为1∶1,化合物(Ⅳ)的1H NMR中显示C-4与C-5的同分异构体的比例为3∶1。
3.2 99Tcm-M4 IDP标记条件的选择
3.2.1 反应时间对标记率的影响 反应时间对标记率的影响示于图2。由图2可知,反应0~30min,标记率与反应时间基本呈正相关,当反应时间达到30 min时,标记率>95%,30 min后,标记率基本稳定。因此,选定最佳反应时间为30min。

图2 反应时间对标记率的影响
3.2.2 pH对标记率的影响 pH对标记率的影响示于图3。由图3可知,pH为4~6时,标记率随着pH的增大而增大,pH为6时,标记率达到最大97.6%。继续增大pH,标记率则开始下降。因此,选取反应体系pH为6时作为最佳标记体系。
3.2.3 SnCl2·2H2O用量对标记率的影响SnCl2·2H2O用量对标记率的影响示于图4。

图3 pH对标记率的影响
由图4可知,SnCl2·2H2O用量为30μg时,标记率>93%,增加SnCl2·2H2O用量,标记率成缓慢上升趋势,当其用量为100μg时,标记率>95%,此后再增大其用量,标记率又略有减小。这是由于SnCl2·2H2O过多,容易生成胶体,致使标记率降低。因此,选取SnCl2·2H2O最佳用量为100μg。
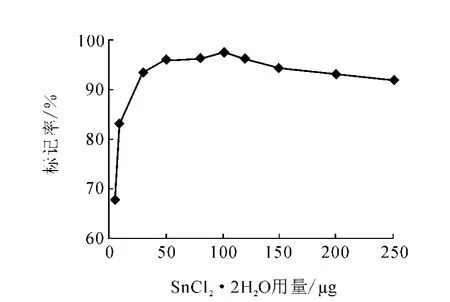
图4 SnCl2·2H 2O用量对标记率的影响
3.2.4 配体用量对标记率的影响 M4IDP配体用量对标记率的影响示于图5。由图5可知,当配体用量在5mg以下时,标记率与配体用量呈正相关趋势,用量为5 mg时,标记率已超过95%,继续增加配体用量,标记率趋于稳定。因此,选定M4IDP的最佳用量为5mg。
3.3 最佳条件下的标记
综上所述,99Tcm-M4 IDP的最佳标记条件为:反应时间30 min,反应体系 pH 6,SnCl2·2H2O用量为 100μg,M4IDP的标记用量为5m g。选用最佳标记条件得到99Tcm-M4IDP的标记率>95%。
3.4 99Tcm-M 4 IDP的体外稳定性

图5 配体用量对标记率的影响
99Tcm-M4IDP在室温下存放0.5~6 h,其放化纯度的变化示于图6。由图6可知,放化纯度在这段时间段里只有略微波动,平均放化纯度>95%,说明其体外稳定性较好,即可以在室温下稳定存放6 h。

图 6 99Tcm-M4IDP的体外稳定性
4 小 结
本实验合成了M4IDP,并对其进行了99Tcm标记,优化了99Tcm-M4IDP的标记条件。合成路线和标记方法简单、易操作,且标记率高,为后续研究99Tcm-M4IDP的临床前药理实验打下基础。
[1] Dong M,Feng FY.Clinicalapp lication of bisphosphonates in treatment of bonemetastases[J].Oncology Progess,2008,6(1):6-10.
[2] Philippe Clezardin,Frank HE,Pierrick GJF.Bisphosphonates and cancer-induced bone disease:beyond their antiresorp tiveactivity[J].Cancer Research,2005,65(12):4 971-4 974.
[3] Michaelson MD,Smith MR.Bisphosphonates for treatment and prevention of bone metastases[J].Journal ClinicalOncology,2005,23(32):8 219-8 224.
[4] Reid IR.Bisphosphonates:new indications and methods o f administration[J].Current Opinion in Rheumato logy,2003,15(4):458-463.
[5] 郝二军,廉洁.唑来膦酸钠的合成工艺改进[J].化学试剂,2009,31(5):383-385.
[6] 王强.放射性核素骨显像在临床骨科的应用[J].医学研究生学报,2001,14(2):154-157.
[7] 王洪勇,罗世能,谢敏浩,等.新型骨显像剂99Tcm-ZL的制备和动物实验研究[J].核技术,2006,29(6):438-441.
[8] 罗世能,王洪勇,谢敏浩,等.99Tcm-MIDP的制备及其生物学分布[J].中华核医学杂志,2005,25(6):341-343.
[9] 牛国塞,罗世能,严孝红,等.99Tcm-EIDP的制备及生物学分布[J].核技术,2008,31(9):698-701.
[10] Chen CQ,Luo SN,Lin JG,etal.Preparation and biodistribution of99Tcm-PIDP as bone imaging agent[J].Nuclear Science and Techniques,2009,20(5):302-306.
[11] Makbu le A,FundaGD.The rabbitbiodistribution of a therapeutic dose of zo ledro nic acid labeled with99Tcm[J].Applied Radiation and Isotopes,2009,67:1 616-1 621.
[12] Lin JG,Luo SN,Chen CQ,etal.Preparation and preclinical pharmaco logical study on a novel bone imaging agent99Tcm-EMIDP[J].Applied Radiation and Isotopes,2010,68(9):1 616-1 622.
[13] El-Mabhouh AA,Angelov CA.A99Tcm-labeled gemcitabine bisphosphonate drug conjugate as a probe to assess the potential for targeted chemotherapy of metastatic bone cancer[J].Nuclear Medicine and Biology,2006,33:715-722.
