抗梅毒治疗和梅毒TRUST滴度对妊娠结局的影响
2010-04-23双洁玉双卫兵
双洁玉,双卫兵
(1.太原市传染病医院妇产科,山西 太原030012; 2.山西医科大学第一医院泌尿外科,山西 太原 030001)
梅毒(syphilis)是一种由梅毒螺旋体引起的性传播感染(sexually transmitted infections,STIs),呈慢性病程。在各种STIs中,其危害性仅次于艾滋病。近年来,女性梅毒和孕妇梅毒增长明显,先天梅毒病例大幅上升。妊娠梅毒(Pregnant syphilis)可在分娩过程中经破损的产道黏膜传给新生儿[1]。但是,绝大多数是通过胎盘垂直传播给胎儿,导致先天梅毒(congenital syphilis,CS)。 出生后数周,CS患儿即可出现全身皮疹,心、肺、肝和肾等器官损害,甚或死亡。我们对妊娠期合并梅毒患者进行治疗,以期了解抗梅毒治疗对梅毒孕妇妊娠结局的影响。
1 临床资料
1.1 一般资料
2006年3 月至2010年3月太原市传染病医院收治的妊娠梅毒患者共82例,其中26例终止妊娠,8例失访,48例完成随访。根据结束妊娠前是否行抗梅毒治疗,将48例妊娠梅毒患者分为治疗组和未治疗组,其中治疗组25例,未治疗组(孕期患者确诊后拒绝治疗,或分娩后经检测确诊者以及因死胎引产确诊为梅毒者)23例。
1.2 诊断方法
梅毒血清学初筛试验阳性的孕妇转诊我院进一步确诊。取孕妇肘静脉血2 mL进行TRUST滴度和TPPA试验进行梅毒的首次确诊。分娩时再取母亲肘静脉血2 mL进行TRUST滴度和TPPA试验。取新生儿静脉血2 mL进行TRUST、TPPA试验。
1.3 不良妊娠结局的判定
不良妊娠结局包括流产、死胎、死产、早产、新生儿死亡、新生儿先天梅毒、低出生体重,多项间不重复计算。流产(abortion):妊娠在28 w以内,胎儿尚不具备独立的生存能力就产出,叫做流产;死胎(IUFD):小于或等于28 w的胚胎在宫内死亡;死产(still birth):孕期超过28 w分娩出已经死亡的胎儿;早产:妊娠28 w~37 w间娩出活产儿;新生儿死亡(neonatal death):新生儿出生1个月以内死亡;低出生体重(LBw):指出生体重<2.5 kg者。
2 方 法
2.1 孕妇梅毒的治疗及管理
采用长效青霉素作为治疗妊娠梅毒的首选药物。方法:苄星青霉素240万U肌肉注射,每周1次,连续3 w为1个疗程[2];如孕妇对青霉素过敏,采用阿奇霉素500 mg口服,每日1次,共10 d;或头孢三嗪250 mg~500 mg肌肉注射,每天1次,共10 d[3]。妊娠初3个月治疗1个疗程,妊娠末3个月治疗1个疗程。如果妊娠晚期才确诊梅毒的,则只能完成1个疗程的治疗。治疗后每个月随访1次,包括临床和血清学TRUST试验。性伴同时检查治疗。妊娠期避免性接触。早期梅毒治疗后,在分娩前应每月检查1次梅毒血清反应,如3个月内血清滴度不下降2个稀释度,或上升2个稀释度,应予复治。分娩后按一般梅毒病例进行随访。
2.2 梅毒孕妇新生儿的治疗及管理
①符合先天梅毒诊断标准的新生儿按先天梅毒治疗。②出生时梅毒血清反应阴性的新生儿,应于出生后1个月、2个月、3个月及6个月复查,至6个月时血清反应仍为阴性,且无先天梅毒的临床表现,可排除先天梅毒;在复查过程中,如果出现血清学阳性或先天梅毒的临床表现,则按先天梅毒治疗。③出生时梅毒血清反应阳性的新生儿,应于出生后1个月、2个月、3个月、6个月及12个月复查,如血清反应阴转,且未出现先天梅毒的临床表现,即可停止观察;如血清滴度持续不降甚至升高,应按先天梅毒治疗。④未经充分治疗或未用青霉素治疗的梅毒孕妇所生新生儿,或无条件对新生儿进行临床及血清学随访者,应考虑对新生儿进行治疗。
2.3 统计学方法
所有数据均应用SPSS16.0统计学软件处理,结果以均值±标准差表示;采用卡方检验分析治疗组与未治疗组不同妊娠结局,P<0.05为差异有统计学意义。
3 结 果
3.1 妊娠梅毒患者的临床表现
本组完成随访的妊娠梅毒患者48例中,经产妇11例,初产妇37例;孕妇年龄18岁~39岁,平均年龄31岁(中位数);治疗组和未治疗组年龄比较差异无统计学意义(P>0.05)。48例妊娠梅毒患者中,一期梅毒2例,表现为1 cm大小的单个无痛性外阴溃疡,表面无明显渗出,伴腹股沟淋巴结肿大;二期梅毒10例,表现为掌跖、躯干梅毒疹,为暗红斑丘疹覆少量鳞屑,不痒;潜伏梅毒36例,患者产前梅毒血清学筛查时发现,无任何临床症状和体征。治疗组一期、二期及潜伏期梅毒分别为1例、6例及18例,而未治疗组分别为1例、4例及18例。
3.2 抗梅毒治疗组与未治疗组妊娠结局比较
结果见表1、表2。治疗组25例中,正常新生儿19例(76.00%),先天梅毒 6例(24.00%),无流产、死胎和死产,不良妊娠结局发生率24.00%(6/25)。先天梅毒6例中合并早产2例(均在孕36 w分娩),出生体重<2.5 kg 1例,先天潜伏梅毒3例,有临床症状的先天梅毒3例 (其中2例的母亲为潜伏梅毒患者,分别在孕18 w和孕25 w接受治疗,配偶患潜伏梅毒但拒绝接受治疗,另1例的母亲为一期梅毒患者,孕35 w确诊并治疗)。

表1 治疗组与未治疗组新生儿先天梅毒发生情况比较 [例(%)]
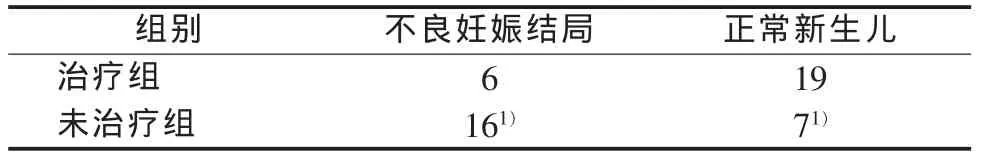
表2 治疗组与未治疗组不良妊娠结局比较 (例)
未治疗组 23例中,流产2例(8.70%),死胎1例(4.35%),死产1例(4.35%),新生儿先天梅毒12例(52.17%),正常新生儿 7例(30.43%),未治疗组不良妊娠结局发生率达69.57%(16/23)。先天梅毒12例中合并新生儿死亡1例及早产3例(分别在孕29 w、30 w和31 w分娩)。除4例流产、死胎、死产者外,出生体重<2.5 kg者5例。
3.3 妊娠梅毒患者TRUST滴度与不良妊娠结局的关系
结果见表3。
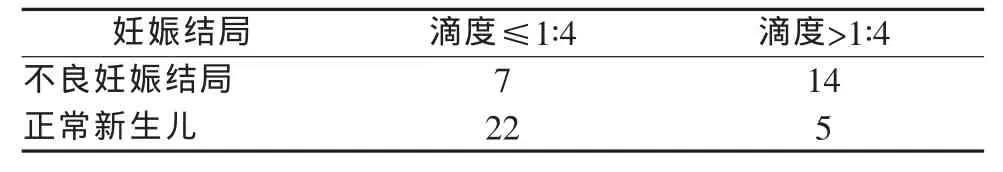
表3 妊娠梅毒患者TRUST滴度与不良妊娠结局的关系 (例)
48例妊娠梅毒患者梅毒血清学TRUST滴度≤1∶4(包括 1∶1,1∶2,1∶4 阳性)29 例,其中 7 例(24.14%)产生不良妊娠结局,22例 (75.86%)分娩正常新生儿;TRUST 滴度>1∶4(包括 1∶8,1∶16,1∶32,1∶64 阳性)19例,其中14例(73.68%)产生不良妊娠结局,5例(26.32%)分娩为正常新生儿。滴度高的妊娠梅毒患者不良妊娠结局发生率显著高于滴度低的妊娠梅毒患者。
4 讨 论
梅毒是一种严重影响人们健康的疾病,在性传播疾病中危害性仅次于艾滋病。梅毒可引起多器官损害,晚期梅毒可导致心脏和神经系统梅毒,危及患者生命,严重危害患者的身心健康。妊娠梅毒可通过胎盘垂直传播给胎儿,未经治疗的早期梅毒孕妇可以引起流产、死产、新生儿围产期死亡、胎传梅毒等不良妊娠后果。感染梅毒的新生儿在出生前后数周即可出现全身皮疹,心、肺、肝、肾多器官损害,还可造成低体重儿、智力发育迟钝等。美国治疗一个先天梅毒儿需花费12000美元,如果由此引起残疾,将给社会、家庭造成巨大的经济和精神损失。控制妊娠梅毒和先天梅毒的流行,将对保护妇女儿童的健康,提高人口素质,有极其重要的意义。
目前,妊娠梅毒的推荐治疗方案仍主要是应用青霉素治疗[4]。国外的研究提示:应用苄星青霉素240万U单剂肌肉注射方案阻断母婴垂直传播的有效率为98%,再增加治疗次数意义不大[5-6]。研究证实口服阿奇霉素,药物可在母体的子宫肌层和胎盘中保持稳定的高浓度及较长的半衰期;并通过临床试验证实,对于青霉素过敏者,单剂阿奇霉素可作为治疗梅毒(尤其是早期)的替代方案。由于苄星青霉素治疗神经梅毒的不确定性,在不能排除神经梅毒的情况下,不用苄星青霉素而应用普鲁卡因青霉素[7]。
通过本研究我们认识到,对妊娠梅毒患者采取以孕期梅毒筛查为主的综合干预措施对预防先天梅毒是有效的。使用青霉素治疗梅毒的实践经验证明,青霉素是治疗梅毒最好的药物。治疗妊娠梅毒的主要用药是普鲁卡因青霉素和苄星青霉素,优点是吸收缓慢、维持血液有效浓度时间长、抑制螺旋体效果可靠,因为梅毒螺旋体繁殖周期为30 h~33 h,所以要求青霉素在血中浓度必须维持一定时间,才能有效杀灭梅毒螺旋体。Alexander J M[8]对340例妊娠梅毒患者用苄星青霉素240万U,每周1次,连用3次治疗,治疗成功率为98.2%。但有些学者研究显示,尽管采用推荐的青霉素治疗妊娠梅毒患者,仍有14%出现死产或分娩出有明显临床症状的早期先天梅毒患儿,这些患者在妊娠期接受抗梅毒治疗晚[9]。本研究用普鲁卡因青霉素或苄星青霉素治疗妊娠梅毒25例,正常新生儿分娩率76.00%(19/25),无流产、死胎、死产及新生儿死亡,先天梅毒分娩率24.00%(6/25),其中有明显临床症状的早期先天梅毒分娩率12.00%(3/25),较未治疗组围产儿预后明显改善。
本研究资料显示,妊娠梅毒TRUST滴度>1∶4者不良妊娠结局明显高于滴度≤1∶4者。TRUST滴度>1∶4的妊娠梅毒患者可建议终止妊娠。医生应当向妊娠梅毒患者及配偶详细解释关于妊娠梅毒对胎儿的危害以及妊娠梅毒治疗与妊娠结局的相关知识和信息,让他们自己作出继续或终止妊娠的决定。
综上所述,抗梅毒治疗可预防新生儿先天梅毒,降低不良妊娠结局的发生。妊娠梅毒TRUST滴度的检测有助于预测不良妊娠结局的发生情况,若妊娠梅毒TRUST滴度较高,宜终止妊娠。
[1]Stoll B J,Lee F K,Larsen S A,et al.Improved serodiagnosis of congenital syphilis with combined assay approach [J]. J Infect Dis,1993,167(3):1093-1099.
[2]Centers for Disease Control and prevention.Sexually transmitted diseases treatment guidelines 2002[J].MMWR,2002,51(2):18-28.
[3]Goh B,Van Voorst Vader P.European guideline for the management of syphilis [J].Int J STD AIDS,2001,12(Suppl 3):14-26.
[4]George D,Wendel J r,Jeanne S,et al.Treatment of syphilis in pregnancy and prevention of congenital syphilis [J].Clinical Infectious Diseases,2002,35(Suppl 2):200-209.
[5]Kingston M,Carlin E.Treatment of sexually transmitted infections with single-dose therapy:a double-edged sword drugs[J].2002,62(6):871-878.
[6]Hook E W 3rd,Martin D H,Stephens J,et al.A randomized,comparative pilot study of azithromycin versus benzathine penicillin G for treatment of early syphilis [J].Sex Transm Dis,2002,9(8):486-490.
[7]Schmid G P.Serologic screening for syphilis.rationale,cost,and realpolitik [J].Sex Transm Dis,1996,23(1):45-50.
[8]Alexander J M.Efficiency of treatment for syphilis in pregnancy[J].Obstet Gynecol,1999,93(1):5-8.
[9]Gene M,Ledger M J.Syphilis in pregnancy[J].Sex Transm Infect,2000,76(1):73-79.
