杂交瘤研究中染色体分析的方法及其意义
2010-04-06林克勤易文褚嘉祐
林克勤,易文,褚嘉祐
杂交瘤研究中染色体分析的方法及其意义
林克勤,易文,褚嘉祐
【摘要】
目的探讨细胞同步化染色体高分辨技术检测杂交瘤细胞染色体的可行性。
方法选择小鼠骨髓瘤 SP-2/O 细胞株、人淋巴母细胞CKM-8 细胞株、人骨髓瘤 KM 细胞株、抗小鼠胰腺癌鼠-鼠杂交瘤细胞株,体外培养 24 ~ 48 h。对 4 种细胞株分别进行同步化处理,加入 5-氟脱氧尿嘧啶核苷和尿嘧啶培养16 ~ 18 h 后,加入 5-溴脱氧尿嘧啶核苷,并在收集细胞前加入秋水酰胺;收集细胞进行离心、低渗处理、固定、再固定,制备染色体滴片,应用胰蛋白酶-Giemsa 染液对染色体进行 G 显带处理。每例标本以 30 个以上分裂象做众数分析,按照《人类细胞遗传学国际命名体制》(ISCN 1978)对细胞株染色体进行 G 显带分析。
结果4 种细胞株的染色体均较长、分散良好、形态较好。SP-2/O 细胞株、CKM-8 细胞株、KM 细胞株、抗小鼠胰腺癌鼠-鼠杂交瘤细胞株的染色体数目分别为 63、46、42、105,其中抗小鼠胰腺癌鼠-鼠杂交瘤细胞染色体数目接近小鼠淋巴细胞和小鼠骨髓瘤细胞染色体数的总和,且多数为端着丝点染色体。
结论细胞同步化染色体高分辨技术检测杂交瘤细胞染色体具有良好的效果。
【关键词】杂交瘤; 细胞遗传学分析; 染色体; 动物实验
www.cmbp.net.cn 中国医药生物技术, 2010, 5(5):367-370
杂交瘤是通过细胞融合技术[1],将具有分泌抗体能力的致敏 B 淋巴细胞和具有无限繁殖能力的骨髓瘤细胞融合成杂交细胞,可在体外连续繁殖并能产生性质专一的单克隆抗体。但杂交瘤细胞在培养过程中,编码抗体的染色体容易丢失,因此对杂交瘤细胞染色体的鉴定就显得尤为必要。在杂交瘤及单抗研究中,细胞遗传分析技术在鉴定杂交瘤[2]、观察细胞株突变、探索抗体特性等方面均具有重要价值,但杂交瘤细胞的异质性往往使得常规染色体制备技术无法获得满意的标本用于分析。为此,我们尝试将改进的细胞同步化染色体高分辨技术引入杂交瘤领域,以探讨其检测杂交瘤细胞染色体的可行性。
1 材料与方法
1.1 材料
1.1.1 细胞株 小鼠骨髓瘤 SP-2/O 细胞株由中国药品生物制品检定所惠赠;人淋巴母细胞CKM-8 细胞株为本研究所遗传室保存;人骨髓瘤KM 细胞株为本研究所自建;抗小鼠胰腺癌鼠-鼠杂交瘤细胞株由云南省肿瘤医院肿瘤研究所免疫研究室惠赠。
1.1.2 试剂 RPMI 1640 培养液、双抗(青、链霉素)均购自美国 Hyclone 公司;小牛血清购自兰州民海生物工程有限公司;KCl、磷酸缓冲液、冰醋酸、甲醇均购自北京化工厂;Giemsa 染液、秋水酰胺、5-氟脱氧尿嘧啶核苷(Fdu)、尿嘧啶和5-溴脱氧尿嘧啶核苷(Brdu)均购自美国 Sigma公司。
1.2 方法
1.2.1 细胞培养 将 4 种细胞株分别置于含20% 小牛血清、100 U/ml 青霉素、100 μg/ml 链霉素的 RPMI 1640 培养液内,于 37 ℃、5% CO2孵箱中培养 24 ~ 48 h。
1.2.2 同步化处理
1.2.2.1 加入试剂 收集 4 种细胞,分别加入终浓度为 1 × 10-7mol/L 的 5-氟脱氧尿嘧啶核苷(Fdu)和终浓度为 4 μmol/L 的尿嘧啶[3],于 37 ℃培养 16 ~ 18 h 后,加入终浓度为 30 μg/ml 的5-溴脱氧尿嘧啶核苷(Brdu),并在收集细胞前30 min 加入终浓度为 0.05 ~ 0.1 μg/ml 的秋水酰胺。
1.2.2.2 低渗处理 加入试剂混匀后,将细胞移入离心管中,212 × g 离心10 min,弃上清液。加入 8 ml 已 37 ℃ 预热的浓度为 0.075 mol/L 的KCl,用吸管将沉淀细胞吹打混匀,置 37 ℃ 水浴中 30 min。
1.2.2.3 固定 在细胞中加入 1 ml 新鲜配制的固定液(甲醇和冰醋酸按 3:1 比例配制)进行预固定,用吸管轻轻吹打混匀细胞,212 × g 离心10 min,弃上清液。
再加入 8 ml 固定液(甲醇和冰醋酸按 3:1 比例配制),用吸管轻轻吹打混匀细胞,室温下静置30 min 后,212 × g 离心 10 min,弃上清液。依法重复固定 2 次。
1.2.2.4 制片 弃上清液,视细胞数量余留适量固定液,轻轻吹散细胞制备成细胞悬液,于垂直60 cm 高度滴于冰水浸泡的洁净载玻片上,在酒精灯上略烤,空气干燥。
1.2.2.5 染色 将凉干的玻片标本加入胰蛋白酶-Giemsa 染液(Giemsa 染液和磷酸缓冲液按1:10 比例配制)进行显带处理,对染色体进行G 显带分析(或以吖啶橙染色,在荧光显微镜下观察荧光 R 显带;或经氯化钙-紫外线照射-Giemsa染色做 Giemsa R 显带)。
1.3 染色体分析
每例标本以 30 个以上分裂象做众数分析。按照《人类细胞遗传学国际命名体制》(ISCN 1978)对细胞株染色体进行 G 显带分析[4]。
2 结果
对 4 种细胞株进行同步化处理,均获得较长、分散良好、形态较好的染色体标本,克服了常规方法制备染色体中常见的染色体短小、分叉、毛发、分散不良以致不能分析的缺点。
对细胞株染色体进行 G 显带分析,结果染色体带型清晰,4 种细胞株的染色体分析结果见表 1。其中抗小鼠胰腺癌鼠-鼠杂交瘤细胞为端着丝点染色体,包含少数中部着丝点染色体(图 1),染色体数目为 105,接近小鼠淋巴细胞与小鼠骨髓瘤细胞染色体数的总和,表明具有鼠-鼠杂交瘤细胞株的特点。
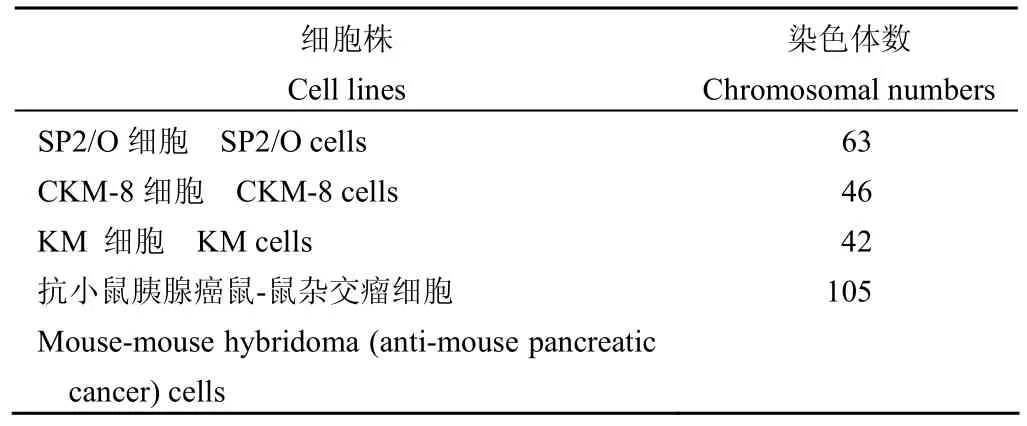
表 1 同步化处理后 4 种细胞株的染色体分析结果Table 1 Results of chromosomal analysis in 4 cell linesafter synchronized processing

图 1 抗小鼠胰腺癌鼠-鼠杂交瘤细胞株染色体的胰蛋白酶-Giemsa 染色 G 显带分析Figure 1 G-banding analysis of mouse-mouse hybridoma (anti-mouse pancreatic cancer) cells by trypsin-Giemsa chromosomal staining
3 讨论
杂交瘤技术的成功建立为产生抗体分子提供了细胞物质基础。通过这一途径获得的杂交瘤细胞系,所分泌的抗体生物活性单一、性状高度均一、与抗原结合的特异性强,且便于人为处理和质量控制,这些优点使得它一问世就受到高度重视。尽管单克隆抗体有其局限性,但随着技术方法的改进,现已可以制备出高效价的人抗体杂交瘤细胞株[5],产生高亲和力的人抗体[6],具有广阔的临床应用前景,并且为基因工程抗体研究奠定了基础[7]。
杂交瘤细胞为体外培养,由于各种细胞的异质性,对数生长期后在 M 期的最恰当时机收获细胞做染色体分析有一定的困难,这常是导致常规方法制备的染色体分叉、缩短、形态不佳以至失败的原因。引入细胞同步化技术后,在细胞体外培养一定时间后加入 5-氟脱氧尿嘧啶核苷(Fdu),5-氟脱氧尿嘧啶核苷(Fdu)可通过将还原型-磷酸尿苷(dUMP)转化为还原型-磷酸胸苷(dTMP)而拮抗腺嘧啶核苷合成酶,阻断 DNA 合成[8]。而这一阻断在 16 ~ 18 h 后加入 5-溴脱氧尿嘧啶核苷(Brdu)时可“通过补救途径”恢复 DNA 的合成,细胞即同步进入分裂期,在适当时间以秋水酰胺(或秋水仙素)处理,即可获得满意的可用于分析的染色体。这一同步化方法可适用于各种肿瘤和正常细胞。在本研究中我们发现,加入 5-溴脱氧尿嘧啶核苷(Brdu)之后的“后培养”时间应根据细胞的生长情况做适当调整,生长迅速者可短至 6 h,生长缓慢者时间宜稍长,可达 10 h。
作为杂交瘤中的亲本细胞骨髓瘤细胞,为体外传代培养建立而成,染色体分析可确定这一细胞株的来源,如鼠源性骨髓瘤细胞染色体多为近端着丝粒染色体,而人源性骨髓瘤细胞较大,A-G 组具有不同的形态特征。我们在建立人骨髓瘤细胞株的过程中,染色体的 G 显带分析提供了人源性的可靠依据。此外,一个稳定的细胞株应具备染色体众数及标记染色体相对稳定的特点[9]。我们认为,如有 2个以上稳定的众数并存,应尽可能进行显带分析,以确定是否存在不同的标记染色体或不同的非随机性染色体增加或丢失,以便确定是否细胞株已分化为 2 个以上亚株。在此需要提及的是,在分析众数时,除明显散乱、重叠者外,应连续计数每一分裂相中的染色体数目,统计分析众数,不宜简单地计算染色体平均数作为众数。
通过细胞融合技术形成杂交瘤细胞株,对杂交瘤细胞进行染色体分析是验证是否获得真正杂交瘤细胞的客观指标之一,并从而明确杂交瘤细胞染色体的变化。细胞融合成功,杂交瘤细胞株形成的标志是出现众数相对稳定、数目多于每一单独细胞株而接近于 2 个单独细胞株相加的染色体。在人-鼠杂交瘤中,通过形态分析证实人染色体与鼠染色体并存于同一细胞是人-鼠细胞融合成功的依据。
动态观察杂交瘤细胞株的稳定情况,探索染色体丢失与抗体分泌的关系,染色体分析对了解杂交瘤分泌单抗的能力有一定意义。杂交瘤细胞培养初期很不稳定,传代过程中会不断丢失染色体。另外,长期液氮冻存的杂交瘤细胞复苏后,其分泌抗体的功能仍有可能丧失。当杂交瘤细胞一旦丢失与抗体分泌有关的染色体,其分泌抗体的能力就会消失。对于种间杂交瘤细胞来说,保留一定数量的人染色体,可能有助于杂交瘤分泌抗体能力的稳定性[10]。因此,显带分析相应的几条人源性染色体存在与否,有助于了解抗体的分泌情况。如杂交瘤细胞染色体数目较集中,其分泌能力则高;反之,其分泌能力则低。丧失分泌能力的杂交瘤细胞株中,多数是丢失了与抗体分泌有关的染色体,但也有少数细胞株轻、重链相关的染色体都具备。分子遗传学的进展已使大部分控制抗体分泌的基因编码于染色体,通过染色体的追踪观察,可以了解抗体分泌与杂交瘤染色体演变的关系。尤其在人-鼠杂交瘤中,人染色体很易逐渐丢失,杂交瘤细胞常保留编码抗体重链的 14 号染色体,而丢失编码 K 轻链的2 号染色体。科学研究的进展已经使遗传工程与杂交瘤技术相互渗透,相信随着研究的深入,染色体分析在杂交瘤研究中将起到更为重要的作用。
本研究通过测定臭牡丹粗提物的DPPH自由基清除活性,对其抗氧化能力进行评估,进一步建立DPPH-HPLC-QTOF-MS/MS技术,通过比较与DPPH反应前后HPLC-QTOF-MS/MS谱图的变化,对臭牡丹粗提物中的抗氧化活性成分进行快速筛选和结构鉴定,共确定13个主要的抗氧化活性成分,其中9个化合物首次报道存在于该植物中.本工作丰富了臭牡丹抗氧化药效物质基础,为其临床应用提供依据.
参考文献
[1] Köhler G, Milstein C. Continuous cultures of fused cells secreting antibody of predefined specificity. Nature, 1975, 256(5517):495-497.
[2] Wollweber L, Munster H, Hoffmann S, et al. Early phase karyotype analysis of chromosome segregation after formation of mouse-mouse hybridomas with chromosome painting probes. Chromosome Res, 2000, 8(1):37-44.
[3] Chu JY, Yang AD, Fei HB, et al. A high-resolution banding technigue of lymphocytes and bone marrow cells synchronized by FdU ethidium bromide. Chin J Med Genet, 1980, 3(4):210-212. (in Chinese)禇嘉祐, 杨爱德, 费洪宝, 等. 淋巴细胞和骨髓细胞染色体的 Fdu同步化高分辨技术及溴化乙啶的合并应用. 遗传与疾病, 1986, 3(4):210-212.
[4] An international system for human cytogenetic nomenclature (1978) ISCN (1978). Report of the standing commitee on human cytogenetic nomenclature. Cytogenet Cell Genet, 1978, 21(6):309-409.
[5] Wrammert J, Smith K, Miller J, et al. Rapid cloning of high-affinity human monoclonal antibodies against influenza virus. Nature, 2008, 453(7195):667-671.
[6] Adekar SP, Jones RM, Elias MD, et al. Hybridoma populations enriched for affinity-matured human IgGs yield high-affinity antibodies specific for botulinum neurotoxins. J Immunol Methods, 2008, 333(1/2):156-166.
[7] Carter PJ. Potent antibody therapeutics by design. Nat Rev Immunol, 2006, 6(5):343-357.
[9] Eton O, Scheinberg DA, Houghton AN. Establishment and characterization of two human myeloma cell lines secreting kappa light chains. Leukemia, 1989, 3(10):729-735.
[10] Wang X, Fox M, Povey S, et al. Mouse-human somatic cell ybrids: loss of mouse and human chromosomes. Somat Cell Mol Genet, 1998, 24(3):165-171.
ObjectiveTo investigate the feasibility of detecting hybridoma chromosome by using synchronized chromosome separation technique.
MethodsMouse myeloma cell line SP-2/O cells, human lymphoblastoid cell line CKM-8 cells, human myeloma cell line KM cells, and mouse-mouse hybridoma (anti-mouse pancreatic cancer) cells were cultured for 24-48 hours in vitro. Chromosomal synchronization was carried out in four cell lines above by treating cells with 5-fluoro-deoxy uridine and uracil for 16-18 hours, then adding 5-BrdU into culture. Cells were treated by Colcemid CCM before harvesting. After centrifugation, cells were treated by hypotonic buffer and followed by double-fix procedures. The liquid form of chromosome pieces were dropped onto glass slides and G-banding was carried out by staining slides with trypsin-Giemsa solution. Mode analysis was performed by using more than 30 separation phase of chromosomes in each case. Chromosomal G-banding analysis was carried out according to “Human Cytogenetics International Naming System” (ISCN 1978).
ResultsThe chromosomes obtained from four cell lines had ideal length with good separation and clear shape. The chromosomal numbers of SP-2/O cells, CKM-8 cells, KM cells and mouse-mouse hybridoma (anti-mouse pancreatic cancer) cells were 63, 46, 42 and 105 respectively. The numbers of chromosomes of the mouse-mouse hybridoma (anti-mouse pancreatic cancer) cells was close to sum of the numbers of chromosomes of the mouse spleen cells and mouse myeloma cells, and most of the chromosomes of mouse-mouse hybridoma (anti-mouse pancreatic cancer) cells were telocentric chromosome.
ConclusionSynchronized chromosome separation technique was effective in detecting hybridoma cells chromosome.
【Key words】Hybridomas; Cytogenetic analysis; Chromosomes; Animal experimentation
Author Affiliat ion:Institute of Medical Biology, Chinese Academy of Medical Sciences & Peking Union Medical College, Kunming 650118, China
Correspongding Author: CHU Jia-you, Email: chujy@imbcams.com.cn www.cmbp.net.cn
Chin Med Biotechnol, 2010, 5(5):367-370
作者单位:650118 昆明,中国医学科学院北京协和医学院医学生物学研究所
通讯作者:褚嘉祐,Email:chujy@imbcams.com.cn
收稿日期:2010-06-25
DOI:10.3969/cmba.j.issn.1673-713X.2010.05.008
Method and significance of chromosome analysis on hybridoma research
LIN Ke-qin, YI Wen, CHU Jia-you
【Abstract】
