卡斯帕酶-3抑制剂的高通量筛选及活性化合物F03ZA-575的初步研究
2010-12-01李韶菁任晓董悦生张华郑智慧路新华段海清
李韶菁,任晓,董悦生,张华,郑智慧,路新华,段海清
卡斯帕酶-3(Caspase-3)作为最重要的成员和关键的执行分子,在凋亡信号传导的许多途径中发挥着重要的功能。许多常见病与多发病(病毒性感染例如感冒、关节炎等)、心脑血管疾病(例如脑卒中、心肌梗死等)、肿瘤、脑神经退行性疾病(例如早老性痴呆症、帕金森病等)的发生,都与卡斯帕酶-3的异常活动有关,因此,Caspase-3 被认为是一个很有前景的药物治疗靶位点。高效、高选择性的抑制剂将可能为治疗上述与Caspase-3相关的疾病提供新的途径[1-3]。
目前国外一些大公司已竞相开展了此类药物的研发工作,其中,美国 Aventis公司和Vertex公司共同开发的治疗风湿性关节炎和脓血症的卡斯帕酶的抑制剂 VX740(Pralnacasan)和VX799 已完成 II 期临床研究;美国 Idun 制药公司开发的卡斯帕酶的抑制剂(代号:IDN6556和IDN6734)主要用于治疗急性心肌梗死,急性酒精中毒引起的肝衰竭;美国 Idun公司正在开发中的另一类卡斯帕酶的抑制剂 IDN5370 可预防缺血性脑卒中引起的脑神经元的大量死亡及由此引起的偏瘫和失语等后遗症[1]。我们以 Caspase-3 为靶点,建立了一个 Caspase-3 抑制剂的高通量筛选模型,应用此模型对微生物来源的共计 10026个次级代谢产物提取物进行了筛选,其中一株真菌产生的化合物 F03ZA-575 对来源于人的Caspase-3 酶具有明显的抑制活性,本文报道了该化合物的有关研究结果。
1 材料和方法
1.1 主要材料
1.1.1 试剂 人源 Caspase-3 酶储液由华北制药集团新药研究开发中心利用基因工程技术在大肠杆菌 E.Coli 中表达并分离得到,–20 ℃ 冻存备用;底物 Ac-DEVD-AMC 购自美国 Sigma公司;其余化学试剂均为分析纯或色谱纯试剂。
1.1.2 主要仪器 Victor21420 多功能测定仪为美国 PE公司产品;低温离心浓缩仪为德国 Christ公司产品;中压层析分离制备系统为瑞士 BUCHI公司产品;HPLC 高压液相分析和半制备系统为美国 Waters公司产品;500 MHz 核磁共振为美国Inova公司产品。
1.1.3 实验菌种与提取物 放线菌株及真菌菌株由华北制药集团新药研究开发有限责任公司天然药物室微生物菌种库提供;筛选用放线菌及真菌发酵代谢产物样品由微生物代谢产物库提供。
1.2 方法
1.2.1 Caspase-3 酶活力测定方法的建立和优化
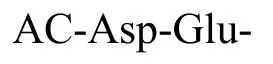
1.2.1.2 Caspase-3 酶测活溶液的配制 Caspase-3酶测活缓冲液含 20 mmol/L HEPES(4-羟乙基哌嗪乙磺酸),0.1% CHAPS[3-3-(胆酰氨丙基)二甲氨基丙磺酸内盐],100 mmol/L NaCl,10 mmol/L DTT(二硫苏糖醇),10% 蔗糖,1 mmol/L EDTA,pH 7.5。荧光底物 Ac-DEVD-AMC 储液:称取 2.5 mg Ac-DEVD-AMC 粉末,加 0.74ml DMSO 溶解,配制成 10 mmol/L的储液。Ac-DEVD-AMC 工作液:准确吸取所需量的Ac-DEVD-AMC 储液,加测活缓冲液稀释成浓度为1 μmol/L的工作溶液(用前临时配制)。
1.2.1.3 Caspase-3 酶活力测定方法的建立和优化 在96 孔板上分别固定一种底物的浓度,研究底物或 Caspase-3 浓度的变化与酶活性的关系。在最佳底物浓度条件下,观察不同的反应温度与酶活性的关系,在此基础上确定酶的加入量与酶反应曲线的线性范围。
1.2.2 微生物来源的Caspase-3 酶抑制的筛选 在96 孔板的样品测定孔中,分别加入 2 μl的待测样品、55 μl 酶工作液,对照孔和空白孔分别以 2 μl DMSO和55 μl 测活缓冲液代替酶液,其余与样品孔相同。37 ℃ 保温 15 min,各孔中加入浓度为1 µmol/L的底物工作液 45 μl。离心 2 min 并振摇混匀,测定各孔在以 355 nm 为激发波长,以460 nm 为发射波长下的荧光强度值(F1),37 ℃ 保温 120 min 后,再测定各孔在同样条件下的荧光强度值(F2)。
样品对 Caspase-3 酶抑制率的计算公式为:

选取抑制率大于80%的样品为阳性样品。
1.2.3 阳性真菌 F03ZA-575 产生的对 Caspase-3酶具有抑制作用的活性物质的分离
1.2.3.1 阳性菌株 F03ZA-575的来源 阳性菌株 F03ZA-575 为真菌,来源于华北制药集团新药研究开发中心(微生物药物国家工程研究中心)微生物菌种库,采自我国云南省。
1.2.3.2 菌株 F03ZA-575的培养 将菌株F03ZA575 斜面接种于含种子培养基(含 2.0% 淀粉;0.2% 豆饼粉;0.6% 麦芽粉;0.3% 酵母粉;NaCl 0.2%;FeSO4·7H2O 0.1%;0.2% CaCO3,pH 7.0)的500ml 三角瓶中,27 ℃ 培养 3 d,按 10%的接种量接种于固体发酵培养基(大米 97.5%,黄豆饼粉 2.5%),27 ℃ 静止培养 8 d。
1.2.3.3 菌株 F03ZA-575 发酵液的提取分离 F03ZA-575 固体发酵培养物 2000 g,加入4000ml的乙酸乙酯,萃取得到褐色 F03ZA-575粗提物 4.2 g,粗提物活性测定结果为IC50=18.7μg/ml。
1.2.3.4 活性组分的硅胶柱层析精制 取 4 g 粗提物,加少量甲醇溶解,使用硅胶柱(Φ3.6cm×40 cm)氯仿-甲醇梯度洗脱,收集洗脱液,40ml/管,共收集 120 管。合并目标活性组分,浓缩抽干后得黄色固体 1.1 g。
1.2.3.5 活性组分的LH-20 柱分离纯化 活性粗品用甲醇溶解后进行 LH-20 柱分离纯化,收集洗脱液,20ml/管收集洗脱液共收集 50 管。检测各管的活性同时对照 HPLC 分析结果(色谱柱:Kromasil 10 μm,Φ250 mm×4.6 mm),合并目标活性组分,浓缩抽干后得浅黄色固体 78 mg。
1.2.3.6 活性组分的结晶精制 取上述浅黄色固体 40 mg,溶于氯仿,然后向氯仿溶液中缓慢滴加甲醇使白色沉淀缓缓析出。离心,过滤并减压蒸干,得到活性组分 F03ZA-575(白色固体)21 mg。
2 结果
2.1 Caspase-3 酶活力的影响因素
2.1.1 反应体系中底物 Ac-DEVD-AMC 对酶活力的影响 保持反应体系中其他组分浓度不变,改
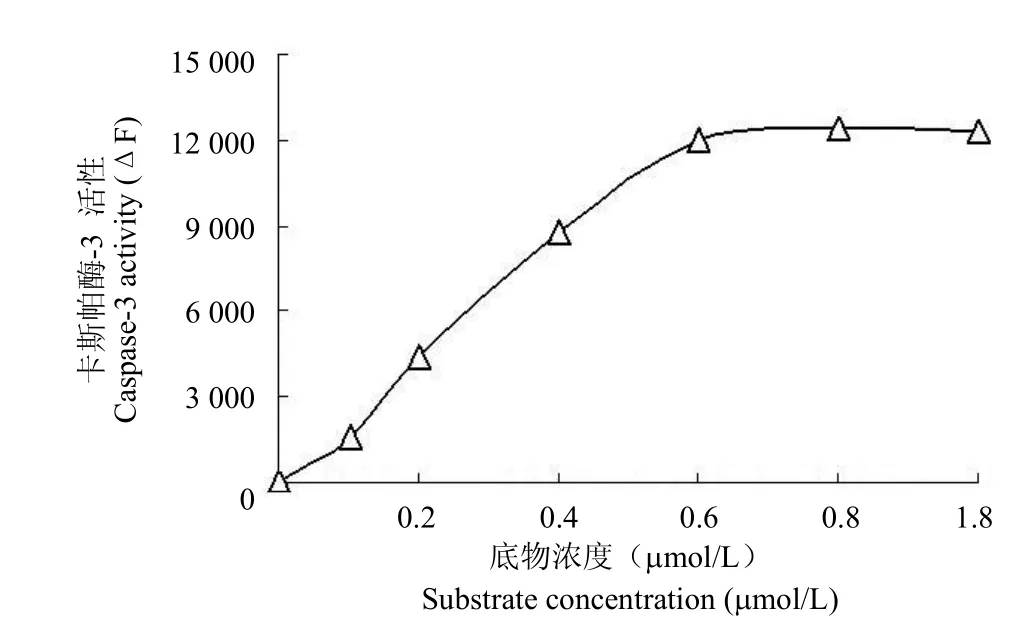
图1 底物浓度对卡斯帕酶-3 活性的影响Figure1 The effect of substrate concentration on Caspase-3 activity
变底物 Ac-DEVD-AMC的工作液浓度,观察其对酶促反应体系的影响,见图 1。实验结果表明,Caspase-3 酶的活力随底物浓度的增加而增加,当工作液的浓度在0.6 μmol/L 以上时,酶活力达到最大。因此,选择底物工作液的浓度为1 μmol/L 已能满足活性测定要求。
2.1.2 反应体系温度对酶活力的影响 在反应体系中保持上述选定的各组分的浓度不变,观察反应体系温度对酶促反应体系的影响,见图 2。结果表明,用该方法测定 Caspase-3 酶的活力,37 ℃ 时达到最大值,因此选择 37 ℃ 为测活温度。
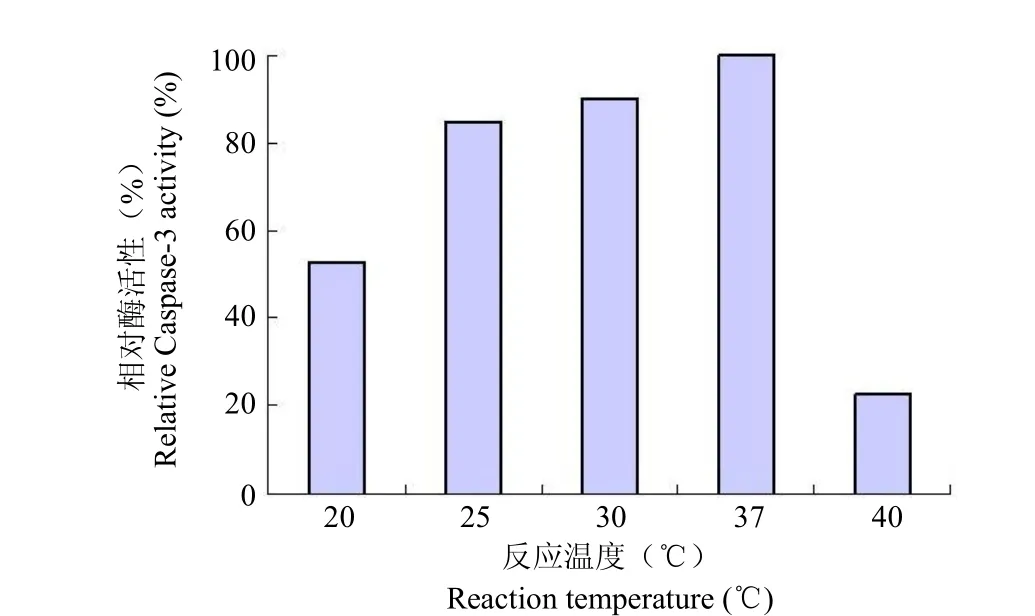
图2 反应温度对卡斯帕酶-3活性的影响Figure2 The effect of reaction temperature on Caspase-3 activity
2.1.3 Caspase-3 酶反应曲线 在上述最佳底物浓度和最佳反应温度条件下,通过改变 Caspase-3酶的加入量测得的Caspase-3 酶活曲线见图 3。由图 3 可见,Caspase-3 酶液的加入量在0~2 μl 范围内呈现出较好的线性关系,相关系数 r=0.9946,据此选定反应体系中 Caspase-3 酶的加入量为2 μl。
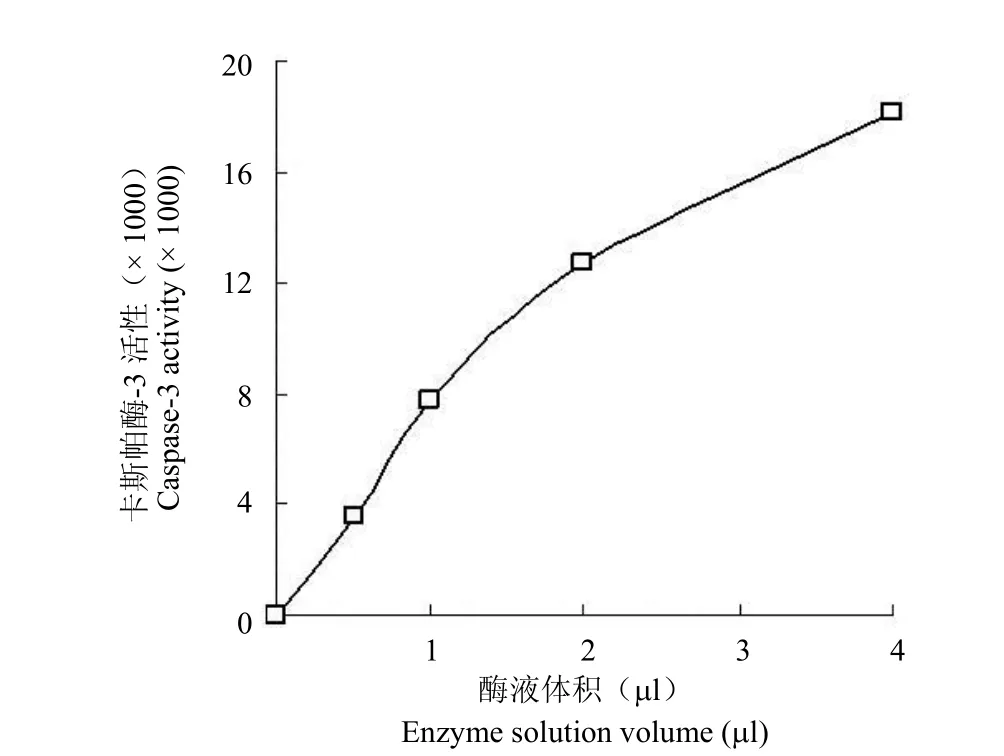
图3 酶活性曲线Figure3 The enzyme activity curve
2.2 已知 Caspase-3 酶抑制剂阳性化合物对酶促反应体系的验证
用已知 Caspase-3 抑制剂阳性化合物 ACDEVD-CHO[6]对酶促反应体系进行了验证,结果显示其对筛选体系可以产生剂量依赖的抑制关系,确定了该筛选模型的可行性。
2.3 微生物来源的Caspase-3 酶抑制剂的筛选结果
利用上述 Caspase-3 酶抑制剂高通量筛选方法,对来源于放线菌、真菌的共 10026个发酵液提取物样品进行了筛选,初筛得到阳性样品 47个(阳性率 0.6%),复筛得到阳性样品 10个(阳性率 0.1%)。
2.4 化合物 F03ZA-575的结构解析

化合物 F03ZA-575的1H-NMR和13C-NMR的测定数据及与Duclauxin 文献报道数据的比较见表1,化学结构见图 4。
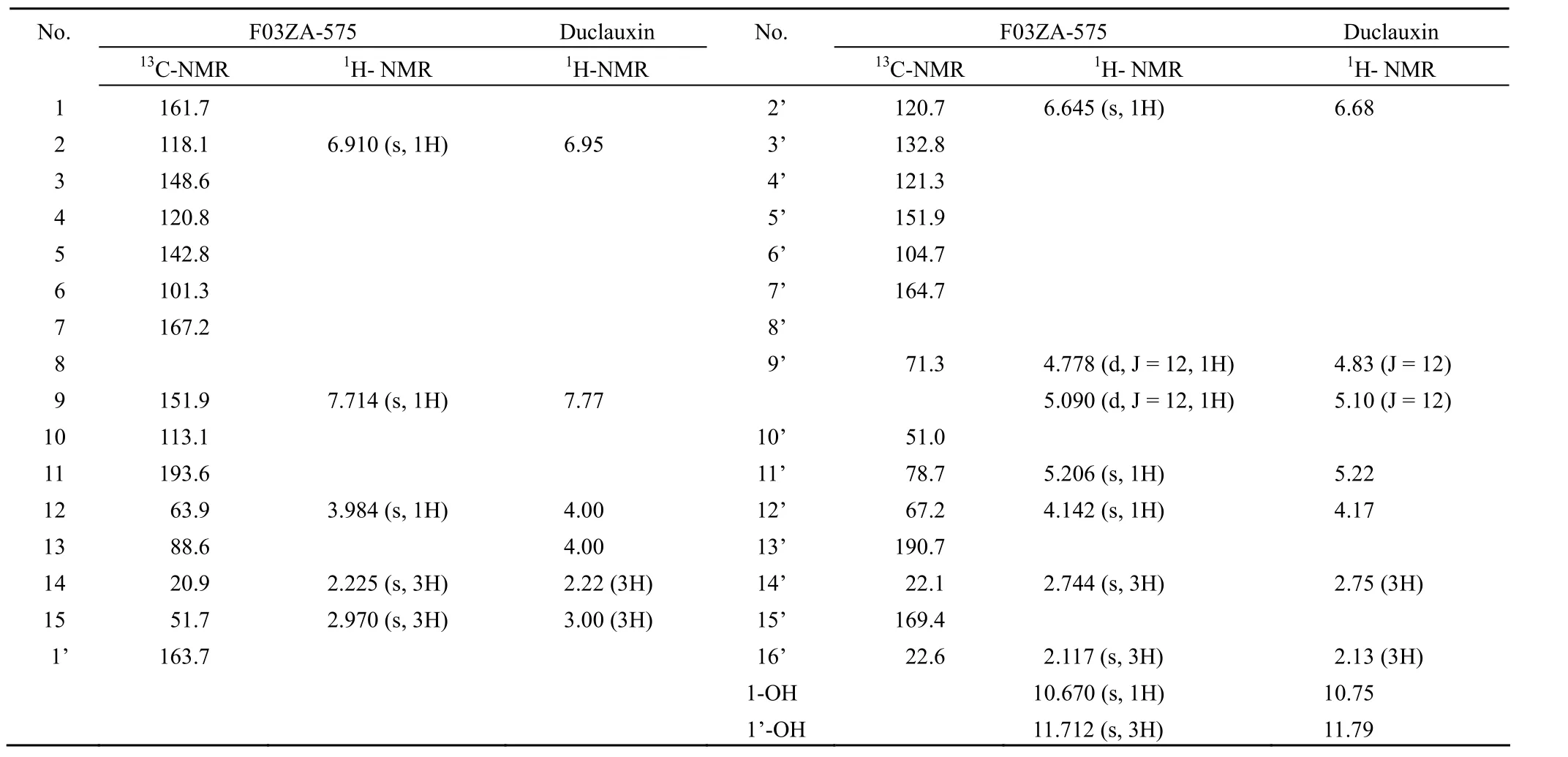
表1 F03ZA-575和Duclauxin的核磁共振(CDCl3)数据Table1 NMR data (CDCl3) of F03ZA-575 and Duclauxin
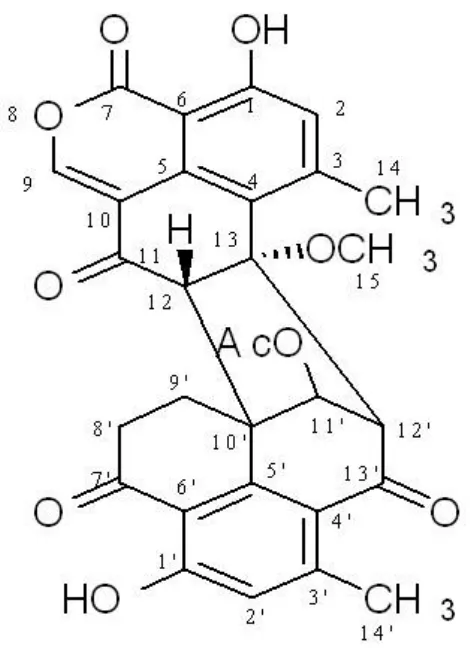
图4 F03ZA-575的化学结构Figure4 The chemical structure of F03ZA-575
2.5 化合物 F03ZA-575 对 Caspase-3 酶抑制活性的测定结果
化合物 F03ZA-575 对 Caspase-3 酶抑制活性的测定结果见图 5,从该图可以看出,化合物F03ZA-575 对 Caspase-3 酶呈现出剂量依赖的抑制作用,其 IC50值为12.5μg/ml。
3 讨论
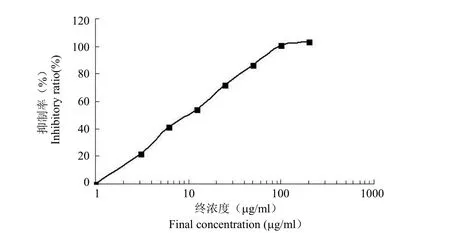
图5 F03ZA-575 对 Caspase-3 酶的抑制活性曲线Figure5 The inhibitory activity curve of F03ZA-575 to Caspase-3
Caspase-3 作为Caspases 家族中最重要的成员之一,是哺乳动物细胞凋亡的关键蛋白酶。近年来研究发现,Caspase-3 除与心脑血管疾病、肿瘤的发生有一定的关系外,在神经退行性疾病的病理过程中也起着很重要的作用。Caspase-3 在这些疾病的病理过程中,不仅仅是起着凋亡的效应器作用,还能直接与老年性痴呆症、帕金森症、亨廷顿舞蹈病、脊椎小脑失调等疾病的致病蛋白质分子相互作用,参与这些疾病的致病机制[9-11]。因此,Caspase-3 也是治疗神经退行性疾病的一个新的重要的靶位点,寻找 Caspase-3 高效、高选择性的抑制剂将为治疗神经退行性疾病提供新的途径[2]。
利用 E.coli 表达的人 Caspase-3 酶,建立了一种基于96-孔板的Caspase-3 酶抑制剂的高通量筛选模型,通过反应前后荧光强度的变化检测样品对 Caspase-3 酶的抑制活性。该方法具有快速准确、灵敏度高的特点,特别适合于大量样品的筛选。利用该筛选模型,通过对 10026个微生物发酵提取物中的筛选,从一株真菌产生的发酵产物中分离得到了一个对 Caspase-3 酶有较强抑制活性的化合物,结构解析确认该化合物与Duclauxin的结构相同。Duclauxin 最早是由 Shibata等[7-8,12]报道的具有抗癌活性的化合物,但对该化合物的抗癌机制未见有很详细和深入的报道,本文首次报道了 Duclauxin 对来源于人的Caspase-3 酶的抑制活性,将对 Duclauxin 在抗肿瘤作用机制和与Caspase-3 酶有关的其他疾病治疗方面的深入研究,提供有用的信息。
[1]Fang Q, Song B.Advances in the inhibitors of caspase 3.Foreign Med Sc (Section Pathophysiology Clin Med), 2001, 21(6):459-461.(in Chinese)方强, 宋波.Caspase 抑制剂研究进展.国外医学(生理、病理与临床分册), 2001, 21(6):459-461.
[2]Zhang YH, Li J, Zhou ZL.Caspase-3: a new target for neurodegenerative diseases treatment.Prog Biochem Biophy, 2003,30(2):175-179.(in Chinese)张亚辉, 李佳,周忠良.Caspase-3: 治疗神经退行性疾病的新靶点.生物化学与生物物理进展, 2003, 30(2):175-179.
[3]Liu XS, Jiang JK.Caspases and Apoptosis.Foreign Med Sci (Section Clini Biochem Lab Medi), 2000, 21(6):322-324.(in Chinese)刘小珊, 蒋纪凯.Caspases与细胞凋亡.国外医学临床生物化学与检验学杂志, 2000, 21(6):322-324.
[4]Mittl PR, Di Marco S, Krebs JF, et al.Structure of recombinant human CPP32 in complex with the tetrapeptide acetyl-Asp-Val-Ala-Aspfluoromethyl ketone.J Biol Chem, 1997, 272(10):6539-6547.
[5]Zhang Y, Shen BH, Yu QW, et al.Fluorescent quantitative assay of Caspase-3 activity.J Cell Mol Immunol, 2001, 17(2):188-190.(in Chinese)张勇, 沈佰华, 余奇文,等.用荧光法定量检测 Caspase-3的活性.细胞与分子免疫学杂志, 2001, 17(2): 188-190.
[6]Garcia-Calvo M, Peterson EP, Leiting B, et al.Inhibition of human caspases by peptide-based and macromolecular inhibitors.J Biol Chem, 1998, 273(49):32608-32613.
[7]Shibata S, Ogihara Y, Tokutake N, et al.Duclauxin, a metabolite of Penicillium duclauxi (Delacroix).Tetrahedron Letters, 1965, 18:1287-1288.
[8]Ogihara Y, Tanaka O, Shibata S.On the metabolites of penicillium duclauxi delacroix--3.The reactions of duclauxin with ammonia and primary amines.The structures of desacetylduclauxin, neoclauxin,xenoclauxin and cryptoclauxin.Tetrahedron Letters, 1966, 25:2867-2873.
[9]Zhang W.Human caspase family protease and apoptosis.Foreign Med Sci (Section of Genetics), 1999, 22(6):290-293.(in Chinese)张伟.人类caspase家族蛋白酶与凋亡.国外医学遗传学分册, 1999,22(6):290-293.
[10]Zeng YY.Advance in molecular mechanism of cellular apoptosis.Bull Natl Nat Found China, 1999, 22(3):137-144.(in Chinese)曾耀英.细胞凋亡分子机制的研究进展.中国科学基金, 1999,22(3):137-144.
[11]Concha NO, Abdel-Meguid SS.Controlling apoptosis by inhibition of caspases.Curr Med Chem, 2002, 9(60):713-726.
[12]Kuhr I, Fuska J, Sedmera P, et al.An antitumor antibiotic produced by Penicillium stipitatum Thom; its identity with duclauxin.J Antibiot(Tokyo), 1973, 26(9):535-536.
