下颌骨节段性缺损修复组织工程中珊瑚支架残留率的研究
2010-12-01袁捷刘广鹏韦敏祁佐良崔磊曹谊林
袁捷,刘广鹏,韦敏,祁佐良,崔磊,曹谊林
修复因创伤、感染、肿瘤等导致的下颌骨缺损是临床常见疾病,自体骨移植是目前疗效最佳的治疗手段,但因患者不但需承受自身供区的明显损伤,供区来源也受限,同时也存在创口感染、血肿形成、取骨区疼痛等诸多并发症[1-2],所以在整复外科领域,目前下颌骨缺损的修复仍是难题。因此,寻找更好的下颌骨整复治疗方法备受关注。
新兴的组织工程技术有很多优点,如良好恢复损伤组织正常结构和功能,支架材料可任意塑形且对供体部位损伤小,为修复下颌骨缺损提供了新的思路。所以应用组织工程技术修复承力下颌骨缺损是目前研究的热点。
骨髓基质干细胞(bone marrow stromal cell,BMSC)已被证明是较好的种子细胞来源[3]。我们在前期已成功地应用成骨诱导 BMSC 分别复合珊瑚和珊瑚羟基磷灰石修复了犬下颌骨 3cm的节段缺损,与珊瑚组织工程骨相比,羟基磷灰石组织工程骨有较多材料残留,修复效果相对较差[4-6]。就组织工程的目的而言,希望支架最终能随新生组织的形成逐步降解,由此达到接近自然的良好修复。但珊瑚作为支架在组织工程骨内降解速率如何目前尚无定论。为此本实验分别采用成骨诱导 BMSC复合珊瑚构建组织工程骨修复犬下颌骨 3cm的标准节段缺损,通过观察比较此珊瑚组织工程骨在不同时间段支架材料降解情况确定其最终修复效果,为临床应用提供进一步的实验依据。
1 材料与方法
1.1 主要试剂和仪器
地塞米松、β-磷酸甘油钠、2-磷酸抗坏血酸和DMEM 培养液购自美国 Sigma公司;杂交犬购自上海交通大学农学院;珊瑚为海南三亚产滨珊瑚。固定钛板、钛钉由常州康辉医疗器有限责任公司提供;µ80 显微 CT(Micro-CT)为瑞士 Scanco medical公司产品;AG-1(Ver.3.80)生物力学测试仪为日本 Shimdzu公司产品。
1.2 方法
1.2.1 BMSC的分离、诱导培养 5%的戊巴比妥钠(0.5ml/kg)麻醉 12只犬后,均抽取骨髓 3~4ml,PBS 洗涤,600×g 离心 5 min,去上层脂滴,4×104个有核细胞/cm2的密度接种于培养皿中,加含有地塞米松(10 nmol/L)、β-磷酸甘油钠(2.16 g/L)和2-磷酸抗坏血酸(37.5 mg/L)的成骨条件培养液,置37 ℃、5% CO2培养箱内培养。5d后PBS 洗去未贴壁细胞,更换培养液。待BMSC 大部分融合,0.25% 胰蛋白酶消化传代,以0.5×104个细胞/cm2密度接种,培养至第 2 代接种珊瑚材料。
1.2.2 BMSC 细胞-珊瑚复合物的植入 12只成年杂交犬,分为2组,每组6只,体重 19~22 kg,术前 8周拔除右侧上下全部前磨牙及第一磨牙预防感染;同时拔除左侧上下全部前磨牙及第一磨牙,作为生物力学测试正常组,即对照组。5%的戊巴比妥钠(0.5ml/kg)麻醉,术中静脉滴注青霉素 160万单位抗炎。右侧卧位,颌下皮肤切开进入,暴露下颌骨体,置入钛板,近远中各 3 枚钛钉固定,线锯离断形成 3cm节段缺损,去除骨膜,局部骨蜡填塞止血。随后将诱导细胞 BMSC-珊瑚组珊瑚复合物植入缺损处,逐层关创。术后隔日起青霉素 80万单位肌肉注射(每天 2 次×3 d),防止感染,并进流质(半流质)饲养。术后22周全部拆除钛板。
1.2.3 节段缺损处的立体骨密度和珊瑚残留率的测定 采用静脉空气栓塞处死术后12周和32周各 6只动物,锯下双侧下颌骨标本,采用Micro-CT测定标本节段缺损处组织的立体骨密度(阈值设为25% 最大灰度值)和珊瑚残留率(阈值设为46.5% 最大灰度值),扫描层厚度均为50µm×50 µm×50 µm。
1.2.4 大体形态结构、新骨形成和珊瑚降解的观察 BMSC-珊瑚组犬术后12周和32周时,取材后各取 6只下颌骨观察大体形态结构,随后4%多聚甲醛固定标本,梯度酒精脱水,以聚甲基丙烯酸甲脂包埋,行包括连接处纵切面的硬组织切片,厚度 50 µm;之后行苦味酸-品红(Van Gieson)染色,并采用组织形态测定法[5]定量观察新骨形成和珊瑚降解情况。
1.2.5 生物力学的检测 12周及32周时,BMSC-珊瑚组和对照组下颌骨标本各取 6只,以75% 酒精擦净、吹干后,采用生物力学测试仪行整骨咬合向三点弯曲测试(以自凝义齿基托树脂固位),跨距为30 mm,受力截面积设为长方形,位于植入物中央,加载速度 0.5mm/min,最大弯曲强度=3LF/(2WT2),弹性模量=L3F/(4WT3⊿l),其中 W 为宽度;T 为厚度;L 为跨距;F 为最大载荷;⊿l 为最大弯距。后两者在三点弯曲实验中测出。
1.3 统计学处理
所得数据采用方差分析和Student t test 方法进行统计分析,统计软件包为SAS Ver.6.12。
2 结果
所有犬术后伤口无感染,早期轻度肿胀。术后2 d开始进食流质,1周后进食半流质。
2.1 节段缺损处的立体骨密度和珊瑚残留率
术后12周诱导 BMSC-珊瑚组新骨形成较好,剖面有孔隙结构出现,但仍可见支架结构明显残留;术后32周伴随珊瑚材料逐步降解新骨进一步成熟,但与正常下颌骨比较,尚无明显的下颌管腔形成(图 1)。
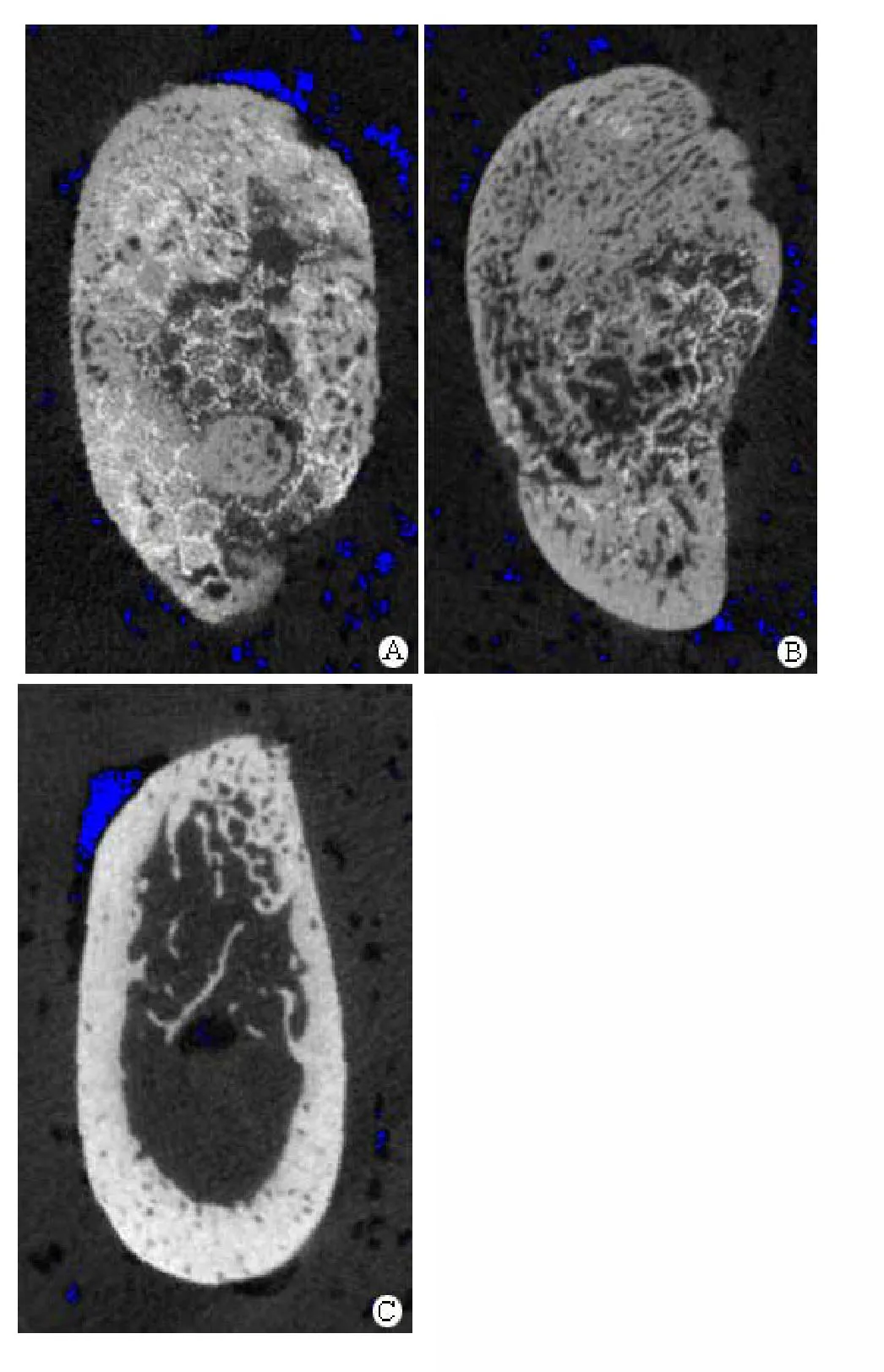
图1 术后立体骨密度和珊瑚残留率的Micro-CT 图像(A:BMSC-珊瑚组12周;B:BMSC-珊瑚组32周;C:自体对照组32周)Figure1 Micro-CT images of density of bone volume and residual material volume post- operation.A: BMSC-coral group at 12 weeks; B:BMSC-coral group at 32 weeks; C: The normal control group at 32 weeks.
术后12周骨组织的平均密度(density of bone volume,DBV)BMSC-珊瑚组为(562.76±85.68)mg HA/cm3显著高于对照组[(474.04±86.85)mg HA/cm3,P<0.05]。术后32周 BMSC-珊瑚组DBV(554.3±59.43)mg HA/cm3也显著高于对照组[(469.36±67.74)mg HA/cm3,P<0.05]。就支架残留率(residual material volume,RMV)而言,BMSC-珊瑚组术后12周为(21.44±4.33)%,显著高于术后32周的[(14.46±2.94)%,P<0.01]。
2.2 大体形态结构、新骨形成和珊瑚降解
BMSC-珊瑚组12周和32周均可见骨缺损已较好修复,断端处为骨样连接(图 2)。Van Gieson染色显示术后12周诱导 BMSC-珊瑚组已形成良好骨组织,有类哈弗系统结构形成,珊瑚支架材料有较多残留;术后32周可见骨进一步成熟形成板层骨结构,且珊瑚支架材料有较多降解(图 3)。通过图像分析可知,BMSC-珊瑚组术后32周新骨量为(60.66±8.09)%,显著高于术后12周的[(46.74±5.17)%,P<0.05],RMV 术后12周为(24.17±5.44)%,则显著高于术后32周的[(11.63±3.29)%,P<0.01],与Micro-CT 检测结果一致。

图2 术后BMSC-珊瑚组下颌骨标本的大体形态结构(A:12周;B:32周)Figure2 Gross view of repaired mandibles post-operation in BMSC-coral group.A: 12 weeks; B: 32 weeks

图3 采用组织学 Van Gieson 染色方法观察术后BMSC-珊瑚组新骨形成和珊瑚降解情况(A.:12周;B:32周)(100×)Figure3 Using Van Gieson’s Picro-fuchsine staining to observe the new bone formation and coral degradation post-operation.A: at 12 weeks; B: I 32 weeks (100×)
2.3 生物力学
术后12周时,BMSC-珊瑚组最大载荷为(1.74±0.37)KN,达到对照组的73.5%;BMSC-珊瑚组最大弯曲强度为(33.43±9.47)MPa,达到对照组的81.67%;均无统计学意义(P >0.05)。术后32周时,BMSC-珊瑚组最大载荷为1.52±0.42 KN,达到对照组的86.37%;BMSC-珊瑚组最大弯曲强度为(54.4±9.88)MPa,达到对照组的90.8%,两者之间的差异具有统计学意义(P >0.05)。术后12周 BMSC-珊瑚组弹性模量显著高于对照组(P<0.05),而 BMSC-珊瑚组术后32周最大弯曲强度显著高于术后12周(P<0.05),表明BMSC-珊瑚组下颌骨随时间延长珊瑚材料逐步降解,其力学强度也有显著提高(表1)。
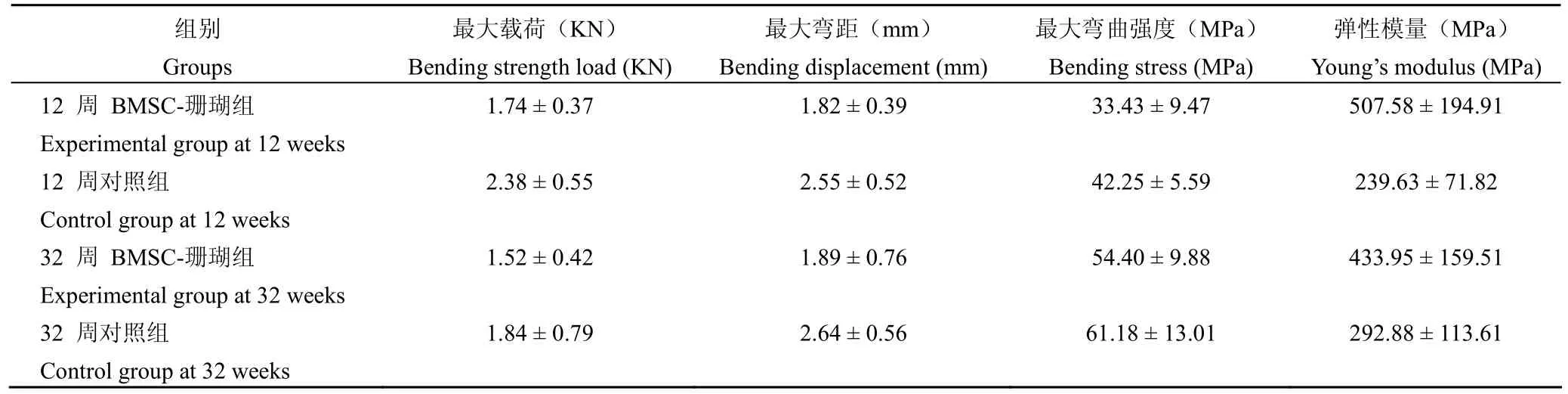
表1 术后下颌骨标本各项生物力学测试参数Table1 Biomechanical analyses of repaired mandibles at 12 and 32 weeks post-operation
3 讨论
本实验采用珊瑚作为细胞载体,一方面是因为珊瑚的孔隙率符合成骨细胞的寄居要求,另一方面珊瑚的力学强度较高,具有与松质骨相类似的力学性能,有较高的压应力(可达 6 MPa),可以满足承力骨要求[7],且其有较好的降解性,这对组织工程骨尤为重要,因降解缓慢的材料在骨修复过程中会占据新骨形成空间,并产生应力遮挡作用,从而影响骨愈合。在我们先前实验中,虽已应用珊瑚复合成骨 BMSC 构建了组织工程下颌骨,但具体材料降解速率尚需进一步明确。本实验中通过Micro-CT 检测发现珊瑚组织工程骨支架残留率术后32周较 12周显著减少(残留率 11%~15%);组织学图像分析也进一步加以证实,而生物力学强度则随时间增长显著增强(术后32周达到正常组的90.8%),提示我们珊瑚支架材料配合新骨形成逐步降解,最终下颌骨达到了较好修复。
单纯珊瑚在体内 3个月完全降解吸收,与我们先前的实验结果也相符合[7-8]。就复合 BMSC 修复骨缺损而言,珊瑚的降解速率却有所不同。Petite等[9]在修复羊跖骨标准缺损时发现术后16周珊瑚残留率 2%,而 Geiger等[10]在修复兔桡骨标准缺损时发现术后16周时珊瑚残留率 6%。本实验中术后12周珊瑚残留率 (21.44±4.33)%,术后32周 残留(14.46±2.94)%,组织学图像分析结果也基本与之相符。造成珊瑚材料降解速率不同的原因可能与修复部位不同有关,前二者都为负重骨缺损,相对承力较下颌骨更高,较高的受力强度造成局部材料降解速度也较快[11-12]。
此外,同样是可降解的多孔磷酸三钙材料,由于其初始强度较低(2MPa 左右),我们在修复同样犬下颌骨缺损时,曾发现单纯材料组有 1 例早期断裂,提示我们应用此材料构建组织工程骨修复大块骨缺损时早期仍要承担一定的风险。此外,磷酸三钙材料降解较慢,术后32周仍有较多材料残留,长期而言新骨质量比大部分降解的珊瑚材料组织工程骨稍差[13]。
综上所述,术后下颌骨中珊瑚支架残留率随时间延长逐渐降低,而生物力学强度则随时间延长显著增强,达到了较好的修复效果;其具体参数的明确也为临床应用组织工程技术修复颌面承力骨缺损进一步提供了有益的例证。
[1]Younger EM, Chapman MW.Morbidity at bone graft donor sites.J Orthop Trauma, 1989, 3(3):192-195.
[2]Hadlock TA, Vacanti JP, Cheney ML.Tissue engineering in facial plastic and reconstructive surgery.Fac Plast Surg, 1998, 14(3):197-203.
[3]Oreffo RO, Triffitt JT.Future potentials for using osteogenic stem cells and biomaterials in orthopedics.Bone, 1999, 25(2 Suppl):5S-9S.
[4]Yuan J, Zhu L, Wang M, et al.Repair of canine segmental mandibular defects using autogenous bone marrow stromal cells and coralline hydroxyapatite.Chin J Stomatol, 2006, 41(2):94-97.(in Chinese)袁捷, 祝联, 王敏,等.自体骨髓基质干细胞-珊瑚羟基磷灰石修复下颌骨节段缺损的实验研究.中华口腔医学杂志, 2006, 41(2):94-97.
[5]Yuan J, Liu GP, Chai G, et al.Pilot study of using autologous bone marrow stromal cells and coral to repair canine segmental mandibular defects.Chin J Plast Surg, 2007, 23(1):51-55.(in Chinese)袁捷, 刘广鹏, 柴岗,等.自体骨髓基质干细胞复合珊瑚修复犬下颌骨节段缺损的初步研究.中华整形外科杂志, 2007, 23(1):51-55.
[6]Yuan J, Yin DM, Wang M, et al.Experimental study of subcutaneous osteogenesis by canine bone marrow stromal cells and coralline hydroxyapatite.China J Oral Maxillofacial Surg, 2005, 3(3):207-211.(in Chinese)袁捷, 殷德民, 王敏,等.犬骨髓基质干细胞复合珊瑚羟基磷灰石皮下成骨的实验研究.中国口腔颌面外科杂志, 2005, 3(3):207-211.
[7]Zhu L, Cui L, Wang M, et al.Experimental study of composite of coral and mesenchymal stem cells to repaire femoral defect.Chin J Orthop, 2003, 23(8):483-488.(in Chinese)祝联, 崔磊, 王敏,等.应用珊瑚及骨髓基质干细胞复合物修复股骨缺损的实验研究.中华骨科杂志, 2003, 23(8) 483-488.
[8]Sciadini MF, Dawson JM, Johnson KD.Evaluation of bovine-derived bone protein with a natural coral carrier as a bone-graft substitute in a canine segmental defect model.J Orthop Res, 1997, 15(6):844-857.
[9]Petite H, Viateau V, Bensaïd W, et al.G.Tissue-engineered bone regeneration.Nat Biotechnol, 2000, 18(9):959-963.
[10]Geiger F, Lorenz H, Xu W, et al.VEGF producing bone marrow stromal cells (BMSC) enhance vascularization and resorption of a natural coral bone substitute.Bone, 2007, 41(4):516-522.
[11]Lanyon LE.Using functional loading to influence bone mass and architecture: objectives, mechanisms, and relationship with estrogen of the mechanically adaptive process in bone.Bone, 1996, 18(1 Suppl.): 37S-43S.
[12]Handschel J, Wiesmann HP, Stratmann U, et al.TCP is hardly resorbed and not osteoconductive in a non-loading calvarial model.Biomaterials, 2002, 23(7):1689-1695.
[13]Yuan J, Cui L, Zhang WJ, et al.Repair of canine mandibular bone defects with bone marrow stromal cells and porous beta-tricalcium phosphate.Biomaterials, 2007, 28(6):1005-1013.
