慢消化淀粉的结构基础和机理
2010-03-15张根义王明珠彭善丽
张根义, 王明珠, 彭善丽,
(江南大学食品学院,江苏无锡214122)
膳食碳水化合物对于人类的健康非常重要,一 般来讲碳水化合物应为每日摄入总热量的45%~65%。然而,对于某种具体的糖类组分来说,它所提供的热量不能够单纯按其数量进行准确评估,这是由于其消化率和消化程度以及葡萄糖的吸收均有所不同[1-2]。因此,Jenkins等人(1981)提出了生糖指数(GI)的概念来反映这些差异[1],生糖指数是指将某测试食品血糖反应曲线(AUC)的面积与具有相同数量(50 g)碳水化合物的参考样品(葡萄糖或者白面包)进行比较所占的比例。按照测定的生糖指数值可将食品分为高生糖指数(GI>70),低生糖指数(GI<55)和中生糖指数食品[3]。虽然食品的生糖指数是通过人体测试确定的,受到食品和个体差异两方面因素的影响,但糖类组分本身的消化性仍是食品生糖指数的最终决定因素[4]。自从生糖指数的概念提出以来,人们已经进行了大量的关于饮食糖类的临床和营养研究,特别是低生糖指数食品潜在的健康效益[5],与此相关的,反映不同食物中糖类的消化性的生糖指数表已经有较为详尽的报道[6]。
淀粉是食品中最重要的产生葡萄糖的组分之一,因为它是由传统的主食材料提供的,如谷物、块根和块茎,以及各种由这些原料制成的产品。与生糖指数的分类相似,淀粉已经根据体外 Englyst法分为快速消化淀粉(RDS),慢消化淀粉(SDS)和抗性淀粉(RS)[7]。RDS能被快速消化并在小肠中的十二指肠和邻近区域吸收,与样品的生糖指数值呈正相关。RS不能被消化,而 SDS的消化速率介于RDS和RS之间,并且可能是沿着整个小肠进行消化的。对于葡萄糖的载送,RDS提供了一个既快又高的葡萄糖水平(高生糖指数),RS理论上不提供任何葡萄糖(生糖指数=0),而SDS则缓慢并且可长时间供给葡萄糖(低生糖指数)。SDS的慢消化特性不仅有利于保持血糖的稳定,而且还可以用来预防各种慢性病[8]。然而,Englyst对于SDS的定义只是根据反应结果来确定的,并没有对淀粉结构的要求和机理的阐述。为了增进慢消化淀粉的了解,本文将主要介绍 SDS的结构特性和慢消化机制。
1 淀粉消化过程和人体消化酶的性质
淀粉,作为食品中主要的生糖碳水化合物,是一种全部由葡萄糖组成的聚合物,包括直链淀粉和高度支化的支链淀粉两种大分子。食品中的淀粉组分主要在小肠被消化,参与消化的酶有唾液和胰腺中的(-淀粉酶和小肠刷状缘的麦芽糖酶-糖化酶和蔗糖酶-异麦芽糖酶[9,10]。这些酶属于α-葡萄糖苷酶。食物被消耗后,淀粉组分首先被α-淀粉酶消化成α-糊精和寡糖,然后再被刷状缘细胞上的酶分解成葡萄糖,而后被肠道细胞表面的钠-葡萄糖共转运载体(SGL T-1)吸收[11]。任何影响酶活性的因素(酶的数量、不同的亚型、酶抑制剂)和水解酶底物的敏感性都会影响淀粉的消化和营养特性[12]。大多数加工过的淀粉类食品都含有少量到中等的水分,因此,从根本上说它们的消化是固液两相的反应,消化酶(特别是α-淀粉酶)需要首先扩散到与水结合的固体食物基质中,并与底物结合,然后酶的活性中才能切割淀粉分子的糖苷键[13]。人体内α-淀粉酶需要5个亚位点(subsite)与淀粉底物结合,并采用多重攻击机制[14]来切割α-1,4糖苷键[15]。影响α-淀粉酶与底物结合的因素,例如:水解产物麦芽糖和麦芽三糖的底物抑制效应(Seigner等,1985)[16]会减慢酶反应。生成葡萄糖的小肠刷状缘酶既能够切割α-1,4糖苷键也能够切割α-1,6糖苷键,但一般来讲,α-1,6糖苷键比α-1,4糖苷键更难断开[17],因此,α-1,6糖苷键越多淀粉消化就越慢[18]。虽然小肠刷状缘细胞上的酶(麦芽糖酶-糖化酶和蔗糖酶-异麦芽糖酶)在生成葡萄糖的过程中发挥了重要作用,不过胰腺中的α-淀粉酶则更为重要[7]。
2 SDS的基本结构和机制
SDS本身是一个方法导向性的概念,并没有关于淀粉原料结构要求的详细规定,如果简单地按照定义来制造就比较困难。因此,SDS的基本结构和机制对SDS的产品发展来说至关重要。根据当前已有的资料,从淀粉本身的观点来看,SDS有两种基本机制:1)物理结构减少了酶的接触2)化学结构限制了酶的反应速率。另外,其他因素,如胃排空的降低、肠胃内部粘度的增大、酶抑制剂的使用以及其他食物组分的交互作用等,都有可能导致生理性慢消化特性。
2.1 SDS物理结构
在食品加工中经常利用物理结构的不同来产生慢消化特性,例如意大利面中,淀粉因受到蛋白质等其他食物组分的保护作用而导致淀粉的慢消化。由物理结构而导致慢消化特性的物质中,原淀粉颗粒可能是最典型的代表,淀粉颗粒有独特的半晶型超分子结构,即自核为中心有一层层的晶体和非晶体交叉排布。支链淀粉是形成半晶体结构的主要分子,根据其X-射线衍射图可以将它的半晶型区域分为A、B、C型,这与淀粉分子的非随机排布和链长[19]相关。影响原淀粉消化的主要的内在因素包括超分子结构(淀粉颗粒内部的微晶)、直连和支链淀粉的比率、支链淀粉的微细结构及淀粉颗粒特有的表面[20]。研究[21]表明,B-类型的淀粉对酶消化有抗性,而A-类型淀粉具有慢消化性。体外Englyst试验测定显示大部分原玉米淀粉含有高含量的慢消化组分,人体试验也显示,普通玉米淀粉(A-类型)餐后血糖反应延缓,表明大多禾谷类原淀粉的慢消化淀粉含量都比较高[22]。对于禾谷类原淀粉慢消化机制的正确理解可以为通过适当的物理结构制作慢消化淀粉原料提供理论基础。
谷物含有A型淀粉,其晶型结构与非晶型结构具有共同的中心,有通道将淀粉颗粒表面与核中心相连(图1)[23]。当淀粉颗粒与淀粉酶混合时,酶通过这些通道进入淀粉颗粒内部开始水解淀粉,从而导致淀粉由内而外的消化模式。通常认为非晶型区域的淀粉容易消化,但是通过Zhang等人[23]的研究发现晶体含量在消化前后并无变化,可以表明晶型区和非晶型区是同时被消化的。同时进行的消化作用和起始于通道的机制(图2)[24],可能导致金字塔型结构的出现,这个消化过程导致了公认的由内至外的消化模式。同时进行的消化机制可能是由于邻近的晶型区和非晶型区紧密连接,所以在消化的整个过程两个区域一直保持在一起。虽然其他的淀粉,如马铃薯和香蕉淀粉,也有共中心的晶型和非晶型区域,由于它们的B形微晶结构,并且不存在通道,因此具有抗消化性。

图1 谷物淀粉颗粒表面孔隙(A,扫描电镜图);汞溴红染色后呈现出的内部通道和孔洞(B,显微图)Fig.1 Cereal starch granule surface pore(A,SEM)and the interior channel and cavity revealed using aqueous solution of merbromin(B,Micrograph)
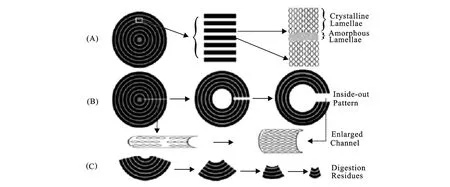
图2 动态旁路消化机制及由此产生的由内而外的静态消化模式图示Fig.2 Schematic representation of a dynamic side-by-side digestion mechanism and resulted static inside-out digestion pattern
淀粉颗粒相邻的结构区域中没有共价键的连接,具有完整的的物理包埋结构。A型的谷物淀粉消化比较缓慢,通过 Englyst测试含有50%或更多的慢消化淀粉,而且从消化动力学的观点来看,谷类淀粉颗粒几乎全部是慢消化淀粉。这是由于按照 Englyst方法检测,在120min后,如果时间延长,SDS还可以进一步消化。因此,由层层晶型区(A-型)和非晶型区所组成的超分子结构是天然谷物淀粉慢消化特性的结构基础,推测在食品产品或者组分中可以制作相似的结构以谋求慢消化效果。
食品不同物理结构导致的慢消化性在意大利面食中有所体现,意大利面食中的网状蛋白质结构限制淀粉酶与淀粉组分的接触。同样的,导致淀粉进入微球体的结构聚合体引发淀粉的缓慢消化,其消化过程由外周向内部区域进行(图3)[25]。后面的例子使得淀粉在体内测试中葡萄糖延缓释放,淀粉的消化性减慢(图4)。

图3 采用Englyst方法测定烹调后包埋淀粉颗粒的消化模式Fig.3 Digestion pattern of entrapped starch granules after cooking with the Englyst test

图4 健康个体餐后血糖浓度(平均值±均值标准误差)Fig.4 Postprandialplasmaglucoseconcentrations(mean±SEM)
2.2 慢消化碳水化合物的分子结构
当淀粉用于食品进行加工时,淀粉糊化,或者在加热破坏淀粉晶体结构的过程中,通常会导致天然谷物淀粉所具有的慢消化特性的减少或丧失[26]。根据最终食品的水分含量,糊化淀粉可能分散在悬浮液中、也可形成了粘稠的胶、或以膨胀颗粒的形式部分或完全无定形状态存在。对于液态糊化淀粉,淀粉颗粒中的粒状或超分子结构几乎完全丧失,而淀粉的分子结构成为决定它的功能性和营养特性的唯一因素。因为淀粉是由α-1,4糖苷键连接D-吡喃葡萄糖单位组成的直链淀粉和α-1,4糖苷键形成直链并与α-1,6糖苷键相互连接而成的高度分支的支链淀粉组成,分散淀粉的分子结构主要取决于直链淀粉和支链淀粉的比例以及支链淀粉的精细结构,即它的链长分布和分枝结构。
淀粉回生即直链淀粉与支链淀粉分子重新组合形成双螺旋结构和可能的晶体结构,是食品储存尤其是在低温过程中,发生的一个重要的过程。已有研究[27-28]表明,淀粉回生降低了淀粉对酶水解的敏感性。直链淀粉与支链淀粉比例高的的淀粉所具有的高抗性淀粉营养特性主要与直链淀粉的回生有关[29]。与此相关的,用淀粉脱枝酶处理后的部分脱支的回生淀粉已被用来制造慢消化碳水化合物[30-31]。其他制被慢消化碳水化合物方法是将淀粉分子的分子结构进行化学改性,包括1-辛烯基琥珀酸酐(OSA)改性淀粉[32-33]和由α-1,6连接酶改性淀粉[18,34]。这些研究表明淀粉分子的分子结构是生产热稳定性慢消化碳水化合物的关键。
我们[26]利用不同的基因型的玉米突变株所进行的研究揭示了SDS含量和支链淀粉短链(DP<13)与长链(DP(13)质量比之间存在抛物线关系,表明无论是含有较多短链还是含有较多长链的支链淀粉,都含有具有相对较高含量的SDS(见图5)。

图5 SDS百分含量与长短链组分重量比间的抛物形关系曲线Fig.5 The parabolic relationship between SDS percentage and the weight ratio of short chain(SF)to long chain fraction(LF)
对此关系机制的进一步研究表明,有两种不同的机制导致糊化淀粉的缓慢消化:对于那些含有更多长链的支链淀粉,淀粉回生显示SDS含量与回生时间关系呈钟形曲线(见图6),说明在回生时形成不完全晶体与淀粉缓慢消化性质相关;另一方面,分子结构本身,或分支状况,是与含有更多短链样品的缓慢消化性质有关(具有高分支密度)。分子结构决定型SDS的一个极端例子,是具有分子连接方式能抗淀粉酶的普鲁兰多糖,其由麦芽三糖或麦芽四糖组成的基本结构单元是通过α-1,6糖苷而连接[35]。直链淀粉,作为淀粉的另一种成分,主要与在粮食储存过程由于淀粉回生形成的RS有关。因此,支链淀粉是SDS的主要组成部分,SDS所需的最佳支链淀粉分子结构可以通过化学、物理、酶和基因进行改性而得到,然而最终需要临床研究来证实其生理作用。

图6 长链含量较高时SDS与回生时间的钟形曲线Fig.6 The bell-shaped SDS content with the retrogradation time for No.6 with high portion of longer chains
2.3 慢消化碳水化合物的生理机制
虽然淀粉分子结构是淀粉颗粒超分子结构的基础,并且淀粉糊化/回生后形成的结构能够影响消化速度,但是在食品被食用时也需要考虑一些外部因素。包括咀嚼效应、胃排空率、经过小肠的时间以及上面讨论到的消化酶特性的影响。如果改进这些因素能够减缓淀粉消化,或更广泛的减缓生糖碳水化合物的消化和延长血糖反应,那么就可以形成生理上慢消化碳水化合物。胃排空率、消化道中食品的粘度和酶抑制剂,可以从现有与慢消化碳水化合物生理导向有关文献中查阅。
有机酸或酸式盐的存在,如酵母发酵过程中产生的酸或在烘烤食物时加入的,都会影响血糖和胰岛素的反应[36-38]。例如,与不含酸的膳食面包相比,酵母发酵面包(在发酵过程中产生乳酸)、或添加了乳酸钙、丙酸钠的面包后,能够显著降低生糖指数和胰岛素指数[38]。摄入含高浓度丙酸钠的面包不仅能降低餐后血糖和胰岛素的反应,而且与其他面包相比还大大延长饱腹感持续的时间。然而,在体外消化中,仅有含有乳酸的面包才能显著减少淀粉酶消化率。作者认为,丙酸钠等酸盐对代谢反应和饱腹感的影响是由于其延迟胃排空[36]。醋对淀粉膳食中也有类似的影响[37]。因此,可以利用发酵过程或实际加入有机酸来改善对碳水化合物需求的营养特性。
由膳食纤维(如抗性淀粉,可溶性纤维)在结肠的发酵所产生的“第二餐效应”中也可以观察到胃排空速率的降低和葡萄糖耐量的提高。所谓的“第二餐效应”首次由Jenkins[5,51]等人提出(1988年),即低GI食物在第二餐时的改善血糖反应的效应,后来证明是由于大量的RS所引起的[39]。Brighenti等(2006年)研究表明,膳食纤维发酵可以通过降低胃排空率来调节餐后血糖反应[40]。一个类似的研究结果表明,食品中加入RS可以提高胰岛素的敏感性,以清除肌肉中的葡萄糖,并通过脂肪组织更多的摄取短链脂肪酸(SCFAs)[41]。SCFAs生理功能的研究显示,他们可以诱导肠肽激素 GLP-1和PYY的分泌,以减少胃肠道和胃的运动[42-43]。因此,在大肠发酵过程中产生的SCFAs,可以作为一个降低胃排空率和其他部分消化道动力的负反馈信号。
现已证明水溶性膳食纤维的粘度效应能够诱导碳水化合物的缓慢消化和具有较低餐后血糖和胰岛素反应的碳水化合物的吸收[44-45]。瓜尔胶,α-葡聚糖,阿拉伯木聚糖,以及其他有效降低血糖反应的物质,在食品制作过程中仍然能保留它们的作用[46-47]。这些可溶性纤维影响血糖反应的机制普遍认为是由于粘度的影响[48]导致胃排空率降低、水解酶对底物的利用降低[49],和/或消化的碳水化合物(比如-糊精和低聚糖)向小肠表面扩散以消化、生成葡萄糖的扩散率降低[50-52]。
3 未来发展趋势
通过对SDS的物理、化学、和生理学方面的一系列研究已经对SDS的结构和机制有了相对较好的理解。然而,把这知识转变成真正的食品仍然存在许多挑战。许多拥有专利权的自命为“慢消化淀粉”产品没有高含量且可以实际利用的 SDS,而天生的粗谷类淀粉仍然是 SDS在许多生理学的研究用的模型。对SDS的将来的研究需要把重心集中在新颖的SDS制造技术、发展评价不同SDS原料品质的体内方法,并深入理解SDS的生理作用,包括饱腹性、感官品质、物理性质、能量代谢和代谢疾病。同时也需要研究SDS和不同膳食纤维之间的生理联系及他们对结肠的影响来全面描绘出碳水化合物的营养作用,更好地控制食物中葡萄糖的释放和传递。
[1]Jenkins D J A,Kendall C W C,Augustin L S A,et al.Glycemic index of foods:a physiological basis for carbohydrate exchange[J].Am J Clin Nutr,1981,34:362-366.
[2]Englyst K N,Vinoy S,Englyst H N,et al.Glycaemic index of cereal products explained by their rapidly and slowly available glucose[J].Br J Nutr,2003,89:329-339.
[3]Brand J C,Colagiuri S,Crossman S,et al.Low-glycemic index foods improve long-term glycemic control in NIDDM[J].Diabetes Care,1991,14:95-101.
[4]Wolever T M,Yang M,Zeng X Y,et al.Food glycemic index,as given in glycemic index tables,is a significant determinant of glycemic responses elicited by composite breakfast meals[J].Am J Clin Nutr,2006,83:1306-12.
[5]Wolever T M,Jenkins D J,Ocana A M,et al.Secondmeal effect:low-glycemic-index foods eaten at dinner improve subsequent breakfast glycemic response[J].Am J Clin Nutr,1988,48:1041-7.
[6]Foster-Powell,K,Holt S H,Brand-Miller J C.International table of glycemic index and glycemic load values’[J].Am J Clin Nutr,2002,76:5-56.
[7]Englyst H N,Kingman S M,Cummings J H.Classification and measurement of nutritionally important starch fractions[J].Eur J Clin Nutr,1992,46:S33-50.
[8]Lehmann U,Robin F.Slowly digestible starch-its structure and health implications:a review[J].Trends Food Sci Tech,2007,18:346-355.
[9]Swallow D M,Poulter M,Hollox E J.Intolerance to lactose and other dietary sugars[J].Drug Meta Dispo,2001,29:513-516.
[10]Nichols B L,Avery S E,Sen P.The Maltase-Glucoamylase Gene:Common Ancestry to Sucrase-Isomaltase With Complementary Starch Digestion Activities[J].Proc Natl Acad Sci,2003,100:1432-1437.
[11]Pencek R R,Koyama Y,Lacy D B,et al.Transporter-Mediated Absorption Is the Primary Route of Entry and Is Required for Passive Absorption of Intestinal Glucose into the Blood of Conscious Dogs[J].J Nutr,2002,132:1929-1934.
[12]Tester R F,Karkalas J,Qi X.Starch structure and digestibility enzyme-substrate relationship[J].Worlds Poultry Sci J,2004,60:186-195.
[13]Leloup V M,Colonna P,Ring S G.α-Amylase adsorption on starch crystallites[J].Biotech Bioeng,2004,38:127-134.
[14]Mazur A K,Nakatani H.Multiple attack mechanism in the porcine pancreatic alpha-amylase hydrolysis of amylose and amylopectin[J].Arch Biochem Biophys,1993,306:29-38.
[15]Brayer GD,Sidhu G,Maurus R,et al.Subsite mapping of the human pancreaticα-amylase active site through structural,kinetic,and mutagenesis techniques[J].Biochem,2000,39:4778-4791.
[16]Seigner C,Prodanov E,Marchis-Mouren G.On porcine pancreaticα-amylase action:kinetic evidence for the binding of two maltooligosaccharide molecules(maltose,maltotriose and o-nitrophenylmaltoside)by inhibition study[J].Eur J Biochem,1985,148:161-168.
[17]Kerr R W,Cleveland F C,Katzbeck W J.The action of amylo-glucosidase on amylose and amylopectin[J].J Am Chem Soc,1951,73:3916-3921.
[18]Ao Z,Simsek S,Zhang G,et al.Starch with slow digestion property produced by altering branch density,chain length and crystalline structure[J].J Agri Food Chem,2007,55:4540-4547.
[19]Annette E,Donald B.Rsistance toα-amylase digestion in four native high-amylose maize stavches[J].Cereal Che,2004,81:31-37.
[20]Jane J L,Wong KS,McPherson A E.Branch structure difference in starches of A-and B-type x-ray patterns revealed by their naegeli dextrin[J].Carbohydr Res,1997,300:219-227.
[21]Planchot,V.,Colonna P,and Bul on A.Enzymatic hydrolysis ofα-glucan crystallites[J].Carbohydr Res,1997,298:319-326.
[22]Seal C J,Daly M E,Thomas L C,et al.Postprandial carbohydrate metabolism in healthy subjects and those with type 2 diabetes fed starches with slow and rapid hydrolysis rates determined in vitro[J].British J Nutr,2003,90:853-864.
[23]Zhang G,Ao Z,Hamaker B R.Slow digestion property of native cereal starches[J].Biomacromolecules,2006a,7:3252-3258.
[24]Huber K C,BeMiller J N.Visualization of channels and cavities of corn and sorghum starches[J].Cereal Chem,1997,74:537-541.
[25]Venkatachalam M,Zhang G,Hamaker B R.Use of polymer encapsulated starches as a novel method to make low glycemic foods[J].World G rain Summit:Foods and Beverages(AACC International),Abstract P-285,2006,Sept.17-20,San Francisco,CA.
[26]Zhang G,Venkatachalam M,Hamaker B R.Structural basis for the slow digestion property of native cereal starch[J].Biomacromolecules,2006b,7:3259-3266.
[27]Farhat I A,Protzmann J,Becker A,et al.Effect of the extent of conversion and retrogradation on the digestibility of potato starch[J].Starch/Stärke,2001,53:431-436.
[28]Okuda M,Aramaki I,Koseki T,et al.Structural and retrogradation properties of rice endosperm starch affect enzyme digestibility of steamed milled-rice grains used in sake production[J].Cereal Chem,2006,83:143-151.
[29]Haralampu S G.Resistant starch a review of the physical properties and biological impact of RS3[J].Carbohydr Polym,2000,41:285-292.
[30]Shi Y C,Cui X,Birkett A M,et al.Slowly digestible starch products[P].美国专利:20030219520,20030215562.
[31]Shin S I,Choi H J,Chung K M,et al.Slowly digestible starch from debranched waxy sorghum starch:preparation and properties[J].Cereal Chem,2004,81:404-408.
[32]Han J,BeMiller J N.Preparation and physical characteristics of slowly digesting modified food starches[J].Carbohydr Polym,2007,67:366-374.
[33]He J,Liu,J,Zhang G.Slowly digestible waxy maize starch prepared by octenyl succinic anhydride esterification and heat-moisture treatment:glycemic response and mechanism[J].Biomacromolecules,2008,9:175-184.
[34]Backer D,Saniez M H.Soluble highly branched glucose polymers and their method of production.美国专利:2005,2005/0142167A1.
[35]Wolf B W,Garleb K A,Choe Y S,et al.Pullulan is a slowly digestible carbohydrate in humans[J].J Nutr,2003,133:1051-1055.
[36]Liljeberg H G,Björck I M.Delayed gastric emptying rate as a potential mechanism for lowered glycaemia after eating sourdough bread:studies in humans and rats using test products with added organic acids or an organic salt[J].Am J Clin Nutr,1996,64:886-93.
[37]Liljeberg H,Björck I.Delayed gastric emptying rate may explain improved glycaemia in healthy subjects to a starchy meal with added vinegar[J].Eur J Clin Nutr,1998,52:368-371.
[38]Liljeberg H G,Lonner C H,Björck I M.Sourdough fermentation or addition of organic acids or corresponding salts to bread improves nutritional properties of starch in healthy humans[J].J Nutr,1995,125:1503-1511.
[39]Björck I,Liljeberg H,Ostman E.Low glycaemic-index foods[J].Br J Nutr,2000,83:S149-55.
[40]Brighenti F,Benini L,Rio D D,et al.Colonic fermentation of indigestible carbohydrate contributes to the second-meal effect[J].Am J Clin Nutr,2006,83:817-822.
[41]Robertson M D,Bickerton A S,Dennis A L,et al.Insulin-sensitizing effects of dietary resistant starch and effects on skeletal muscle and adipose tissue metabolism[J].Am J Clin Nutr,2005,82:559-567.
[42]Massimino S P,McBurney M I,Field CJ,et al.Fermentable dietary fiber increases GLP-1 secretion and improves glucose homeostasis despite increased intestinal glucose transport capacity in healthy dogs[J].J Nutr,1998,128:1786-1793.
[43]Cuche G,Cuber J C,Malbert C H.Ileal short-chain fatty acids inhibit gastric motility by a humoral pathway[J].Am J Physiol G astrointest Liver Physiol,2000,279:G925-30.
[44]Jenkins D J A,Leeds A R,Gassul M A,et al.Unabsorbable carbohydrates and diabetes.Decreased post-prandial hyperglycemia[J].Lancet,1976,2:172-174.
[45]Jenkins D J A,Leeds R,Gassul M A,et al.Decrease in post-prandial insulin and glucose concentrations by guar and pectin[J].Ann Intern Med,1977,86:20-23.
[46]Wolever T M.Carbohydrate and the regulation of blood glucose and metabolism[J].Nutr Rev,2003,61:S40-S48.
[47]Jenkins A L,Jenkins D J A,Zdravkovic U,et al.Depression of the glycemic index by high levels ofα-glucan fiber in two functional foods tested in type 2 diabetes[J].Euro J Clin Nutr,2002,56:622-628.
[48]Wood P J,Braaten J T,Fraser W S,et al.Comparisons of viscous properties of oat and guar gum and the effects of these and oat bran on glycemic index[J].J Agric Food Chem,1990,38:753-757.
[49]Slavin J L.Dietary fiber and body weight[J].Nutr,2005,21:411-418.
[50]Briani G,Bruttomesso D,Bilardo G,et al.Guar-enriched pasta and guar gum in the dietary treatment of type II diabetes[J].Phytother Res,1987,1:177-179.
[51]Jenkins D J,Wolever T M,Taylor R H.Slow release dietary carbohydrate improves second meal tolerance[J].Am J Clin Nutr,1982,35:1339-46.
[51]Zhang G,Ao Z,Hamaker B R.Nutritional property of endosperm starches from maize mutants:A parabolic relationship between slowly digestible starch and amylopectin fine structure[J].J Agri Food Chem,2008a,56:4686-4694.
[52]Zhang G,Sofayan M,Hamaker B R.Slowly digestible state of starch:mechanism of slow digestion property of gelatinized maize starch[J].J Agri Food Chem,2008b,56:4695-4702.
