TLR9受体介导枯否细胞对转染HepG2细胞HBx信号转导的抑制作用
2010-03-14范熠唐宇高燕
范熠 唐宇 高燕
类铎受体(Toll-like receptors,TLRs)是近年来发现的模式识别分子,在诱导免疫应答中具有非常重要的作用。胞嘧啶鸟嘌呤二核苷酸-脱氧寡核苷酸(cytidine-phosphate-guanosine oligodeoxynucleotides,CpG ODN)是TLR9的激动剂,它能够有效地增强机体的免疫功能,从而成为研究热点。CpG能够激活多种天然免疫细胞抑制细菌、病毒和寄生虫等病原体的感染和增强机体的抗肿瘤效应[1]。通过激活肝脏内的巨噬细胞-枯否细胞(Kupffer cells,KC)功能,CpG 能够抑制某些肝脏疾病的发生[2],抑制肿瘤的增殖与转移[3]。然而,CpG抑制肝癌细胞增殖与转移的具体机制尚不清楚。研究已证实,乙型肝炎病毒X蛋白(hepatitis B virus X protein,HBx)是导致肝癌恶化的多功能病毒调节蛋白,具有广泛的基因转录调控作用。因此,本研究对CpG是否通过KC细胞干扰HBx信号转导进行了初步研究。
材料与方法
一、动物、质粒和细胞株 雄性BABL/c小鼠,8~12周龄,由本校动物中心提供。重组表达质粒pcDNA3.1D/V5-HIS-TOPO-HBx和空质粒pcDNA3.1D/V5-HIS-TOPO及人肝母细胞瘤HepG2细胞均由本室保存。
二、主要试剂 TLR9激动剂CpG ODN1826、对照ODN1826 Control和脂质体转染试剂盒LipofectamineTM 2000购自美国Invitrogen公司;双荧光素酶报告基因检测试剂盒(Dual Luciferase Reporter Gene Assay)购自美国Promega公司;鼠抗人β-actin抗体和抗HBx抗体均购自美国Santa公司;Ⅳ型胶原酶、链霉蛋白酶E和Percoll细胞分离液均购自美国Sigma公司;FITC anti-mouse F4/80抗体购自美国Ebioscience公司;检测小鼠干扰素-α、γ(mouse IFN-α、γ)ELISA试剂盒购自上海西唐生物科技有限公司。
三、KC细胞的分离与鉴定 根据严茂林等[4]报告的两步灌注法,应用0.05%Ⅳ型胶原酶和链霉蛋白酶E溶液对BALB/c小鼠肝脏进行原位灌注,将获得的细胞悬液用35%~65%Percoll细胞分离液进行双层密度梯度离心。分离的KC细胞经贴壁培养1h后换液,继续培养24h后用0.25%胰酶消化,收集KC细胞。将KC细胞与FITC anti-mouse F4/80抗体冰浴30min,进行流式细胞术(fluorescence activated cell sorting,FACS)检测,以分析细胞的纯度。
四、转染HepG2细胞HBx蛋白表达的检测 采用Western blotting法,分别取1×107个重组表达质粒pcDNA3.1D/V5-HIS-TOPO-HBx和空质粒pcDNA3.1D/V5-HIS-TOPO转染HepG2细胞,12%SDS-PAGE电泳,取下凝胶,将蛋白质在100V转印1h至聚偏二氟乙烯膜(PVDF),再将该PVDF膜用5%脱脂奶粉-吐温封闭过夜,PBS-T漂洗,加入用5%脱脂奶粉稀释的鼠抗人 β-actin抗体和抗 HBx抗体(1:1000),在室温下孵育2h,PBS-T洗膜3次,加入5%脱脂奶粉稀释并与辣根过氧化物酶偶联的羊抗鼠IgG(1:5000)孵育,室温轻摇2h,PBS-T洗膜3次,DAB避光显色5min,摄像。
五、质粒转染HepG2细胞酶活性检测 转染前1d,取对数生长期HepG2细胞铺24孔板,每孔500μl DMEM完全培养基含1.5×105个细胞,次日,细胞生长融合度达95%。转染前更换为无血清的培养基待用,转染时按LipofectiamineTM 2000试剂盒要求分别进行HBx表达质粒和空质粒转染操作。转染后的HepG2细胞用无抗生素的完全培养基继续培养24h。弃去原培养基,加入新鲜培养基500μl。在HBx转染HepG2细胞孔中加入1×106个KC细胞,设不加细胞对照,再分别加入TLR9激动剂CpG ODN1826或对照ODN1826 Control,使其终浓度为10μM。继续培养12h后收集上清液待用,贴壁细胞用双荧光素酶报告基因检测试剂盒处理,分别测定萤火虫荧光素酶和海肾荧光素酶活性值,并计算酶的相对活性。细胞转染和荧光素酶活性检测重复3次,每次均设置复孔。
六、培养上清液干扰素的检测 将培养上清液进行离心,取50μl上清液,采用ELISA法分别检测干扰素-α和γ。以IgG标准品浓度为横坐标(对数坐标),吸光度(A值)为纵坐标绘制标准曲线,查找被检样品的相应浓度。每次设置复孔,干扰素的检测重复3次,取平均值。
七、统计学分析 双荧光素酶检测结果以空质粒转染HepG2的结果为参照,对各组数据进行标准化处理并计算出相对比值。应用SPSS10.0统计学软件对数据进行方差分析,P<0.05被认为具有显著性差异。
结 果
一、转染HepG2细胞HBx蛋白的表达 检测发现重组表达质粒转染的HepG2细胞能够表达HBx蛋白,分子量为17kD,与预期相符,而空质粒转染的HepG2细胞不表达HBx蛋白,见图1。
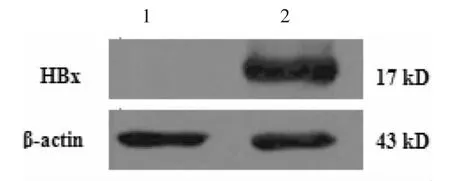
图1 转染HepG2细胞中HBx蛋白的表达
二、KC细胞的鉴定 成功分离的KC细胞经培养24h后,细胞形态较好,均伸展成梭形或不规则形,见图2。
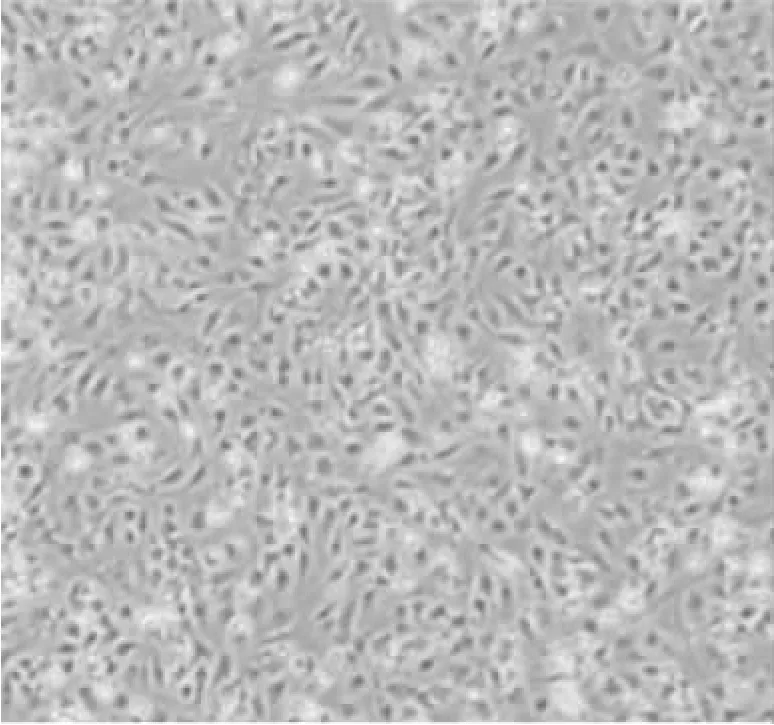
图2 KC细胞的形态学表现
用荧光抗F4/80标记后进行流式细胞术分析,发现其纯度为83.6%,见图3。台盼蓝染色显示细胞活力>95%。
三、转染HepG2细胞HBx转导NF-κB信号的变化
在HBx转染的HepG2细胞培养体系中加入KC细胞和TLR9激动剂进行共培养,采用双荧光素酶试剂盒检测HBx介导的NF-κB信号通路的活化状况,以空质粒转染组为对照进行标准化处理。结果显示,与HBx转染组(4.83±0.56)比,加入 KC细胞和 TLR9激动剂后双荧光素酶的相对活性显著下降(3.14±0.85,P<0.05),约为HBx转染组的65%;而加入KC细胞和TLR9激动剂对照对NF-κB信号通路的活化无显著性影响(4.69±0.52,P>0.05),见图 4。
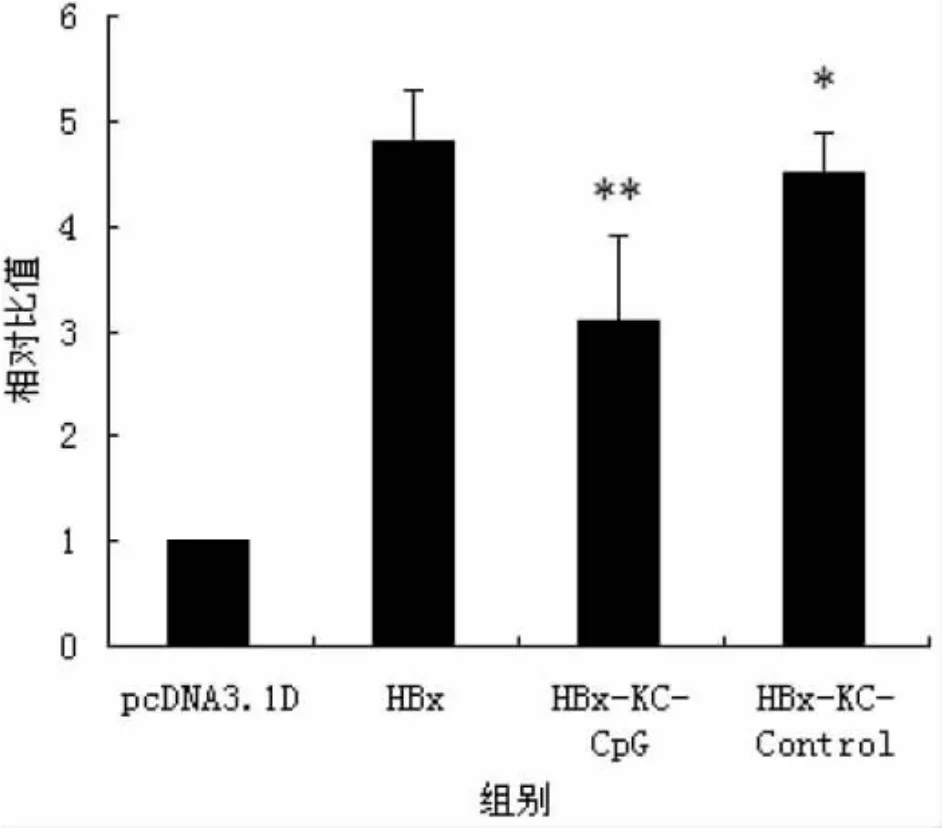
图4 HBx介导的NF-κB信号活性比较
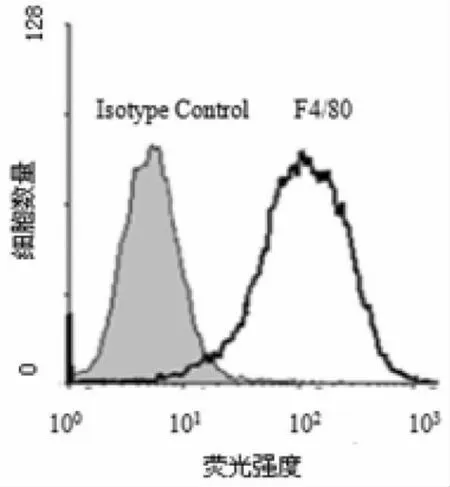
图3 流式细胞术检测KC细胞纯度
四、KC细胞依赖的转染HepG2细胞HBx介导的NF-κB信号变化 进一步对抑制HBx介导NF-κB信号活性的KC细胞进行剂量依赖性分析。在HBx转染的 HepG2 细胞培养液中分别加入 1×105、1×106和1×107个KC细胞,孵育后进行双荧光素酶分析,结果显示加入不同数量的KC细胞后NF-κB信号活性存在显著性差异(P<0.05),即随着KC细胞数量的增加,双荧光素酶的相对活性逐渐下降,见图5。
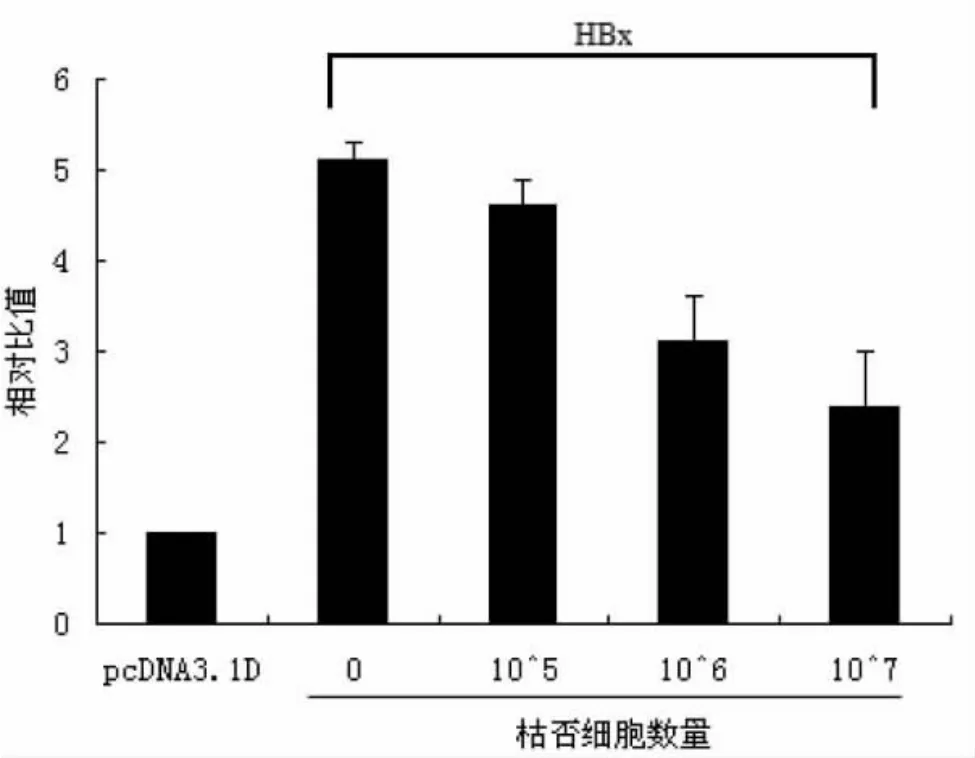
图5 不同数量的KC细胞对转染HepG2细胞HBx信号转导的影响
五、共培养体系上清液干扰素水平的变化 在HBx转染的HepG2细胞与枯否细胞和TLR9激动剂共培养12h,与HBx转染组比,加入枯否细胞和TLR9激动剂后IFN-α和IFN-γ水平分别增加了8.7倍和6.5倍(P<0.05),而加入枯否细胞和TLR9激动剂Control则对IFN-α和IFN-γ的产生无显著性影响,见图6。
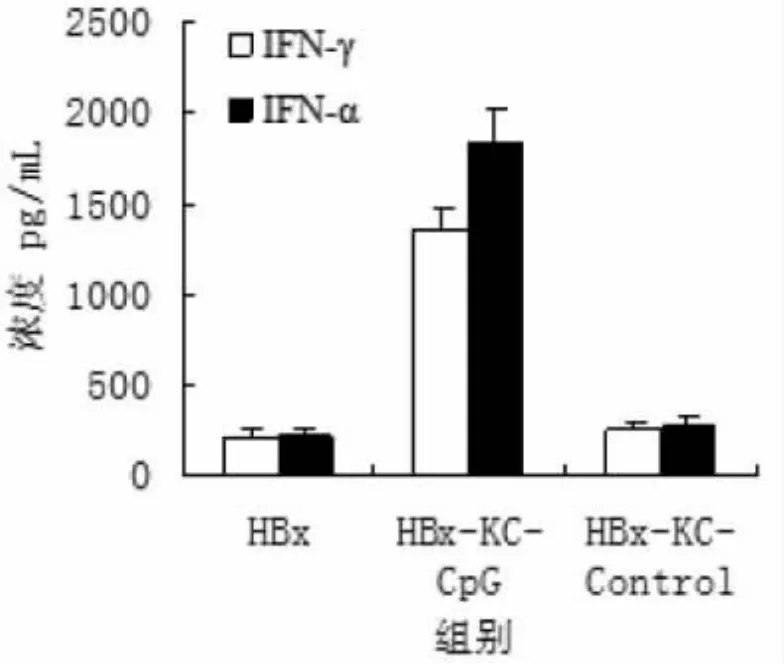
图6 共培养体系上清IFN-α和IFN-γ水平的变化比较
讨 论
HBV感染和肝细胞癌(hepatocellular carcinoma,HCC)的发生有关。HBV感染者发生HCC的危险性是无感染者的200多倍[5]。HBx基因是HBV复制所必需的基因,在乙型肝炎慢性化和HCC的发生中具有重要的作用。HBx蛋白是一种反式激活因子,其本身不能与双链DNA直接结合,而是通过调控基因表达和蛋白间相互作用,激活多条细胞信号转导通路,如HIF-1α、NF-κB、AP-1、SP1 和 oct-1 等多种核转录因子,影响细胞的增殖、分化和凋亡,促进其恶性转化[6]。因此,干扰HBx蛋白信号转导功能对防治HBV相关性肝癌的发生具有重要意义。
TLRs受体是近年来发现的重要模式识别受体(pattern recognition receptors,PRRs),是介导天然免疫与适应性免疫的桥梁[7]。CpG能够激活TLR9信号通路,并诱导机体产生抗病原体感染和抑制肿瘤细胞增殖等多种免疫效应[8]。近期研究发现,CpG对HCC的增殖与转移具有一定的抑制作用[2],但CpG具体的作用机制尚不清楚。本实验结果显示,当CpG作用于KC细胞后,能够显著地抑制HBx蛋白介导的NF-κB信号通路的活化。KC细胞是肝脏内最重要的免疫细胞,是组织巨噬细胞中最大的群体。CpG激活KC细胞能够产生多种细胞因子,如干扰素、白介素12(IL-12)和肿瘤坏死因子(TNF-α)等[9]。其中,IFN 是抑制病毒感染的重要效应分子。本研究发现CpG激活KC细胞能够诱导IFN-α和IFN-γ的大量分泌,后者可能干扰了HBx信号的转导,最终影响到肝脏肿瘤细胞的增殖与恶化。
Van等研究发现,KC细胞在抑制肝脏肿瘤方面具有潜在的利用价值,CpG能够激活KC细胞,诱导产生大量的IFN-α等效应分子,从而在肝脏局部产生高浓度的IFN-α微环境,显著抑制HBx蛋白介导的多种信号通路的活化[10,11],与本研究结果相符。因此,本研究为通过阻断HBx信号转导途径治疗肝癌提供了实验依据。
[1]杨光,杨亮,包木胜,等.新型CpGODN对乙型肝炎病毒复制的抑制作用[J].中国免疫学杂志,2009,(7):60-63.
[2]CHEN J,XU W,ZHOU T,et al.Inhibitory role of tolllike receptors agonists in Plasmodium yoelii liver stage development[J].Parasite Immunol,2009,31(8):466-473.
[3]BERTIN S,ANJUERE F,GAVELLI A,et al.Plasmidic CpG sequences induce tumor microenvironment modifications in a rat liver metastasis model[J].Int J Mol Med,2008,21(3):309-315.
[4]严茂林,王耀东,田毅峰,等.小鼠肝Kupffer细胞分离方法探讨[J]. 福建医科大学学报,2008,42(6):526-528.
[5]王郁杰.pCMV-tag2B—HBX质粒的构建和表达[J].内科,2008,3(3):326-328.
[6]孙长宇,张贤强,杨观瑞,等.HBX蛋白、骨桥蛋白、基质金属蛋白酶-9在肝细胞癌组织中的表达及意义[J].山东医药,2008,48(48):6-8.
[7]董宁,姚咏明.Toll样受体免疫学研究新进展[J].感染炎症修复,2008,9(3):34-36.
[8]SHARMA S,DOMINGGUEZ AL,MANRIQUE SZ,et al.Systemic targeting of CpG-ODN to the tumor microenvironment with anti-neu-CpG hybrid molecule and T regulatory cell depletion induces memory responses in BALB-neuT tolerant mice[J].Cancer Res,2008,68(18):7530-7540.
[9]KAWABATA T,KINOSHITA M,INATSU A,et al.Functional alterations of liver innate immunity of mice with aging in response to CpG-oligodeoxynucleotide[J].Hepatology,2008,48(5):1586-1597.
[10]VAN DER BIJ GJ,OOSTERLING SJ,MEIJER S,et al.Therapeutic potential of Kupffer cells in prevention of liver metastases outgrowth[J].Immunobiology,2005,210(2-4):259-265.
[11]OHATA K,ICHIKAWA T,NAKAO K,et al.Interferon alpha inhibits the nuclear factor kappa B activation triggered by X gene product of hepatitis B virus in human hepatoma cells[J].FEBS Lett,2003,553(3):304-308.
