陕北甜荞麦麸皮中黄酮类化合物提取工艺的研究
2010-02-25杨芙莲
杨芙莲, 何 琳
(陕西科技大学生命科学与工程学院, 陕西 西安 710021)
0 前 言
荞麦(Buckwheat)又名三角麦、乌麦,是一种在低温环境下生长的短季蓼科植物,主要包括甜荞和苦荞两种.甜荞主要分布在华北、西北、东北地区,是一种药食兼备的食品[1,2],含有丰富的蛋白质、淀粉、脂肪、粗纤维、维生素、矿物元素等[3-5].不仅如此,荞麦麸皮中还含有大量的黄酮类化合物[6-9],但在加工中荞麦麸皮通常被作为饲料使用,或被丢弃,若能从中提取黄酮类化合物,不但可以开发利用新资源,改变黄酮类物质来源短缺的问题,而且可以提高荞麦麸皮的利用率.本实验采用乙醇浸提法,研究了不同因素对甜荞麦麸皮中黄酮类物质得率的影响,并在此基础上通过正交试验确定了最佳工艺条件.
1 材料与方法
1.1 主要材料与试剂
甜荞麦麸皮:采自陕北神木;芦丁,生化试剂,国药集团化学试剂有限公司;无水乙醇,亚硝酸钠,硝酸铝,氢氧化钠均为分析纯.
1.2 主要仪器
722型光栅分光光度计,上海精科;DK-98-1型电热恒温水浴锅,天津泰斯特仪器有限公司;BS323S 型分析天平,北京赛多利斯仪器系统有限公司;RE-52A旋转蒸发器,上海亚荣生化仪器厂.
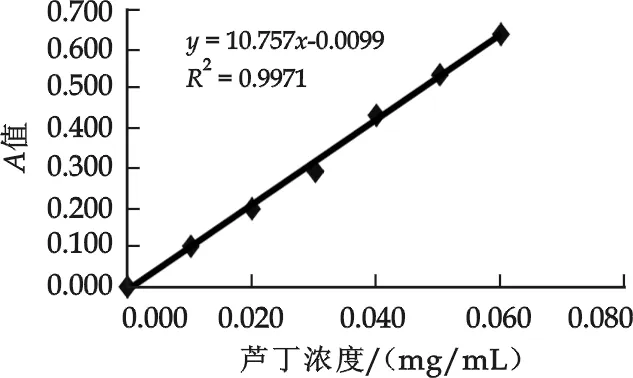
图1 芦丁标准曲线的测定结果
1.3 实验方法
1.3.1 标准曲线的制作[10]
准确称取120 ℃干燥至恒重的芦丁标准品20 mg,加10 mL甲醇置于水浴锅中微热使之溶解,冷却,置于100 mL容量瓶中,加水至刻度,摇匀,即得浓度为0.2 mg/mL的芦丁对照品溶液.
精密吸取0.5、1.0、1.5、2.0、2.5、3.0 mL上述芦丁对照品溶液,分别置于10 mL比色管中,加60%乙醇至5 mL,加5%亚硝酸钠溶液1 mL,摇匀,静置6 min,加10%硝酸铝溶液1 mL,摇匀,静置6 min,加1 mol/L氢氧化钠溶液2 mL,再加水至刻度,摇匀,静置15 min,以相应的试剂为空白,在波长500 nm处测定吸光度值,以芦丁浓度-吸光度值作图(见图1),得到回归方程:Y=10.757X-0.009 9,R2=0.997 1.
1.3.2 甜荞麦麸皮中黄酮类化合物的提取及测定[11,12]
准确称取1.0 g干燥至恒重的甜荞麦麸皮,过60目筛,置于锥形瓶中,按要求加入适量一定体积分数的乙醇,放入恒温水浴锅中浸提一段时间,抽滤,再浸提一次,合并滤液,旋转蒸发后将滤液定容至50 mL,作为待测液.准确吸取1 mL待测液于10 mL比色管中,按照1.3.1的方法测定吸光度值,计算黄酮类化合物的得率.
黄酮类化合物的得率=[X×V定×稀释倍数×10-3/W]×100%
式中:X—样品中黄酮浓度,mg/mL;V定—定容体积,mL;稀释倍数—10;W— 样品的质量,g.
1.3.3 单因素实验
(1)乙醇体积分数单因素试验:准确称取6份干燥至恒重的荞麦麸皮1 g,过60目筛,置于锥形瓶中,分别加入20 mL体积分数为40%、50%、60%、70%、80%、90%的乙醇浸泡过夜,然后置于70 ℃的水浴中浸提2 h,浸提2次,抽滤,合并滤液,旋转浓缩后将滤液定容至50 mL,待测.
(2)料液比单因素试验:准确称取6份干燥至恒重的荞麦麸皮1 g,过60目筛,置于锥形瓶中,分别加入10 mL、20 mL、30 mL、40 mL、50 mL、60 mL体积分数为60%乙醇浸泡过夜,然后置于70 ℃的水浴中浸提2 h,浸提2次,抽滤,合并滤液,旋转浓缩后将滤液定容至50 mL,待测.
(3)浸提温度单因素试验:准确称取6份干燥至恒重的荞麦麸皮1 g,过60目筛,置于锥形瓶中,加入50 mL体积分数为60%乙醇浸泡过夜,然后分别置于30 ℃、40 ℃、50 ℃、60 ℃、70 ℃、80 ℃的水浴中浸提2 h,浸提2次,抽滤,合并滤液,旋转浓缩后将滤液定容至50 mL,待测.
(4)浸提时间单因素试验:准确称取6份干燥至恒重的荞麦麸皮1 g,过60目筛,置于锥形瓶中,加入50 mL体积分数为60%乙醇浸泡过夜,然后置于70 ℃的水浴中,分别浸提1 h、1.5 h、2 h、2.5 h、3 h、3.5 h,浸提2次,抽滤,合并滤液,旋转浓缩后将滤液定容至50 mL,待测.
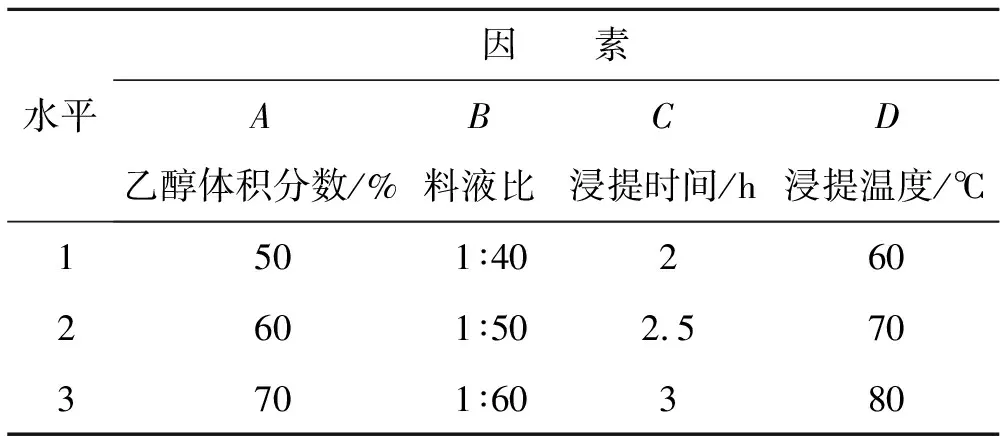
表1 正交试验因素水平表
1.3.4 正交试验设计
以单因素试验结果为依据,选择乙醇体积分数、料液比、浸提时间、浸提温度4个因素,以黄酮得率为指标,采用L9(34)正交试验方法对甜荞麦麸皮中黄酮类化合物最佳提取工艺条件进行试验,因素水平表见表1.
2 结果与分析
2.1 单因素试验结果及分析
2.1.1 乙醇体积分数对黄酮得率的影响
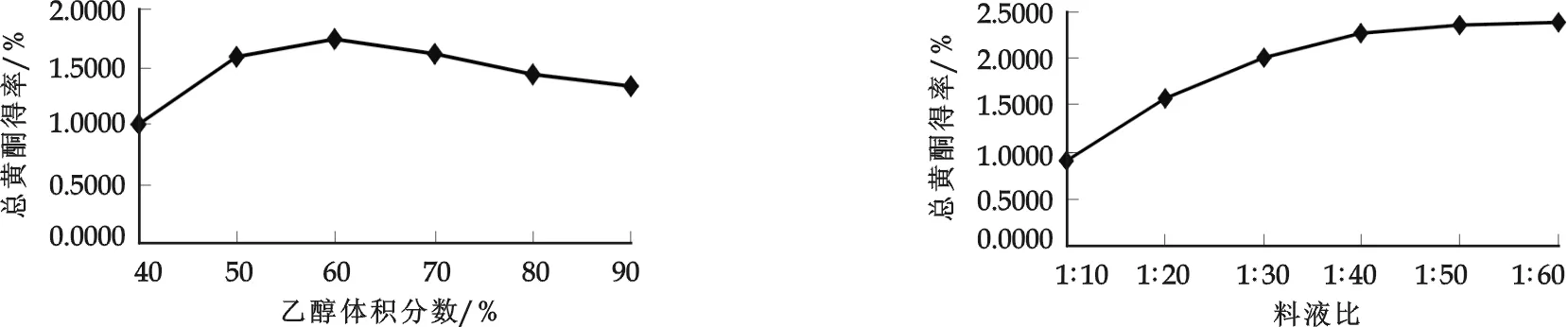
图2 乙醇体积分数对荞麦麸皮中黄酮类化合物得率的影响 图3 料液比对荞麦麸皮中黄酮类化合物得率的影响
从图2可以看出:随着乙醇体积分数的增大,黄酮类化合物得率呈上升趋势;当乙醇体积分数达到60%时,黄酮类化合物的溶解度最大,但超过60%后,黄酮类化合物得率有所下降.这可能是由于一些醇溶性杂质、色素、亲脂性成分的溶出量增加,与黄酮类化合物竞争乙醇,从而导致黄酮类化合物的得率下降,因此最适宜的乙醇体积分数为50%~70%.
2.1.2 料液比对黄酮得率的影响
从图3可以看出:随着料液比的增大,总黄酮得率逐渐增加,当料液比达到1∶50后,总黄酮得率增加缓慢.溶剂量的增加提高了样品体系与提取剂体系间黄酮类化合物的浓度差,使得样品中有效成分的残留量减少,从而提高了黄酮的得率;但当达到一定比例时,溶剂将样品中有效成分基本溶出,使得黄酮得率趋于稳定.综合考虑浸提效果、溶剂用量和降低浓缩负荷等因素,乙醇的用量不宜过大,故将料液比定为1∶40~1∶60.
2.1.3 浸提温度对黄酮得率的影响

图4 浸提温度对荞麦麸皮中黄酮类化合物得率的影响 图5 浸提时间对荞麦麸皮中黄酮类化合物得率的影响
从图4中可以看出,随着浸提温度的升高,黄酮类化合物得率增大,到70 ℃时黄酮得率达到1.760 3%,但温度进一步升高,黄酮得率却趋于平稳,这可能是由于随着温度的升高,有效成分的溶解速度加快,并且温度的提高也会引起细胞膜结构发生变化,使荞麦麸皮中黄酮类物质大量溶出,从而提高了黄酮的得率;但温度增加的同时也会提高杂质的溶出量,与黄酮类化合物竞争溶剂,因此温度不宜过高,故浸提温度为60℃~80℃.
2.1.4 浸提时间对黄酮得率的影响
从图5中可以看出,随着浸提时间的延长,荞麦麸皮中黄酮类化合物的得率逐渐增加,浸提2 h后逐渐趋于平稳.这可能是由于随着时间的延长,一定比例的乙醇已逐渐将荞麦麸皮中的有效成分基本溶出,再延长浸提时间对黄酮得率影响不大.因此从浸提时间、浸提级数考虑,将浸提时间定为2~3 h.
2.2 正交试验结果及分析
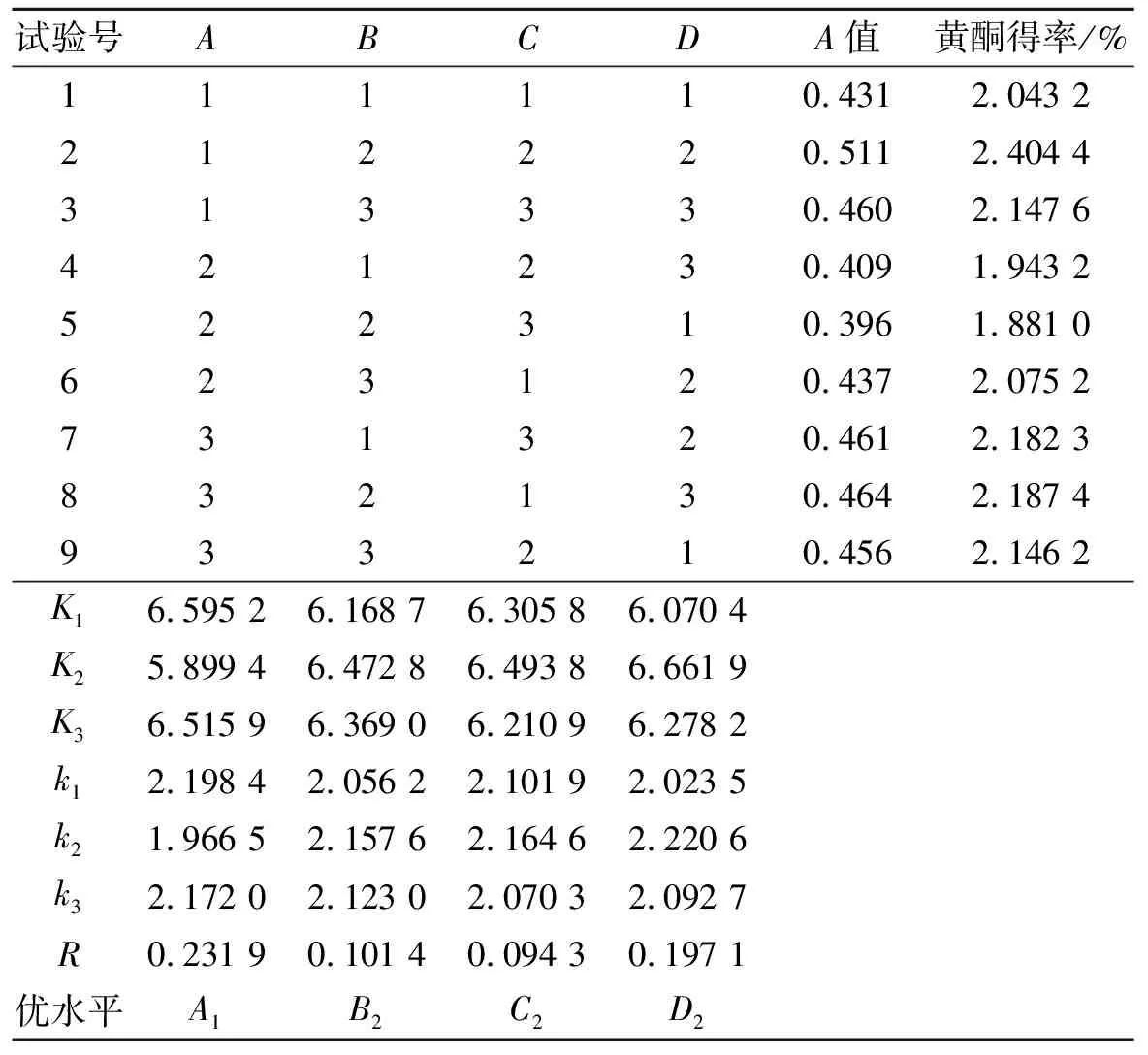
表2 正交试验设计及结果
从表2的试验结果可以看出,影响甜荞麦麸皮中黄酮类化合物提取得率的各因素依次是:A>D>B>C,表明乙醇体积分数对黄酮得率的影响最为显著,其余依次是浸提温度、料液比,浸提时间影响最小.最佳的因素水平组合为A1D2B2C2,即:乙醇体积分数50%、浸提温度70 ℃、料液比1∶50、浸提时间2.5 h,在此条件下黄酮类化合物得率为2.404 4%.
2.3 浸提级数的确定
称取3 g干燥至恒重的甜荞麦麸皮,过60目筛,置于锥形瓶中,加入150 mL 50%的乙醇,放入70 ℃恒温水浴锅中浸提2.5 h,抽滤,在同样条件下多次提取,按照1.3.1的方法测定吸光度值,计算黄酮类化合物的得率,结果见表3.
从表3中可以看出:随着浸提级数的增加,累积黄酮得率逐渐增大,但三级到四级之间黄酮得率增长不明显,从浸提效果、浸提时间和提取成本等方面考虑,浸提3次最佳.

表3 浸提级数试验结果
3 结论
(1)通过正交试验确定了甜荞麦麸皮中黄酮类化合物的最佳提取工艺,即:乙醇体积分数50%、料液比1∶50、浸提温度70 ℃、浸提时间2.5 h,在该工艺条件下黄酮类化合物得率达到2.204 4%.
(2)在最佳工艺条件下进行浸提级数试验,结果表明:浸提三级最佳,其黄酮类化合物累计得率达到2.419 5%,为甜荞麦麸皮的回收利用提供了科学依据.
参考文献
[1] 王红育,李 颖. 荞麦的研究现状及应用前景[J]. 食品科学,2004,25(10):388-391.
[2] 罗庆林,邵继荣. 荞麦中类黄酮的研究进展[J]. 食品研究与开发,2008,29(2):160-164.
[3] 张纪宁,欧阳艳. 黄酮类化合物的提取工艺研究进展[J]. 伊犁师范学院学报,2008,(5):62-64.
[4] 欧阳平,张高勇,康保安. 苦荞麦黄酮类化合物提取的工艺参数优化及数据模型研究[J]. 食品科学,2005,26(1):107-111.
[5] 甑云鹏. 苦荞麦中黄酮类化合物提取、纯化与其组分分离、测定[D]. 成都:成都理工大学,2007.
[6] 程俊丽,田 晋,冯翠萍. 荞麦粉中黄酮类化合物提取工艺的研究[J]. 农产品加工学刊,2009,(5):33.
[7] 曹艳萍. 苦荞麦麸皮中总黄酮的乙醇提取工艺研究[J]. 食品科学,2005,26(3):98-100.
[8] 王 军,王 敏. 苦荞麦麸皮总黄酮提取工艺及其数学模型研究[J]. 天然产物研究与开发,2006,22(7):223-225.
[9] 肖诗明,张 忠,李 勇,等. 苦荞麦荞麦麸皮中黄酮的提取工艺条件研究[J]. 食品科学,2006,27(1):156-158.
[10] 毛跟年,许牡丹. 功能食品生理特性及检测技术[M]. 北京:化学工业出版社,2005.
[11] 张 岩,曹国杰. 黄酮类化合物的提取以及检测方法的研究进展[J]. 食品研究与开发,2008,29(1):154-157.
[12] 冯年平,郁 威. 中药提取分离技术原理与应用[M]. 北京:中国医药科技出版社,2005.
