基于石墨烯的碳糊电极对多巴胺的测定
2010-02-25庄贞静李建永
庄贞静, 李建永
(华侨大学分子药物研究所, 福建 泉州 362021)
0 前 言
多巴胺(DA)是哺乳动物中枢神经系统重要的神经递质,它在机体内的浓度变化与神经活动有直接关系,对其测定方法的研究具有重要意义.由于DA分子内含有2个容易被氧化的酚羟基,具有电化学活性,因此可用电化学方法对其进行定量检测.然而,DA在金电极、铂电极或玻碳电极等裸电极上的过电位高,电极反应缓慢、灵敏度低,此外与DA共存的另一种生物物质抗坏血酸(AA)的氧化峰电位与DA非常接近,对DA的测定产生干扰.因此,如何在AA存在下选择性的测定DA成为DA检测的研究热点和难点.近年来,使用化学修饰电极尤其是纳米材料修饰电极研究DA的电化学行为引起了人们的广泛关注,如用金纳米颗粒[1]、铂纳米颗粒[2]、钯纳米颗粒[3]、碳纳米管[4-6]及其复合材料[7]等对电极进行修饰可有效地分离DA与AA的氧化峰.
碳纳米材料的新成员——石墨烯,由于其结构独特、性能优异,具有良好的导电性、较高的比表面、较好的机械稳定性、化学稳定性和热稳定性,因此有望作为一种良好的电化学传感材料用于传感器的构建[8].目前基于石墨烯修饰电极的电化学生物传感平台已有报道[9-15],然而用不同方法制备的石墨烯其性能不尽相同,并且用不同方法制备的修饰电极其电化学响应性能也不相同.以廉价的天然石墨为基本原料,通过插层、高温膨胀以及超声粉碎处理即可大量制备石墨烯[16],本文以该种石墨烯为传感材料,制备了基于石墨烯的碳糊电极,用电化学方法对该电极进行了表征,研究了DA在该电极上的电化学行为,并对DA进行了测定.结果表明,该电极可在AA存在下选择性测定DA.此外,该电极还具有制备简单、重现性好、稳定性好等优点,可用于实际样品分析.
1 实验部分
1.1 原料及试剂
石墨烯由华侨大学陈国华教授提供,具体的制备与表征过程见参考文献[16].石墨粉购自山东青岛石墨股份有限公司;多巴胺、抗坏血酸、液体石蜡均购自上海晶纯试剂有限公司;磷酸盐缓冲溶液(PBS)由0.1 mol/L NaH2PO4-Na2HPO4配制,并用NaOH与H3PO4调节其pH值.所用试剂均为市售分析纯,实验用水为超纯水(18.2 MΩ·cm-1).
1.2 工作电极的制备
基于石墨烯碳糊电极的制备:将液体石蜡和石墨烯按质量比1∶3混合,用玛瑙研钵研磨使其均匀混合,压入洁净的塑料管(内径为2.70 mm)中,压实,另一端插入铜丝作为导线,即制得基于石墨烯的碳糊电极(GPE).为了对比,用石墨粉代替石墨烯,以同样方法制备碳糊电极(CPE).使用前将电极在称量纸上抛光.
1.3 分析测试
电化学实验是在CHI660D电化学工作站(上海辰华仪器公司)上进行;电化学实验采用三电极系统:以石墨烯或石墨粉制备的碳糊电极为工作电极,铂丝电极为对电极,Ag/AgCl(3 mol/L KCl)电极为参比电极.
2 结果与讨论

图1 CPE与GPE在0.05 mol/L K2Fe (CN)6 和0.2 mol/L KCl混合溶液中的循环伏安图
2.1 GPE在K2Fe( CN)6 溶液中的电化学行为
将GPE和CPE置于0.05 mol/L K2Fe (CN)6和0.2 mol/L KCl混合溶液中进行循环伏安(CV)扫描,结果如图1所示.CPE在上述溶液中的CV曲线上(曲线a) 出现了1对氧化还原峰,峰电位差约为480 mV,这是[Fe (CN)6]3-/4-在CPE上的电化学行为.与CPE相比,GPE在该溶液中的氧化还原峰电流都有明显增大,且氧化峰电位负移,还原峰电位正移,电位差减小为280 mV(曲线b),说明石墨烯对K2Fe (CN)6在GPE电极表面上的电子转移起到了明显的促进作用.因此,本实验所用石墨烯有望作为一种良好的电化学材料用于传感器的构建.
2.2 多巴胺的GPE上的电化学行为
用差示脉冲伏安法(DPV)对比考察了GPE与CPE电极在pH=7的PBS缓冲溶液中对DA、AA和同时含有DA及AA的电化学响应性能,结果如图2所示.在CPE电极上(图2A),AA和DA都出现一个明显的氧化峰,两个氧化峰电位较为接近,分别位于0.25 V和0.18 V附近;当溶液中同时存在AA和DA时,AA和DA在该电极上的氧化峰电位相互叠加.对于GPE而言(图2B),该电极在含有AA及不含AA的PBS(pH=7)缓冲溶液中的DPV曲线基本重合,而在含有DA的PBS(pH=7)缓冲溶液中在0.21 V处出现了一个明显的氧化峰,并且该氧化峰的电位及电流强度不受AA的影响.可见,用DPV方法在石墨粉制备的CPE电极上检测DA将受AA的干扰,而用石墨烯制备的GPE电极在AA存在下对DA具有很好的选择性响应,这可能是由于一方面石墨烯具有较大表面积,可促进分析物质与电极表面之间的电子转移过程,另一方面,所用石墨烯表面带有羟基、羧基等官能团而使得表面带有负电荷,对DA具有富集作用,可提高DA检测的灵敏度,而对AA有排斥作用,因此能减小AA的干扰.

图2 CPE(A)和GPE(B)在各种不同介质中的DPV曲线(所用介质分别是:pH=7的PBS缓冲溶液(曲线a)以及在该溶液中分别含有1 mmol/L AA (曲线b)、 50 μmol/L DA(曲线c)和同时含有1 mmol/L AA与50 μmol/L DA(曲线d))

图3 在GPE上的DA氧化峰电位与pH关系图
溶液的pH对DA在GPE上的电化学行为也有较大影响.用DPV方法考察溶液pH的变化对DA在GPE上响应性能的变化,结果如图3所示.由图3可看出:随着pH升高(5.0~9.0),DA在GPE上的氧化峰电位负移,呈线性关系,其线形回归方程为y(V)=0.644 7-0.065 2pH,相关系数为0.999 7.方程的斜率接近理论的能斯特斜率,说明DA在GPE电极上的氧化还原是等电子等质子过程,与文献报道一致[17].为保持与人体内接近的pH环境,以下实验介质均取pH=7的PBS为缓冲溶液.
2.3 线性范围和检出限
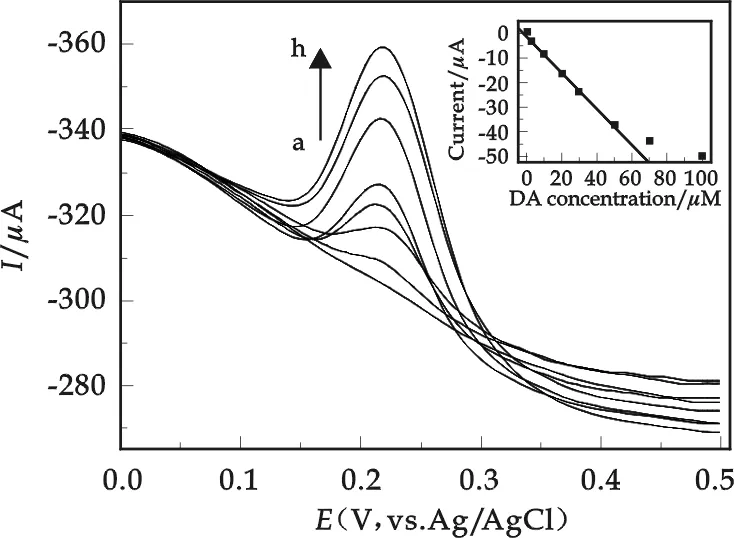
图4 含有1 mmol/L AA的PBS(pH=7)缓冲溶液中不同浓度的DA在GPE上的DPV图(a.0 μmol/L DA;b.3 μmol/L DA;c.10 μmol/L DA; d.20 μmol/L DA; e.30 μmol/L DA; f.50 μmol/L DA; g.70 μmol/L DA; h.100 μmol/L DA.插入图为峰高与DA浓度的线性关系图)
图4是在含有1 mmol/L AA的PBS(pH=7)缓冲溶液中,不同浓度的DA在GPE上的DPV图.由图4可看出,随着DA浓度的增加,相应的氧化峰电流明显增大,在3 μmol/L到50 μmol/L范围内,DA浓度与氧化峰峰高呈良好的线性关系(见图4的插入图),对应线性方程为y(μA)=-0.805 7-0.748 8c(μmol/L),r=0.998 4,检出限为0.8 μmol/L (S/N=3).
2.4 重现性与稳定性
用PEG电极连续平行测定含有0.05 DA的PBS溶液,测定结果的相对标准偏差为4.23%,该电极放置一个星期后(每天检测一次),对相同浓度的DA的响应下降5.87%,表明所制备的PEG电极对DA的响应具有良好的重现性和稳定性.
2.5 样品分析
取10 μL盐酸多巴胺注射液样品,加入20 mL PBS(pH=7)缓冲溶液中,用PEG对样品中的DA含量进行测定(n=5),测定结果为10.2 g/L,与标准值(10 g/L)相符,相对标准偏差为4.87%.
3 结束语
用石墨烯制备了碳糊电极,首先考察了该电极在含有KCl的K2Fe (CN)6溶液中的电化学性能,结果表明石墨烯对K2Fe(CN)6在GPE电极表面上的电子转移起到了明显的促进作用.其次,考察了该电极对多巴胺的响应性能,结果表明该电极对多巴胺的响应具有良好的选择性,可在抗坏血酸存在下定量测定多巴胺,并具有良好的灵敏度、稳定性和重现性.该电极可用于实际样品分析,结果令人满意.
参考文献
[1] Li M., Gao F., Yang P.,etal. Conveniently assembling dithiocarbamate and gold nanoparticles onto the gold electrode: a new type of electrochemical sensors for biomolecule detection[J]. Surface Science, 2008, 602: 151-155.
[2] Atta N. F., El-Kady M. F.. Novel poly(3-methylthiophene)/Pd, Pt nanoparticle sensor: Synthesis, characterization and its application to the simultaneous analysis of dopamine and ascorbic acid in biological fluids[J]. Sensors and Actuators B, 2010, 145: 299-310.
[3] Atta N. F., El-Kady M. F., Galal A.. Simultaneous determination of catecholamines, uric acid and ascorbic acid at physiological levels using poly(N-methylpyrrole)/Pd-nanoclusters sensor[J]. Analytical Biochemistry, 2010, 400: 78-88.
[4] Zhu S., Li H., Niu W.,etal. Simultaneous electrochemical determination of uric acid, dopamine, and ascorbic acid at single-walled carbon nanohorn modified glassy carbon electrode[J]. Biosensors and Bioelectronics,2009, 25: 940-943.
[5] Alwarappan S., Liu G., Li C.-Z.. Simultaneous detection of dopamine, ascorbic acid, and uric acid at electrochemically pretreated carbon nanotube biosensors[J]. Nanomedicine: Nanotechnology, Biology and Medicine, 2010, 6: 52-57.
[6] Habibia B., Pournaghi-Azarb M. H.. Simultaneous determination of ascorbic acid, dopamine and uric acid by use of a MWCNT modified carbon-ceramic electrode and differential pulse voltammetry[J]. Electrochimica Acta, 2010, 55: 5 492-5 498.
[7] Adekunlea A. S., Agboolab B. O., Pillay J.,etal. Electrocatalytic detection of dopamine at single-walled carbon nanotubes-iron (Ⅲ) oxide nanoparticles platform[J]. Sensors and Actuators B, 2010, 148: 93-102.
[8] Yang W., Ratinac K. R., Ringer S. P.,etal. Carbon nanomaterials in biosensors: should you use nanotubes or graphene[J]. Angewandte Chemie International Edition , 2010, 49:2 114-2 138.
[9] Kim Y.-R., Bong S., Kang Y.-J.,etal. Electrochemical detection of dopamine in the presence of ascorbic acid using graphene modified electrodes[J]. Biosensors and Bioelectronics, 2010, 25: 2 366-2 369.
[10] Zhou M., Zhai Y., Dong S.. Electrochemical sensing and biosensing platform based on chemically reduced graphene oxide[J]. Analytical Chemistry, 2009, 81: 5 603-5 613.
[11] Alwarappan S., Erdem A., Liu C.etal. Probing the electrochemical properties of graphene nanosheets for biosensing applications[J]. The Journal of Physical Chemistry C, 2009, 113: 8 853-8 857.
[12] Tan L., Zhou K.-G., Zhang Y.-H.,etal. Nanomolar detection of dopamine in the presence of ascorbic acid at b-cyclodextrin/graphene nanocomposite platform[J]. Electrochemistry Communications, 2010, 12: 557-560.
[13] Li F., Chai J., Yang H.,etal.Synthesis of Pt/ionic liquid/graphene nanocomposite and its simultaneous determination of ascorbic acid and dopamine[J].Talanta, 2010, 81: 1 063-1 068.
[14] Han D., Han T., Shan C.,etal. Simultaneous determination of ascorbic acid, dopamine and uric acid with chitosan-graphene modified electrode[J]. Electroanalysis, in press.
[15] Guo S., Wen D., Zhai Y.,etal. Platinum nanoparticle ensemble-on-graphene hybrid nanosheet: one-pot, rapid synthesis, and used as new electrode material for electrochemical sensing[J]. ACS Nano, 2010, 4: 3 959-3 968.
[16] Chen G., Wu D., Weng W.,etal. Exfoliation of graphite flake and its nanocomposites[J]. Carbon, 2003, 41: 579-625.
[17] 王春燕, 唐小风, 田 坚, 等, 聚氨基黑10B/Naf ion修饰电极上多巴胺的检测[J]. 分析化学, 2009, 37:1 800-1 804.
