可溶性肿瘤坏死因子受体II-脂联素球部融合蛋白的真核表达及生物学活性检测
2010-02-10陈素云何秋山董小岩吴小兵高基民1
陈素云,何秋山,董小岩,吴小兵,高基民1,
1 温州医学院 浙江省医学遗传学重点实验室,温州 325035
2 中国疾病预防控制中心 病毒病预防控制所 病毒基因工程国家重点实验室,北京 100052
3 南方医科大学生物技术学院,广州 510515
4 北京五加和分子医学研究有限公司,北京 100176
TNFα (肿瘤坏死因子 α) 在许多疾病的病理生理过程中起着重要的介质作用,拮抗 TNFα已经成为治疗自身免疫性疾病的新手段[1]。可溶性 TNFR (Soluble TNF receptor,sTNFR) 是肿瘤坏死因子受体胞外区经剪切脱落而成,分为sTNFRI与sTNFRII两种。它们都能与TNFα结合而拮抗其活性[2]。现已上市用于治疗类风湿性关节炎的药物 Etanercept被认为是一种高效的 TNFα拮抗剂,它是一种融合蛋白,是通过将sTNFRII基因编码区与IgG的Fc基因编码区融合并在哺乳动物细胞中表达而成。借助于Fc的二聚化作用使其拮抗 TNFα的能力较相应sTNFR II 单体提高了50~1000倍[3]。由于体内成熟的TNFα主要以三聚体形式存在[4-5],本研究欲借助脂联素球部 (Globular domain of adiponectin,gAD)可形成同源三聚体[6]的特性,构建一种可溶性肿瘤坏死因子受体II-脂联素球部的融合基因,并在无血清悬浮培养的哺乳动物细胞中表达,试图获得具有更高比活性和稳定性的TNFα拮抗剂。
1 材料与方法
1.1 质粒、菌种和细胞
pET24-gAD质粒由南方医科大学高基民教授课题组提供;pGluc-Basic质粒购自 NEB 公司;Max Efficiency DH5αTM购自Invitrogen公司;pBluescript SK质粒为病毒基因工程国家重点实验室保存;pAAV2neo质粒、BHK-21S细胞由北京五加和分子医学研究所提供,BHK-21S细胞已经过无血清悬浮驯化,在有血清存在时表现为贴壁生长,在化学成分限定的无血清培养基LK021中则表现为悬浮生长特性;L929细胞购自美国ATCC,用含10%胎牛血清的DMEM培养液培养。
1.2 主要试剂和材料
限制性内切酶及连接酶、蛋白Marker、Gaussia Luciferase Assay Kit购自NEB公司;质粒大提试剂盒购自Qiagen公司;Ficoll试剂购自北京鼎国生物技术有限公司;ConA购自Sigma;Trizol试剂盒,脂质体LipofectamineTM2000购自Invitrogen公司;G418购自 Merck公司;噻唑蓝 (MTT)、二甲基亚砜 (DMSO) 购自Ameresco;放线菌素D购自Fluka;鼠抗人脂联素单抗由本元正阳基因技术有限公司谭淑萍老师提供;鼠抗人TNFRII单抗购自Abcam公司;FITC标记的羊抗鼠 IgG抗体购自中山金桥;IRD800CW羊抗鼠的IgG购自LI-COR公司;DMEM培养基、胎牛血清购自Gibco;化学成分限定培养基LK021由北京五加和分子医学研究所提供;人 TNFα国家标准品 (3500 U/支) 由中国药品生物制品检定所提供;hTNFR-Fc阳性对照品由复旦张江生物医药公司提供;100 kDa超滤离心管购自Sartorius;人脂联素定量ELISA试剂盒购自北京博蕾德生物科技有限公司。
1.3 质粒构建
1.3.1 人肿瘤坏死因子II型受体胞外区的扩增
抽取10 mL健康人外周血于肝素抗凝管中,以PBS稀释 1倍后用 Ficoll密度梯度离心法分离PBMC,将其于含有2 µg/mL ConA的1640全培中培养24 h,离心收集剌激后的细胞,按Trizol Kit操作说明提取总RNA,取1 µg进行反转录,以逆转录后的cDNA为模板PCR扩增得到目的基因sTNFRII。目的基因上游引物:5′-ggggtacc atggcgcccgtcgccg tctggg-3′ (下划线部分为Kpn I酶切位点),下游引物:5′-gaagctt gtcgccagtgctcccttcagctg-3′ (下划线部分为Hind III酶切位点)。反应条件:95℃ 5 min;94℃ 40 s,58℃ 40 s,72℃ 1 min,25个循环;72℃ 10 min。扩增得到目的基因sTNFRII大小为771 bp。1%琼脂糖凝胶电泳后,回收目的片段,Kpn I、Hind III双酶切后克隆入pBluescript SK载体中,转化大肠杆菌DH5αTM,挑取氨苄抗性克隆,酶切及测序鉴定,获得pBluescript SK-sTNFRII。
1.3.2 脂联素球部区域基因的扩增
以pET24-gAD质粒为模板PCR扩增得到gAD基因片段。上游引物:5′-gaagctt cctggagaaggtgcctat gtatac-3′ (下划线部分为Hind III酶切位点),下游引物:5′-ccggatcc tcagtggtggtggtggtggtgc-3′ (下划线部分为BamH I酶切位点),扩增得到目的基因gAD大小为423 bp。gAD PCR产物纯化后以BamH I与Hind III双酶切后克隆入 pBluescript SK-sTNFRII中,转化大肠杆菌DH5αTM,挑取氨苄抗性克隆酶切鉴定,获得pBluescript SK-sTNFRII-gAD。
1.3.3 sTNFRII-gAD融合基因克隆入pAAV2neo载体
将 pBluescript SK-sTNFRII-gAD用 Kpn I及BamH I酶切,得到目的基因sTNFRII-gAD,克隆到以Kpn I和Bgl II双酶切的pAAV2neo载体片段中(BamH I和 Bgl II是同尾酶),获得表达质粒pAAV2neo-sTNFRII-gAD,酶切鉴定。
1.3.4 对照质粒pAAV2neo-Gluc-gAD的构建
构建分泌型报告基因Gluc与gAD基因的融合基因Gluc-gAD作为pAAV2neo-sTNFRII-gAD的对照质粒。根据pGluc-basic序列设计引物。上游引物:5′-ttaggtacc
gtcaccaccggcccc-3′ (下划线部分为 EcoR I酶切位点,已去除终止密码子),以 pGluc-Basic为模板PCR扩增得到含Gluc的目的片段。琼脂糖凝胶电泳后,回收目的片段,Kpn I、EcoR I双酶切后克隆到pAAV2neo载体上,转化大肠杆菌DH5αTM,挑取氨苄抗性克隆,酶切鉴定,获得pAAV2neo-Gluc质粒。
根据Adiponectin开放阅读框序列设计引物。上游引物:5′-gcggaattc
ccagccaccatgggagtc-3′ (下划线部分为Kpn I酶切位点,阴影部分为ATG起始密码子),下游引物:5′-taagaattc
cctggagaaggtgccta-3′ (下划线部分为EcoR I酶切位点),下游引物:5′-ggcggatcc tcagtt ggtgtcatggta-3′ (下划线部分为BamH I酶切位点,阴影部分为终止密码子),以构建成功的 pAAV2neosTNFRII-gAD质粒为模板进行PCR扩增得到含gAD的目的片段,gAD片段回收后经EcoR I与BamH I酶切后克隆入以EcoR I与Bgl II酶切的pAAV2neo-Gluc质粒中,酶切鉴定获得pAAV2neo-Gluc-gAD质粒。
1.4 BHK-21S细胞的转染
BHK-21S细胞在含 10%胎牛血清的 DMEM培养基中 (37℃,5% CO2) 贴壁生长。参考LipofectamineTM2000说明书,转染前1天将细胞以1×105/孔接种于24孔板中,待BHK-21S细胞密度达到 80%~90%时转染,转染前培养基改换为不含血清和双抗的DMEM培养基,取0.8 µg质粒用100 µL无血清培养基稀释混匀,2 µL LipofectamineTM2000同样用100 µL无血清培养基稀释,将上述2种液体放到同一EP管中混匀,室温避光放置20 min后分别加入对应的24孔板中,6~8 h后补加含10%胎牛血清的DMEM培养基于37℃、5% CO2培养箱培养。
1.5 转染细胞中sTNFRII-gAD蛋白表达的检测
1.5.1 免疫荧光检测
pAAV2neo-sTNFRII-gAD和pAAV2neo-Gluc-gAD质粒瞬时转染BHK-21S细胞24 h后,免疫荧光检测目标蛋白在细胞中的表达。24孔板中转染目的质粒的细胞和阴性未转染质粒细胞,分别弃去上清,PBS洗涤3次,用200 µL冰预冷的甲醇固定20 min,弃去甲醇,分别加入1∶300 (用5%脱脂牛奶稀释)的鼠抗人脂联素抗体或 1∶500 (用 5%脱脂牛奶稀释) 的鼠抗人TNFRII抗体各200 µL,37℃温育1 h。PBS洗涤3次后,加入1:100稀释的FITC标记的羊抗鼠IgG二抗200 µL,37℃避光温育1 h。PBS洗涤3次,加0.01%的伊文斯兰染色15 min,荧光显微镜观察结果。
1.5.2 分泌性荧光素酶的检测
按照 Gaussia Luciferase Assay Kit说明书,pAAV2neo-Gluc-gAD、pAAV2neo-sTNFRII-gAD转染BHK-21S细胞24 h后,分别取20 µL 细胞培养上清,加入 50 µL Gluc底物,混匀后,用发光检测仪(ModulusTM Luminometer) 测定其相对光强度单位(Relative light unit,RLU),光子收集时间为10 s。
1.6 稳定表达细胞株的建立及无血清悬浮培养
采用脂质体介导的细胞转染技术,将真核细胞表达质粒 pAAV2neo-sTNFRII-gAD和 pAAV2neo-Gluc-gAD分别导入BHK-21S细胞。利用pAAV2neo质粒上带有neo抗性基因筛选将质粒DNA稳定整合入基因组的 BHK-21S细胞。转染后第 2天改加含G418的选择性培养基 (G418浓度为800 µg/mL),细胞长满后转移至培养瓶中,加压筛选15 d,获得抗性细胞株。
抗性细胞株BHK-21S/pAAV2neo-sTNFRII-gAD和BHK-21S/pAAV2neo-Gluc-gAD在含10% FBS的DMEM培养基中贴壁生长,分别改换为无血清悬浮培养基LK021培养,待细胞数达到2×106/mL,加入丁酸钠使其终浓度为10 mmol/L,24 h后离心收集上清。
1.7 培养上清的超滤浓缩和ELISA检测
将抗性细胞 BHK-21S/pAAV2neo-sTNFRII-gAD,BHK-21S/pAAV2neo-Gluc-gAD无血清悬浮培养24 h的上清分别经0.22 µm滤膜过滤,用100 kDa超滤浓缩管离心将上清浓缩20倍。浓缩后上清用人脂联素定量ELISA试剂盒检测sTNFRII-gAD蛋白含量,该试剂盒的包被抗体及检测抗体采用的是鼠抗人脂联素单克隆抗体,标记检测系统为生物素、亲和素辣根酶,定量标准品为人全长脂联素。
1.8 Western blotting检测sTNFRII-gAD蛋白的表达
取浓缩20倍的上清10 µL加入10 µL 2×loading buffer,100℃沸水煮5 min,20 µL样品上样,10%分离胶进行SDS-PAGE分离,然后用湿胶转移仪将蛋白转移至NC膜上。取出NC膜,用封闭液 (5%脱脂牛奶,PBS配制) 37℃封闭NC膜1 h。弃去封闭液,加入1:300 (用含5%脱脂奶的PBST稀释) 的鼠抗人脂联素单抗或 1:500 (用含 5%脱脂奶的PBST稀释) 的鼠抗人TNFRII的单抗,温育1 h。PBST洗涤NC膜3次后,加入1:5000 ( 用含5%脱脂奶的PBST稀释) IRD800CW标记的羊抗鼠IgG二抗,37℃避光温育1 h。避光PBST洗涤3次后,PBS洗涤2次去除多余的吐温,用Odyssey红外荧光成像仪进行检测。
1.9 sTNFRII-gAD融合蛋白的生物活性测定
以L929为靶细胞,检测sTNFRII-gAD融合蛋白拮抗TNFα杀伤细胞的中和活性[7]。取对数生长期的L929细胞,胰蛋白酶消化计数,用5%的DMEM培养基调整细胞浓度至1.5×105/mL,取96孔板每孔加入100 µL细胞悬液,置37℃的5%CO2培养箱中培养过夜;第2天将BHK-21S/pAAV2neo-sTNFRII-gAD和BHK-21S/pAAV2neo-Gluc-gAD无血清悬浮培养 24 h后收获的上清以及 sTNFRII-Fc对照品(起始浓度为50 µg/mL) 分别用含20 µg/mL放线菌素D、20 U/mL TNFα的DMEM培养液进行4倍比梯度稀释,共稀释10个梯度;弃去96孔板中L929细胞的上清,加入前面已倍比稀释好的 sTNFRII-gAD融合蛋白上清样品和 Gluc-gAD 上清样品及sTNFRII-Fc对照品,每孔100 µL,每个梯度设3个复孔;同时加入含20 µg/mL放线菌素D与20 U/mL TNFα的DMEM培养液 (两者结合杀伤性最大) 作为阴性对照。该96孔板在37℃、5% CO2条件下培养24 h后,每孔加入MTT溶液 (5 mg/mL) 20 µL,继续培养4 h后,DMSO终止培养,检测各孔的OD570值。
2 结果
2.1 重组质粒的结构
重组质粒pAAV2neo-sTNFRII-gAD和对照质粒pAAV2neo-Gluc-gAD结构如图 1所示。其中包括CMV启动子、sTNFRII基因、gAD基因和其后的6His序列、牛生长激素的 polyA加尾信号、AAV2的倒转末端重复序列 (ITR) 以及 Gluc-gAD基因。载体骨架上有新霉素抗性的 neo基因,便于转染后的G418加压筛选。
2.2 重组质粒的酶切鉴定
pAAV2neo-sTNFRII-gAD用插入位点 Kpn I和EcoR I双酶切得到约7 kb载体片段和大于1 kb的sTNFRII-gAD片段 (图2A),与预期结果一致;用pAAV2neo克隆位点两端的通用引物测序表明,sTNFRII-gAD 序列与预期序列相同;pAAV2neo-Gluc-gAD用Kpn I和EcoR I酶切可得到一条大于500 bp的片段,与Gluc 555 bp大小一致。用BamH I和EcoR I酶切可切出gAD与BGH polyA约接近700 bp的片段,与预期一致。用Kpn I和 BamH I可切出大于1 kb的片段,与Gluc-gAD预期大小一致 (图2B)。
2.3 质粒瞬时转染BHK-21S细胞的免疫荧光检测
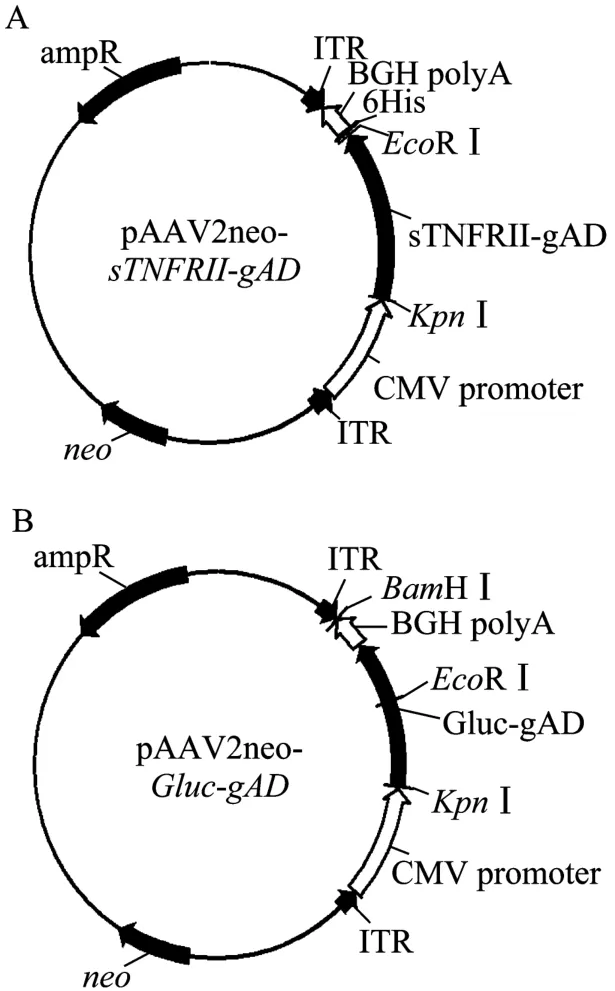
图1 pAAV2neo-sTNFRII-gAD和pAAV2neo-Gluc-gAD质粒结构示意图Fig. 1 Diagrams of recombinant expression vectors pAAV2neosTNFRII-gAD and pAAV2neo-Gluc-gAD. (A) pAAV2neosTNFRII-gAD vector. (B) pAAV2neo-Gluc-gAD vector. ITR: AAV2 inverted terminal repeat; CMV: cytomegalovirus promoter; sTNFRII: soluble TNF receptor II; gAD: globular domain of adiponectin; Gluc: Gaussia luciferase; BGH: bovine growth hormone polyA signal.
重组质粒pAAV2neo-sTNFRII-gAD转染BHK-21S细胞24 h后,分别用抗人脂联素单抗和抗TNFRII单抗进行免疫荧光检测,结果均可观察到BHK-21S细胞的胞浆中有很强绿色荧光 (图 3A,3D),提示融合蛋白sTNFRII-gAD在BHK-21S细胞中实现了表达;pAAV2neo-Gluc-gAD质粒转染 BHK-21S细胞后,用抗 TNFRII单抗检测 (图 3E) 无绿色荧光显示,而用抗脂联素单抗检测 (图 3B) 能够看到围绕细胞核周围的绿色荧光;未转染质粒的阴性对照细胞分别用抗人脂联素单抗和抗 TNFRII单抗检测(图3C,3F) 均未观察到绿色荧光。
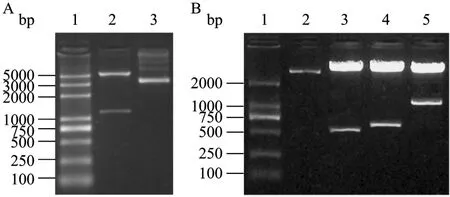
图2 pAAV2neo-sTNFRII-gAD和pAAV2neo-Gluc-gAD质粒的酶切鉴定Fig. 2 Identification of pAAV2neo-sTNFRII-gAD and pAAV2neo-Gluc-gAD by enzyme digestion. (A) 1: DNA marker BM 5000; 2: pAAV2neo-sTNFRII-gAD digested with Kpn I and EcoR I; 3: pAAV2neo-sTNFRII-gAD. (B) 1: DNA marker BM 2000; 2: pAAV2neo-Gluc-gAD; 3: pAAV2neo-Gluc-gAD digested with Kpn I and EcoR I; 4: pAAV2neo-Gluc-gAD digested with BamH I and EcoR I; 5: pAAV2neo-Gluc-gAD digested with Kpn I and BamH I.
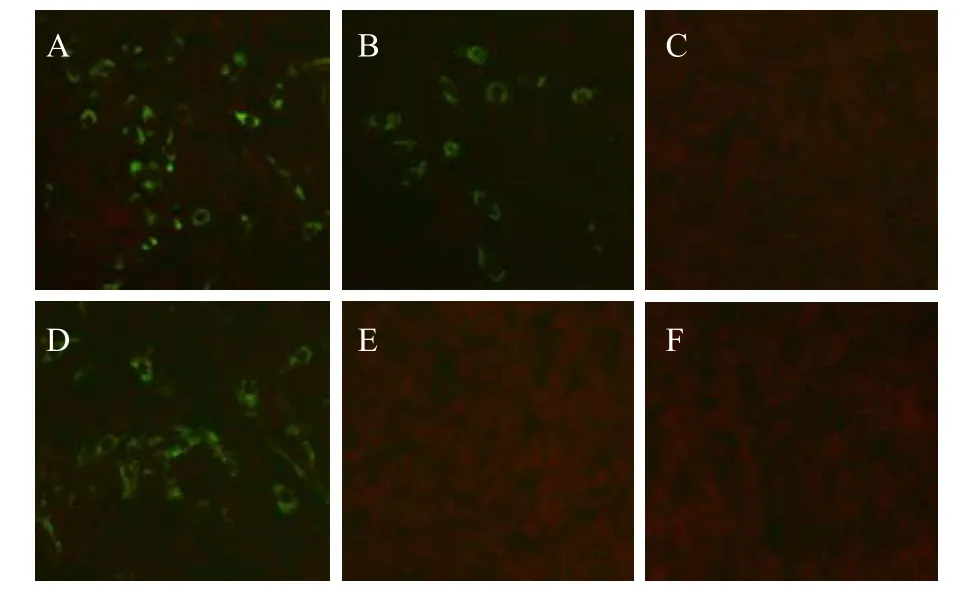
图3 免疫荧光检测 sTNFRII-gAD及 Gluc-gAD在BHK-21S细胞中的表达Fig. 3 Detection of sTNFRII-gAD and Gluc-gAD protein expressed in BHK-21S cells with immunofluorescence staining. (A) pAAV2neo-sTNFRII-gAD detected by monoclonal antibody against adiponectin. (B) pAAV2neo-Gluc-gAD detected by monoclonal antibody against adiponectin. (C) Negative control detected by monoclonal antibody against adiponectin. (D) pAAV2neo-sTNFRII-gAD detected by monoclonal antibody against TNFRII. (E) pAAV2neo-Gluc-gAD detected by monoclonal antibody against TNFRII. (F) Negative control detected by monoclonal antibody against TNFRII.
2.4 Gluc-gAD在上清中表达
pAAV2neo-Gluc-gAD质粒瞬时转染 BHK-21S细胞24 h后,用Gaussia Luciferase检测试剂盒及ModulusTM Luminometer发光检测仪检测上清中的Gluc活性 (图4),结果显示Gluc蛋白在上清中有较高表达;而 pAAV2neo-sTNFRII-gAD转染BHK-21S后的检测数值与新鲜细胞培养液所测数值基本相同。该实验表明Gluc-gAD融合蛋白可以有效表达并分泌到上清中。
2.5 无血清培养上清中sTNFRII-gAD、Gluc-gAD融合蛋白的分泌表达
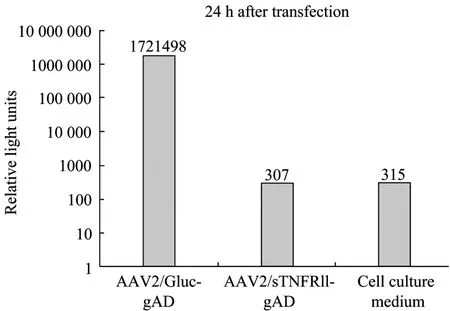
图4 pAAV2neo-Gluc-gAD和pAAV2neo-sTNFRII-gAD转染BHK-21S细胞后上清中Gluc的检测Fig. 4 Detection of Gluc protein in supernatant of BHK-21S cells transfected with pAAV2neo-Gluc-gAD or pAAV2neosTNFRII-gAD.
BHK-21S/pAAV2neo-sTNFRII-gAD无血清悬浮培养24 h后的上清经100 kDa超滤管浓缩20倍后,ELISA检测 sTNFRII-gAD蛋白含量相当于0.28 µg/mL、SDS-PAGE电泳及免疫印迹分析还原状态/非还原状态的 sTNFRII-gAD融合蛋白样品 (图5)。 对于还原状态的样品,用抗人脂联素单抗检测(图 5B) 在约 62 kDa处有特异性条带,比预期的sTNFRII-gAD蛋白分子量 43 kDa要大;而用抗TNFRII的单抗检测 (图5C) 则未见特异性条带。对于非还原状态的样品,浓缩后上清除了在约62 kDa处与脂联素单抗及TNFRII单抗 (分别为图5D,5E)有特异性条带外,在小于但接近175 kDa处和远大于175 kDa处也有特异性条带,提示BHK-21S细胞表达分泌至上清中的sTNFRII-gAD蛋白除单体外,还有三聚体和三聚体以上的多聚体;还原样品的SDS-PAGE用考马斯亮蓝染色结果 (图5A) 显示在约62 kDa处有一条主带,与相同样品经抗人脂联素单抗免疫印迹分析的条带位置一致 (图 5B),且SDS-PAGE中其他杂带非常弱,提示 BHK-21S/ pAAV2neo-sTNFRII-gAD无血清悬浮培养的上清中主要成分是sTNFRII-gAD融合蛋白。
此外,BHK-21S/pAAV2neo-Gluc-gAD无血清悬浮培养 24 h后的上清经100 kDa超滤管浓缩20倍(还原状态) 后进行Western blotting分析,用抗人脂联素单抗检测 (图5F-12) 显示在接近47.5 kDa处有特异性条带,比阳性对照人血清样品所含的脂联素(约30 kDa的分子量,图5F-13) 要大,表明Gluc-gAD融合蛋白也能分泌到培养基上清中。
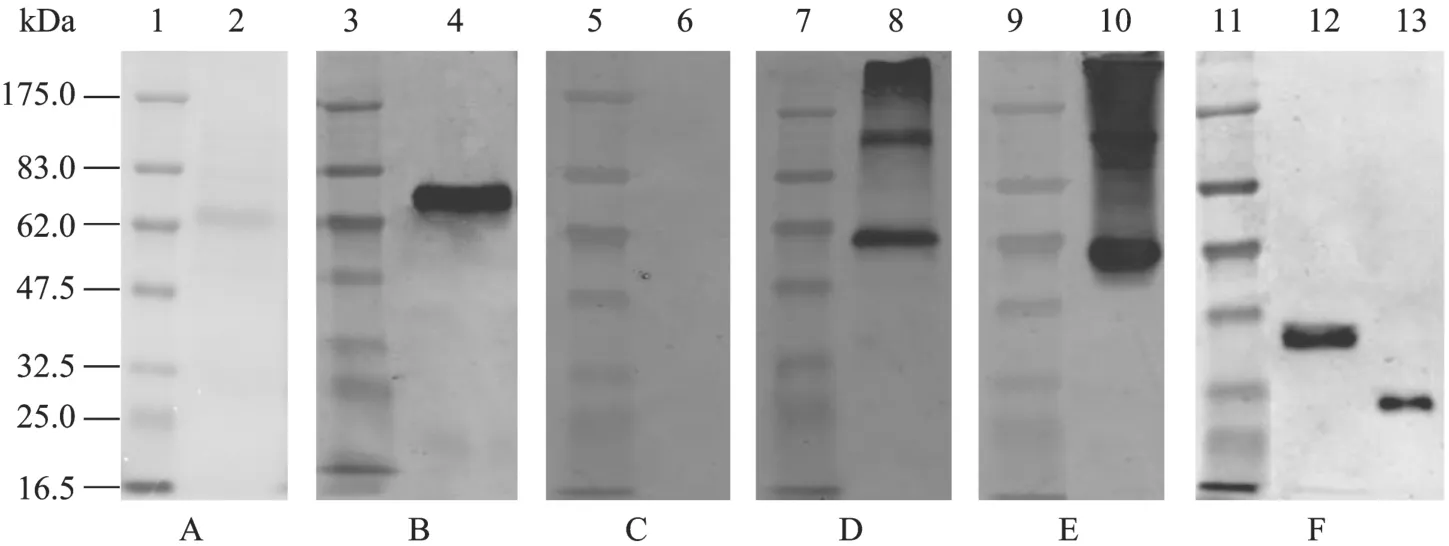
图5 SDS-PAGE及免疫印迹分析鉴定BHK-21S/pAAV2neo-sTNFRII-gAD和BHK-21S/pAAV2neo-Gluc-gAD无血清悬浮培养上清中sTNFRII-gAD融合蛋白和Gluc-gAD融合蛋白的表达 (已浓缩20倍)Fig. 5 SDS-PAGE and Western blotting analysis of sTNFRII-gAD and Gluc-gAD fusion proteins in the supernatants of serum-free cultured BHK-21S/pAAV2neo-sTNFRII-gAD and BHK-21S/pAAV2neo-Gluc-gAD (20-fold concentration). 1,3,5,7,9,11: protein marker; 2: SDS-PAGE of sTNFRII-gAD fusion protein stained with Coomassie blue; 4,6: Western blotting of reduced sTNFRII-gAD fusion protein with monoclonal antibody either against adiponectin or against TNFRII; 8,10: Western blotting of non-reduced sTNFRII-gAD fusion protein with monoclonal antibody either against adiponectin or against TNFRII; 12: Western blotting of reduced Gluc-gAD fusion protein with monoclonal antibody against adiponectin; 13: adiponectin (positive control) in the serum with monoclonal antibody against adiponectin.
2.6 sTNFRII-gAD融合蛋白中和TNFα的生物活性
BHK-21S/pAAV2neo-sTNFRII-gAD和BHK-21S/ pAAV2neo-Gluc-gAD无血清悬浮培养24 h后,收集上清,分别检测它们对TNFα杀伤L929细胞的中和活性。sTNFRII-Fc融合蛋白 (浓度由50 µg/mL开始,4倍比梯度稀释) 在本研究中作为拮抗TNFα的阳性对照。sTNFRII-Fc融合蛋白具有中和TNFα的活性,且其抑制TNFα杀伤L929细胞的活性呈剂量依赖性(图6B);同理,sTNFRII-gAD融合蛋白也能够抑制TNFα对L929细胞的杀伤作用,并与sTNFRII-Fc融合蛋白有类似的梯度曲线 (图 6A)。阴性对照Gluc-gAD融合蛋白无中和TNFα的作用,由此说明对TNFα的中和作用是sTNFRII-gAD融合蛋白所特有的。
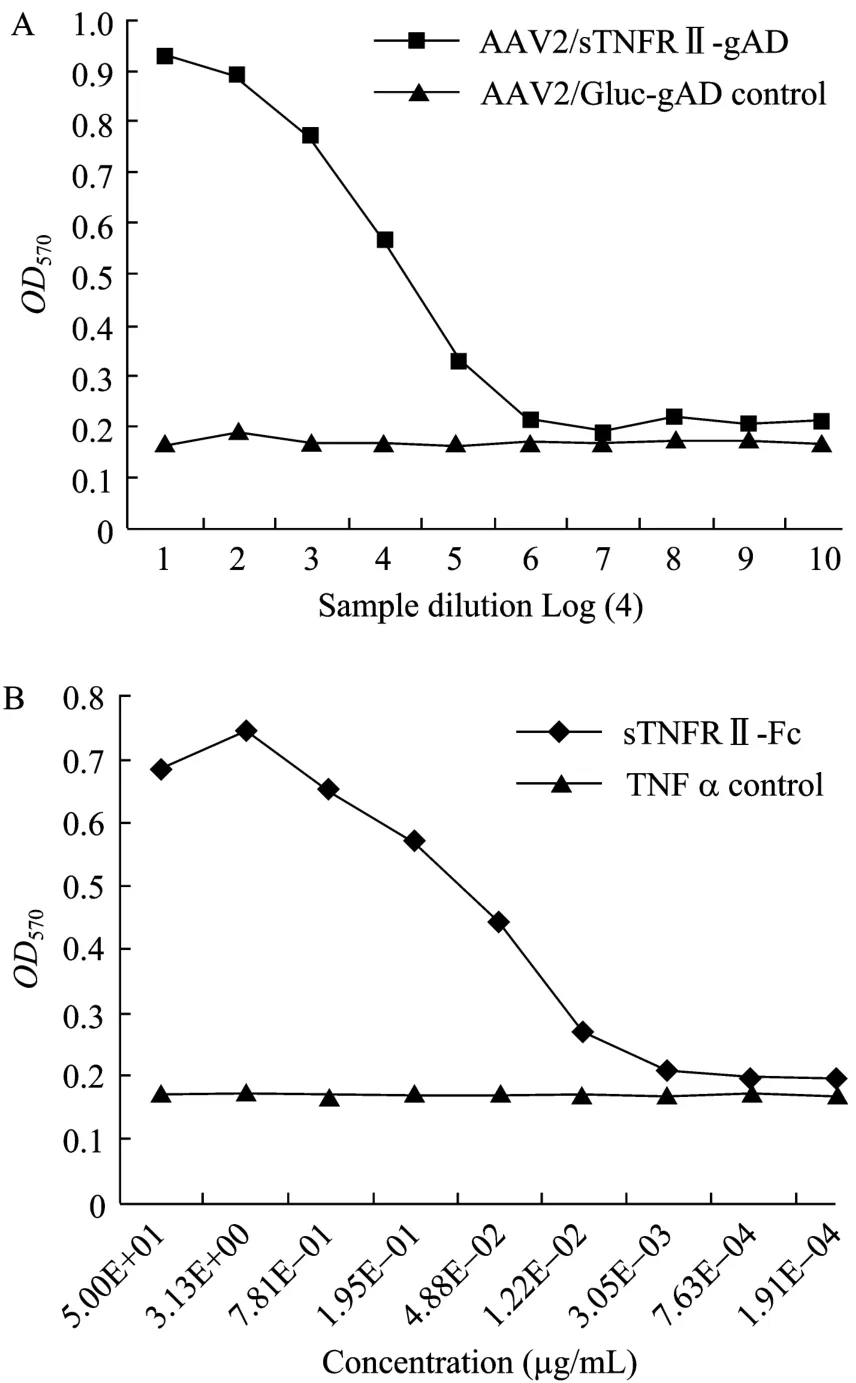
图6 上清中sTNFRII-gAD融合蛋白对TNFα中和活性的检测Fig. 6 TNFα-neutralizing activity of sTNFRII-gAD fusion protein in the supernatant of BHK-21S/pAAV2neo-sTNFRII-gAD serum-free culture.
3 讨论
TNFα是一种重要的生物活性因子,具有抗肿瘤、抗病毒、防止细菌对机体的侵害作用。然而,过多 TNFα的产生和释放则会破坏机体的免疫平衡,导致自身免疫性疾病如类风湿性关节炎等的发生[8]。TNFα主要通过与细胞膜上的特异性受体(TNFR) 结合发挥生物学活性,TNFR有TNFRI和TNFRII两种,其胞外区域均可经剪切脱落成为sTNFR。sTNFR不介导信号的传导,但仍能与TNFα结合,中和TNFα的活性,是TNFα的天然拮抗剂[9]。商品化Etanercept即sTNFRII与IgG的Fc形成的融合蛋白,此融合蛋白不仅延长了受体在体内的半衰期,并且借助于Fc的二聚化作用使融合蛋白形成同源二聚体,相比可溶性的sTNFRII单体更能有效地抑制TNFα的作用,用于治疗类风湿性关节炎,能有效缓解疼痛,防止或明显降低关节结构的破坏,从而改善并维持关节功能。研究表明,成熟的TNFα以三聚体形式存在。因此设想,若sTNFRII能形成同源三聚体,则可能获得更高效的TNFα拮抗剂。
脂联素是近年来发现的脂肪细胞分泌的一种蛋白激素[10-13],血浆中浓度为5~30 µg/mL。脂联素全长由信号肽、一段特异的氨基酸序列、胶原状区域和球状结构域4部分组成。gAD为脂联素在蛋白酶裂解作用下产生,是全长脂联素的羧基端部分。Fruebis等研究报道,gAD能够增强肌肉组织中脂肪酸的氧化,其活性优于全长脂联素[14];Shapiro等通过晶体结构的研究发现,脂联素的球状区域以紧密的同源三聚体形式存在,并且与胶原 8、胶原 9和补体C1q具有相似的结构特征。全长脂联素通过其球状结构可形成紧密的同源三聚体,继而通过其胶原状结构进一步形成更为复杂的同源多聚体,但gAD的三聚体是脂联素的基本结构形式。
本研究拟借 gAD能自发形成同源三聚体的特性,以实现sTNFRII的同源三聚体化,从而获得一种TNFα新型拮抗剂——sTNFRII-gAD融合蛋白。
首先构建了sTNFRII-gAD融合基因,同时还构建了分泌型 Gluc-gAD融合基因作为对照。Gluc为Gaussia荧光素酶(Gaussia luciferase),是海洋桡角类生物Gaussia princeps来源的蛋白,具有高分泌、易检测等优点,是一种新型的荧光素报告基因[15]。本实验构建的sTNFRII-gAD和Gluc-gAD融合基因分别采用了 sTNFRII和 Gluc基因天然的信号肽。将pAAV2neo-sTNFRII-gAD和pAAV2neo-Gluc- gAD重组表达载体分别瞬时转染 BHK-21S细胞,用抗TNFRII或抗gAD的单克隆抗体进行免疫荧光检测分析:pAAV2neo-sTNFRII-gAD转染细胞用上述两种抗体均检测到了阳性信号,而 pAAV2neo-GlucgAD转染细胞仅用抗gAD的单克隆抗体可检测到绿色免疫荧光;在pAAV2neo-Gluc-gAD转染细胞的上清中可检测到很高的 Gluc酶活性。这些结果表明sTNFRII-gAD融合蛋白和 Gluc-gAD融合蛋白在BHK-21S细胞中分别获得了有效表达;且Gluc-gAD融合蛋白能有效地分泌到上清中。
在此基础上,通过 G418筛选获得稳定表达sTNFRII-gAD融合蛋白和Gluc-gAD融合蛋白的细胞株。采用的表达载体pAAV2neo与常用的真核表达载体如pcDNA3.1不同之处在于:pAAV2neo中携带了腺相关病毒 (Adeno-associated virus,AAV) 来源的2个ITR序列,使得表达载体转染细胞后在加G418选择培养时更容易形成稳定表达的细胞株。
为了便于以后大量制备 sTNFRII-gAD融合蛋白,在获得稳定表达细胞株以后,将培养液由原来含10%胎牛血清的DMEM换成化学成分限定的无血清、无蛋白、无肽的培养液LK021 (北京五加和分子医学研究所有限公司)。所采用的 BHK-21S细胞在更换培养液后细胞由原来的贴壁培养方式直接变成了悬浮培养方式,期间不需要再次驯化。收集BHK-21S/pAAV2neo-sTNFRII-gAD细胞无血清悬浮培养24 h后的上清并经100 kDa膜包浓缩20倍后,SDS-PAGE考马斯亮蓝染色显示只有一条主带,与抗脂联素单抗免疫印迹检测到的特异性条带位置相同,而其他位置的蛋白条带染色很浅,提示无血清培养后的细胞分泌到上清中的sTNFRII-gAD融合蛋白较纯,十分有利于以后的纯化。
对BHK-21S/pAAV2neo-sTNFRII-gAD无血清悬浮培养24 h后的上清经100 kDa膜包浓缩20倍后,进行SDS-PAGE及免疫印迹分析发现,含有DTT的还原样品用抗 TNFRII单抗未检测的特异性蛋白条带,而相应的非还原样品则有特异性蛋白条带。这可能是由于采用的抗 TNFRII的单抗只能识别sTNFRII的空间表位 (而不是线性表位) 所致。用抗脂联素的单抗进行免疫印迹检测,则无论是还原样品还是非还原样品均检测到特异性蛋白条带,说明所用的抗脂联素单抗识别的是gAD线性表位。此外,用抗 TNFRII单抗和抗脂联素单抗,在非还原的sTNFRII-gAD融合蛋白样品中,除单体 (62 kDa) 的特异性蛋白条带外,均可检测到在接近175 kDa处和远大于175 kDa处有特异性蛋白条带,提示所表达的sTNFRII-gAD融合蛋白以单体、三聚体和三聚体以上的多聚体形式存在。
为了验证 sTNFRII-gAD融合蛋白中起中和TNFα作用的只是N端的sTNFRII,在活性测定时以pAAV2neo-Gluc-gAD融合蛋白作为阴性对照,以sTNFRII-Fc融合蛋白作为阳性对照。活性测定结果表明,sTNFRII-gAD融合蛋白具有中和TNFα的活性,并与sTNFRII-Fc融合蛋白有类似的梯度曲线,而阴性对照Gluc-gAD融合蛋白则无拮抗TNFα的活性。
本研究设计并构建了一种 TNFα新型拮抗剂——sTNFRII-gAD融合蛋白,建立了无血清悬浮培养的BHK-21S细胞表达系统,在细胞上清中检测到了sTNFRII-gAD融合蛋白的表达且该融合蛋白以单体、三聚体和三聚体以上的多聚体形式存在,并证实了上清中的 sTNFRIIgAD融合蛋白具有中和TNFα的活性。因此,本研究为下一步大量制备sTNFRII-gAD融合蛋白,以便进一步研究该融合蛋白的单体、三聚体和三聚体以上多聚体及其相应的生物功能打下了良好的基础。
[1] Taylor PC, Williams RO, Feldmann M. Tumour necrosis factor alpha as a therapeutic target for immune-mediated inflammatory diseases. Curr Opin Biotechnol, 2004, 15(6): 557−563.
[2] Tracey D, Klareskog L, Sasso EH, et al. Tumor necrosis factor antagonist mechanisms of action: a comprehensive review. Pharmacol Ther, 2008, 117(2): 244−279.
[3] Mohler KM, Torrance DS, Smith CA, et al. Soluble tumor necrosis factor (TNF) receptors are effective therapeutic agents in lethal endotoxemia and function simultaneously as both TNF carriers and TNF antagonists. J Immunol, 1993, 151(3): 1548−1561.
[4] Smith RA, Baglioni C. The active form of tumor necrosis factor is a trimer. J Biol Chem, 1987, 562(15): 6951−6954. [5] Jones EY, Stuart DI, Walker NP. Structure of tumour necrosis factor. Nature, 1989, 338(6212): 225−228.
[6] Shapiro L, Scherer PE. The crystal structure of a complement-1q family protein suggests an evolutionary link to tumor necrosis factor. Curr Biol, 1998, 8(6): 335−338.
[7] Zhang Y, Gao K, Han CM, et al. Study on methods and requirements for quality control of recombinant human tumor necrosis factor receptor Fc fusion protein. Acta Pharm Sin, 2003, 38(3): 165−168.张翊, 高凯, 韩春梅, 等. 重组人肿瘤坏死因子受体-Fc融合蛋白质控方法和标准的研究. 药学学报, 2003, 38(3): 165−168.
[8] Keffer J, Probert L, Cazlaris H, et al. Transgenic mice expressing human tumour necrosis factor: a predictive genetic model of arthritis. EMBO J, 1991, 10(13): 4025−4031.
[9] Fernandez-Botran R. Soluble cytokine receptors: novel immunotherapeutic agents. Expert Opin Investig Drugs, 2000, 9(3): 497−514.
[10] Scherer PE, Williams S, Fogliano M, et al. A novel serum protein similar to C1q, produced exclusively in adipocytes. J Biol Chem, 1995, 270(45): 26746−26749.
[11] Nakano Y, Tobe T, Choi-Miura NH, et al. Isolation and characterization of GBP28, a novel gelatin-binding protein purified from human plasma. J Biochem, 1996, 120(4): 803−812.
[12] Hu E, Liang P, Spiegelman BM. AdipoQ is a novel adipose-specific gene dysregulated in obesity. J Biol Chem, 1996, 271(18): 10697−10703.
[13] Maeda K, Okubo K, Shimomura J, et al. cDNA cloning and expression of a novel adipose specific collagen-like factor, apM1 (AdiPose Most abundant Gene transcript 1). Biochem Biophys Res Commun, 1996, 221(2): 286−289.
[14] Fruebis J, Tsao TS, Javorschi S, et al. Proteolytic cleavage product of 30 kDa adipocyte complement-related protein increases fatty acid oxidation in muscle and causes weight loss in mice. Proc Natl Acad Sci USA, 2001, 98(4): 2005−2010.
[15] Tannous BA, Kim DE, Fernandez JL, et al. Codonoptimized Gaussia luciferase cDNA for mammalian gene expression in culture and in vivo. Mol Ther, 2005, 11(3): 435−443.
