酪丁酸梭菌代谢工程菌的构建及其发酵特性
2010-10-16杨贵清刘刚杨长得
杨贵清,刘刚,杨长得
1 深圳大学生命科学学院 深圳市微生物基因工程重点实验室,深圳 518060 2 深圳市罗湖疾病预防控制中心,深圳 518020
酪丁酸梭菌代谢工程菌的构建及其发酵特性
杨贵清1,2,刘刚1,杨长得1
1 深圳大学生命科学学院 深圳市微生物基因工程重点实验室,深圳 518060 2 深圳市罗湖疾病预防控制中心,深圳 518020
酪丁酸梭菌Clostridium tyrobutyricum可以利用葡萄糖、木糖、纤维二糖、阿拉伯糖等多种底物进行产酸发酵,主要发酵产物为丁酸和乙酸,是一种适合于木质纤维素同步糖化发酵生产丁酸的菌种。将酪丁酸梭菌乙酸发酵关键基因取代为丁酸发酵关键基因来构建突变株,可使突变株丁酸发酵量增多,乙酸发酵量减少。分别获得来源于丙酮丁醇梭菌的丁酸代谢关键酶基因——乙酰乙酰辅酶A转移酶基因(thl)、来源于酪丁酸梭菌本身的乙酸代谢关键酶基因片段——磷酸转乙酰基酶基因片段(pta)和来源于质粒pIMP1的红霉素抗性基因(em)。将它们与质粒pUC19相连构建为非复制性质粒pUC19-EPT。通过电转化将其导入酪丁酸梭菌中。利用红霉素抗性平板筛选获得转化子,通过PCR验证发现,获得的突变株染色体上pta被thl替换。在以葡萄糖为底物的发酵中,突变株丁酸得率为0.47,较野生型增大了34%,乙酸得率为0.05,较野生型下降了29%。
酪丁酸梭菌,丁酸,乙酰乙酰辅酶A转移酶,磷酸转乙酰基酶,代谢工程
Abstract:Clostridium tyrobutyricum is suitable for simultaneous saccharification and fermentation of lignocellulosic.It can produce butyric acid, acetic acid as its main fermentation products from a wide variety of carbohydrates such as glucose, xylose,cellobiose and arabinose.In order to decrease acetic acid content and increase butyric acid content in C.tyrobutyricum, we replaced genes on the acetic acid fermentation pathway with genes on the butyric acid fermentation pathway.Three genes were selected.They were acetyl-CoA acetylrtansfers gene(thl)which is the key enzyme gene associated with acetic acid fermentation pathway from Clostridium acetobutylicum, erythromycin gene(em)from plasmid pIMP1 and phosphotransacetylase gene(pta)which is the key enzyme gene associated with butyric acid fermentation pathway from C.tyrobutyricum.We fused these genes with pUC19 to construct nonreplicative integrated plasmids pUC19-EPT.Then we transformed pUC19-EPT into C.tyrobutyricum through electroporation.The recombinant transformants grown on plates containing erythromycin were validated by PCR.A mutant whose pta gene was displaced by thl gene on the chromosome was selected.In the fermentation from glucose, the mutant’s yield of butyric acid is 0.47, increased by 34% compared with wild type; and the yield of acetic acid is 0.05, decreased by 29%compared with wild type.
Keywords:Clostridium tyrobutyricum, butyric acid, acetyl coenzyme A acetyltransferase, phosphotransacetylase, metabolic engineering
正丁酸(分子式CH3(CH2)2COOH,以下简称为丁酸)是一种用途广泛的化工原料和医药原料,可以用于各类丁酸酯类、丁酸纤维、清漆、香料等的生产制造,也可以用作乳化剂、杀菌剂和萃取剂[1],还可作为组蛋白去乙酰化酶的抑制剂抑制多种肿瘤细胞的增殖,诱导肿瘤细胞分化、衰老和调亡[2-4]。当前,丁酸工业化生产属于石油加工行业,随着石油资源的快速消耗,通过石油加工获得丁酸必将受到原料来源的限制。通过微生物发酵生产丁酸的传统原料是富含淀粉的粮食,随着全球可耕地的减少和人口的增长,全球范围内的粮食短缺问题将不可避免,将来利用粮食作为原料发酵生产丁酸的规模必然受到限制。在这种情况下,利用木质纤维素为原料发酵生产丁酸将是可能的解决途径。
梭菌中酸产物的代谢途径已经得到了较广泛的研究,例如丙酮丁醇梭菌Clostridium acetobutylicum和酪丁酸梭菌Clostridium tyrobutyricum[5-7]。乙酰辅酶A(Acetyl-CoA)是乙酸途径和丁酸途径的分支点,它在磷酸转乙酰基酶的催化下形成磷酸乙酰开始乙酸代谢,在乙酰乙酰CoA转移酶的催化下形成乙酰乙酰CoA开始丁酸代谢。研究也表明[7],在酪丁酸梭菌发酵中,没有乙醇、丁醇等醇类物质出现。其代谢途径见图1。
酪丁酸梭菌是主要的丁酸发酵菌之一,研究表明酪丁酸梭菌可以利用纤维二糖、木糖、阿拉伯糖等多种碳源进行发酵[8-9],解决了木质纤维素同步糖化发酵中存在的五碳糖利用不足问题,特别适合于进行木质纤维素的同步糖化发酵。然而,酪丁酸梭菌的发酵产物不单一,除丁酸外还产生部分乙酸,杂酸的产生有可能降低整个发酵过程的效率。敲除突变可使宿主染色体中不受欢迎的基因失活,已经成功地应用于构建梭菌属代谢工程突变菌[10-11]。同样的代谢工程方法也能在酪丁酸菌中用于减少或消除乙酸产物[12-13]。
本实验构建了非复制性重组质粒转入酪丁酸梭菌,对其进行遗传改造,敲除其乙酸代谢关键酶基因pta,取代上来自丙酮丁醇梭菌丁酸代谢关键酶基因thl,获得的酪丁酸梭菌代谢工程菌发酵产物丁酸得率提高,且产物较单一,为丁酸的工业化生产以及利用木质纤维素同步糖化发酵生产丁酸提供了新的技术支撑,具有较主要的社会、经济意义。
1 材料和方法
1.1 菌株和质粒
表 1列举了本研究所用到的菌株、质粒的来源及特点。野生株为酪丁酸菌ATCC 25755,在厌氧室中用加强型梭菌培养基(RCM)培养传代,液体培养置于梭菌生长培养基(CGM)中,37℃、厌氧环境中培养[14]。在筛选突变株时,这些培养基中都加入了 50 µg/mL 的红霉素(Erythromycin)。
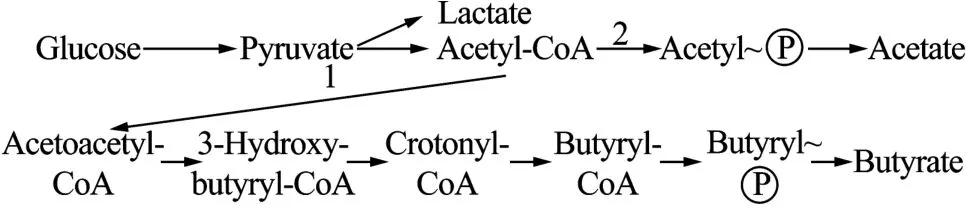
图1 酪丁酸梭菌的代谢途径Fig.1 Metabolic pathway of C.tyrobutyricum.1: acetyl-CoA acetyltransferase(thl gene); 2: phosphotransacetylase(pta gene).
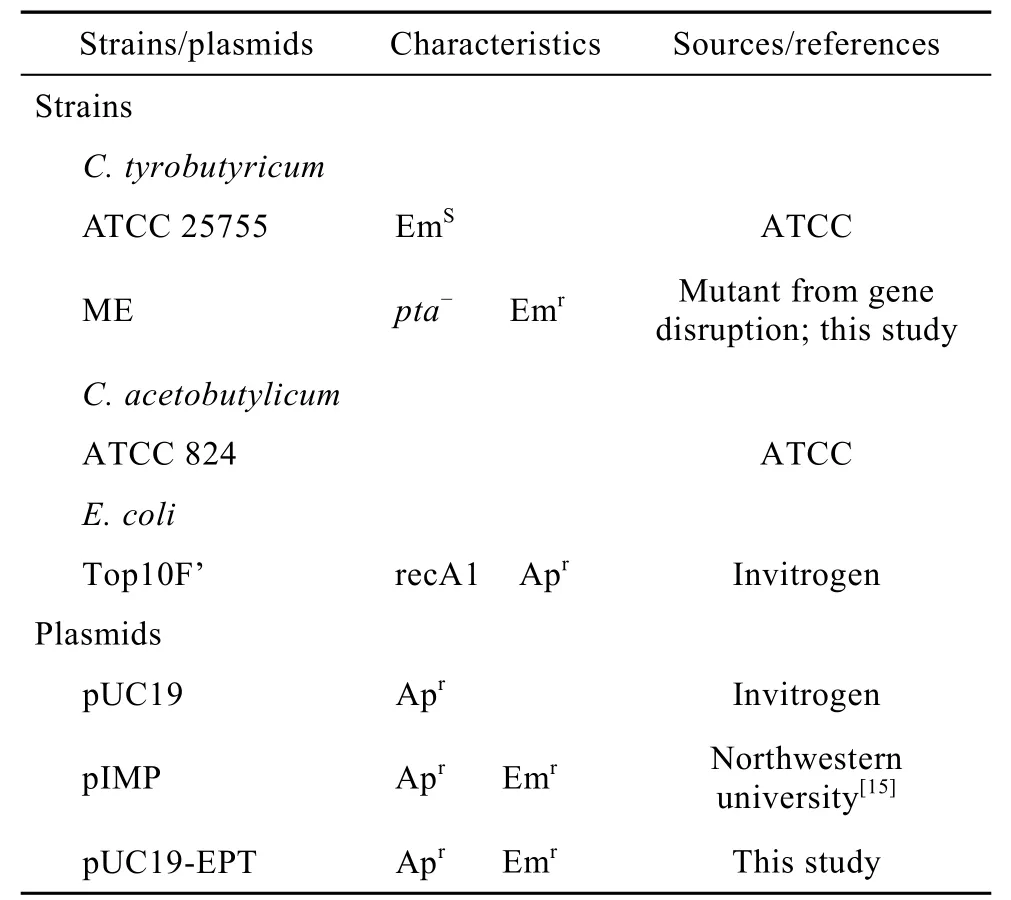
表1 菌株和质粒Table 1 Bacterial strains and plasmids
1.2 酪丁酸梭菌生长与发酵分析
挑取酪丁酸梭菌单菌落置于CGM液体培养基,于37℃厌氧箱中静置培养24 h后,按5%的接种量转接于新鲜的CGM液体培养基中,于37℃厌氧箱中静置培养,每隔4 h左右取样,记录菌的生长情况、发酵液中残余葡萄糖含量以及发酵产物中有机酸含量。为确保实验数据准确可靠,每次发酵均进行平行实验,具体做法为:分别挑取 3个单菌落于等体积CGM液体培养基培养24 h制备种子培养液,再各按 5%的接种量将种子培养液转接于 10份等体积新鲜的CGM液体培养基培养,以平均数据作图。
生长情况用600 nm下菌液吸光值表示,发酵液中残余葡萄糖含量通过 3,5-二硝基水杨酸(DNS)比色法测定,有机酸含量采用气相色谱分析。发酵结束后计算有机酸得率,其得率定义为发酵过程中每消耗 1 g葡萄糖生成的有机酸量。气相色谱分析发酵产物方法如下:
色谱型号为 TRACE GC;色谱柱为:Agilent DB-624毛细管柱,30 m×0.32 mm;进样口为:S/SL型;检测器为FID检测器;载气为:N2。炉温程序:初始温度 40℃,2 min;10℃/min升温;最终温度210℃,2 min。FID 温度:220℃。载气恒流:1.5 mL/s。载气N2流速为30 mL/min,氢气流速为35 mL/min,空气流速为350 mL/min;进样器:自动进样,不分流,进样量为0.5 µL。
1.3 基因替换载体的构建
1.3.1 基因的分离
以酪丁酸梭菌基因组 DNA为模板,PCR扩增与乙酸代谢途径关键酶——磷酸转乙酰基酶基因片段pta;以丙酮丁醇梭菌基因组DNA为模板,PCR扩增与丁酸代谢途径关键酶——乙酰乙酰CoA转移酶基因thl;以pIMP1为模板,PCR扩增红霉素基因em。将获得的各基因片段连接T载体,构建成T-pta、T-thl、T-em载体,送英骏公司测序验证。本研究所用引物序列见表2。
1.3.2 pUC19-EPT的构建
首先用EcoRⅠ和XbaⅠ双酶切重组载体T-pta,回收约610 bp的DNA片段,纯化连接到经同样处理的pUC19载体,构建成pUC19P;接着用SalⅠ和SphⅠ双酶切重组载体T-thl,回收大小约1880 bp的DNA片段,纯化后连接经同样处理的pUC19P载体,构建成pUC19PT;最后分别用Sph I和Aat Ⅱ分步单酶切重组载体T-em,回收大小约1000 bp的DNA片段,纯化后连接经同样处理的pUC19PT载体,构建成pUC19-EPT。质粒物理图谱如图2。
1.4 酪丁酸梭菌的电转
将酪丁酸梭菌接种于含 40 mmol/L DL-苏氨酸的CGM培养基中,待其生长至OD ≈1.2时收集细胞。先用预先冰冷的无菌水洗涤2次,再用预冰冷的SMP电转缓冲液(蔗糖 270 mmol/L,MgCl21 mmol/L,Na3PO47 mmol/L,pH 6.0)洗涤2次后,将细胞悬浮于预冰冷的电转缓冲液中。将处理好的细胞悬浮液放入预冰冷的直径为4 mm的电转杯中,冰上放置4~5 min后加入25 µg非复制性质粒pUC19-EPT进行脉冲刺激(2500 V)。电击后将转化细胞转入大概5 mL的CGM(不带抗性)中37℃温孵2~4 h,然后低速(约4000~6000 r/min)离心使细胞沉降,弃上清,留200 µL左右涂板(带Em+50 µg/mL的 RCM固体培养基)。
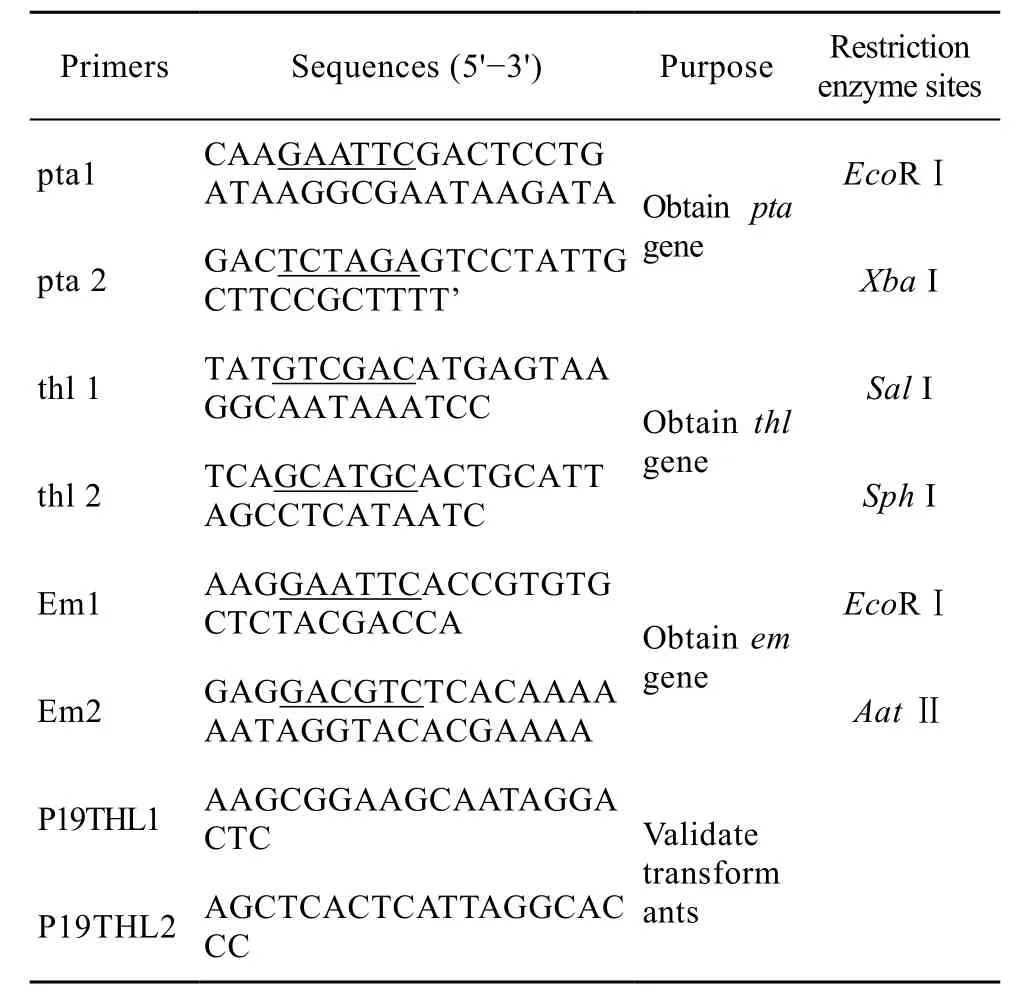
表2 本研究所用引物Table 2 Primers used in this study
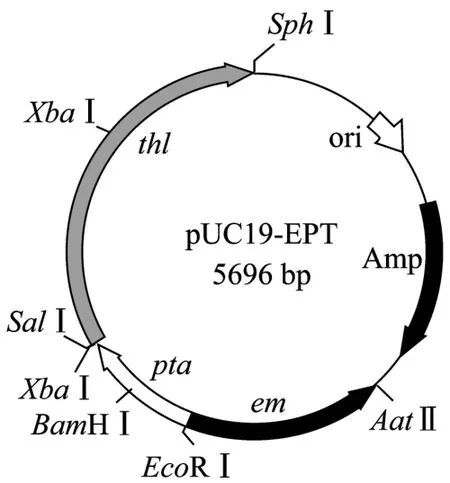
图2 非复制性质粒pUC19-EPT的物理图谱Fig.2 Physical map of nonreplicative integrational plasmids pUC19-EPT.The directions of each gene are shown by arrows;pta: the middle sequence of pta gene; thl: the full thl gene; amp:ampicillin resistance gene; em: erythromycin resistance gene;ori: the origin of replication in E.coli.
1.5 重组酪丁酸梭菌的筛选与鉴定
目标菌应是在染色体上整合了来自丙酮丁醇梭菌的thl基因,且原染色体上pta基因失活的重组菌株。因此,在筛选鉴定时,根据野生型酪丁酸梭菌无红霉素抗性,利用重组质粒与酪丁酸梭菌染色体发生同源重组时,重组质粒上附带的红霉素抗性基因整合在染色体上使重组酪丁酸梭菌带上红霉素抗性基因来进行初筛。然后提取所获得的转化子的基因组DNA,进行相关PCR验证。
1.6 重组酪丁酸梭菌的生理特性分析
重组酪丁酸梭菌生理特性分析主要包括3个方面,即其生长情况、底物利用情况和发酵情况,具体的分析方法与野生型酪丁酸梭菌分析方法相同。
2 结果与讨论
2.1 酪丁酸梭菌生长与发酵分析
以葡萄糖为唯一碳源,于厌氧培养箱中37℃静置培养酪丁酸梭菌,分析不同时相菌生长情况、底物利用情况以及发酵情况。结果见图3。
结果表明,有机酸的发酵开始于对数生长期的后半段,在稳定期开始大幅度生产,在稳定期后期达到最大,发酵到50 h左右,发酵产物几乎没有增加。丁酸最大发酵量约为(5±0.09)g/L,乙酸约为(1±0.07)g/L。结合同期底物消耗,计算得出:酪丁酸梭菌发酵结束后,丁酸得率为(0.35±0.02)g/g,乙酸得率为(0.07±0.004)g/g。另外由于发酵产物主要是有机酸,酸的积累使pH值下降,菌体生长受到抑制,从而导致残糖含量较高,底物得不到完全利用。当在发酵培养基中加入 1%固体碳酸钙来中和发酵过程产生的有机酸时,发现糖的利用和发酵产物量都有一定提高(图4)。发酵结束后,发酵液中并无葡萄糖残余,此时丁酸的产量约为(6.56±0.1)g/L,乙酸的产量约为(1.34±0.06)g/L,丁酸得率(0.33±0.03)g/g,乙酸得率(0.07±0.005)g/g。
综合比较说明,野生型酪丁酸梭菌在含 2%葡萄糖的 CGM 培养基中主要发酵产物只有丁酸和乙酸,无醇类,就发酵产物得率来看,酪丁酸梭菌是一种优良的丁酸发酵菌。采用固体碳酸钙来中和发酵过程产生的有机酸虽然有利于底物的充分利用,但由于少量丁酸和碳酸钙生成固体络合物,使丁酸得率有所下降,不能很好地反应丁酸的实际得率,因此后续发酵培养基中均未添加碳酸钙成份。
2.2 基因替换载体pUC19-EPT的构建与验证
分别提取酪丁酸梭菌和丙酮丁醇梭菌基因组DNA以及质粒PIMP1,并以酪丁酸梭菌基因组DNA为模板,设计相应引物,通过PCR扩增目的基因片段pta,使pta上游含EcoRⅠ位点,下游含XbaⅠ位点;以丙酮丁醇梭菌基因组DNA为模板,设计相应引物,通过 PCR扩增目的基因 thl,使 thl 上游含SalⅠ位点,下游含SphⅠ位点;以质粒PIMP1为模板,设计相应引物,通过PCR扩增目的基因em1使em1上游含 EcoRⅠ位点,下游含AatⅡ位点。测序证实所获得片段的正确性。
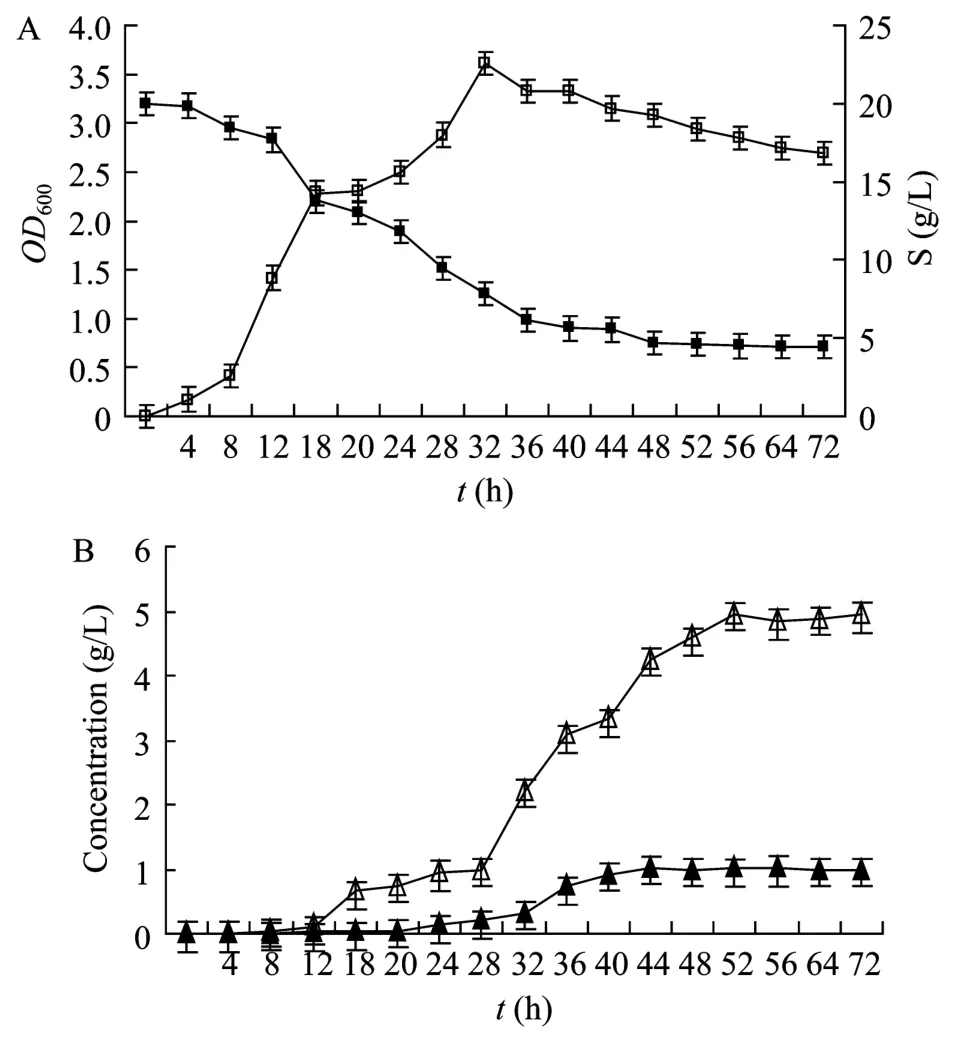
图3 酪丁酸梭菌在CGM培养基中的发酵情况Fig.3 Fermentation of C.tyrobutyricum in CGM.(A)Growth and substrate consumption of C.tyrobutyricum.(B)Application of fermentation production of C.tyrobutyricum.□: growth curve; ■: substrate consumption curve; △: butyric acid; ▲:acetic acid.
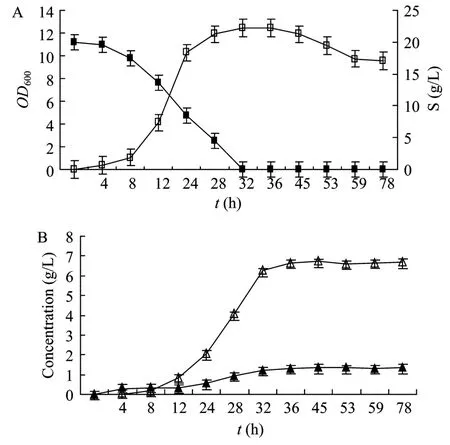
图4 酪丁酸梭菌在CGM-CaCO3培养基中的发酵情况Fig.4 Fermentations of C.tyrobutyricum in CGM-CaCO3.(A)Growth and substrate consumption of C.tyrobutyricum.(B)Application of fermentation production of C.tyrobutyricum.□:growth curve; ■: substrate consumption curve; △ : butyric acid;▲: acetic acid.
对基因片段 pta进行 EcoRⅠ、XbaⅠ双酶切处理,纯化后与经同样处理的pUC19相连,构建为重组质粒 pUC19P;然后对基因片段 thl进行 SalⅠ、SphⅠ双酶切,纯化后与经同样处理的pUC19P相连,构建为重组质粒 pUC19PT;对基因片段 em进行EcoRⅠ、AatⅡ分步单切处理,纯化后与经同样处理的pUC19PT相连,构建为重组质粒pUC19-EPT。
提取重组质粒pUC19-EPT,以其为模板,用相应引物对进行PCR扩增,PCR产物经1%琼脂糖凝胶电泳分离。pta基因片段的PCR产物约为600 bp,thl约为1880 bp,em约为1000 bp,与预期的大小一致(图5)。测序证明其序列正确。
2.3 重组菌株的筛选与鉴定
从红霉素抗性平板上挑出单克隆到 CGM Em+进行液体培养,提重组菌的基因组DNA。以基因组DNA为模板,根据质粒pUC19-EPT中thl基因两翼设计引物进行PCR扩增,获得大小为2 kb的片段(图6)。对PCR产物进行测序证明,2 kb大小片段中包含完整的thl基因(1880 bp)。说明thl基因随pta片段与染色体同源区域发生重组而整合到染色体上,其重组方式为单交换(图7)。将该转化子命名为酪丁酸梭菌ME。
2.4 重组菌的生理生化分析
将重组菌与野生型同时按 5%的接种量接种于含2%的葡萄糖的CGM中,厌氧摇瓶培养,定期取样,检测同时相的菌的生长、发酵液残糖含量和发酵产物含量。结果见图8。
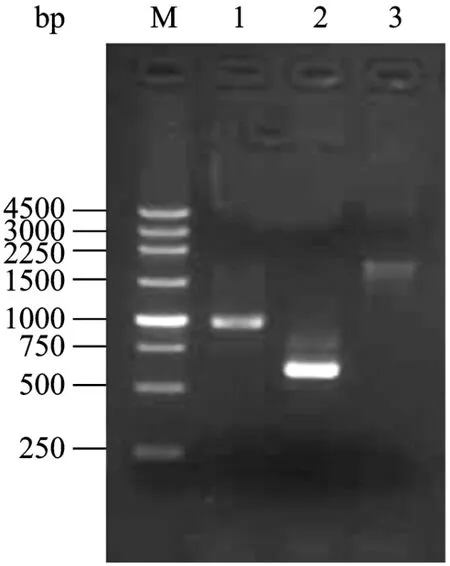
图5 重组质粒pUC19-EPT的PCR验证Fig.5 Identification of recombinational plasmid pUC19-EPT by PCR.M: DNA marker; 1–3: PCR products of plasmid pUC19-EPT; 1: em; 2: pta; 3: thl.
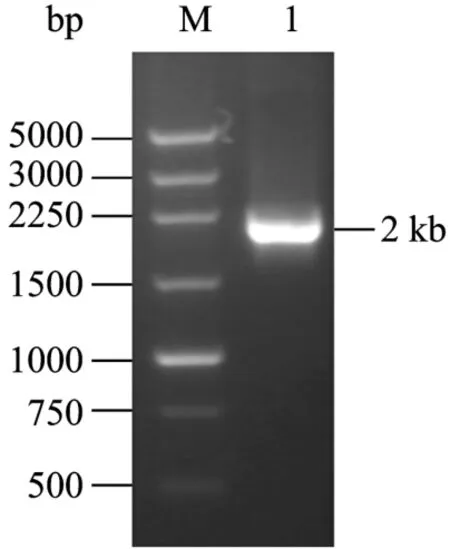
图6 pUC19-EPT电转获得的转化子验证Fig.6 Identification of the transformant obtained by transfer pUC19-EPT into C.tyrobutyricum through electroporation.M:DNA marker; 1: PCR products.
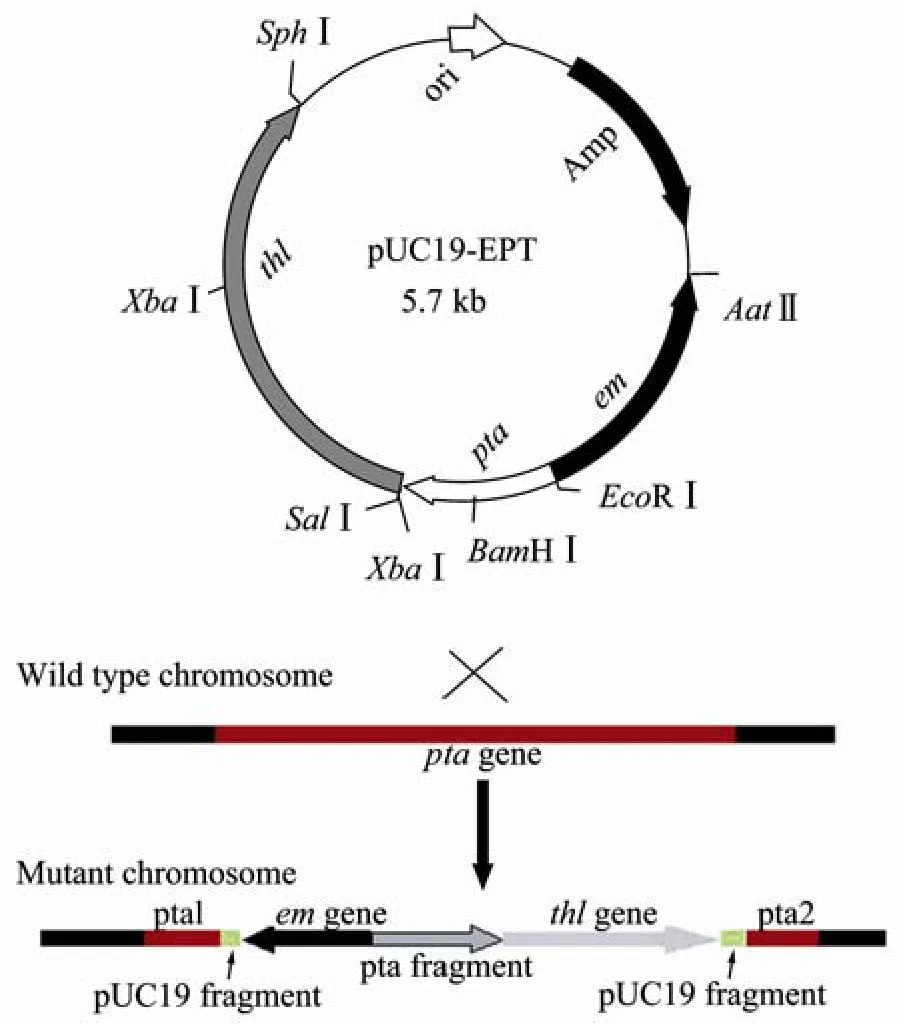
图7 pUC19-EPT转入酪丁酸梭菌发生的单交换Fig.7 Single crossover of plasmid pUC19-EPT containing pta gene with the chromosome.
结果表明,与野生菌相比,重组菌进入对数生长期、稳定期的时间与野生菌类似,但由于丁酸产率提高其生长更快进入衰亡期;丁酸、乙酸等发酵产物均是在对数生长期后期开始出现,稳定期开始大量生成,丁酸发酵量均是在40 h左右停止增加,乙酸发酵量在50 h左右停止增加。在发酵终液中,野生菌、重组菌丁酸发酵量分别为:(4.7±0.31)g/L、(5.8±0.17)g/L,丁酸得率分别为:(0.352±0.013)g/g、(0.471±0.021)g/g;乙酸发酵量分别为:(0.97±0.08)g/L、(0.63±0.06)g/L,乙酸得率分别为:(0.072±0.003)g/g、(0.051±0.004)g/g。重组菌与野生型相比,丁酸得率增长34%,乙酸得率下降29%。同时比较野生菌摇瓶发酵与野生菌静置培养,结果发现摇瓶发酵菌的生长较迅猛,使发酵丁酸速度加快,导致pH值下降更快,最终丁酸发酵量有所下降。
本研究在Zhu等[13]的研究基础上,用丁酸关键酶基因thl取代了乙酸关键酶基因pta,使发酵产物中丁酸得率进一步提高,而乙酸得率下降(表3)。说明以thl基因取代pta基因,使细胞在关闭磷酸转乙酰基酶的表达的同时提高了乙酰乙酰辅酶A转移酶的表达量,从而使更多的底物流向丁酸发酵。另外乙酸发酵并未完全停止也表明细胞乙酸代谢途径并非仅通过磷酸转乙酰基酶催化一条途径。
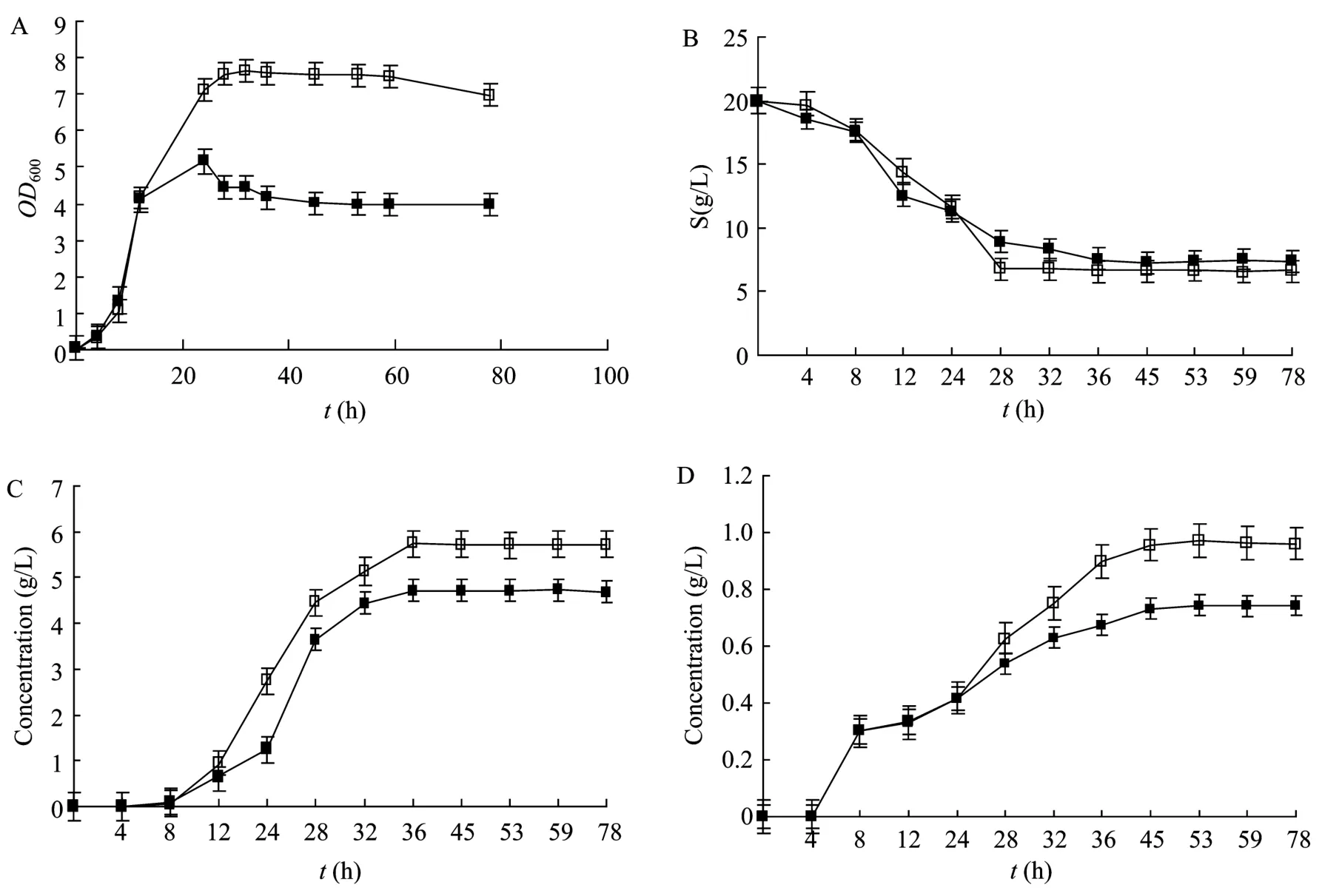
图8 野生型酪丁酸梭菌与重组菌的发酵情况Fig.8 Fermentations of wild type and recombination C.tyrobutyricum.(A)Growth curves of wild type and recombination C.tyrobutyricum.(B)Utilization of carbon sources by wild type and recombination C.tyrobutyricum.(C)Butyric acid output of wild type and recombination C.tyrobutyricum.(D)Acetic acid output of wild type and recombination C.tyrobutyricum.□: wild type;■: ME.
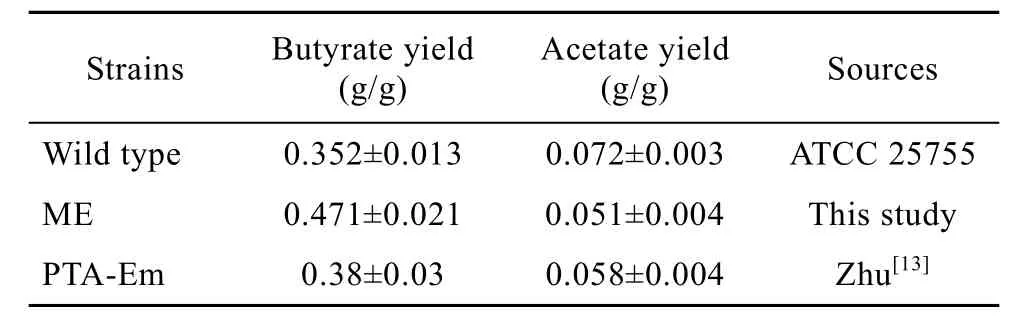
表3 不同菌株有机酸得率的比较Table 3 Comparison of organic acid yield from different strains
3 结论
作为重要的化工原料,全世界对丁酸的需求量非常大,2006年全球丁酸产量达到30 000吨,依然供不应求[1]。而石油资源匮乏进一步导致丁酸生产跟不上需求,利用生物发酵木质纤维素生产丁酸将是可能的解决途径。
酪丁酸梭菌可以利用葡萄糖、木糖、纤维二糖、阿拉伯糖等多种底物进行产酸发酵,这在一定程度上解决了木质纤维素同步糖化发酵过程中五碳糖利用不充分的问题。但酪丁酸梭菌发酵过程也因副产物乙酸的出现而减少丁酸产量提高了产品纯化费用。
本工作分析了酪丁酸梭菌生理生化特点,并在这个基础上构建了非复制性替换载体pUC19-EPT,电转进入酪丁酸梭菌,通过同源重组将酪丁酸梭菌染色体上 pta基因替换为来自丙酮丁醇梭菌的 thl基因,关闭乙酸代谢途径中关键酶磷酸转乙酰基酶基因(pta)的表达,并提高丁酸代谢过程中关键酶基因(thl)的表达量。同时对野生菌和重组菌进行发酵分析,发现所获得的重组菌,其丁酸得率为0.47 g/g,与野生菌相比,增加了34%,乙酸得率为0.05 g/g,与野生菌相比,下降了29%。基因替换突变株的获得为丁酸的化工生产转型为木质纤维素同步糖化发酵提供了新的研究思路。
REFERENCES
[1]Gao F, Liu JQ.The preparation technology and application for n-butyric acid at home and abroad.Tianjin Chem Ind,2006, 20(6): 42–44.高飞, 刘继泉.正丁酸的生产技术及应用状况.天津化工, 2006, 20(6): 42–44.
[2]Wakabayashi K, Saito H, Kaneko F, et al.Gene expression associated with the decrease in malignant phenotype of human liver cancer cells following stimulation with a histone deacetylase inhibitor.Int J Onvol, 2005, 26(1):233–239.
[3]Ruemmele EM, Sclavartz S, Seidman EG, et al.Butyrate induced Caco-2 cell apoptosis is mediated via the mitochondrial pathway.Gut, 2003, 52(1): 94–100.
[4]Nakano K, Mizuno T, Sowa Y, et al.Butyrate actives the WAF1/Cip1 gene promoter through Sp1 sites in a p53-negative human colon cancer cell line.J Biol Chem,1997, 272(35): 22199–22206.
[5]Rogers P, Gottschalk G.Biochemistry and regulation of acid and solvent production in Clostridia//Woods DR, ed.The Clostridia and Biotechnology.Boston: Butterworth-Heinemann, 1993: 25–50.
[6]Zhu Y, Yang ST.Adaptation of Clostridium tyrobutyricum for enhanced tolerance to butyric acid in a fibrous-bed bioreactor.Biotechnol Prog, 2003, 19(2): 365–372.
[7]Liu X, Yang ST.Kinetics of butyric acid fermentation of glucose and xylose by Clostridium tyrobutyricum wild type and mutant.Process Biochem, 2006, 41(4): 801–808.
[8]Michel-Savin D, Marchal R, Vandecasteele JP.Control of the selectivity of butyric acid production and improvement of fermentation performance with Clostridium tyrobutyricum.Appl Microbiol Biotechnol, 1990, 32(4): 387–392.
[9]Michel-Savin D, Marchal R, Vandecasteele JP.Butyrate production in continuous culture of Clostridium tyrobutyricum: effect of end product inhibition.Appl Microbiol Biotechnol, 1990, 33(2): 127–131.
[10]Green EM, Boynton ZL, Harris LM, et al.Genetic manipulation of acid formation pathways by gene inactivation in Clostridium acetobutylicum ATCC 824.Microbiol, 1996, 142(8): 2079–2086.
[11]Green EM, Bennett GN.Genetic manipulation of acid and solvent formation in Clostridium acetobutylicum ATCC 824.Biotechnol Bioeng, 1998, 58(2/3): 215–221.
[12]Liu X, Zhu Y, Yang ST.Construction and characterization of ack eeleted mutant of Clostridium tyrobutyricum for enhanced butyric acid and hydrogen production.Biotechnol Prog, 2006, 22(5): 1265–1275.
[13]Zhu Y, Liu X, Yang ST.Construction and characterization of pta gene deleted mutant of Clostridium tyrobutyricum for enhanced butyric acid fermentation.Biotechnol Bioeng, 2005, 90(2): 154–166.
[14]Huang YL, Mann K, Novak JM, et al.Acetic acid production from fructose by Clostridium formicoaceticum immobilized in a fibrous-bed bioreactor.Biotechnol Prog,1998, 14(5): 800–806.
[15]Mermelstein LD, Papoutsakis ET.In vivo methylation in Escherichia coli by the Bacillus subtilis phage φ3T methyltransferase to protect plasmids from restriction upon transformation of Clostridium acetobutylicum ATCC 824.Appl Environ Microbiol, 1993, 59(4): 1077–1081.
Engineering and metabolic characteristics of a Clostridium tyrobutyricum strain
Guiqing Yang1,2, Gang Liu1, and Changde Yang1
1 Shenzhen Key Laboratory of Microbial Genetic Engineering, College of Life Sciences, Shenzhen University, Shenzhen 518060, China 2 Shenzhen Luohu Center For Disease Control Prevention, Shenzhen 518020, China
Received:August 14, 2009;Accepted:December 24, 2009
Corresponding author:Guiqing Yang.Tel: +86-755-25508339; Fax: +86-755-25611283; E-mail: hawk80459@sohu.com
