克雷伯杆菌甘油脱氢酶和1,3-丙二醇氧化还原酶的动力学机制
2010-10-16陈宏文聂金峰陈国方柏山
陈宏文,聂金峰,陈国,方柏山
华侨大学 工业生物技术福建省高等学校重点实验室,厦门 361021
克雷伯杆菌甘油脱氢酶和1,3-丙二醇氧化还原酶的动力学机制
陈宏文,聂金峰,陈国,方柏山
华侨大学 工业生物技术福建省高等学校重点实验室,厦门 361021
本研究主要对克雷伯杆菌甘油转化1,3-丙二醇代谢途径中的2个关键酶甘油脱氢酶(GDH)、1,3-丙二醇氧化还原酶(PDOR)反应机制和动力学进行了研究。首先,通过初速度和产物抑制动力学研究确定了GDH、PDOR双底物酶促反应机制为有序BiBi机制,明确了由反应物消耗到产物生成之间的历程。其次,建立了GDH、PDOR双底物酶促反应动力学模型,由动力学模型可知,在偶合反应中,如果GDH和PDOR酶量相同,GDH氧化反应成为限速反应,而辅酶I将主要以氧化型NAD+形式存在。动力学信息为酶法合成1,3-丙二醇和代谢工程研究提供理论指导。
甘油脱氢酶,1,3-丙二醇氧化还原酶,有序BiBi机制,动力学模型
Abstract:The kinetic mechanisms of two key enzymes in the biotransformation of glycerol to 1,3-propanediol(1,3-PD)by Klebsiella pneumoniae, glycerol dehydrogenase(GDH)and 1,3-propanediol oxidoreductase(PDOR), was characterized.Kinetics on initial velocity and product inhibition revealed that GDH and PDOR follow an ordered Bi-Bi sequential mechanism.Kinetic models for GDH and PDOR showed that the oxidation reaction catalyzed by GDH was the rate-limiting step in coupled enzymatic reaction when the GDH/PDOR was 1:1, and the NAD+was the main form of coenzyme in the reaction.Knowledge about the kinetic mechanisms will be helpful to understand how these enzymes is regulated, which will be useful for further enzyme catalysis and metabolic engineering studies.
Keywords:glycerol dehydrogenase, 1,3-propanediol oxidoreductase, ordered Bi-Bi mechanism, kinetic model
1,3-丙二醇(1,3-PD)是一种重要的化工原料,它可作为抗冻剂、多种增塑剂、洗涤剂、防腐剂和乳化剂的合成原料,也可用于食品、化妆品和制药等行业。它最主要的用途是作为新型聚酯(如PTT)、聚醚和聚亚氨酯的单体[1]。1,3-PD的生产方法有化学法和生物转化法。近年来,生物转化法以其利用可再生资源、对环境友好等特点日益受到人们的重视。能将甘油转化为1,3-PD的微生物主要包括克雷伯杆菌属、柠檬菌属及梭状芽孢杆菌属等。
甘油脱氢酶(GDH,EC 1.1.1.6)和1,3-丙二醇氧化还原酶(PDOR,EC 1.1.1.202)是甘油(Gly)转化 1,3-PD过程中的两个关键酶,它们的活力与1,3-PD的产率密切相关[2]。在甘油转化为1,3-PD的厌氧发酵途径中,依赖NAD+的GDH控制着甘油到二羟基丙酮(DHA)的氧化反应,依赖 NADH的PDOR控制着 3-羟基丙醛(3-HPA)到 1,3-PD的还原反应。辅酶Ⅰ的再生和平衡通过 GDH和 PDOR的自氧化还原实现。依赖辅酶维生素B12的甘油脱水酶(GDHt,EC 4.2.1.30)调控着甘油到3-HPA的转化。目前已有一些关于GDH和PDOR的克隆、表达及酶学性质方面的研究,而关于 GDH特别是PDOR催化机制的深入研究国内外鲜有报道。本研究室已从克雷伯杆菌中分离纯化了 GDH和PDOR[3-4],且生物法合成 3-HPA[5],为动力学机制研究打下基础。本研究通过催化机制的研究,提供了 GDH和PDOR的双底物催化动力学模型,动力学信息的提供有助于深入理解伴有辅酶再生的酶偶联反应系统,为今后的酶法合成 1,3-PD、代谢工程研究提供帮助。
1 材料和方法
1.1 材料
克雷伯杆菌Klebsiella pneumoniae DSM 2026由德国生物技术中心曾安平博士惠赠。DHA为英国BDH公司产品。甘油、1,3-PD、NAD(H)等购自上海化学试剂公司。3-HPA为本实验室自制[5]。
1.2 GDH和PDOR的纯化
来源于克雷伯杆菌的GDH和PDOR经过DEAE Sepharose(或 Fast Flow Q Sepharose Fast Flow)离子交换层析和Blue Sepharose CL-6B亲和层析得到分离纯化[3-4]。
1.3 GDH和PDOR的催化反应
GDH、PDOR酶活力用初速度法测定,参考Ahrens等[1]的方法并适当修改。1.5 mL GDH酶活力分析反应液含有30 mmol/L(NH4)2SO4、0.2 mol/L甘油、2 mmol/L NAD+、1 μmol/L Fe(NH4)2(SO4)2、0.1 mol/L碳酸钾缓冲溶液(pH 12.0)。45℃条件下,加入适量酶液启动反应,紫外分光光度计340 nm波长下测定吸光度的变化(NADH形成)。PDOR酶活力测定以1,3-PD为底物(碳酸钾缓冲溶液pH 9.5),其余步骤同GDH酶活力测定方法。酶活力定义为:在上述条件下,每分钟还原1 μmol底物的酶量为1个单位。
动力学机制实验分成两组。第一组为不含产物的初速度实验,对于 GDH,分别固定 Gly浓度(0.025、0.5、0.1、0.2 mol/L),初速度法测定不同NAD+浓度(0.2、0.1、0.067、0.047及 0.04 mmol/L)下的初速度;对于 PDOR,分别固定 3-HPA浓度(0.01、0.025、0.05、0.075 mol/L),初速度法测定不同NADH浓度下的初速度。第二组为产物抑制实验,对于GDH,在含不同产物NADH(或DHA)浓度的测活体系中,固定酶和Gly(或NAD+)的浓度,改变底物NAD+(或Gly)浓度,测定酶促反应初速度;对于 PDOR,在含不同产物 NAD+(或 1,3-PD)浓度的测活体系中,固定酶和3-HPA(或NADH)的浓度,改变底物NADH(或3-HPA)浓度,测定酶促反应初速度。所有动力学实验平行3次,所有实验数据的相对标准偏差在0.5%~1.5%范围内。
1.4 动力学数据分析
双底物酶促反应机制主要有有序机制、随机机制和乒乓机制。有序机制和快速平衡的随机机制中,两种底物在酶促反应中与酶分子上的特定位点结合形成非共价三元复合物。乒乓机制反应中不形成三元复合物,在第二个底物结合上去之前,第一个底物已经转化成产物并从酶上释放出来。如果酶促反应为有序 BiBi反应或快速平衡的随机 BiBi反应,则其实验数据符合如下的初速度方程和双倒数方程(稳态条件下推导的速度方程)[6]:
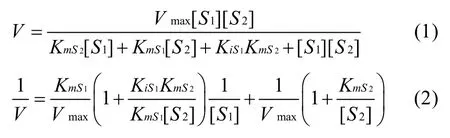
其中,S1为先与酶结合的第一底物,S2为后与酶结合的第二底物, KmS1和KmS2分别是以 S1、S2为底物的米氏常数,KiS1是第一底物的解离常数,Vmax为最大反应初速度。实验室自制的3-HPA没有完全提纯,对于PDOR(1)式中 KmS1、KmS2分别是以S1、S2为底物的表观米氏常数。
如果酶促反应是乒乓BiBi反应,则其实验数据应符合下面的初速度方程和双倒数方程[6]:
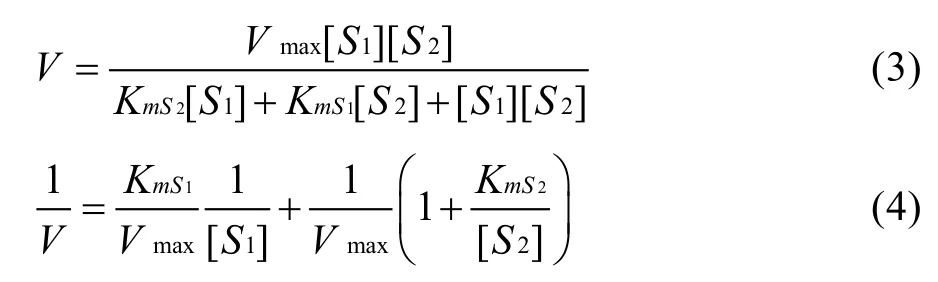
其中,符号含义同上。如果实验数据不符合上面任何一个双倒数直线方程,则反应可能具有稳态随机BiBi反应机制。
2 结果和讨论
2.1 初速度研究
不含产物条件下,研究了GDH和PDOR双底物动力学。由于无法获得纯的 PDOR,实验所用的PDOR还含有少量GDH[4]。GDH对生理反应底物甘油等含有相邻羟基的醇类有较强的专一性,但对单羟基的 3-HPA和非相邻羟基的 1,3-丙二醇(PDOR酶促反应的底物和产物)等活性则很低[3],因此GDH对于 PDOR机制鉴别和动力学的影响可忽略。初速度法测定不同底物 NAD+(GDH)和 NADH(PDOR)浓度下的初速度。将对作图,结果如图1和图2所示。所得到的曲线均为一簇交于第二象限的直线,这表明GDH和PDOR酶促反应为有序或快速平衡的随机BiBi反应。如果为乒乓BiBi反应,则一簇直线相互平行,斜率相同。如果酶促反应是稳态随机BiBi反应,则双倒数图是非线性的。这些结果也说明GDH和PDOR酶促反应在产物释放之前,其两种底物会与酶形成三元复合物。另外,双倒数图中的一簇直线没有集中在X轴上,说明两种底物与酶结合时会相互影响。
2.2 产物抑制
为进一步确定GDH和PDOR反应机制,分别在产物存在条件下,测定GDH和PDOR酶促反应初速度。双倒数作图实验结果显示,对于 GDH,NADH对 NAD+只有斜率效应而无截距效应(图3A),表明产物NADH对NAD+的抑制类型为竞争性抑制,而产物 DHA 对 NAD+的抑制类型为非竞争性抑制(图3B),对 Gly抑制机理表现为混合型抑制(图3C)。PDOR酶促反应模式与 GDH类似,产物 NAD+对NADH的抑制为竞争性抑制(图4A),产物1,3-PD对NADH和3-HPA的抑制为混合型抑制(图4B、C)。
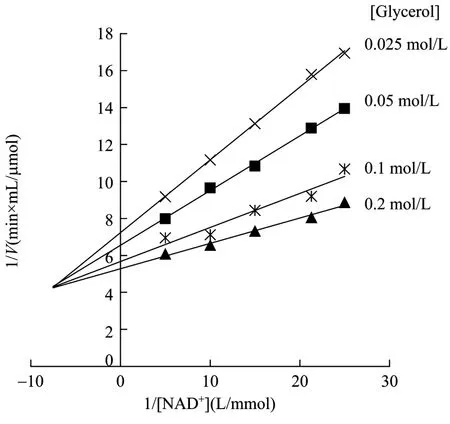
图1 GDH氧化反应的双倒数关系图Fig.1 Double reciprocal plots for the oxidation reaction of GDH.
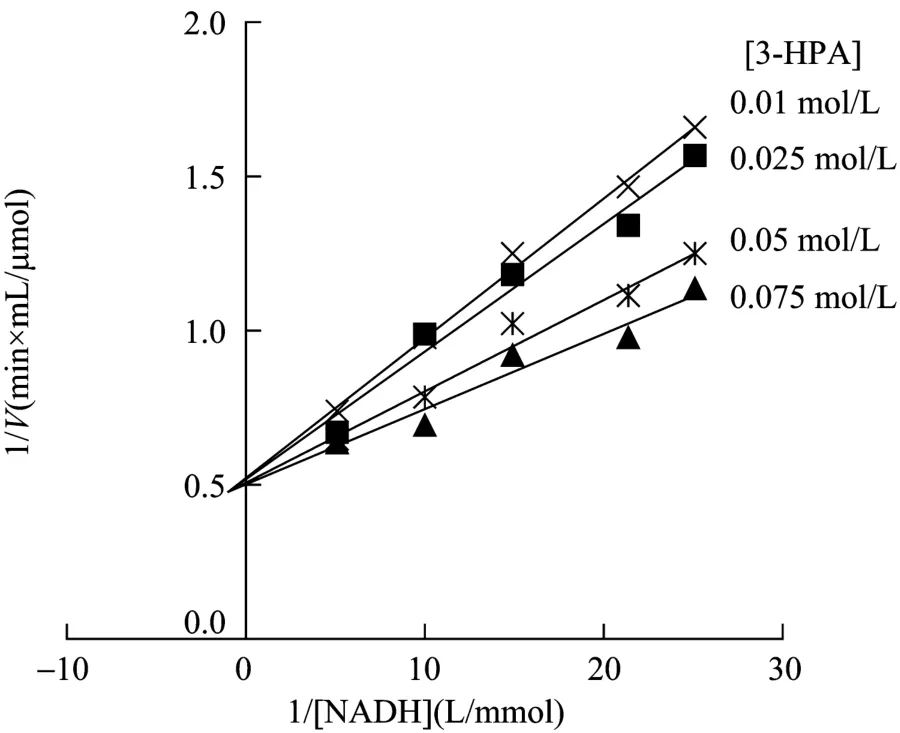
图2 PDOR还原反应的双倒数关系图Fig.2 Double reciprocal plots for the reduction reaction of PDOR.
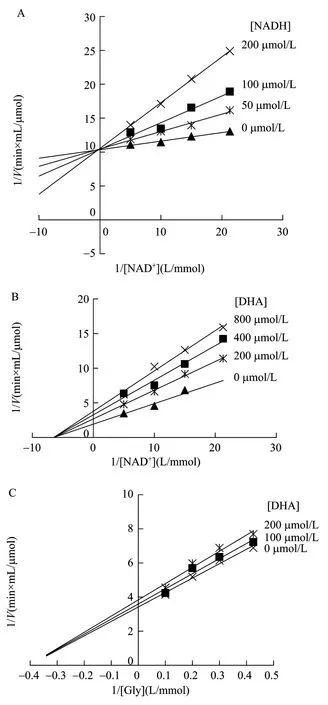
图3 GDH产物抑制的双倒数关系图Fig.3 Double reciprocal plots for product inhibition on GDH.(A)Product inhibition by NADH on GDH.(B)Product inhibition by DHA on GDH.(C)Product inhibition by DHA on GDH.
通过产物抑制作用的研究说明 GDH和 PDOR双底物催化反应中,在不同产物浓度下,产物抑制作用既有竞争性抑制又有非竞争性抑制和混合型抑制,而不是表观为快速平衡随机反应中的全部为竞争性抑制(底物不饱和)或不抑制现象(底物饱和),因此GDH和PDOR双底物酶促反应均为有序BiBi反应。
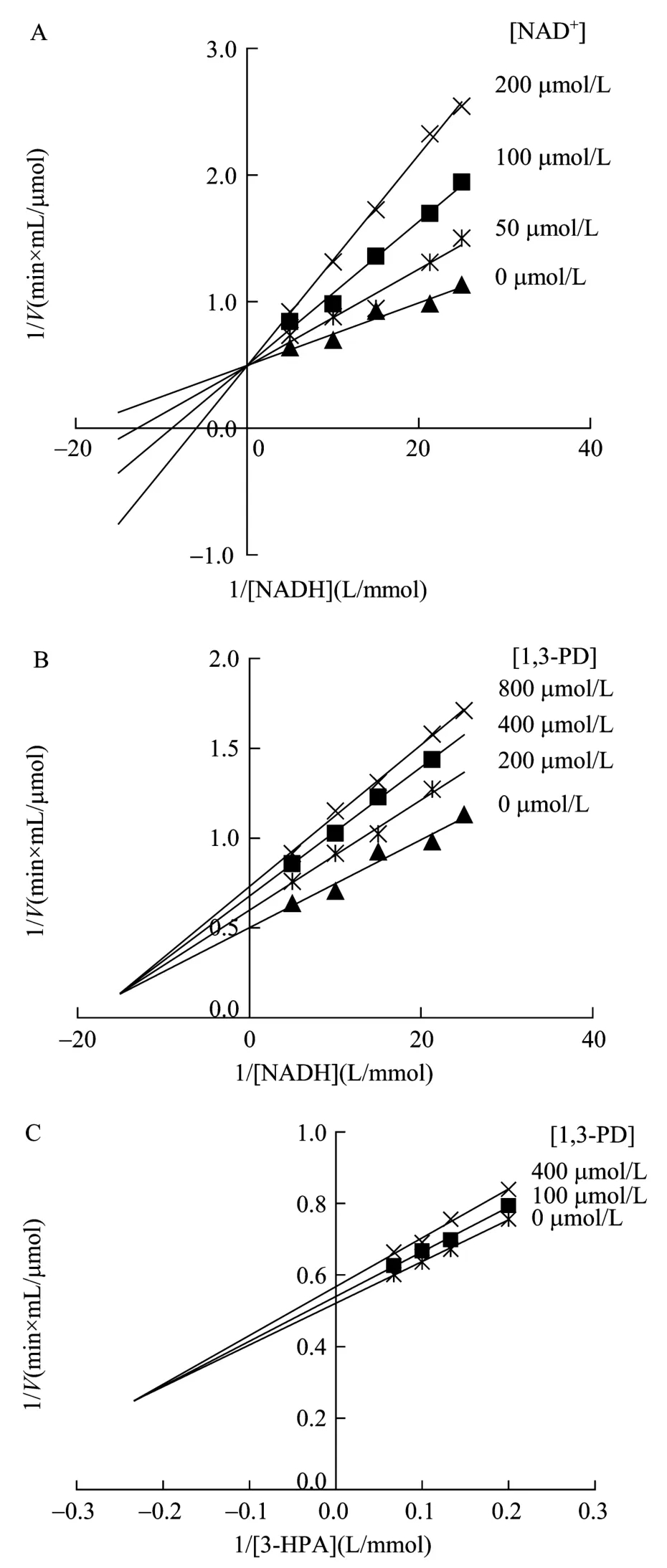
图4 PDOR产物抑制的双倒数关系图Fig.4 Double reciprocal plots for product inhibition on PDOR.(A)Product inhibition by NAD+on PDOR.(B)Product inhibition by 1,3-PD on PDOR.(C)Product inhibition by 1,3-PD on PDOR.
竞争性的产物抑制为底物结合和产物释放顺序提供了线索。因为抑制剂与可变底物结合于同一种酶形式才能看到竞争性抑制作用,对于有序BiBi反应来说,只有第一个底物和最后一个产物才能与同一种酶形式(自由酶 E)结合,所以对于 GDH,可变底物 NAD+必为第一个底物,而竞争性产物抑制剂 NADH必为最后一个释放的产物,由于 BiBi反应只有两种底物和两种产物,这样整个反应次序即可决定。即其中NAD+是第一底物,Gly是第二底物,DHA是首先释放的第一产物,NADH是随后释放的第二产物,GDH氧化反应的过程如图5(A)所示。同理,PDOR还原反应中,NADH是第一底物,3-HPA是第二底物,1,3-PD是第一产物,NAD+是第二产物,反应过程如图5(B)所示。
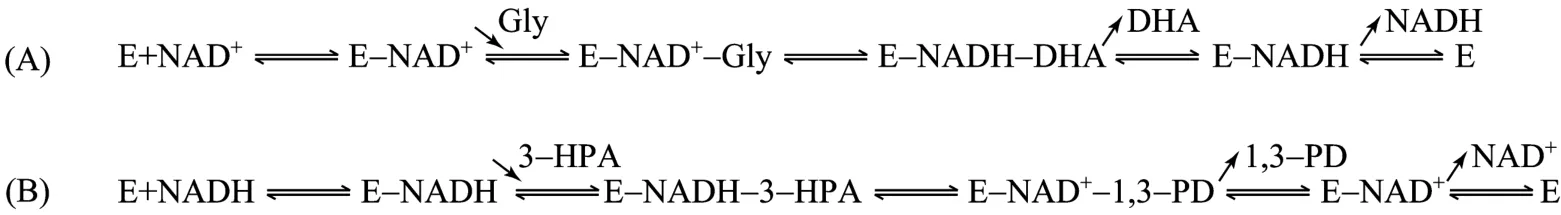
图5 GDH(A)和 PDOR(B)有序 BiBi机制Fig.5 Ordered BiBi mechanism of GDH(A)and PDOR(B).
2.3 双底物酶促反应速度方程及动力学常数求解
以GDH为例,反应为有序BiBi反应,其酶促反应速度方程符合(1)式,双倒数方程符合(2)式,从(2)式可知,以对作图为直线(图1),其直线斜率为,截距为。以图1的截距、斜率分别对二次作图(图略),可测得相关动力学常数。同样求得PDOR有序BiBi反应动力学常数,结果见表1。GDH反应由于 KmS1≪KmS2,说明 E-DHA-NADH的分解是整个反应的限速反应,可用快速平衡法推导的有序 BiBi速度方程表示 GDH的氧化反应动力学方程,即:
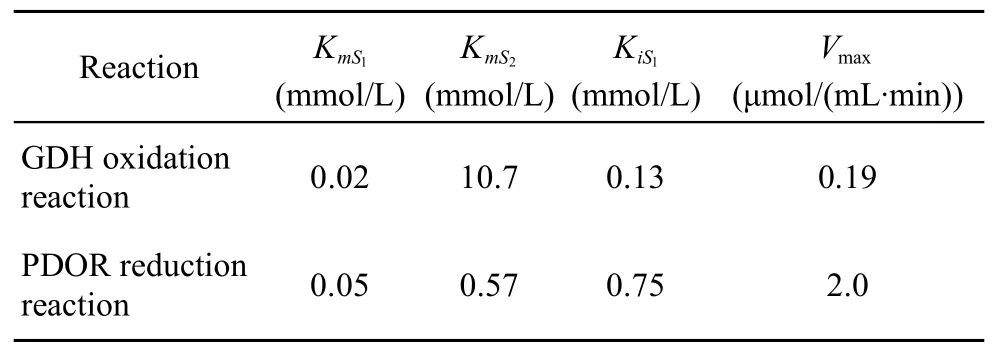
表1 GDH、PDOR有序BiBi反应动力学常数Table 1 Kinetic constants of GDH and PDOR ordered BiBi reaction
利用数学工具软件(Maple 7.0)分别对GDH、PDOR动力学微分方程进行数值积分求解(设甘油、3-HPA初始浓度为20 mmol/L,GDH、PDOR酶量相等),计算结果如图6、图7所示。由这两个图可知在分批反应中,GDH催化的氧化反应速度远小于PDOR催化的还原反应速度,如果两个偶合反应同时进行,GDH氧化反应将成为限速反应,而辅酶 I将主要以氧化型 NAD+形式存在。若要提高偶合酶系的反应速度,可考虑加大GDH酶量。
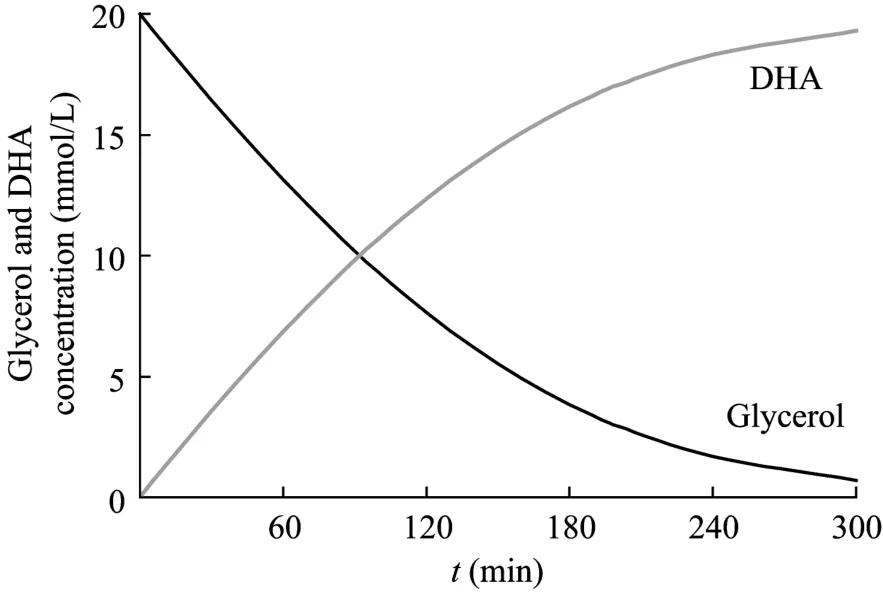
图6 分批操作条件下甘油、二羟基丙酮变化的模型计算值Fig.6 Model values of variation of glycerol and DHA in batch mode.
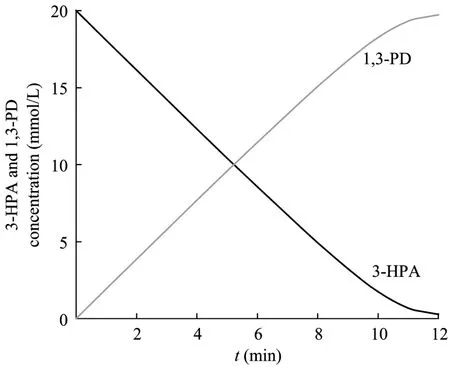
图7 分批操作条件下3-HPA、1,3-PD变化的模型计算值Fig.7 Model values of variation of 3-HPA and 1,3-PD in batch mode.
3 结语
本研究主要对克雷伯杆菌甘油转化1,3-PD代谢途径中2个关键酶GDH、PDOR反应机制和动力学进行了研究。确定了GDH、PDOR双底物酶促反应机制为有序 BiBi,明确了由反应物消耗到产物生成之间的历程。并对有序BiBi动力学参数求解,建立了GDH、PDOR双底物酶促反应动力学模型。动力学信息的提供加深了克雷伯杆菌转化1,3-PD胞内伴有辅酶再生的酶偶联反应系统的理解,为今后代谢工程手段分子育种或是胞外酶法合成1,3-PD的操作提供了指导。
REFERENCES
[1]Ahrens K, Menzel K, Zeng AP, et al.Kinetic dynamic and pathway studies of glycerol metabolism by Klebsiella pneumoniae in anaerobic continuous culture.Ⅲ .Enzymes and fluxes of glycerol dissimilation and 1,3-propanediol formation.Biotech Bioeng, 1998, 59(5): 544–552.
[2]Chen HW, Fang BS, Hu ZD.Optimization of process parameters for key enzymes accumulation of 1,3-propanediol production from Klebsiella pneumonia.Biochem Eng J,2005, 25(1): 47–53.
[3]Chen HW, Wu YH, Wu ZH, et al.Purification and characterization of glycerol dehydrogenase from Klebsiella pneumoniae.J Food Sci Biotech, 2005, 24(1): 1–5.陈宏文, 吴雅红, 吴振华, 等.克雷伯杆菌甘油脱氢酶的分离纯化及性质.食品与生物技术学报, 2005, 24(1):1–5.
[4]Chen HW, Nie JF, Fang BS.Purification and characterization of 1,3-propanediol oxidoreductase from Klebsiella pneumoniae.J Huaqiao Univ, 2009, 30(1):62–66.陈宏文, 聂金峰, 方柏山.克雷伯杆菌 1,3-丙二醇氧化还原酶的分离纯化及其酶学性质.华侨大学学报, 2009,30(1): 62–66.
[5]Chen HW, Hong QW, Xu J, et al.Aerobic conversion of glycerol to 3-hydroxypropionaldehyde by Klebsiella pneumoniae.Mod Chem Ind, 2004, 24(11): 36–39.陈宏文, 洪其文, 徐晶, 等.克雷伯杆菌有氧发酵利用甘油生产 3-羟基丙醛的研究.现代化工, 2004, 24(11):36–39.
[6]Zou GL, Zhu RF.Enzymology.Wuhan: Wuhan University Press, 1997: 127–162.邹国林, 朱汝璠.酶学.武汉: 武汉大学出版社, 1997:127–162.
Kinetic mechanisms of glycerol dehydrogenase and 1,3-propanediol oxidoreductase from Klebsiella pneumoniae
Hongwen Chen, Jinfeng Nie, Guo Chen, and Baishan Fang
Key Laboratory of Industrial Biotechnology, Fujian Province, Huaqiao University, Xiamen 361021, China
Received:September 25, 2009;Accepted:November 2, 2009
Supported by:National High Technology Research and Development Program of China(863 Program)(No.2006AA020103), National Natural Science Foundation of China(No.20676048), Natural Science Foundation of Fujian Province(No.D0810015), New Century Excellent Talents in Fujian Province University(No.07FJRC03).
Corresponding author:Baishan Fang.Tel: +86-592-2185869; Fax: +86-592-2184822; E-mail: fangbs@hqu.edu.cn国家高技术研究发展计划(863计划)(No.2006AA020103),国家自然科学基金项目(No.20676048),福建省自然科学基金项目(No.D0810015),福建省高等学校新世纪优秀人才支持计划(No.07FJRC03)资助。
