利用Tol2转座子构建斑马鱼心脏组织特异表达转基因载体及其表达分析
2010-10-16陈婷芳罗娜谢华平吴秀山邓云
陈婷芳,罗娜,谢华平,吴秀山,邓云
湖南师范大学生命科学学院 心脏发育研究中心,长沙 410081
利用Tol2转座子构建斑马鱼心脏组织特异表达转基因载体及其表达分析
陈婷芳,罗娜,谢华平,吴秀山,邓云
湖南师范大学生命科学学院 心脏发育研究中心,长沙 410081
为了制备用于在斑马鱼心脏中特异表达目的基因的转基因载体,通过分子克隆的方法对能够在斑马鱼心脏中特异表达EGFP报告基因的Tol2载体进行了改造,在原有的CMLC2启动子与EGFP编码区之间插入带有多克隆位点的IRES序列,获得pTol2-CMLC2-IRES-EGFP转基因表达载体,该载体可以实现在同一个启动子CMLC2的驱动下分别同时表达目的基因和 EGFP;为了验证该表达载体的有效性,进一步在 CMLC2启动子与 IRES序列之间插入DsRed-Monome编码区,利用得到的pTol2-CMLC2-RED-IRES-EGFP转基因载体显微注射到斑马鱼单细胞期胚胎中进行表达分析,结果表明外源目的基因DsRed-Monome和报告基因EGFP均能以相同的表达模式在斑马鱼心脏组织中特异表达。pTol2-CMLC2-IRES-EGFP转基因表达载体的成功构建对于建立心脏发育候选基因的斑马鱼转基因实验模型具有重要意义。
Tol2转座子,斑马鱼,转基因,心脏特异表达
Abstract:In an effort to generate a desired expression construct for making heart-specific expression transgenic zebrafish, a Tol2 plasmid, which can drive EGFP reporter gene specifically expressed in the heart, was modified using subcloning technology.An IRES fragment bearing multiple cloning site(MCS)was amplified directly from pIRES2-EGFP plasmid and was inserted between the CMLC2 promoter and EGFP fragment of the pDestTol2CG vector.This recombinant expression plasmid pTol2-CMLC2-IRES-EGFP can drive any interested gene specifically expressed in the zebrafish heart along with EGFP reporter gene.To test the effectiveness of this new expression plasmid, we constructed pTol2-CMLC2-RED-IRES-EGFP plasmid by inserting another reporter gene DsRed-Monome into MCS downstream of the CMLC2 promoter and injected this transgenic recombinant plasmid into one-cell stage embryos of zebrafish.Under fluorescence microscope, both the red fluorescence and the greenfluorescence produced by pTol2-CMLC2-RED-IRES-EGFP were detected specifically in the heart tissue in the same expression pattern.This novel expression construct pTol2-CMLC2-IRES-EGFP will become an important tool for our research on identifying heart development candidate genes’ function using zebrafish as a model.
Keywords:Tol2 transposon, zebrafish, transgenesis, heart-specific expression
转座子作为插入突变源和分子标签被广泛应用于基因的分离、克隆以及基因功能分析,利用基因的转座原理可研究基因的调控模式,可为脊椎动物细胞的分化和发育提供依据[1]。Tol2是近年发现的唯一的天然存在且具有转座活性的脊椎动物转座子,存在于中国、韩国、日本等国的一种淡水鱼——青鳉Oryzias latipes的基因组中[2]。Kawakami等利用Tol2转座子构建了含有特异性启动子调节基因表达的序列(SIX3.2:gfp)载体,该质粒DNA和体外合成的相应转座酶基因 mRNA共注射到单细胞期斑马鱼胚胎中。插入基因组的转座子序列能高频率传递 F1斑马鱼,其中特异性启动子调节基因表达的序列(SIX3.2:gfp)可以稳定存在于转基因鱼[3]。Tol2转座子系统在脊椎动物的基因克隆和基因功能分析方面具有重要的应用前景,对分子生物学的发展有着深远的意义。但是,目前还没有适合斑马鱼心脏组织特异性表达外源目的基因的Tol2转座子转基因载体。
Kwan等将Tol2转座子中转座酶编码基因切除,代之以 CMLC2-EGFP-polyA 表达序列和其他重组筛选序列,如CCDB(Control of cell death)基因序列等,构建了pDestTol2CG2质粒,将该质粒与转座酶mRNA 一起显微注射斑马鱼单细胞期胚胎,观察到斑马鱼心脏组织中有绿色荧光蛋白特异表达,同时外源片段整合效率高[4]。但是直接将 pDestTol2CG2质粒用于心脏发育候选基因的斑马鱼转基因载体还有许多缺陷。首先,CMLC2启动子下游没有可供选择的多克隆位点以便插入一个心脏发育候选基因编码序列;其次,如果将EGFP编码基因切除,代之以其他心脏发育候选基因编码序列,失去报告基因——绿色荧光蛋白的表达对分析目的基因的表达非常不方便;第三,如果将心脏发育候选基因编码序列与EGFP编码基因直接连接,在CMLC2启动子驱动下两个蛋白融合表达,目的基因蛋白的生物活性可能受到影响。
为了构建适用于在斑马鱼心脏中特异表达目的基因的转基因载体,本实验利用分子克隆的方法对能够在斑马鱼心脏中特异表达 EGFP报告基因的Tol2转座子载体进行了改造,在原有的CMLC2启动子与EGFP编码区之间插入带有多克隆位点的IRES序列,获得pTol2-CMLC2-IRES-EGFP转基因表达载体,该载体可以实现在同一个启动子CMLC2的驱动下分别同时表达目的基因和EGFP;为了验证该表达载体的有效性,在CMLC2启动子与IRES序列之间插入DsRed-Monomer编码区,将得到的表达外源基因 DsRed-Monomer的重组载体 pTol2-CMLC2-RED-IRES-EGFP显微注射到斑马鱼单细胞期胚胎中进行表达分析:外源目的基因(DsRed-Monomer)和报告基因(EGFP)均能以相同的模式在斑马鱼心脏组织中特异表达。pTol2-CMLC2-IRES-EGFP转基因表达载体的成功构建为以斑马鱼作为动物模型,研究人类心脏发育候选基因在心脏发育中的功能奠定了重要基础。
1 材料与方法
1.1 材料
pDestTol2CG2等质粒为日本国立遗传研究所Kawakami教授惠赠,Tol2转座子中含有 CCDB(Control of cell death)基因和CMLC2-EGFP-polyA表达序列,其详细的载体结构图见 Kawakami教授实验室网站 http://chien.neuro.utah.edu/tol2kitwiki/index.php/PDestTol2CG。pDsRed-Monomer-C1、pIRES2-EGFP质粒以及大肠杆菌 DH5α菌株为湖南师范大学心脏发育研究中心保存。凝胶回收试剂盒、DNA连接试剂盒、DNA补平试剂盒、LA Taq DNA聚合酶和各种限制性内切酶为 TaKaRa公司产品。大肠杆菌One Shot ccdB Survival Competent Cells购自Invitrogen公司,–80℃保存。条纹斑马鱼品系购自中国科学院武汉水生生物研究所,28℃自动水循环鱼缸培养。
1.2 pTol2-CMLC2-IRES-EGFP多克隆位点表达载体的构建
pTol2-CMLC2-IRES-EGFP多克隆位点表达载体及其下游表达载体的构建流程见图1。
pDestTol2CG2转化入大肠杆菌One Shot ccdB Survival Competent Cells,氨卞青霉素筛选,混收菌落,提取质粒后用限制性内切酶SalⅠ和KpnⅠ切除pDestTol2CG2质粒中的CCDB片段,回收骨架目的片段后用DNA补平试剂盒补平后连接环化,转化大肠杆菌DH5α,纯化得到pTol2-CMLC2-EGFP质粒。以 pIRES2-EGFP质粒 DNA为模板,以 IRES-F3(5'−3'):TCCATGGTTCGAATTCTGCAGTCGACGG(下划线部分为 Nco I酶切位点)和 IRES-R3(5'−3'):GGTCATGATTGTGGCCATATTATCATCG(下划线部分为BspHⅠ酶切位点)为引物,利用LA Taq PCR扩增带有EcoR I、Sal I、BamH I等克隆位点的IRES序列,克隆到pUM18-T质粒上,酶切、测序鉴定获得pUM18-T/IRES质粒。然后用Nco I/BspH I双酶切pUM18-T/IRES质粒,回收IRES目的片段克隆至pTol2-CMLC2-EGFP质粒中 CMLC2启动子下游的Nco I位点。经酶切、测序鉴定获得pTol2-CMLC2-IRES-EGFP表达质粒。
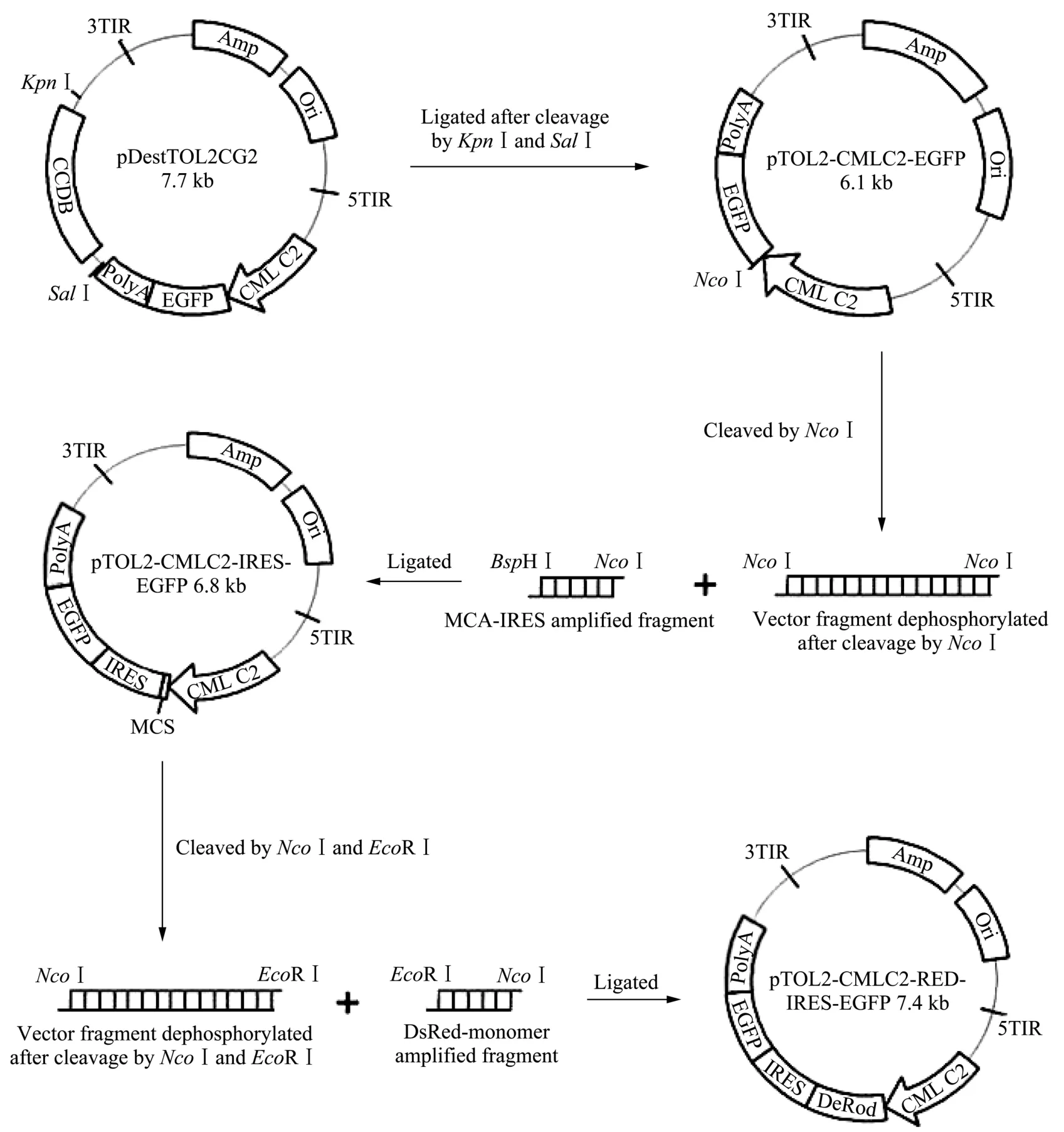
图1 斑马鱼心脏组织特异表达转基因载体的构建Fig.1 Construction of the zebrafish heart-specific transgenetic vector.
1.3 pTol2-CMLC2-RED-IRES-EGFP表达载体的构建
根据红色荧光蛋白的表达序列,设计PCR扩增引物 DSRED-F(5'−3'):GCCATGGACAACACCGAG GACGTC(下划线部分为 Nco I酶切位点)和DSRED-R(5'−3'):GGAATTC TTACTACTGGGAGCC GGAGTGG(下划线部分为EcoR I酶切位点)。利用引物DSRED-F/DSRED-R,以 pDsRed-Monomer-C1质粒DNA为模板,通过PCR 扩增出DsRed-Monomer编码序列的DNA 片段,克隆到pUC18-T 质粒上,经酶切,测序鉴定得到pUC18-T/DsRed- Monomer质粒。Nco I/EcoR I双酶切pUC18-T/DsRed-Monomer质粒后,将回收到的DsRed-Monomer编码序列的DNA片段克隆到 pTol2-CMLC2-IRES-EGFP多克隆位点表达质粒中。经PCR、测序鉴定获得pTol2-CMLC2-RED-IRES-EGFP表达质粒。
1.4 斑马鱼心脏特异表达转基因载体的表达分析
斑马鱼受精卵的获取:受精前将雌雄亲鱼分开饲喂2~3 d后按1:1~2比例放入产卵池中进行产卵受精。分选和洗净的卵移到有琼脂糖的表面皿中,注射外源 DNA 浓度为 0.15 μg/μL, DNA 体积约 2 nL。受精卵的动物极注射完毕后,慢慢抽出注射针,将受精卵放入装有无菌水的培养皿中,使其恢复发育;25℃~28℃培养胚胎,分别在24 h、48 h、72 h后,荧光显微镜下观察筛选心脏组织具有荧光蛋白的胚胎个体。有绿色荧光的个体表示成功载入报告基因EGFP的嵌合个体。
2 结果与分析
2.1 pTol2-CMLC2-IRES-EGFP多克隆位点表达载体的鉴定
pDestTol2CG2质粒是把Tol2转座子中转座酶切除后,将CCDB(Control of cell death)基因和CMLC2-EGFP-polyA 表达序列并入到Tol2转座子中,其中CCDB基因的上游和下游均带有同源重组臂。如果没有外源 DNA片段同源重组置换 CCDB片段,CCDB基因则会表达蛋白,会破坏细菌的 DNA gyrase,造成细菌染色体的降解导致细菌死亡,因此不能转入DH5α中进行扩增。pDestTol2CG2质粒经限制性内切酶Sal I和Kpn I切除其中的CCDB片段,回收骨架目的片段用 DNA补平试剂盒补平后连接环化;限制性内切酶 Sal I的酶切位点在得到的pTol2-CMLC2-EGFP质粒中并未消失,该位点位于poly A序列的下游。将带有EcoR I、Sal I、BamH I等克隆位点的IRES序列正确连接到pTol2-CMLC2-EGFP质粒的 Nco I位点,得到 pTol2-CMLC2-IRES-EGFP重组质粒。本实验共制备了6个重组质粒DNA,经Sal I酶切后电泳结果见图2,有5个质粒酶切片段的大小与预期大小一致(5044 bp和1779 bp)。结果表明,带有EcoR I、Sal I、BamH I等克隆位点的 IRES序列已成功地克隆到pTol2-CMLC2-EGFP质粒中,该结果经进一步的测序分析得到证实。
2.2 pTol2-CMLC2-RED-IRES-EGFP表达载体的鉴定
用引物 DSRED-F/DSRED-R从质粒 pDsRed-Monomer-C1克隆到 DsRed-Monomer编码序列的DNA 片段,经测序鉴定后连接到 pTol2-CMLC2-IRES-EGFP 表达质粒的Nco I/ EcoR I位点,获得pTol2-CMLC2-RED-IRES-EGFP表达质粒。用Nco I/EcoR I双酶切的方法鉴定获得pTol2-CMLC2-REDIRES-EGFP表达质粒,用 0.8%琼脂糖凝胶电泳分析双酶切产物,结果如图3所示。质粒双酶切后DNA片段的大小与预期的DsRed-Monomer编码序列片段(687 bp)和表达载体片段(6823 bp)的大小一致。结果表明,已成功地构建了 pTol2-CMLC2-REDIRES-EGFP表达载体,也进一步证实了测序结果。
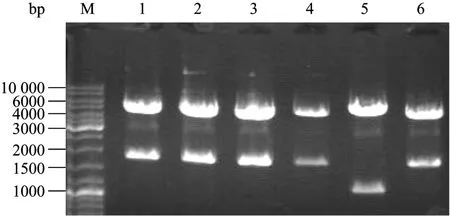
图2 pTol2-CMLC2-IRES-EGFP质粒的酶切鉴定Fig.2 Identification of pTol2-CMLC2-IRES-EGFP plasmid by enzyme digestion.M: DNA marker; 1–6: agarose electrophoresis of the six different pTol2-CMLC2- IRES-EGFP plasmids digested with Sal I.1, 2, 3, 4 and 6 are the positive plasmids.
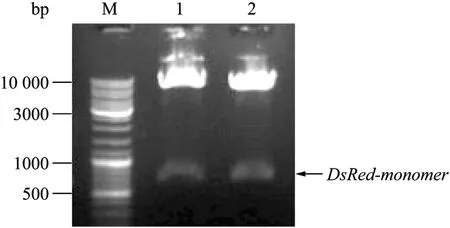
图3 pTol2-CMLC2-RED-IRES-EGFP质粒的Nco I和EcoR I双酶切鉴定Fig.3 Identification of pTol2-CMLC2-RED-IRES-EGFP plasmids by enzyme digestion with Nco I and EcoR I.M: DNA marker; 1, 2: agarose electrophoresis of the two different pTol2-CMLC2-RED-IRES-EGFP plasmids digested with Nco I and EcoR I.1 and 2 are both the positive plasmids.
2.3 斑马鱼心脏特异表达转基因载体的表达分析
将目的基因序列连接到 pTol2-CMLC2-IRES-EGFP质粒的多克隆位点(MCS),得到目的基因的表达载体;该载体在CMLC2启动子作用下,可以在心脏组织中特异转录目的基因的 mRNA;该mRNA实际上也包括 IRES转录序列和报告基因EGFP转录序列。因此,该mRNA能在细胞中翻译成目的蛋白和绿色荧光蛋白,绿色荧光蛋白在心脏组织中的表达时空模式可以间接地反映外源目的蛋白的时空表达模式。为了分析IRES序列或克隆位点插入的目的基因对绿色荧光蛋白表达的影响,pTol2-CMLC2-IRES-EGFP和pTol2-CMLC2-REDIRES-EGFP表达质粒纯化后显微注射到斑马鱼单细胞期胚胎,在24 h后,在荧光显微镜下可以观察到绿色荧光蛋白在显微注射了 pTol2-CMLC2-IRESEGFP表达质粒的斑马鱼胚胎心脏组织中特异表达(图4)。显微注射pTol2-CMLC2-RED-IRES-EGFP表达质粒的斑马鱼胚胎心脏组织中既有红色荧光蛋白又有绿色荧光蛋白特异表达,且绿色荧光蛋白的时空表达模式与红色荧光蛋白相同;绿色荧光的荧光强度比红色荧光弱(图5)。
3 讨论
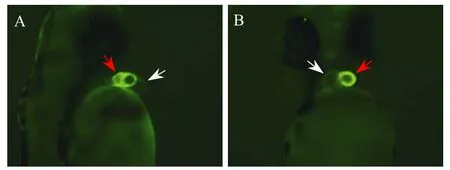
图4 绿色荧光蛋白在斑马鱼心脏组织中的表达分析Fig.4 EGFP protein was specifically expressed in the heart tissue of the zebrafish embryos microinjected with pTol2-CMLC2-IRES-EGFP.Lateral(A)and ventral(B)side observation was performed with Nikon fluorescence microscope,and green fluorescence was detected in the heart of the zebrafish embryos using green light excitated.Ventricle marked by red arrow and atria marked by white arrow.
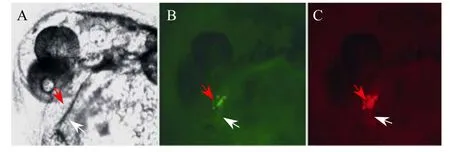
图5 绿色和红色荧光蛋白在斑马鱼心脏组织中的表达分析Fig.5 EGFP protein and RED protein were specifically and coinstantaneously expressed in the heart tissue of the zebrafish embryos microinjected with pTol2-CMLC2-RED-IRES-EGFP.Observation of fluorescence of the heart tissue of the zebrafish embryos microinjected with pTol2-CMLC2-RED-IRES-EGFP was performed with a Nikon fluorescence microscope.The green fluorescence(B)and red fluorescence(C)was displayed specifically and coinstantaneously in the heart tissue of the zebrafish embryos(A)microinjected and excited by blue light and red light respectively.Ventricle marked by red arrow and atria marked by white arrow.
Koga等[5]将Tol2转座子中119 kb的转座酶编码基因切除,代之以GFP基因,将改造后的片段与转座酶mRNA一起显微注射到基因组不含Tol2转座元件的菲律宾青鳉受精卵中。将存活的成年青鳉与未注射转座元件的青鳉交配,后代中有约 1/5的基因组中带有GFP基因,表明GFP基因在当代通过Tol2的转座整合到基因组中了。已经有研究表明,Tol2可携带长达9.7 kb的外源标记基因,整合到受体基因组的染色体上[6]。
Kwan将 Tol2转座子中转座酶编码基因切除,代之以 CMLC2-EGFP-polyA表达序列,构建了pDestTol2CG2质粒,将该质粒与转座酶 mRNA 一起显微注射斑马鱼单细胞期胚胎,观察到斑马鱼心脏组织中有绿色荧光蛋白特异表达,同时外源片段整合效率高[4]。正如上述所言,直接将pDestTol2CG2质粒用于心脏发育候选基因的斑马鱼转基因载体还有许多缺陷。内部核糖体进入位点(IRES)序列来源于脑心肌炎病毒[7],它可翻译一条mRNA上的两个开放阅读框,由其连接的两个基因的表达效率相同[8-9]。本实验切除了pDestTol2CG2质粒中的CCDB片段,同时将带有多克隆位点的IRES片段克隆到质粒中CMLC2启动子下游的Nco I位点。改造后的表达质粒 pTol2-CMLC2-IRES-EGFP在斑马鱼心脏组织中有绿色荧光蛋白特异表达(图4);同时,绿色荧光在心房和心室中表达的强度有差异,心室荧光信号很强,而心房的荧光信号很弱;该结果与其他文献报道的结果一致[4],这种情况可能是与CMLC2启动子特性有关[10]。因此,插入 IRES片段后对绿色荧光蛋白特异表达没有影响。
根据基因工程原理将目的基因和报告基因(如EGFP)通过 IRES序列连接起来,两个基因在同一个启动子作用下转录成单链 mRNA,但翻译时又是相互独立的,不会形成嵌合蛋白[8-9],保证了目的基因蛋白的生物活性,并且理论上只要有报告基因(如 EGFP)的表达,目的基因也肯定会表达,因此便于通过检测报告基因EGFP的表达来进行转基因生物个体的筛选[11]。对于pTol2-CMLC2-RED-IRESEGFP表达质粒来说,在CMLC2启动子作用下,在心脏组织中特异转录目的基因 DsRed-Monomer的mRNA实际上也包括 IRES转录序列和报告基因EGFP转录序列。该mRNA能在细胞中翻译出目的蛋白——红色荧光蛋白和报告基因蛋白——绿色荧光蛋白;EGFP蛋白与DsRed-Monomer蛋白的编码框是独立的,均有各自的起始位点ATG和终止位点TGA或TAA等,核糖体与该mRNA的5′端前导序列结合翻译成目的蛋白——红色荧光蛋白后脱离,同时,核糖体也可以与该mRNA的IRES序列结合翻译下游的绿色荧光蛋白。因此,在细胞中红色荧光蛋白和绿色荧光蛋白是两个独立蛋白,而不是融合蛋白。同时,只要有绿色荧光蛋白的表达就可以证明IRES在斑马鱼胚胎中的有效性。将质粒纯化后显微注射到斑马鱼单细胞期胚胎,24 h后,在荧光显微镜下观察斑马鱼胚胎心脏组织中红色荧光蛋白和绿色荧光蛋白均同时特异表达,绿色荧光的荧光强度比红色荧光弱(图5)。因此,在CMLC2启动子的驱动下,与 IRES序列相连接的双基因可同时表达,绿色荧光蛋白表达时空模式可以间接地反映RED基因的表达时空模式。
根据已有的文献报道共注射编码转座酶 mRNA整合率高达 50%[3],在向单细胞期斑马鱼胚胎中注射实验中,本实验曾尝试表达质粒与转座酶 mRNA共注射和表达质粒单独注射两种方法,结果表明:表达质粒与转座酶mRNA共注射和表达质粒单独注射均能观察到红色荧光和绿色荧光在斑马鱼心脏组织中特异表达,并且两者的时空模式相同(图4);且有无转座酶mRNA的显微注射,阳性个体之间红色荧光和绿色荧光在心脏组织中分布和均一性等均有不同程度的差异,并未发现共注射阳性个体的均一性明显优于单独注射阳性个体;只是共注射编码转座酶mRNA的斑马鱼胚胎表达红色荧光和绿色荧光的阳性率高达18%,单独注射Tol2转座子重组表达载体只有 3%~6%,但表达阳性率的高低并不影响转基因表达载体的定性分析[12]。
本实验构建的 pTol2-CMLC2-IRES-EGFP的斑马鱼转基因表达载体引入一个多克隆位点片段,能方便插入一个心脏发育候选基因;与转座酶 mRNA一起显微注射斑马鱼单细胞期胚胎,Tol2 转座子整合效率高可以实现心脏发育候选基因表达序列的高效整合,通过荧光显微镜观测报告基因EGFP有无表达,即能准确分析目的基因的表达情况,且方法简单易行。因此,该载体的成功构建对于建立心脏发育候选基因的斑马鱼转基因实验模型具有重要意义。
REFERENCES
[1]Ni J, Clark KJ, Fahrenkrug SC, et al.Transposon tools hopping in vertebrates.Brief Funct Genomic Proteomic,2008, 7(6): 444–453.
[2]Inagaki H, Koga A, Bessho Y, et al.The tyrosinase gene from medakafish: transgenic expression rescues albino mutation.Pigment Cell Res, 1998, 11(5): 283–290.
[3]Kawakami K, Takeda H, Kawakami N, et al.A transposon-mediated gene trap approach identifies developmentally regulated genes in zebrafish.Dev Cell,2004, 7(1): 133–144.
[4]Kwan KM, Fujimoto E, Grabher C, et al.The Tol2 kit: a multisite gateway-based construction kit for Tol2 transposon transgenesis constructs.Dev Dyn, 2007,236(11): 3088–3099
[5]Koga A, Hori H, Sakaizumi M.Gene transfer and cloning of flanking chromosomal regions using the medaka fish Tol2 transposable element.Mar Biotechnol(NY), 2002,4(1): 6–11.
[6]Yant SR, Meuse L, Chiu W, et al.Somatic integration and longterm transgene expression in normal and haemophilic mice using a DNA transposon system.Nat Genet, 2000,25(1): 35–41.
[7]Martínez-Salas E.Internal ribosome entry site biology and its use in expression vectors.Curr Opin Biotechnol, 1999,10(5): 458–464.
[8]Hennecke M, Kwissa M, Metzger K, et al.Composition and arrangement of genes define the strength of IRES driven translation in bicistronic mRNAs.Nucleic Acids Res, 2001, 29(16): 3327–3334.
[9]Li T, Zhang J.Stable expression of three genes from a tricistronic retroviral vector containing a picornavirus and 9-nt cellular internal ribosome entry site elements.J Virol Methods, 2004, 115(2): 137–144.
[10]Huang CJ, Tu CT, Hsiao CD, et al.Germ-line transmission of a myocardium-specific GFP transgene reveals critical regulatory elements in the cardiac myosin light chain 2 promoter of zebrafish.Dev Dyn, 2003, 228(1): 30–40.
[11]Xiao T, Roeser T, Staub W, et al.A GFP-based genetic screen reveals mutations that disrupt the architecture of the zebrafish retinotectal projection.Development, 2005,132: 2955–2967.
[12]Fisher S, Grice EA, Vinton RM, et al.Evaluating the biological relevance of putative enhancers using Tol2 transposon-mediated transgenesis in zebrafish.Nat Protoc,2006, 1: 1297–1305.
Construction and expression analysis of the zebrafish heart-specific transgenetic vector based on Tol2 transposable element
Tingfang Chen, Na Luo, Huaping Xie, Xiushan Wu, and Yun Deng
College of Life Sciences, Hunan Normal University, Changsha 410081, China
Received:August 14, 2009;Accepted:December 16, 2009
Supported by:National Natural Science Foundation of China(No.30671137), Postgraduate Scientific Innovation Fund of Hunan Province(No.CX2009B108).
Corresponding author:Yun Deng.Tel: +86-731-88872780; Fax: +86-731-88615078; E-mail: dengyun2008@yahoo.com.cn国家自然科学基金(No.30671137),湖南省研究生科研创新项目(No.CX2009B108)资助。
