二硫键稳定的抗CD3/抗Pgp微型双功能抗体稳定性研究①
2010-02-06杜志荣范冬梅刘娟妮王金宏高瀛岱
杨 铭 程 昕 杜志荣 王 彦 范冬梅 刘娟妮 王金宏 纪 庆 高瀛岱
(中国医学科学院&北京协和医学院血液学研究所,天津 300020)
二硫键稳定的抗CD3/抗Pgp微型双功能抗体稳定性研究①
杨 铭 程 昕 杜志荣②王 彦③范冬梅 刘娟妮 王金宏 纪 庆 高瀛岱④
(中国医学科学院&北京协和医学院血液学研究所,天津 300020)
目的:研究二硫键稳定的抗CD3/抗Pgp微型双功能抗体(Diabody)在体外和体内的稳定性。方法:将抗CD3/抗Pgp Diabody置于37℃含0.2%人血清白蛋白(human serum albumin,HSB)的PBS中,孵育不同时间后,用流式细胞术(FACS)检测其结合活性。建立K562/A02裸鼠移植瘤模型,用Cy5荧光标记试剂盒标记抗CD3/抗Pgp Diabody,通过尾静脉注射给荷瘤裸鼠,在小动物活体成像系统上动态观察荧光信号。结果:二硫键稳定的抗CD3/抗Pgp Diabody(Ds-diabdoy)体外孵育72小时后活性无明显下降,而改造前Diabody孵育1小时后活性即开始下降,24小时后活性完全丧失。Ds-diabdoy注射后72小时仍能在肿瘤部位检测到荧光信号,而改造前Diabody在注射后24小时肿瘤部位荧光信号消失。结论:Ds-diabdoy较改造前Diabody稳定性大大提高。
药物稳定性;Diabody;二硫键;多药耐药
①本文为天津市科技计划资助项目(No.08ZCKFSH04100),专利号:
CN 99125250.0,CN 02146742.0
②中国医学科学院&北京协和医学院基础医学研究所,北京100730
③中国医学科学院&北京协和医学院放射医学研究所,天津300192
④通讯作者,E-mail:gaoyingdai@hotmail.com
肿瘤细胞对不同的化学相关或不相关的抗肿瘤药物产生不敏感性,即多药耐药(Multidrug resistance,MDR)。MDR是造成肿瘤化疗失败的主要原因,产生MDR的原因通常是因为药物失活或被外排泵排出肿瘤细胞[1-4]。MDR产生的主要分子机制是细胞表面存在一种叫做P-糖蛋白(P-glycoprotein,Pgp)的跨膜糖蛋白,由MDR1基因编码,Mr为170 000。Pgp蛋白属于ATP结合盒(ATP-binding cassette,ABC)转运蛋白超家族,是ATP依赖性的药物外排泵,能将各种不同的药物排出细胞,从而产生MDR。已经证实Pgp蛋白与肿瘤复发和预后差高度相关,是评价肿瘤预后的重要指标之一[3,5,6]。以Pgp为治疗靶点已经成为克服肿瘤耐药的新策略。
本实验室前期构建了抗CD3/抗Pgp微型双功能抗体(Diabody),并进行原核可溶性表达,体外实验证实具有良好的生物学活性,体内实验证实能有效地介导细胞毒性T淋巴细胞杀伤耐药移植瘤细胞。但抗CD3/抗Pgp Diabody在体内实验中,停药一周后肿瘤复发,不能彻底根除肿瘤[7]。可能与体外活化的T细胞在体内不能维持其持续活化的状态,以及Diabody不稳定有关。本实验主要是评价引入二硫键的抗CD3/抗Pgp Diabody体内外的稳定性。
1 材料与方法
1.1 实验仪器及实验材料 流式细胞仪(美国Coulter公司),小动物活体成像系统(KODAK Image Station in vivo FX),Cy5荧光标记试剂盒购自GE公司,FITC标记兔抗鼠IgG、HIT3a由中国医学科学院血液学研究所免疫室提供,HRP标记鼠抗E-tag单抗和抗E-tag单抗均购于Amersham Bioscience公司,BALB/c裸鼠(nu/nu),雌性,5~7周龄,体重16~20克,购自中国协和医科大学实验动物中心,在SPF级动物合格环境下饲养。
1.2 细胞培养 K562、K562/A02和 Jurkat细胞由本室保存,用含有10%胎牛血清的RPMI1640培养基,于5%CO2,37℃,饱和湿度下培养。其中K562/A02细胞是由本室长期诱导的耐阿霉素的白血病细胞株,在培养过程中加入阿霉素以维持耐药性,实验前两周停药。
1.3 载体 二硫键稳定的抗CD3/抗Pgp微型双功能抗体由本室构建保存[8]。
1.4 二硫键稳定的抗CD3/抗Pgp微型双功能抗体体外血清稳定性检测 将纯化后的二硫键稳定的Diabody或改造前的Diabody分别置于37℃含0.2%人血清白蛋白(HSA)的PBS中,37℃条件下孵育0、1、4、8、12、24、48 和 72 小时。在上述不同时间点分别取孵育后的抗体,与1×106K562/A02细胞或Jurkat细胞4℃共同孵育1小时,4℃,2 000 r/min,离心10分钟。弃上清,PBS洗细胞2次,弃上清。将细胞重悬于100μl PBS中,加入抗 E-tag单抗,使其终浓度为10μg/m l,4℃孵育1小时。PBS洗3次,弃上清,将细胞重悬于20μl FITC标记的羊抗鼠IgG抗体中,4℃孵育40分钟。至4℃,2 000 r/min,离心10分钟。PBS洗3次,弃上清,将细胞重悬于300μl PBS中,300目尼龙网过滤后,FCM检测荧光强度。同型对照中只加入FITC标记的羊抗鼠IgG抗体。
1.5 二硫键稳定的抗CD3/抗Pgp微型双功能抗体体内稳定性检测
1.5.1 裸鼠移植瘤模型的建立 选用BALB/c nu/nu裸鼠21只,雌性,6周龄,体重16~20克。以4Gy/只剂量进行γ射线亚致死量照射。将照射后的裸鼠,次日于裸鼠右后肢根部背侧皮下接种K562/A 02耐药细胞,每只裸鼠接种细胞数为2×107细胞/0.2m l。待肿瘤生长至直径为0.5 cm左右时备用。
1.5.2 二硫键稳定的抗CD3/抗Pgp微型双功能抗体Cy5荧光标记及标记后的抗体活性检测 使用GE公司Cy5荧光标记试剂盒标记改造前后两种抗CD3/抗Pgp微型双功能抗体。将Cy5标记后的Diabody通过间接免疫荧光法结合流式细胞术,检测其与Pgp抗原的结合活性。
1.5.3 Cy5标记的二硫键稳定的抗CD3/抗Pgp微型双功能抗体活体成像 将标记好的抗体通过尾静脉注射给荷瘤裸鼠,注射剂量为4mg/kg。用乙醚将裸鼠麻醉后,分别于注射后 12、24、48和72小时在Kodak FX in vivo小动物活体成像仪下观察荧光信号。实验分3组,每组 7只裸鼠,如下:对照组注射游离的Cy5荧光染料;实验组1注射改造前Diabody(Cy5标记);实验组2注射二硫键稳定的Diabody(Cy5标记)。
2 结果
2.1 二硫键稳定的抗CD3/抗Pgp微型双功能抗体体外血清稳定性检测将改造前后的两种Diabody分别于37℃含0.2%HSA的PBS中孵育,取不同时间点检测孵育后抗体对K562/A02细胞的结合活性。改造前的Diabody在37℃含0.2%HSA的PBS中孵育1小时后活性开始下降,4小时后活性仅剩约1/2,24小时后则活性完全丧失。而dsCD3-Diabody在37℃含0.2%HSA的PBS中孵育72小时后细胞亲和活性无明显下降(图1)。
2.2 二硫键稳定的抗CD3/抗Pgp微型双功能抗体体内稳定性检测
2.2.1 Cy5标记后结合活性的检测 为了评估Cy5标记对Diabody的结合活性是否有影响,利用间接免疫荧光方法结合流式细胞术,检测标记后的Diabody与Pgp抗原的结合能力。实验结果显示与标记前的Diabody相比,Cy5标记的Diabody与Pgp抗原的结合活性没有明显下降(图2)。

图1 dsCD3-diabody与改造前Diabody稳定性比较Fig.1 Serum stability of the dsCD3-diabody in com parison with the parent diabody
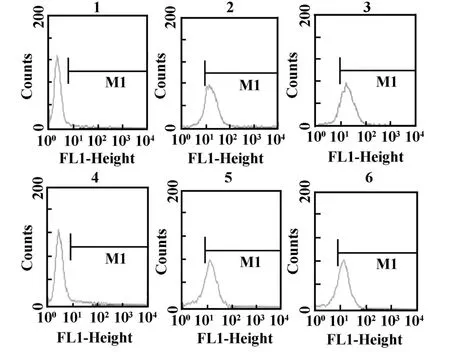
图2 Cy5标记的Diabody与 Pgp抗原结合活性的鉴定Fig.2 Identification the Pgp-binding activity of Cy5 labeled Diabody
2.2.2 二硫键稳定的抗CD3/抗Pgp微型双功能抗体体内稳定性 本实验利用荧光素Cy5标记Diabody进行示踪,直观地观察Diabody进入Pgp高表达的移植瘤裸鼠模型体内,在移植瘤部位定位、停留和被代谢的过程,从而比较改造前后两种Diabody在体内的定位和稳定性。所有移植瘤裸鼠在注射标记抗体后2小时均能在移植瘤部位检测到明显的荧光信号(图3A2和A3)。在每个时间点二硫键稳定的抗CD3/抗Pgp微型双功能抗体在移植瘤部位的荧光信号均比改造前的Diabody强(图3A2,B2,C2和A3,B3,C3)。抗体注射后24小时,改造前Diabody在移植瘤部位的荧光信号变得较弱,而dsCD3-Diabody在移植瘤部位的荧光信号仍然较强(图3C2和C3)。抗体注射后72小时,改造前Diabody在移植瘤部位的荧光信号基本不能被检测到,而dsCD3-Diabody在移植瘤部位的荧光信号仍然可以被检测到(图3D2和D3)。游离Cy5对照组在所有时间点,移植瘤部位均无明显荧光信号。

图3 近红外活体成像对比二硫键稳定的抗CD3/抗Pgp微型双功能抗体和改造前Diabody体内稳定性Fig.3 The in vivo stability of the dsCD3-Diabody in comparison with the parent Diabody
3 讨论
抗体稳定性是影响抗体疗效的一个至关重要的因素。Diabody的两条肽链是非共价结合在一起,容易解离成单体,失去活性。Diabody稳定性差是由其结构特点导致的,要想增强其稳定性,必须从改造其结构入手。增强Diabody稳定性的方法主要有2种:一是用一段柔性肽将VH和VL连接在一起,形成单链双特异抗体(或单链双价抗体)[9];另一种是向Diabody引入二硫键,使两条肽链共价结合在一起,形成二硫键稳定的Diabody[10]。后一种方法已经被大量实验证实是可行的,在VL和VH适当位置引入二硫键,使两者通过共价键结合,可以大大增强Diabody的稳定性[11,12]。
本实验主要是评价引入二硫键的抗CD3/抗Pgp Diabody体内外的稳定性。在体外,将抗体置于37℃的含0.2%HAS的PBS中孵育不同时间,检测其结合活性来评估其体外血清稳定性。改造前的Diabody在37℃含0.2%HSA的PBS中孵育1小时后活性开始下降,4小时后活性仅剩约1/2,24小时后则活性完全丧失。而dsCD3-Diabody在37℃含0.2%HSA的PBS中孵育72小时后细胞亲和活性无明显下降。dsCD3-Diabody体外血清稳定性显著强于改造前Diabody。在体内,我们将抗体用Cy5荧光标记,建立裸鼠移植瘤模型,进行示踪,在小动物成像仪下观察抗体在体内的定位和代谢。结果显示dsCD3-Diabody定位更快,在肿瘤部位停留更长。dsCD3-Diabody稳定性增强后,疗效必将显著增强,主要由于:第一,改造前Diabody在穿透进入肿瘤深处前大部分因为不稳定而解离,失去活性,到达肿瘤中心的Diabody数量较少。而dsCD3-Diabody因为稳定,到达肿瘤中心部位的数量较多。另一原因可能是,根据“binding site barrier”理论 ,肿瘤细胞能够形成一层屏障,阻止抗体到达肿瘤中心[13]。这样能够自由弥散进入肿瘤深部区域的抗体数量将会减少,而稳定性更好的dsCD3-Diabody受此影响较小。体内示踪实验结果与上述 2种解释是吻合的。故dsCD3-Diabody因其稳定性的改善,进入肿瘤内部的有活性的抗体数量较改造前Diaobody多,并且在肿瘤部位停留时间更长,对耐药移植瘤的杀伤作用更强。dsCD3-Diabody将具有更好的临床应用前景。
1 Moscow JA,Schneider E,Ivy S Petal.Multidrug resistance[J].Cancer Chemother Biol ResponseModif,1997;17:139-177.
2 Gottesman M M,Pastan I.Biochemistry ofmultidrug resistancemediated by themultidrug transporter[J].Annu Rev Biochem,1993;62:385-462.
3 Endicott JA,Ling V.The biochemistry of P-glycoprotein-mediatedmultidrug resistance[J].Annu Rev Biochem,1989;58:137-171.
4 Ling V.Multi-drug resistance:molecularmechanisms and c linical relevance[J].Cancer Chemother Pharmacol,1997;40:S3-S8.
5 Schaich M,Soucek S,Thiede Cetal,MDR1 and MRP1 gene expression are independent predictors for treatment outcome in adult acutemyeloid leukaemia[J].Br JHaematol,2005;128(3):324-332.
6 Tsukamoto F,Shiba E,Taguchi Tetal,Immunohistochem icaldetection of P-glycoprotein in breast cancer and its significance asa prognostic Factor[J].Breast Cancer,1997;4(4):259-263.
7 Gao Y,Xiong D,YangMetal,Efficient inhibition ofmultidrug-resistant human tumors with a recombinant bispecific anti-P-glycoprotein x anti-CD3 diabody[J].Leukemia,2005;18(3):513-520.
8 苏 晔,刘娟妮,高瀛岱etal.二硫键稳定的抗CD3/抗pgp微型双功能抗体的构建、表达及活性测定[J].生物工程学报,2009;25(7):1042-1048.
9 Kipriyanov SM,Moldenhauer G,Schuhmacher Jetal,Bispecific tandem diabody for tumor therapy with improved antigen binding and pharmacokinetics[J].JMolBiol,1999;293(1):41-56.
10 FitzGerald K,Holliger P,WinterG.Improved tumour targeting by disulphide stabilized diabodiesexpressed in Pichia pastoris[J].Protein Eng,1997;10(10):1221-1225.
11 Bera T K,Williams-Gould J,Beers Retal.Bivalent disulfide-stabilized fragment variable immunotoxin directed againstmesotheliomasand ovarian cancer[J].MolCancer Ther,2001;1(2):79-84.
12 Bera TK,OndaM,Brinkmann Uetal.A bivalentdisulfide-stabilized Fv with improved antigen binding to erbB2[J].JMol Biol,1998;281(3):475-483.
13 Juweid M,Neumann R,Paik Cetal.Micropharmacology ofmonoclonal antibodies in solid tumors:direct experimentalevidence for abinding site barrier[J].Cancer Res,1992;52(19):5144-5153.
[收稿2010-05-29 修回2010-06-24]
(编辑 许四平)
Stability analyze of the disulphide bond stabilized anti-CD3/anti-Pgp diabody
YANGMing,CHENGXin,DUZhi-Rong,WANGYan,FANDong-Mei,LIUJuan-Ni,WANGJin-Hong,JIQing,GAO Ying-Dai.StateLaboratoryofExperimentalHematology,InstituteofHematologyandBloodDiseasesHospital,ChineseA-cademyofMedicalSciencesandPekingUnionMedicalCollege,Tianjin300020,China
Objective:To analyze the in vitroand in vivo stability of a disulphide anti-CD3/anti-Pgp diabody.Methods:Theanti-CD3/anti-Pgp diabodywas incubated in PBS which contained 0.2%HSB at 37℃for different times,and then analyzed the binding activity by FACS.The diabody was labeled with the fluorescent dye Cy5.Labeled diabdoy was injected via tail veil into BALB/c nudemice bearingMDR(Multi-drug resistance)human xenografts.The fluorescence em ission was recorded with a whole-body small-animal imaging system.Results:The remained binding activity of ds-diadody showed no obvious decreaseafter incubation for 72 h in vitro,while the remained binding activity of the parent diabody began to decrease after incubation for1 h,and couldn'tbe detected after incubation for 24 h.Intense fluorescence could be detected for the ds-diabody at72 h post-in jection,while fluorescence for the parentdiabody disappeared at24 h post-injection.Conclusion:The data demonstrate thatds-diabody has improved stability compared with the parent diabody.
Drug stability;Diabody;Disulphide bond;MDR
R392-33
A
1000-484X(2010)12-1078-04
10.3969/j.issn.1000-484X.2010.12.005
杨 铭(1970年-),男,副主任技师,主要从事药学方面的研究,E-mail:my1970@163.com。
·实用临床免疫学·
