自噬与免疫应答
2010-02-06林庆国山东中医药大学济南250355
林庆国 (山东中医药大学,济南 250355)
自噬与免疫应答
林庆国 (山东中医药大学,济南 250355)
真核细胞主要存在两种降解循环大分子物质的系统:蛋白酶体和溶酶体[1]。蛋白酶体在桶状多聚蛋白复合体中催化降解蛋白底物,而在溶酶体则将底物限制于溶酶体膜内,在脂肪酶、DNA酶、RNA酶、糖苷酶和蛋白酶的作用下被降解。蛋白酶体主要降解翻转及错误折叠的蛋白和短寿命蛋白质:转录因子和细胞周期调控分子[2]。溶酶体在机体稳定的状态下则主要降解长寿命蛋白质、受损的细胞器和内吞的物质,在饥饿等代谢应激的状态下还可以降解细胞内的组成成份,溶酶体是唯一可以降解细胞器的降解系统[3-5]。自噬是一种细胞自我降解的过程,主要经自噬溶酶体通路清除受损或多余的蛋白质和细胞器。
我们下面主要讨论代谢物质在由胞浆入溶酶体途径中可能参与的信号分子,即自噬通路以及胞内自噬通路如何限制病原体入侵、活化免疫系统、提呈抗原给T细胞以及维持T细胞和B细胞的功能,研究自噬与免疫应答的相互作用,为疾病过程中调节免疫应答或免疫耐受提供了可能性。
1 小自噬,大自噬和分子伴侣介导的自噬
1.1 自噬的类型 近来的研究表明,自噬是指细胞浆内的组成成分转运到溶酶体内被降解的过程。Christian de Duve现代细胞生物学创始人之一,于1963年提出该术语,用于解释早期电镜下观察的线粒体在双模囊泡中降解的现象,这个过程被称为自溶[6]。转运胞浆成分进入溶酶体降解的途径主要包括3种:小自噬,大自噬和分子伴侣介导的自噬(Chaperone-mediated Autophagy,CMA)[7](见图1)。
高等真核细胞中,小自噬是溶酶体变形后直接吞噬将要降解的物质,其分子机制不明。至今研究较多的是大自噬的分子机制和生理作用,一般所说的自噬都指大自噬。大分子自噬首先由来源不明的双层游离膜样结构形成杯状凹陷,然后包裹蛋白质、胞液和线粒体、内质网等细胞器,形成具有双层膜结构的自噬体,继而自噬体外膜与晚期内体和溶酶体融合,分别形成孢子体和自噬溶酶体,最终自噬体膜和自噬大分子在溶酶体中降解。目前在酵母中已经发现30多种自噬相关基因(命名为:ATG),并证实它们在自噬中发挥重要的作用。自噬在进化中有高度的保守性,在酵母、果蝇、线虫和哺乳动物中均发现自噬相关的同源基因,目前已经被免疫学家用于固有和适应性免疫研究[7]。
1.2 自噬发生过程 自噬囊泡形成和扩张过程中参与的蛋白分子及机制是当前研究和了解最多的,主要包括Atg8和Atg12两种泛素样蛋白系统。A tg4蛋白酶切除Atg8C-端的5个氨基酸,暴露出的C末端甘氨酸结合位点(G120)与自噬体内膜和外膜上的磷脂酰乙醇胺(PE)结合,使Atg8转变为膜偶联蛋白。Atg8与PE的结合除了需要暴露出其C末端的G120位点,还需要Atg7将其活化,然后与E2泛素样蛋白A tg3作用共价结合PE。自噬体形成后,外膜上的Atg8在Atg4的作用下可以再循环利用;与自噬体内膜结合的Atg8则与囊泡一同最终被溶酶体水解降解。
参与自噬体吞噬底物的蛋白分子目前还没有明确的报道[8,9]。除了Atg8在自噬体形成中发挥重要的作用以外,泛素化反应也是必需的。过程如下:A tg12在E1活化的Atg7以及E2共价结合的Atg10的辅助作用下,通过C末端甘氨酸残基与A tg5蛋白(K149)的赖氨酸残基结合,并与Atg16结合,形成A tg12-Atg5/Atg16复合体,该复合体在膜延伸的过程中位于自噬体的外膜,当自噬体形成后则被剪切掉,对于该复合体的功能目前还不完全了解。该复合体的组成还包括Ⅲ型磷脂酰肌醇3激酶(PI3K或VPS34)和Atg6/Beclin-1,其他组成成份可以调节这两种蛋白分子,VPS34和Atg6/Beclin1已经作为靶点用于调节自噬,3-甲基腺嘌呤、渥曼青霉素、LY294002(PI3K抑制剂)和锂常用于抑制这两种蛋白分子[10-13]。由于该复合体是Atg8共价结合所必需的,研究人员推测Atg5-Atg12/Atg16L1复合体可以催化Atg8脂化,并决定Atg8的附着位点[14,15]。用小干扰RNA作用于Atg6/Beclin-1或者Atg12-Atg5/Atg16能够抑制自噬的发生,而过表达Atg6/Beclin-1自噬则增强[16]。VPS34/Beclin-1,A tg5-Atg12/A tg16L1和Atg8-PE复合体全都参与形成转运囊泡,通过跨膜通道转运胞浆成份到溶酶体。
分子伴侣介导的自噬(CMA)是通过信号肽转运蛋白质到溶酶体。RNAse A,KFERQ等最初认为是传递CMA作用底物的信号肽,该信号肽能够被胞质内的 HSC70识别,那些未折叠的 CMA底物,在HSP40,Hip,Hop,Bag-1和HSP90的辅助作用下锚定于溶酶体膜,这种伴侣复合体能够依赖溶酶体相关膜蛋白(LAMP-2A)的C末端胞浆区指导CMA底物的锚定,LAMP-2A是单一跨膜分子,以多聚体的形式形成跨膜通道辅助HSC70将CMA作用底物转运到溶酶体内[17-20]。调节胞浆内HSC70和LAMP-2A能够影响CMA的转运水平,但是CMA仅在应激状态时上调,例如:饥饿[18]。
综上所述,目前认为至少有3条途径参与胞内成份的溶酶体降解,其中的大自噬和CMA,在固有和适应性免疫系统中的作用底物和特点已经比较明确。
2 自噬对病原体的作用
自噬选择性清除胞浆内细胞器和蛋白的功能还可以用于清除胞内细菌、寄生虫和病毒。自噬是唯一能够转运大分子到溶酶体的途径,该途径参与细胞自主清除胞内病原体,如果该功能受损,受感染的细胞只能通过其他途径导致细胞死亡,然后被吞噬细胞吞噬。
2.1 自噬对细菌的作用 自噬能够作用于胞浆内的微生物,也能够作用于吞噬体内的病原体[21]。自噬清除细胞内微生物最好的例子就是对A组链球菌属(GAS)的清除,自噬依赖的GAS清除伴随着直径较大的自噬液泡(10μm)的形成,一般哺乳动物自噬体直径多为0.5~1.5μm,这就说明自噬体有相当大的可塑性,被吞噬物质的大小决定了所形成游离膜的大小[5]。立克次体存在类似的现象[22]。
自噬清除胞内菌和寄生虫的另外一种常见机制是作用于包含病原体的吞噬小体,例如:结核分枝杆菌,巨噬细胞吞噬结核杆菌后形成吞噬囊泡,并防止其与溶酶体融合[23]。巨噬细胞被IFN-γ活化后增强对细菌的吞噬并促进吞噬囊泡与自噬体融合,从而降解病原体。在小鼠中IFN-γ诱导的免疫相关p47鸟苷三磷酸酶(IRGs)和LRG-47(IRGs成员之一)的过表达能够促进自噬体的形成以及自噬依赖的包含结核杆菌的自噬体的清除[23]。与结核杆菌类似,通过该机制清除的病原体还有鼠弓形体,与结核杆菌不同的是小鼠IFN-γ诱导的GTP酶:IIGP1和IGTP能够破坏包含鼠弓形体的囊泡膜,甚至破坏寄生虫的膜结构,从而使病原体暴露经自噬降解[24]。这些研究说明包含病原体的吞噬体可能需要加工处理才能够被有效清除。沙门氏菌能够诱导自噬并在囊泡中复制,只有当包含沙门氏菌的囊泡受损后才能够有效的通过自噬将其转运到溶酶体降解,这一现象更加证实了上述说法[25]。

图1 自噬的类型和发生过程Fig.1 The type and development of autophagy
2.2 自噬对病毒的作用 关于自噬在固有免疫中对病毒的作用目前了解的相对较少,尽管在几种病毒感染中发现了自噬体积聚,例如:人微小病毒B19和丙型肝炎病毒,但是自噬对它们的作用还不是很清楚。在Ⅰ型单纯疱疹病毒感染细胞形成的自噬体中能够观察到疱疹病毒颗粒的存在[26]。在体内,Atg6/Beclin-1的过表达能够抵抗病毒引起的脑炎,然而,自噬如何抵抗这些病毒还不清楚[27]。通过对水泡型口膜炎病毒(VSV)的研究提示,Toll样受体7可以识别这些病毒,并经自噬转运病毒复制中间体到内体。Atg5依赖的TLR7对病毒的识别,以及诱导Ⅰ型干扰素的分泌,均是细胞类型依赖的,VSV感染的小鼠胚胎成纤维细胞(MEFs)自噬存在时诱发产生的 Ⅰ型干扰素较没有自噬发生时减少[28]。RNA解螺旋酶维甲酸诱导基因1(RIG-1)主要介导VSV感染的MEFs细胞IFN的产生,Atg5-Atg12能够直接与RIG-1和下游IFN-β启动刺激因子1(IPS-1)相互作用。因此,自噬能够经PAMP受体识别病毒并通过分泌抗病毒Ⅰ型干扰素作用于病毒。
总之,自噬通过直接降解胞内微生物或者辅助宿主细胞抗感染等不同的机制介导细菌、寄生虫和病毒引起的固有免疫反应。
3 自噬与抗原提呈
蛋白酶体和溶酶体等胞内降解系统不仅可以用于清除不必要的胞内物质(例如:病原体),其降解产物还可以用于激活免疫系统。这些降解产物可以活化NKT等固有免疫细胞,也能够活化T细胞等适应性免疫细胞。自噬也具有类似的功能,自噬可以激活固有免疫细胞,此外,自噬作用的底物能够作为抗原提呈给适应性免疫细胞从而启动适应性免疫应答。
CD4+和CD8+T细胞可以分别监视溶酶体和蛋白酶体内抗原肽的形成,抗原肽与MHCⅠ类分子结合提呈给CD8+T细胞,与MHCⅡ类分子结合提呈给CD4+T细胞。MHCⅠ类分子的配体主要是短寿命的胞浆和胞核蛋白,例如:细胞周期蛋白[29]。蛋白酶体水解产物——多肽,通过抗原加工相关转运体(LAMP)被转运到内质网,在内质网中被氨基肽酶ERAAP进一步加工修饰然后装载到新合成的MHCⅠ类分子上[30,31]。只有稳定的与MHCⅠ类分子高亲和力结合的肽才能够被释放到胞浆,转运到细胞表面提呈给CD8+T细胞。MHCⅡ类分子与肽的结合在晚期内体中发生,即MHCⅡ类分子憩室(MIIC),MHCⅡ类分子在恒定链(Ii)的指导下进入憩室[32]。Ii链不仅能够防止未成熟的肽在内质网中与MHCⅡ类分子结合,还能够传递胞内选择信号,运送Ii/MHCⅡ类分子到MIIC中。Ii链在MIIC中,在溶酶体蛋白水解酶的作用下降解,最终在HLADM的协助下被高亲和力的肽所替代,抗原肽-MHCⅡ类分子复合物被转运到细胞表面活化CD4+T细胞。MHCⅡ类分子的配体由溶酶体蛋白水解作用产生,其可以通过内吞作用到达M IIC。然而,目前没有充足的证据说明MHCⅡ类分子配体来源于胞内蛋白的实际比例以及自噬传递这些蛋白到MIIC的途径(见图2)。
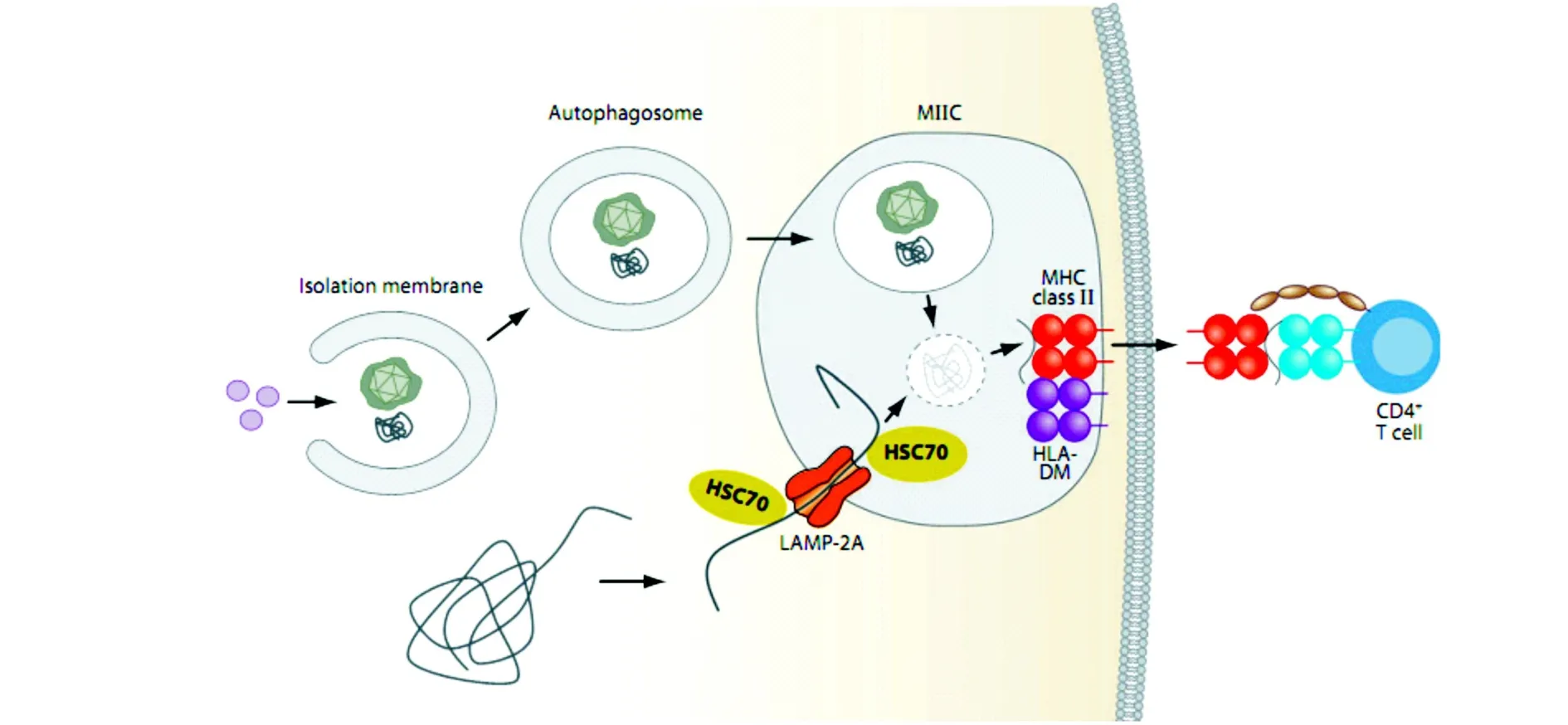
图2 自噬参与抗原加工处理及提呈的过程Fig.2 Antigen processing for major histocompatibility complex(MHC)classⅡpresentation via autophagy
哺乳动物自噬体与晚期内体的融合优先于与溶酶体的融合,游离的融合囊泡即晚期内体与MIIC具有相同的形态,自噬体也能够与MIICs融合,采用GFP-Atg8/LC3标记自噬体,可以观察自噬体与M IICs的融合[33,34,36]。有研究发现人内皮细胞、单核细胞来源的DCs、EB病毒感染的 B淋巴细胞系(LCLs)超过50%的MIICs接受自噬体的融合。免疫金电镜观察超微结果发现,包含GFP-Atg8/LC3-MHCⅡ类分子的小室类似大的多囊泡内体。而且,GFPAtg8/LC3和MHCⅡ类分子紧邻囊泡的内膜,主要维持MHCⅡ类分子与抗原肽的结合以及MHCⅡ类分子与HLA-DM的共区域化。因此,自噬体能够与MIICs融合,Atg8/LC3在晚期内体阶段传递底物到囊泡内膜与MHCⅡ类分子结合。
多数研究认为自噬除了可以参与MHCⅡ类分子的抗原提呈,自噬还可以协助经典的和非经典的MHCⅠ类分子的抗原提呈。Levine's实验室最近研究显示自噬可以使凋亡细胞更容易被吞噬细胞以及专职抗原提呈细胞DCs等摄入,从而促进交叉提呈。除了通过经典的MHC分子提呈抗原,自噬还可能传递其他病原体来源的成分到溶酶体降解并被免疫系统所识别。非经典的MHCⅠ类分子CD1d在MIICs与其糖脂类配体相结合[37,38],由于自噬体常与M IICs融合,溶酶体水解可以作用于脂质,所以自噬能够传递糖脂类配体与CD1d分子结合,然后提呈给NKT细胞。因此,自噬能够通过不同的机制提呈抗原给固有免疫和适应性免疫细胞。
4 自噬与T和B细胞发育及免疫应答
自噬影响适应性免疫应答的另外一种机制是影响适应性免疫细胞的发生和存活。自噬缺陷的B细胞和T细胞的分化受影响,免疫应答发生失衡。Atg5敲除的T细胞,CD4+和CD8+T细胞的发育均受损[39]。Atg5-/-T细胞除了分布到外周的数目减少,自噬缺陷的T细胞受刺激后增殖能力也下降。因此,自噬可以维持细胞的存活,而且自噬无论在T细胞发育早期阶段还是在外周增殖阶段都是必需的。然而,自噬并不一定对所有的免疫应答,尤其是不同类型的免疫应答都有利。在人类,Th2细胞主要参与体液免疫应答,能够积聚大量的自噬体,甚至到不健康的程度[40],用小干扰RNA作用于Atg7或Atg6/Beclin-1,营养缺乏的情况下可以抑制细胞死亡。而在Th1细胞介导的免疫应答中,通过自噬可以预防细胞死亡。这些数据说明,Th2细胞正常状况下,已经利用高水平自噬维持自身存活,营养成分的缺乏会经自噬促进细胞死亡。类似于T细胞的发生,祖B细胞在他们发育成前B细胞的过程中需要自噬的参与,B-1a细胞自噬功能减弱后其存活明显受到影响[41]。这些研究说明在T和B细胞的发育过程中自噬发挥重要的维持细胞存活的作用,而且这些淋巴细胞有很强的增殖能力,细胞增殖也需要自噬的参与。
5 自噬在适应性免疫应答和免疫耐受中的作用
自噬在3个水平上参与免疫应答:自噬可以直接清除胞内病原体,自噬还可以加工处理抗原后与MHCⅡ类分子结合提呈给适应性免疫细胞,最终在保护性免疫应答过程中维持适应性免疫淋巴细胞的增殖和存活。
目前有很多证据显示自噬对机体还具有保护性作用,自噬能够维持肌体对自身组织的免疫耐受。T细胞免疫耐受主要包括:中枢免疫耐受和外周免疫耐受,T细胞的阳性和阴性选择在自噬缺陷的胸腺内明显受损[42-44]。近来有研究报道,5种转基因CD4+T细胞种属中,其中两种Atg5缺失的胸腺组织不能进行有效的阳性和阴性选择,而且,Atg5缺失小鼠可以发生自身免疫性疾病。因此,自噬对于CD4+T细胞发育过程中所诱导的中枢免疫耐受是必需的。在胸腺阴性选择以后,那些逃脱的自身反应性T细胞在外周也会诱导耐受的产生,主要有两种细胞参与这个过程:未成熟DCs和淋巴结基质细胞[43,45]。由上述内容可见,自噬参与了CD4+T细胞中枢和外周免疫耐受的形成。
自噬维持免疫耐受的第三种机制是促进凋亡小体的清除,凋亡小体清除发生障碍可以导致系统性红斑狼疮的形成[46-48]。凋亡小体在系统性红斑狼疮患者局部聚集,产生了一个较高水平的自身抗原储存库,从而导致自身抗体的形成。自噬可以使被吞噬细胞吞噬的凋亡细胞的磷脂酰丝氨酸暴露于细胞表面。Atg6/Beclin-1或Atg5缺失的细胞,凋亡后不能够被有效吞噬。
因此自噬在适应性免疫应答中从不同的水平维持免疫耐受,第一是在中枢和外周耐受诱导过程中加工处理抗原并提呈给MHCⅡ类分子,第二是平衡免疫激活和耐受,第三促进自身抗原清除,避免活化自身反应性B细胞。
6 结论
自噬的分子组成决定了其在固有免疫和适应性免疫中的作用,自噬可以清除胞内病原体,加工处理病原体成分活化适应性免疫应答。自噬在CD4+T细胞的发育过程中通过自身抗原与MHCⅡ类分子结合,诱导中枢和外周免疫耐受的发生,并通过提呈抗原活化CD4+T细胞。而且,自噬利用维持细胞存活的功能,在免疫应答过程中有效的维持淋巴细胞扩增。自噬这些在固有免疫和适应性免疫中的作用目前在不同的模型中已经得到证实,但是在体内,自噬对免疫应答抵抗病原体和肿瘤的确切作用还需要更进一步的探讨。以自噬作为靶点治疗免疫相关疾病已经成为目前研究的热点。
1 Ciechanover A.Intracellular protein degradation:from a vague idea thru the lysosome and the ubiquitin-proteasome system and onto human diseases and drug targeting[J].Cell Death Differ,2005;12(9):1178-1190.
2 Ciechanover A,Finley D,Varshavsky A.Ubiquitin dependenceof selective protein degradation demonstrated in themammalian cell cyclemutant ts85[J].Cell,1984;37(1):57-66.
3 Henell F,Berkenstam A,Ahlberg Jetal.Degradation of short-and longlived proteins in perfused liver and in isolated autophagic vacuoles-lysosomes[J].Exp MolPathol,1987;46(1):1-14.
4 Sandoval H,Thiagarajan P,Dasgupta SKetal.Essential role for Nix in autophagicmaturation of erythroid cells[J].Nature,2008;454(7201):232-235.
5 Mizushima N,Klionsky D J.Protein turnover via autophagy:implications formetabolism[J].Annu Rev Nutr,2007;27:19-40.
6 Ashford T P,Porter K R.Cytoplasm ic components in hepatic cell lysosomes[J].JCell Biol,1962;12:198-202.
7 Mizushima N,Levine B,Cuervo A Metal.Autophagy fights disease through cellular self-digestion[J].Nature,2008;451(7182):1069-1075.
8 Pankiv S,Clausen T H,Lamark Tetal.p62/SQSTM 1 binds directly to Atg8/LC3 to facilitate degradation of ubiquitinated protein aggregates by autophagy[J].JBiol Chem,2007;282(33):24131-24145.
9 Bjorkoy G,Lamark T,Brech Aetal.p62/SQSTM1 forms protein aggregates degraded by autophagy and has a protective effect on huntingtin-induced cell death[J].JCell Biol,2005;171(4):603-614.
10 Levine B,K roemer G.Autophagy in the pathogenesis of disease[J].Cell,2008;132(1):27-42.
11 Seglen PO,Gordon P B.3-Methyladenine:specific inhibitorofautophagic/lysosomal protein degradation in isolated rat hepatocytes[J].Proc Natl Acad Sci USA,1982;79(6):1889-1892.
12 Blommaart E F,K rause U,Schellens JPetal.The phosphatidyli-nositol 3-kinase inhibitorswortmannin and LY294002 inhibit autophagy in isolated rat hepatocytes[J].Eur JBiochem,1997;243(1-2):240-246.
13 Criollo A,MaiuriM C,Tasdem ir Eetal.Regulation of autophagy by the inositol trisphosphate receptor[J].CellDeath Differ,2007;14(5):1029-1039.
14 Hanada T,Noda N N,Satom i Yetal.The Atg12-Atg5 conjugate has a novel E3-like activity for protein lipidation in autophagy[J].J Biol Chem,2007;282(52):37298-37302.
15 Fujita N,Itoh T,OmoriHetal.TheAtg16L complex specifies thesiteof LC3 lipidation formembrane biogenesis in autophagy[J].Mol BiolCell,2008;19(5):2092-2100.
16 K lionsky D J,Abeliovich H,Agostinis Petal.Guidelines for theuseand interpretation of assays for monitoring autophagy in higher eukaryotes[J].Autophagy,2008;4(2):151-175.
17 Dice JF.Peptide sequences that target cytosolic proteins for lysosomal proteolysis[J].Trends Biochem Sci,1990;15(8):305-309.
18 Massey A C,Zhang C,Cuervo A M.Chaperone-mediated autophagy in aging and disease[J].Curr Top Dev Biol,2006;73:205-235.
19 Cuervo AM,Dice JF.A receptor for the selective uptake and degradation of proteinsby lysosomes[J].Science,1996;273(5274):501-503.
20 Agarraberes FA,Terlecky SR,Dice JF.An intralysosomalhsp70 is required for aselectivepathway of lysosomalprotein degradation[J].JCell Biol,1997;137(4):825-834.
21 Schmid D,MunzC.Innate and adaptive immunity through autophagy[J].Immunity,2007;27(1):11-21.
22 Walker DH,Popov V L,Crocquet-ValdesPAetal.Cytokine-induced,nitric oxide-dependent,intracellular antirickettsialactivity ofmouse endothelial cells[J].Lab Invest,1997;76(1):129-138.
23 Gutierrez M G,Master S S,Singh S Betal.Autophagy is a defense mechanism inhibiting BCG and Mycobacterium tuberculosis survival in infectedmacrophages[J].Cell,2004;119(6):753-766.
24 Andrade R M,Wessendarp M,Gubbels M Jetal.CD 40 induces macrophage anti-Toxoplasma gondii activity by triggering autophagy-dependent fusion ofpathogen-containing vacuolesand lysosomes[J].JClin Invest,2006;116(9):2366-2377.
25 Birm ingham C L,Sm ith A C,Bakowski M Aetal.Autophagy controls Salmonella infection in response to damage to the Salmonella-containing vacuole[J].JBiolChem,2006;281(16):11374-11383.
26 Levine B,Deretic V.Unveiling the roles of autophagy in innate and adaptive immunity[J].Nat Rev Immunol,20;7(10):767-777.
27 Liang XH,Kleeman LK,JiangH Hetal.Protection against fatal Sindbis virusencephalitisby beclin,a novel Bcl-2-interacting protein[J].J VirolM,1998;72(11):8586-8596.
28 Jounai N,Takeshita F,Kobiyama Ketal.The Atg5 Atg12 conjugate associateswith innate antiviral immune responses[J].Proc NatlAcad Sci USA,2007;104(35):14050-14055.
29 Rammensee H,Bachmann J,Emmerich N Petal.SYFPEITHI:database for MHC ligands and peptidemotifs[J].Immunogenetics,1999;50(3-4):213-219.
30 Hammer G E,KanasekiT,Shastri N.The final touchesmake perfect the peptide-MHC classⅠrepertoire[J].Immunity,2007;26(4):397-406.
31 Pamer E,Cresswell P.Mechanisms of MHC classⅠrestricted antigen processing[J].Annu Rev Immunol,1998;16:323-358.
32 Trombetta ES,Mellman I.Cell biology of antigen processing in vitro and in vivo[J].Annu Rev Immunol,2005;23:975-1028.
33 Eskelinen E L.Maturation of autophagic vacuoles in mammalian cells[J].Autphagy,2005;1(1):1-10.
34 ZwartW,Griekspoor A,Kuijl Cetal.Spatial separation of HLA-DM/HLA-DR interactions within MIIC and phagosome-induced immune escape[J].Immunity,2005;22(2):221-233.
35 Chicz RM,Urban RG,Gorga JCetal.Specificity and promiscuity among naturally processed peptides bound to HLA-DR alleles[J].JExp Med,1993;178(1):27-47.
36 Schmid D,PypaertM,M¨unz C.MHC classⅡ antigen loading compartments continuously receive input from autophagosomes[J].Immunity,2007;26(1):79-92.
37 Kang S J,Cresswell P.Regulation of intracellular trafficking of human CD1d by association with MHC classⅡmolecules[J].EMBO J,2002;21(7):1650-1660.
38 Sullivan BA,Nagarajan NA,Kronenberg M.CD1 andMHCⅡfind differentmeans to the same end[J].Trends Immunol,2005;26(5):282-288.
39 PuaH H,Dzhagalov I,Chuck Metal.A critical role for the autophagy gene Atg5 in T cell survivaland proliferation[J].JExpMed,2007;204(1):25-31.
40 Li C,Capan E,Zhao Yetal.Autophagy is induced inCD4+T cellsand important for the growth factor-withdrawal cell death[J].J Immunol,2006;177(8):5163-5168.
41 M iller B C,Zhao Z,Stephenson LMetal.The autophagy gene ATG5 playsan essential role in B lymphocyte development[J].Autophagy,2008;4(3):309-314.
42 Starr T K,Jameson SC,HogquistK A.Positive and negative selection of T cells[J].Annu Rev Immunol,2003;21:139-176.
43 Steinman RM,Hawiger D,NussenzweigM C.Tolerogenic dendritic cells[J].Annu Rev Immunol,2003;21:685-711.
44 Nedjic J,Aichinger M,Emmerich Jetal.Autophagy in thymic epithelium shapes the T-cell repertoire and is essential for tolerance[J].Nature,2008;455(7211):396-400.
45 Lee JW,Epardaud M,Sun Jetal.Peripheral antigen display by lymph node stroma promotes T cell tolerance to intestinal self[J].Nat Immunol,2007;8(2):181-190.
46 Qu X,Zou Z,SunQetal.Autophagy gene-dependent clearance of apoptotic cells during embryonic development[J].Cell,2007;128(5):931-946.
47 Mellen M A,de la Rosa E J,Boya P.Theautophagicmachinery isnecessary for removalof cell corpses from thedeveloping retinal neuroepithelium[J].Cell Death Differ,2008;15(8):1279-1290.
48 BijlM,Reefman E,Limburg PCetal.Inflammatory clearance of apoptotic cells after UVB challenge[J].Autoimmunity,2007;40(4):244-248.
[收稿2010-06-21 修回2010-08-05]
(编辑 张晓舟)
R392.1
A
1000-484X(2010)12-1146-06
10.3969/j.issn.1000-484X.2010.12.023
林庆国(1970年-),男,硕士,讲师,主要从事心血管免疫方面的研究,E-mail:496487518@qq.com。
·分子与细胞免疫学·
