利用生物芯片技术检测人参皂苷Rg1对小鼠树突状细胞功能调控相关基因表达的影响①
2010-02-06周英武彭桂英顾立刚殷胜骏
周英武 彭桂英 顾立刚 殷胜骏
(北京中医药大学中医药防治病毒性疾病教育部重点实验室,北京 100029)
利用生物芯片技术检测人参皂苷Rg1对小鼠树突状细胞功能调控相关基因表达的影响①
周英武 彭桂英 顾立刚 殷胜骏
(北京中医药大学中医药防治病毒性疾病教育部重点实验室,北京 100029)
目的:利用基因芯片技术检测人参皂苷Rg1对小鼠骨髓来源DC细胞功能调控相关基因表达的影响。方法:分离C57小鼠骨髓细胞,经GM-CSF、IL-4体外诱导培养6天的未成熟DC细胞(iDC)经不同因素处理并分为:对照组(Ⅰ)、人参皂苷Rg1组(Ⅱ)、内毒素(LPS)组(Ⅲ)、Rg1+LPS组(Ⅳ),24小时后收集各组细胞,抽提总RNA,利用树突状和抗原呈递细胞基因芯片对细胞功能相关基因进行检测。结果:(Ⅱ/Ⅰ)上调≥2倍基因23个,下调≥2倍基因45个;(Ⅲ/Ⅰ)上调≥2倍基因15个,下调≥2倍基因47个;(Ⅳ/Ⅱ)上调≥2倍基因35个,下调≥2倍基因15个;(Ⅳ/Ⅲ)上调≥2倍基因37个,下调≥2基因10个。这些基因功能主要涉及细胞因子分泌及其受体表达、抗原摄取、抗原提呈、细胞表面受体、信号传导。结论:人参皂苷Rg1对DC作用涉及多个基因的表达调控,这些基因控制并影响着DC功能、分化和成熟,为进一步寻找药物靶点提供了线索。
人参皂苷Rg1;树突状细胞;基因芯片
人参具有的补气生血和扶正祛邪等功效与其调 节机体免疫系统功能密切相关,人参皂苷单体Rg1(ginsenoside Rg1)是人参三醇组皂苷的一个代表性单体,被认为是其主要活性成分,对心血管、神经系统及免疫功能等具有广泛的药理作用[1-3]。树突状细胞(Dendriticcell,DC)是机体内最重要、功能最强的专职抗原提呈细胞,它启动并连接了天然免疫和获得性免疫,特异性地激活T、B淋巴细胞,通过募集炎性分子在炎症部位的聚集以及自身在病灶的浸润,参与炎性反应[4,5]。前期研究表明,人参皂苷Rg1具有促进成熟树突状细胞表面粘附分子和共刺激分子的表达,刺激T细胞增殖等作用[6]。为进一步探讨其调控机制,我们采用了基因芯片技术,检测人参皂苷Rg1对DC细胞功能调节相关基因表达的影响。
1 材料与方法
1.1 实验材料 人参皂苷Rg1购于中国药品生物制品检定所(批号 110703-200424),淡黄色粉末,用RPM I1640溶液配制成2 mg/m l的溶液,并用0.22 μm的滤器(Millpore)过滤除菌;TRIZOL试剂(Invitrogen life technologies);Oligo Dendritic&Antigen Presenting CellGene Array(OMM-406,SuperArray)。
1.2 实验方法
1.2.1 细胞培养及分组处理 按照文献[7]略做改进,制备树突状细胞。无菌条件下取C57小鼠骨髓细胞,计数,用完全 RPMI1640培养基调节浓度为1×106个/m l细胞悬液接种于培养皿中,并加入GMCSF(终浓度为40 ng/m l)及IL-4(终浓度为20 ng/m l),37℃,5%CO2条件下培养6天。第3、5天半量换液,并补充相应细胞因子。在培养的第6天将iDC进行分组,经不同处理:对照组(Ⅰ)不做任何处理;人参皂苷Rg1组(Ⅱ)加入 Rg1使其终浓度为40 μg/ml;LPS组(Ⅲ)加入LPS使其终浓度为1μg/ml;人参皂苷Rg1+LPS组(Ⅳ)分别加入人参皂苷Rg1和LPS使其终浓度分别为40μg/m l和1μg/ml;37℃,5%CO2条件下培养24小时后,收集各组细胞。
1.2.2 RNA抽提及质量检测 加入TRIZOL试剂反复吹打裂解细胞,抽提RNA,用DNaseⅠ消化RNA样品,去除其中可能含有的基因组DNA,然后用RNeasy MinEluteTM纯化试剂盒(Qiagen)纯化所得RNA,紫外吸收测定法和变性琼脂糖凝胶电泳检测RNA浓度和纯度。
1.2.3 cDNA标记与合成 将样品RNA进行逆转录反应合成cDNA,在逆转录反应液中加入RNA扩增缓冲液,生物素标记的UTP和扩增酶类混合液,合成生物素标记的cRNA探针,然后使用SuperArray ArrayGrade cRNA纯化试剂盒纯化cRNA探针。
1.2.4 芯片杂交 将纯化的cRNA探针在GEAhyb杂交液中与Oligo GEA rray芯片杂交。
1.2.5 化学发光检测 探针与芯片杂交后,加入链亲和素偶联的碱性磷酸酶(AP)及化学发光底物反应。X射线胶片曝光后,在胶片上显示检测结果。
1.2.6 图像采集和数据分析 X射线曝光胶片后,将胶片上的图像扫描并转换为灰度TIFF格式的图片文件。运行ScanAlyze软件,将灰度TIFF格式图片的点阵转化为数字型数据,将此原始数据储存为M icrosoft Excel文件。运用GEA rray表达分析配套软件(GEArray Expression Analysis Suite)进行完整的芯片数据分析。
2 结果
2.1 RNA提取并鉴定 Ⅰ、Ⅱ、Ⅲ、Ⅳ组的RNA溶液A260/A280的比值在1.8~2.0之间。变性琼脂糖凝胶电泳RNA条带清晰,28S∶18S rRNA条带亮度接近 2∶1,结果见图 1。
2.2 基因芯片检测结果分析
2.2.1 基因芯片分析 芯片上包含260个与抗原提呈细胞功能相关的基因,另外包括管家基因7个、阴性对照基因及背景点等28个,共计12行、24列。为监控芯片杂交体系的整个过程,在芯片上设置阴性对照,杂交时信号很低,说明背景低。此外管家基因转录水平平均无显著变化,说明芯片的结果具有良好的稳定性和可靠性,结果见图2。
2.2.2 差异基因的统计 使用6μg的cRNA样品,是芯片上的大部分表达丰度较高的基因信号。经终浓度为40μg/m l的人参皂苷Rg1和 1μg/m l LPS处理24小时后,人参皂苷Rg1组与对照组相比较(Ⅱ/Ⅰ)上调≥2倍基因23个,下调≥2倍基因45个;LPS组与对照组相比较(Ⅲ/Ⅰ)上调≥2倍基因15个,下调≥2倍基因 47个;人参皂苷 Rg1+LPS组与人参皂苷 Rg1组相比(Ⅳ/Ⅱ)上调≥2倍基因35个,下调≥2倍基因 15个;人参皂苷 Rg1+LPS组与LPS组相比(Ⅳ/Ⅲ)上调≥2倍基因37个,下调≥2倍基因10个。表1和表2显示的是差异表达值高于5倍或小于0.2倍。
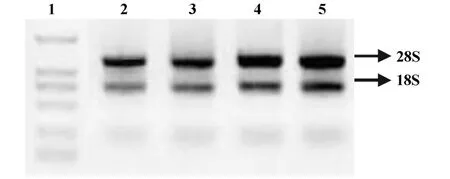
图1 RNA变性琼脂糖凝胶电泳图Fig.1 RNA denaturing agarose gelelectrophoresis
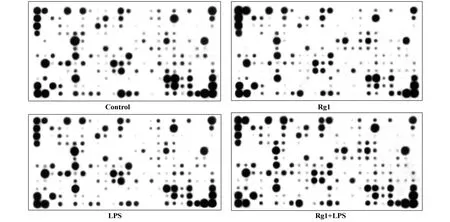
图2 基因芯片扫描结果Fig.2 The Results ofm icroarray after scan
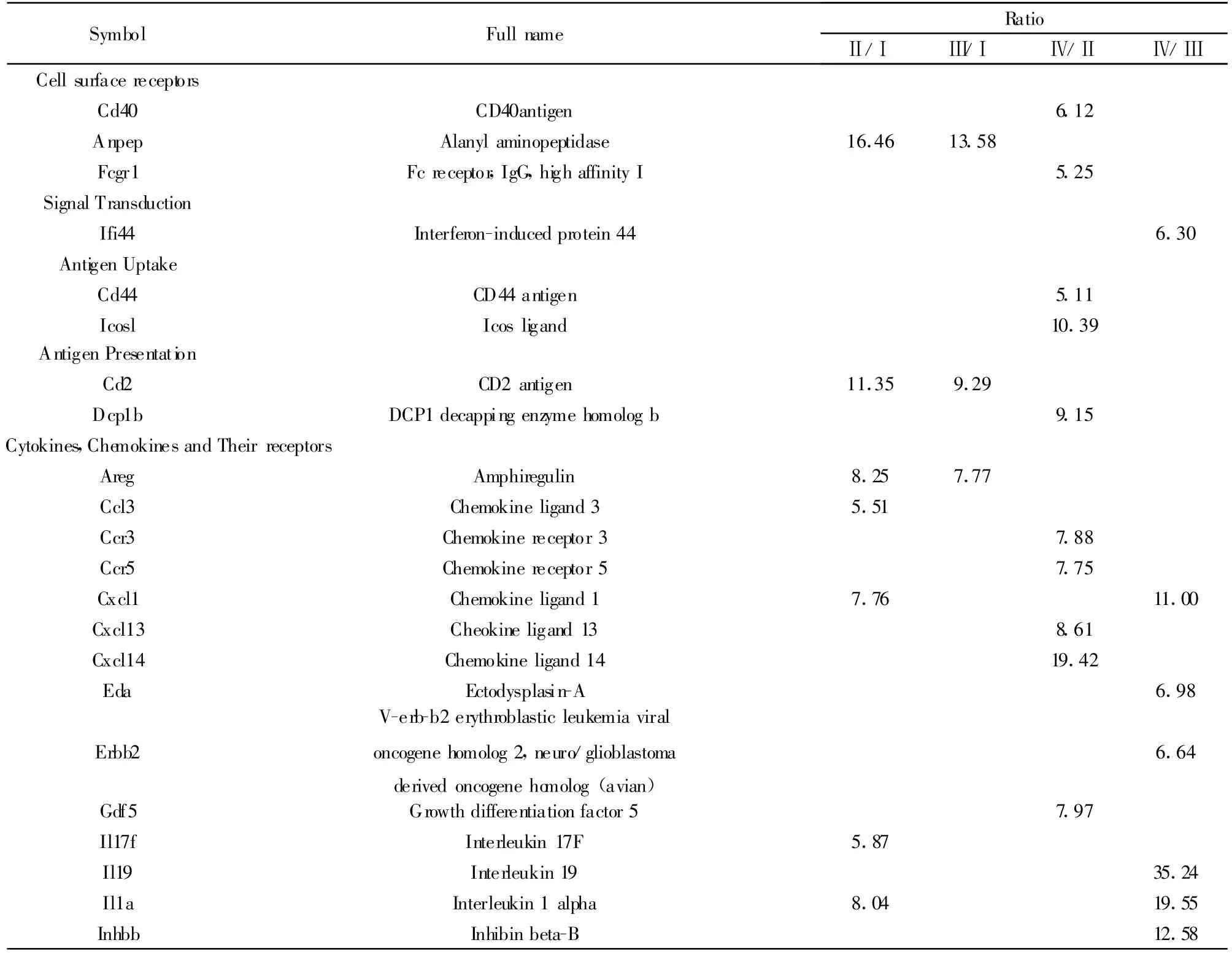
表1 差异表达明显上调的基因(大于5)Tab.1 Significant up-regulation of gene expression(above 5)
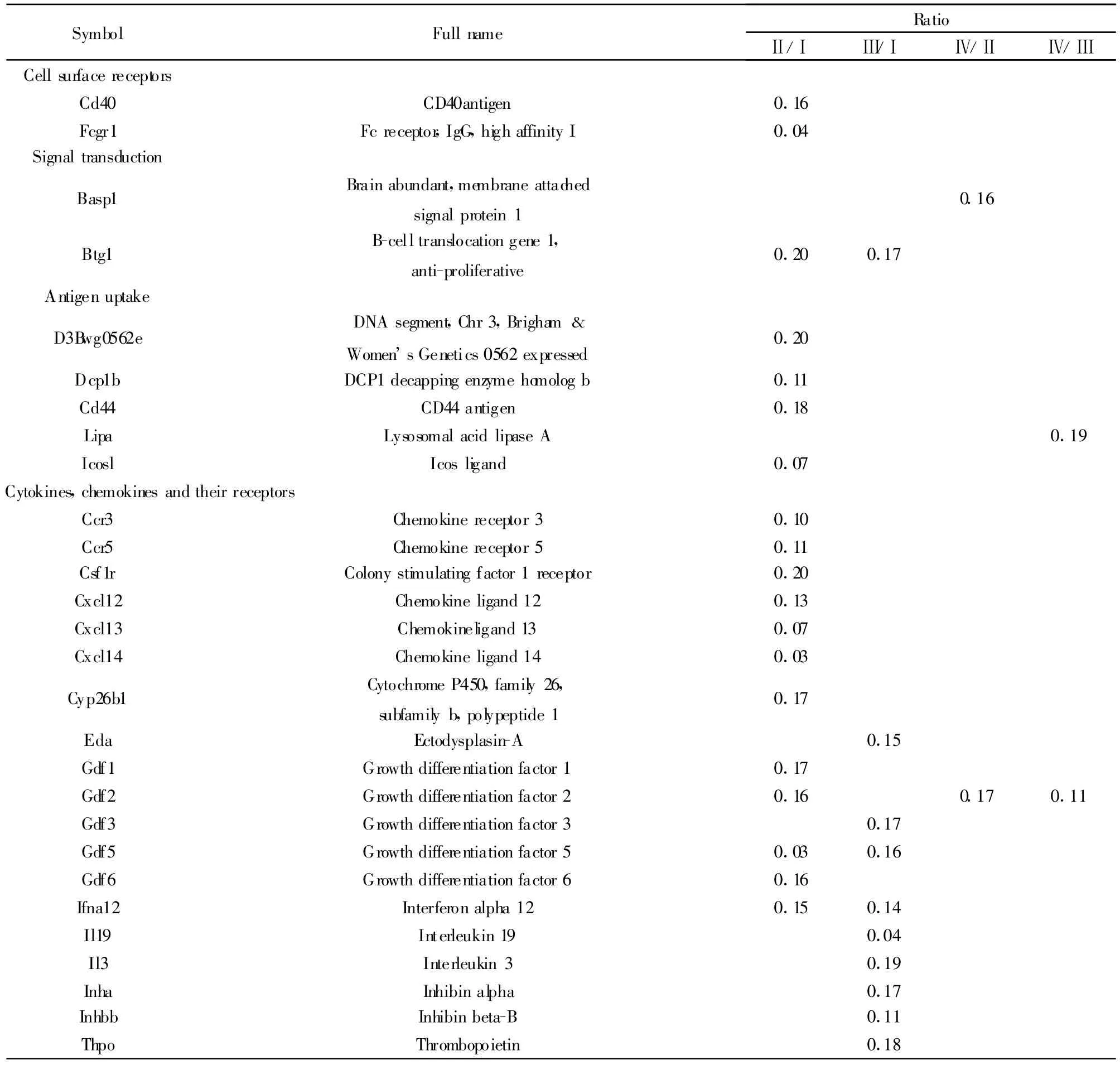
表2 差异表达明显下调的基因(小于0.2)Tab.2 Significant down-regulation of gene expression(below 0.2)
3 讨论
人参皂苷Rg1是人参的主要活性物质,具有增强免疫力及抗衰老活性。有研究表明,Rg1可通过增强前体DC与血管内皮细胞的粘附,从而促进DC前体细胞的移行和发育成熟;增加DC分泌IL-12 P40蛋白及其mRNA的转录,刺激T细胞的增殖及增强LPAK细胞杀伤肿瘤的活力,具有启动和增强免疫应答的作用,但其机制有待进一步研究[8,9]。基因芯片是一种特异、高效、快速的现代检测技术,被广泛用于免疫学研究,如免疫细胞的分化、成熟、活化以及表型的改变,它能同时检测上千个基因的变化,全面反映细胞基因变化水平。现代免疫学认为,基因变化与免疫药理存在一定联系,在研究药物对机体免疫系统的调节,寻找药物靶向,基因芯片更体现其优越性,可以为中药药理研究提供了一种有效途径[10]。
DC是最强的抗原提呈细胞,能活化初始T细胞,是特异性免疫应答的启动因素[11]。本实验取C57小鼠骨髓来源细胞,用人参皂苷Rg1处理,基因芯片检测不同状态DC功能相关基因的表达,研究发现,不同剂量浓度 Rg1作用于DC,发现40μg/ml浓度能显著促进树突状细胞分泌IL-12等细胞因子,因此基因芯片分析采用此浓度。同时发现,经人参皂苷Rg1处理后的DC,不论是在成熟还是非成熟阶段,其功能相关基因表达都发生了明显变化,这些基因对DC的迁移、抗原摄取、抗原吞噬、抗原提呈以及自身分化成熟起着至关重要的作用。初步研究显示,人参皂苷Rg1和LPS对iDC作用主要表现为协同促进作用,在一定意义上可认为,人参皂苷Rg1促进了mDC的功能。这些基因在DC发育的不同阶段,其表达水平可以一致,也可不同,有时甚至相反。如:在iDC阶段,人参皂苷 Rg1促进了 Anpep、Areg、ccl25 、cd2 、cd1d1、cd5、Csf3、Cxcl1、Ifi44 、Ifit1、IL-12b 、IL-17f、IL-1a、IL-4、Lta、Mx2、Tnfrsf11 基因表达,在与LPS共同作用于DC细胞后,这些基因的表达仍然处于一种高水平状态,这种一致性说明,人参皂苷Rg1促进了DC的基因表达。其中,cd2、cd1d1、Mx2具有抗原呈递摄取功能;Anpep、Ifi44、Ifit1、Lta为信号传导分子;cd5是细胞表面受体 ;A reg、ccl25、Csf3、Cxcl1、IL-1a、IL-4、IL-12b、IL-17f、Tnfrsf11b 是细胞因子、趋化因子及其受体。以上结果表明人参皂苷Rg1对DC的调控可能涉及到多个靶点。
从实验结果发现,在Ⅳ/Ⅲ(即LPS+Rg1组/LPS组)差异表达基因中,Erbb2和Ifi44均高表达。Erbb2作为细胞表面膜受体,是表皮生长因子受体(EGFR)家族成员之一[12];而Ifi44又称p44,位于胞浆内,是IFN-α/β的诱导基因,是干扰素抗病毒途径中的一个重要分子[13]。考虑到Erbb2是EGFR家族成员,我们认为Rg1可能通过和DC表面EGFR相结合,从而启动EGFR-p44MAPK信号通路从而产生下游的作用。而且单纯用Rg1刺激DC,也发现Ifi44转录水平明显增高(比值为2.8),进一步证实我们推测的可能性。
此外,我们用ELISA检测人参皂苷Rg1影响DC分泌IL-12和IL-4的情况(数据待发表),发现二者均上调,这也和基因芯片结果(IL-12和IL-4差异表达值分别为3.84和2.57)一致,一方面证明基因芯片结果的可靠性,另一方面表明人参皂苷Rg1影响DC的功能,诱导了混合型Th1/Th2免疫反应,这与人参具有的双向调节作用一致。
综上所述,人参皂苷Rg1对DC功能调控涉及多基因、多靶点,这些基因贯穿了DC分化、成熟与凋亡整个过程,控制着DC的细胞因子分泌、受体表达、吞噬和抗原提呈功能。但有关EGFR-p44MAPK信号通路以及差异表达明显上调的相关蛋白功能还有待进一步研究确定。
1 ChengY,Shen LH,Zhang JT.Anti-amnestic and anti-aging effectsofginsenoside Rg1 and Rb1 and itsmechanism of action[J].Acta Pharmacol Sin,2005;26(2):143-149.
2 Zhang JT.Nootropicmechanisms of ginsenoside Rg1--influence on neuronal plasticity and neurogenesis[J].Acta Pharm Sin,2005;40(5):385-388.
3 Zhao CH,Chen XC,Zhu Y Getal.Rolesof telomere and telomerase in the processofginsenoside Rg1 protection against tert-butyl hydroperoxideinduced senescence in WI-38 cells[J].Chin Pharmacol Bull,2005;21(1):61-66.
4 Gervais A,ToutiraisO,Bouet-Toussaint Fetal.In vitro antitumor lymphocyte generation using dendritic cells and innate immunity mechanisms as tumor cell treatments[J].Anticancer Research,2007;27(4B):2385-2392.
5 Watanabe S,YamakawaM,HiroakiTetal.Correlation of dendritic cell infiltration with active crypt inflammation in ulcerative colitis[J].Clin Immunol,2007;122(3):288-297.
6 王 毅,郝 钰,邱全瑛etal.人参皂甙Rg1、Rh1对树突状细胞刺激T细胞增殖及LPAK抗肿瘤活性的影响[J].中国免疫学杂志,2003;19(4):248-252.
7 Boudreau J,Koshy S,Cummings D,Wan Y.Culture ofmyeloid dendritic cells from bonemarrow precursors[J].JVis Exp,2008;25(17):769-769.
8 王 毅,王本祥,刘铁汉etal.人参皂苷Rg1的肠内菌代谢Ⅱ.人参皂苷Rg1和Rh1免疫活性[J].中国药理学报(英文版),2000;21(9):792-796.
9 王 毅,郝 钰,娄金丽etal.人参皂苷Rg1和 Rh1对树突状细胞功能的影响[J].中国病理生理杂志,2004;20(10):1764-1764.
10 马宇滢,张新民.基因芯片技术在免疫学研究中的应用及其对中医药研究的启发[J].中西医结合学报,2004;2(2):90-93.
11 Stuart LM,LucasM,Simpson Cetal.Inhibitory effectsof apoptotic cell ingestion upon endotoxin-drivenmyeloid dendritic cellmaturation[J].J Immunol,2002;168(4):1627-1635.
12 Alison Reid,Laura Vidal,Heather Shawetal.Dual inhibition of ErbB1(EGFR/HER1)and ErbB2(HER2/neu)[J].Euro JCancer,2007;43(3):481-489.
13 Lin L,Hwang Y,Chen E Y.Gene-gene and gene-environmentinteractions in interferon therapy for chronic hepatitis C[J].FutureMedicine,2007;8(10):1327-1335.
[收稿2010-04-29 修回2010-07-09]
(编辑 倪 鹏)
Identification of the regulatory effect of Ginsenoside-Rg1 on functional regulation gene expressing in murine dendritic cell by bio-chip technology
ZHOUYing-Wu,PENGGui-Ying,GULi-Gang,YINSheng-Jun.KeyLaboratoryofChineseMedicineonViralInfectious Disease,BeijingUniversityofChineseMedicine,MinistryofEducation,Beijing100029,China
Objective:cDNA microarrary technique was emp loyed to detect the effects of ginsenoside-Rg1 on functional regu lation of gene expressing inmurinemarrow-derived dendritic cells.Methods:Immature dendritic cells(iDC)derived from bonemarrow of C57m ice were induced by GM-CSF and IL-4 for six days in vitro and
different treatments for 24 h.Then the cellswere divided into themedia control group(Ⅰ),ginsenoside Rg1 group(Ⅱ),LPSgroup(Ⅲ)and ginsenoside Rg1 plus LPSgroup(Ⅳ).24 h later,total RNA of the cells was collected,and four chips ofOligo Dendritic&Antigen Presenting CellGene Array were used to investigate the transcription levels of the functional genes from dendritic cells.Results:Therewere twenty-three genes up-regulated and forty five genes down-regulated two-folds above inⅡ/Ⅰ;fifteen genes up-regulated and forty seven genes down-regulated two-folds above inⅢ/Ⅰ;thirty fivegenesup-regulated and fifteen genes down-regulated two-folds above inⅣ/Ⅱ;thirty seven genes up-regulated and ten genes down-regulated two-folds above inⅣ/Ⅲ.The function of these genes involves the secretion of the cytokines and the exp ression of their receptors,antigen uptake and p resentation,cell surface receptors and signal transduction.Conclusion:The effects of ginsenoside-Rg1 on dendritic cell involve in multi-regulation and expression of geneswhich contribute to the functions,differentiation and maturation of the dendritic cells.This study provides a clue to further seek the target ofmedicine.
Ginsenoside-Rg1;Dendritic cell;Microarrary
R285.5
A
1000-484X(2010)12-1086-05
10.3969/j.issn.1000-484X.2010.12.007
①本文为国家自然科学基金青年科学基金资助项目(No.30701105)
周英武(1974年-),男,在读博士,讲师,主要从事中医药免疫调节的分子机制研究,E-mail:zhouyingwuhn@163.com;
及指导教师:彭桂英(1978年-),女,博士,副教授,主要从事中医药免疫调节的分子机制研究,E-mail:penggy@bucm.edu.cn。
