辅助性T细胞亚群在小鼠EAE模型视神经中的变化①
2010-02-06张荣伟田阿勇禹红梅中国医科大学附属第一医院老年病干诊科沈阳110001
张荣伟 田阿勇 禹红梅 陈 蕾 (中国医科大学附属第一医院老年病干诊科,沈阳 110001)
辅助性T细胞亚群在小鼠EAE模型视神经中的变化①
张荣伟 田阿勇②禹红梅③陈 蕾④(中国医科大学附属第一医院老年病干诊科,沈阳 110001)
目的:探讨辅助性T细胞亚群Th1、Th2、Th17及Treg在小鼠EAE模型视神经炎发病机制中的意义。方法:C57BL/6小鼠随机分为佐剂对照组(n=16)、EAE模型组(n=48),免疫后第11、15、19天分批处死小鼠,观察视神经组织的病理改变。ELISA方法检测视神经IFN-γ、IL-4、IL-17的蛋白含量;Real-time PCR方法检测视神经组织IFN-γ、IL-4、IL-17和Foxp3的基因表达。结果:免疫后第11天IL-17的蛋白及mRNA的表达比正常对照组明显增高(14.255±0.790 vs 10.615±0.664;0.798±0.137 vs 0.083±0.013,均P<0.05),免疫后第19天IFN-γ的蛋白及mRNA的表达比对照组明显增高(21.060±1.821 vs 12.845±0.970;0.617±0.070 vs 0.089±0.014,均P<0.05),IL-4的蛋白及mRNA的表达与对照组比较减少(10.227±0.767 vs 14.258±0.885;0.089±0.014 vs 0.250±0.047,均P<0.05)。Foxp3mRNA的表达由免疫后11天、15天至19天与对照组比较均明显减少(1.068±0.121,0.495±0.064,0.605±0.021 vs 3.087±0.194,P<0.01)。结论:EAE小鼠视神经Foxp3和Treg表达减少可能为视神经炎发生发展的重要因素;IL-17在EAE小鼠视神经炎的早期阶段介导炎症损伤,IFN-γ在发病的高峰期加重了EAE小鼠视神经的炎症损伤。
EAE;视神经;白介素17;干扰素γ、白介素4;叉头蛋白3
①本文为辽宁省教育厅资助项目(2009A733)
②中国医科大学附属第一医院麻醉科,沈阳110001
③中国医科大学附属第一医院神经内科,沈阳110001
④中国医科大学附属第一医院眼科,沈阳110001
视神经炎(Optic neuritis,ON)是累及视神经的急 性或亚急性炎症,是神经眼科临床最常见的疾病之一,西方国家文献报道原发性或特发性脱髓鞘性视神经炎(Idiopathic demyelinatingoptic neuritis,IDON)是临床最为常见的类型,该类型的视神经炎和多发性硬化(Multiple sclerosis,MS)的发病密切相关,二者有共同的病理改变[1,2]。流行病学研究表明70%的MS病人存在视神经炎,10%~20%的MS病人临床首发症状为视神经炎,而且具有很高的转化为MS的风险[3-5]。对视神经炎的早期识别与干预具有重要意义。从现有资料看,国内外脱髓鞘性视神经炎的分子免疫学研究并不多见,CD4+T辅助细胞(Th)是重要的免疫调节细胞,根据其分泌的细胞因子不同,分为Th1、Th2细胞亚型,Th1细胞主要分泌IFN-γ、TNF-α等细胞因子,具有促炎症反应作用;Th2细胞主要分泌IL-4、IL-6、IL-10等细胞因子,具有抗炎作用[6]。最近研究发现一类不同于Th1和Th2的细胞亚群,它们不表达IL-4或IFN-γ,却高水平分泌IL-17,被命名为Th17细胞,Th17细胞被证实能通过分泌炎症介质IL-17诱导严重的自身免疫反应[7]。调节性T细胞(CD4+CD25+regulatory T cell,Treg),约占外周CD4+T细胞的5%~10%,具有很强的免疫抑制能力[8]。叉头蛋白3(forkhead/winged helix transcription factorp3,Foxp3)是FOX蛋白家族成员之一,主要表达于CD4+CD25+调节性T细胞,是Treg的特异性标志,调节 Treg发育和发挥功能的重要开关[9]。在EAE/MS发病机制的研究中,以往学者们更关注于脑与脊髓的病变,而缺乏对视神经病变的研究,尤其对辅助性T细胞亚群在小鼠EAE模型视神经中的变化报道很少。本研究通过ELISA、荧光定量PCR技术检测Th1、Th2、Th17细胞因子IFN-γ、IL-4、IL-17以及Foxp3在视神经组织的蛋白及基因表达,旨在探讨小鼠EAE模型视神经的免疫环境变化,研究辅助性T细胞亚群Th1、Th2、Th17和Treg在发病机制中的意义。
1 材料与方法
1.1 材料 健康6~8周龄的雌性野生型C57BL/6小鼠(SPF15)共 64只,体重16~18克,购于上海斯莱克实验动物有限责任公司,许可证号:SOXK(沪)2007-0005;MOG35-55多肽MEVGWYRSPFSRVVHLYRNGK由西安美联多肽合成有限公司合成,合成纯度HPLC>99%;结核杆菌冻干粉、百日咳菌液(北京生物制品研究所);完全弗氏佐剂(Sigma公司);细胞因子ELISA试剂盒(北京博奥森公司);逆转录试剂盒(TaKaRa公司);Real time PCR试剂盒(TaKaRa公司);H-600型透射电镜(日本);Olympus BX51荧光显微镜(日本Olympus公司);ABI 7500 PCR仪(美国ABI公司);
1.2 方法 动物购进后适应性喂养2周,随机分为佐剂对照组(简称C),模型组(简称M),其中模型组又分为免疫后11天、免疫后15天和免疫后19天3个时间点,分别简称M11、M 15、M19,每组16只动物。
1.2.1 EAE模型制备 取MOG35-55 10 mg溶于2.5ml生理盐水,取TB 17.5mg溶于2.5m l CFA(TB 1mg/m l),充分乳化制备抗原乳剂(MOG 200μg/m l,TB 4mg/ml)。二组小鼠分别于背部脊柱中线两侧各选二个进针点皮下注射相应抗原,0.2 m l/只,以生理盐水为对照,记免疫当天为0天,第0、2天予模型组腹腔注射百日咳菌液0.1ml(含百日咳杆菌109个),对照组予等量生理盐水。免疫后第7天以相同抗原乳剂重复免疫。
1.2.2 行为学观察 小鼠经MOG免疫后,每日由观察者按EAE症状评分标准对小鼠进行功能评分,直至MOG免疫后19天。评分标准[11]:0分:无任何临床症状;1分:尾部张力消失,可见轻度步态笨拙;2分:双后肢无力,被动翻身后可以恢复;3分:双后肢瘫痪,被动翻身后不能恢复,但给予刺激后可以挪动;4分:双后肢瘫痪,前肢瘫痪或肌力减弱伴尿便失禁;5分:濒死状态或死亡。症状介于两者标准之间者以±0.5计。
1.2.3 标本收集及形态学观察 分别于免疫后11天、15天、19天分批处死各组小鼠,快取双侧视神经,低温匀浆后取上清,用于ELISA检测;2.5%戊二醛固定后,常规方法制备电镜切片;预冷PBS清洗后,置于DEPC处理过的冻存管中,投入液氮罐,4小时后转入-70℃冰箱冻存备用。
1.2.4 IL-17、IL-4、IFN-γ细胞因子的ELISA 检测采用ELISA双抗体夹心ABC法,加入酶标板检测。检测程序按照试剂盒说明书进行。洗板后加入TBM显色,置反应板于酶标仪上读取OD值,制备标准曲线,求出小鼠视神经组织中IL-17、IFN-γ、IL-4蛋白的含量。
1.2.5 PCR实验 (1)RNA提取及逆转录反应:采用Trizol法抽提各组视神经总RNA,将经过稀释后的RNA样本进行逆转录,反应体系如下:5×Buffer 2 μl,RTEnzymeMix Ⅰ 0.5 μl,OligodT(50Um)0.5μl,Total RNA(1 μg/μl)1.0,Random 6mers(100Um)0.5 μl,RNase Free dH2O up to 20μl,反应条件:37℃15分钟,85℃5秒。(2)Real-time PCR:引物委托TaKaRa公司合成(见表1),按照说明书用蒸馏水配成0.2 μmol/L浓度,将制备好的cDNA进行PCR扩增,扩增体系如下:SYBR-green(2×)10μl,PCR Forward Primer(10 Um)0.4 μl,PCR Reverse Primer(10 Um)0.4 μl,ROX Reference DyeII(50×)0.4μl,预变性95℃10秒检测关;变性95℃5秒检测关;退火 60℃34秒检测关;延伸72℃45秒检测开;变性、退火和延伸重复45个循环。以标准品梯度的测量结果绘制标准曲线,以计算各样品所测基因的含量,各样品目的基因的含量除以其管家基因的含量,即得到样品校正后的基因相对含量。实验引物见表1。

表1 各细胞因子基因的引物序列Tab.1 Cytokine prem ier sets for Real-time PCR
1.3 统计学处理 采用SPSS13.0软件包统计,计量资料用±s,采用双尾t检验,P<0.05有统计学差异。
2 结果
2.1 EAE小鼠行为学变化 免疫后14天左右,小鼠出现运动功能障碍,评分开始上升,发病后表现为慢性进展型,临床神经功能评分见图1。
2.2 视神经超微结构 电镜所见正常视神经纤维较细,髓鞘密度较为均匀(图2A)。免疫后第11天,少部分有髓神经轴索破坏,个别轴索内线粒体轻度肿胀;髓鞘不规则扭曲,板层结构消失(图2B)。免疫后第15天,大部分有髓神经轴索破坏,神经纤维髓鞘明显水肿,不规则增厚或板层状结构排列疏松(图2C)。免疫后第19天,绝大多数视神经均有较明显的病变,表现为不同程度脱髓鞘:髓鞘板层状分离、剥脱,轴突轴膜与髓鞘间有间隙形成,轴突髓鞘部分向内向外突起,或板层分离范围扩大,夹杂着髓鞘半环形套叠、轴索水肿,电子密度低,细胞器消失,轴突呈空泡样和均质状,微管消失,甚至可见髓鞘塌陷(图2D)。
2.3 EAE小鼠视神经IL-17、IL-4、IFN-γ蛋白含量的变化 IL-17蛋白含量检测显示:与对照组比较,M11组含量明显增加(P<0.05),M 15组含量仍有增加(P<0.01),M 19组与对照组比较无显著性差异(P>0.05);IFN-γ蛋白含量检测显示:与对照组比较,M 15组含量增加(P<0.01),M19组显著增加(P<0.01),M11组与对照组比较无显著性差异(P>0.05);IL-4蛋白含量检测显示:与对照组比较,M 19组减少(P<0.01),M 11、M 15组蛋白含量无明显变化(P>0.05)。细胞因子蛋白的表达趋势如图3所示。

图1 EAE小鼠神经功能评分变化Fig.1 The clinical score of EAE mice
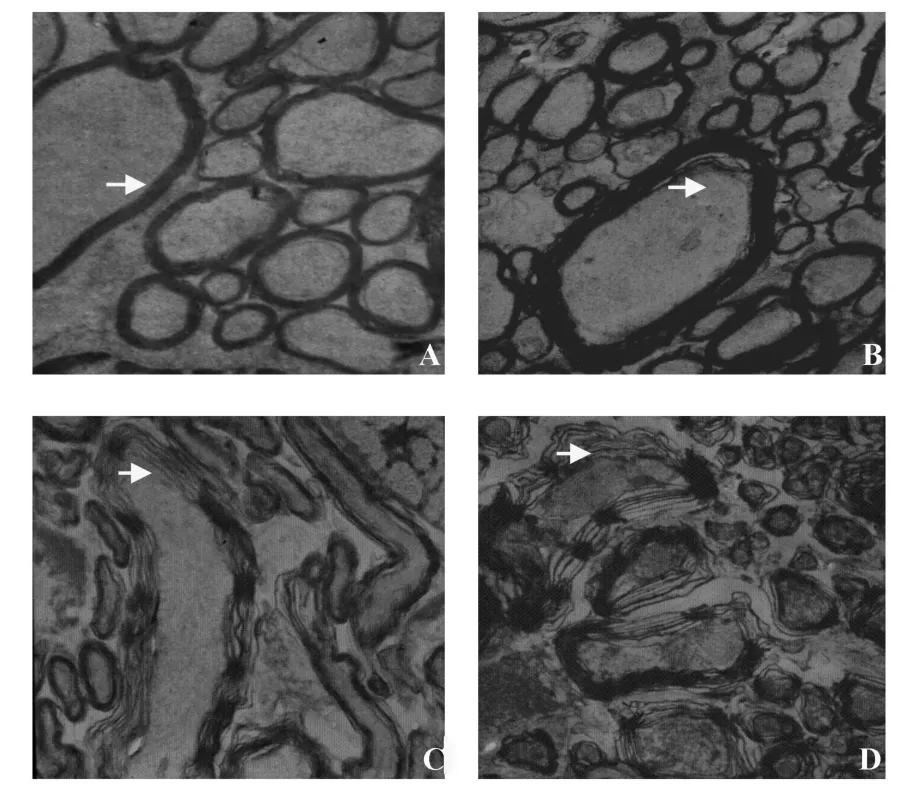
图2 EAE小鼠视神经超微结构Fig.2 Ultra structure in the optic nerve of EAE m ice

图3 EAE小鼠视神经IL-17、IFN-γ、IL-4蛋白的表达Fig.3 Expression of IL-17,IFN-γ,IL-4 proteins in the optic nerve of EAEm ice

图4 细胞因子及其转录因子Real-time PCR的融解曲线Fig.4 Melt curve of IL-17,IFN-γ,IL-4 and Foxp3 mRNA of Real-time PCR
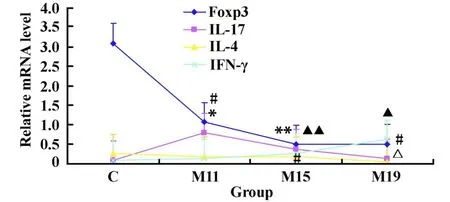
图5 EAE 小鼠视神经 IL-17、IFN-γ、IL-4、Foxp3mRNA的时程表达Fig.5 Expression of IL-17,IFN-γ,IL-4,Foxp3 mRNA in the optic nerve
2.4 IL-17、Foxp3、IL-4 、IFN-γmRNA 在 EAE 小鼠视神经的表达 结果如图4所示,融解曲线呈单峰,说明PCR反应特异性很好,生成单一产物。细胞因子mRNA的表达与其蛋白的表达规律一致,与对照组比较,M11组、M 15组视神经IL-17 mRNA的表达增加(分别P<0.01,P<0.05),M19组表达逐渐下降(P>0.05);M15组视神经IFN-γmRNA表达增多,(P<0.05),M 19组表达最明显(P<0.01);Foxp3 mRNA在 M11、M15、M19组表达均明显减少(P<0.01);IL-4mRNA在M 19组表达下降,与对照组比较有统计学差异(P<0.05)。细胞因子mRNA的表达趋势如图5所示。
3 讨论
多年来关于视神经炎的发病机制缺乏深入系统的研究,原发性或IDON是临床最为常见的类型,该类型的视神经炎和MS的发病密切相关,二者有共同的病理改变。在众多有关MS的发病机制的学说中,具有更为充分的证据且广为多数学者接受的理论是T淋巴细胞(Th0细胞)向致炎性的Th1细胞类型分化,致使Th1和Th2细胞(抗炎性Th细胞类型)平衡失调进而导致一系列炎症细胞因子和化学因子释放,从而引发中枢炎症[12-13]。然而近来研究发现一种主要由活化的T细胞产生的具有较强致炎性的细胞因子IL-17能启动和刺激多种细胞产生多种致炎性细胞因子和化学因子等,导致炎症产生[14-16]。缺失Th17细胞能防止或减轻自身免疫性脑脊髓炎(EAE)等自身免疫病的发病[17]。此外,研究表明CD4+CD25+调节性T细胞在维持外周免疫耐受中起重要作用,其数量减少或功能缺失可导致自身免疫性疾病的发生。然而目前对于不同的辅助性T细胞亚群及其细胞因子在EAE小鼠视神经的表达规律缺乏深入系统的研究,本文对此作一初步探讨,对于发病机制的认识及有效的干预具有重要意义。
本研究对上述CD4+T辅助细胞特异性细胞因子的蛋白及mRNA表达的研究发现小鼠致敏早期,即发病前出现IL-17的转录及翻译高峰,开始发病后明显下降,而IFN-γ在发病前表达较少,开始发病时表达增加,发病高峰时表达明显增加,研究结果提示Th17细胞在EAE小鼠早期视神经炎的发病中发挥重要作用,而Th1细胞在延长或促进后期组织炎症反应方面发挥主导作用。与Korn等[18]的研究结果类似,他们对EAE小鼠局部组织检测到的炎症介质的动态分析发现,IL-17出现高峰的时间早于IFN-γ,而且IFN-γ在IL-17消失后仍维持了很长的时间。IFN-γ的分泌滞后于IL-17的分泌提示Th1及Th17的分化表达具有阶段性。
本文对Treg及Th2细胞因子及转录因子的研究发现,在小鼠致敏早期,即发病前出现Foxp3 mRNA表达的减少,且持续至发病的高峰期,而IL-4 mRNA表达只在发病高峰时出现轻微的减少,提示二者可能在疾病的不同时期发挥作用。Venken等[19]在一项对复发-缓解型多发性硬化和继发进展型多发性硬化患者的研究中发现:两组患者的CD4+CD25+T细胞均没有明显的数量和表型异常,继发进展型多发性硬化患者CD4+CD25+T细胞上Foxp3表达水平和对INF-γ产生的抑制功能也是正常的,而RR-MS患者CD4+CD25+T细胞Foxp3表达减少,对CD4+CD25+T细胞增殖和INF-γ产生的抑制功能下降。证明了CD4+CD25+T细胞的抑制活性与疾病持续时间的关联性,CD4+CD25+T细胞的功能在疾病早期更易受影响。研究证明Foxp3 mRNA与Treg细胞的表达频率一致[20,21],因此本研究通过对Foxp3mRNA检测,结果提示Treg在EAE小鼠视神经的早期分化或功能受到抑制。
总之,Foxp3和Treg表达减少,其抑制功能下降,使 Th17、Th1、Th2 细胞的分化和增殖异常 ,表现为视神经Th细胞在发病的早期阶段优先向Th17亚群分化,在发病的高峰期优先向Th1亚群分化,分泌大量的 IL-17、IFN-γ、TNF-α等促炎细胞因子,而具有抗炎作用的Th2类细胞因子IL-4的基因表达量在发病的早期阶段无明显变化,在发病高峰期则出现轻微的减少,致使促炎和抗炎力量失衡,这是EAE小鼠视神经炎发生发展的重要因素。检测病程不同阶段IL-17、IFN-γ、Foxp3基因表达将可能作为该病的临床诊断手段,而应用药物或其他手段调节Th17/Treg、Th1/Th2亚群保持平衡,抑制促炎细胞因子分泌,将对该病的临床防治具有重要作用。
1 M iller N R,Newman N J,Biousse Vetal.Walsh and Hoyt clinicalNeuro-ophthalmology[M].6th eds.Baltimore:LippincottWilliams&W ilkins,2005:293-326.
2 Beck RW,Trobe JD,Moke P S Detal.High-and low-risk profiles for the developmentofmultiple sclerosiswithin 10 yearsafter optic neuritis:experience of the optic neuritis treatment trial[J].Arch Ophthalmol,2003;21:944-949.
3 Cohen MM,Lessell S,Wolf PA.A prospective study of the risk of developingmultiple sclerosis in uncomplicated optic neuritis[J].Neurology,1979;29:208-213.
4 Rizzo JF,LessellS.Risk of developingmultiple sclerosis after uncomplicated optic neuritis:A long-term prospective study[J].Neurology,1988;38:185-190.
5 Beck RW,Arrington J,Murtagh F Retal.Brain magnetic resonance imaging in acute optic neuritis.Experience of the optic neuritis study group[J].Arch Neurol,1993;50:841-846.
6 Hu P,Pollard J,HuntNetal.Microvascular and cellular responses in the optic nerve of rats with acute experimental allergic encephalomyelitis(EAE)[J].Brain Pathol,1998;8:475-483.
7 Park H,LiZ,Yang X Oetal.A distinct lineage ofCD4 T cells regulate tissue inflammation by producing interleukin 17[J]Nat Immunol,2005;6(11):1133-1141.
8 Robin JB,Phillips TM,Rao N A.Anti-myelin basic protein antibodyin experimental allergic optic neuritisand encephalomyelitis[J].Oph-thalmic Res,1985;17:174-180.
9 Hayreh SS.Experimental allergic encephalomyelitis.Ⅱ.Retinalandother ocularmanifestations[J].InvestOphthalmol Vis Sci,1981;21:270-281.
10 Kuertena S,Kostova-BalesaDA,Frenzel L Petal.MP4-and MOG:35-55-induced EAE in C57BL/6 mice differentially targets brain,spinal cord and cerebellum[J].JNeuroimmunol,2007;189(1-2):31-40.
11 Kerr JF,Wyllie A H,Currie A R.Apoptosis:a basic biological phenomenon with wide-ranging implications in tissue kinetics[J].Br JCaneer,1972;26(4):239-257.
12 White CA,Nguyen K B,Pender P.B Cell apoptosis in the central nervous system in experimental autoimmune encephalomyelitis:roles of B cellCD95,CD95L and Bcl-2 expression[J].J Autoimmun,2000;14(3):195-204.
13 Khoruts A,Miller S D.Neuroantigen-specific Th2 cells are inefficient suppressors of expe-rimental autoimmune encephalomyelitis induced by effector Th1 cells[J].JImmunol,1995;155:5011-5017.
14 Harrington LE,Hatton RD,Mangan P Retal.Interleukin 17-producing CD4+effector T cells develop via a lineage distinct from the T helper type 1 and 2 lineages[J].Nat Immunol,2005;6:1123-1132.
15 Claire L,Langrish,Yi Chenetal.IL-23 drivesa pathogenic T cellpopulation thatinducesautoimmune inflammation[J].JExpMed,2005;201:233-240.
16 Chen Xin,Winkler-PickettRobin T,CarbonettiNicholasHetal.Pertussis toxin as an adjuvant suppresses the number and function of CD4+CD25+T regulatory cells[J].Eur J Immunol,2006;36(3):671-680.
17 Yutaka Komiyama,Susumu Nakae,Taizo Matsukietal.IL17 play an important role in the development of experimental autoimmune encephalomyelitis[J].J Immunol,2006;177:566-573.
18 Korn J,GaoW,Reddy Jetal.Melin-specific regulatory T cellsaccumulate in the CNS but fail to control autoimmune inflammation[J].Nat Medicine,2007;13:423-431.
19 Venken K,Hellings N,Hensen Ketal.Secondary progressive in contrast to relapsing-remi ttingmultiple scleros ispatients show a normal CD4+CD25+regulatory T-cell function and FOXP3 expression[J].JNeuro sci Res,2006;83(8):1432-1446.
20 Sakaguchi S,SakaguchiN,Asano Metal.Immunologic self-tolerance maintained by ativated T cells expressing IL-2 receptor alpha-chains(CD 25),Breakdown of a singlemechanism of self-tolerane causesvariousautoimmune diseases[J].J Immunol,1995;155:1151-1164.
21 Janson PC L,WinerdalM E,Marits Petal.Foxp3 promoter demyelination reveals the com itted Treg regulation in hummans[J].PloS ONE,2008;3(2):e1612-e1612.
[收稿2010-06-25 修回2010-09-08]
(编辑 倪 鹏)
Alteration of T helper cell subsets in the optic nerve of experimental autoimmune encephalomyelitis
ZHANGRong-Wei,TIANA-Yong,YUHong-Mei,CHENLei.DepartmentofGeriatrics,theFirstAffiliatedHospitalof ChinaMedicalUniversity,Shenyang110001,China
Objective:To detect protein and gene expression of interleukin-17(IL-17),interferon-gamma(IFN-γ),interleukin-4(IL-4)and forkhead/winged helix transcription factor p3(Foxp3)in optic nerve and further to explore the role of T helper cell subsets such as Th1,Th2,Th17,Treg in the pathogenesis of optic neuritis of experimentalautoimmune encephalomyelitis(EAE).Methods:Mice in C57BL/6 background were randomly divided into control group and EAE group,at the day 11,15 and 19 post-immunization,optic nerveswere dissected for morphological study,to detect IL-17,IFN-γ,IL-4.Protein analysiswas done by Enzyme-linked immunosorbentassay(ELISA).Quantitative realtime polymerase chain reaction(PCR)was used formeasuring the gene expression of IL-17,IFN-γ,IL-4 and Foxp3.Results:The concentrations of IL-17 protein in theoptic nervewere significantup-regulated at11 days post-immunization,and sowere IFN-γprotein concentrations in 19 days.Concentrations of IL-4 protein in the optic nerve declinesslightly in19 days(P<0.05,respectively).ThemRNA expression of IL-17,IFN-γand IL-4 was consistentwith their protein expression(P<0.05,respectively).Foxp3 mRNA transcription was down-regulated from 11 days to 19 days post-immunization(P<0.01,respectively).Conclusion:Decreased expression of Foxp3mRNA and Treg in optic nervemay p lay a key role in developmentof optic neuritis.IL-17maymediate inflammatory pathogenicity at the early stage of optic neuritis,and IFN-γ may aggravate inflammatory injury during the peak stage of optic neuritis.
EAE;Optic nerve;IL-17;IFN-γ;IL-4;Foxp3
R741
A
1000-484X(2010)12-1101-05
10.3969/j.issn.1000-484X.2010.12.010
张荣伟(1971年-),女,博士,副教授,主要从事神经免疫方面的研究,E-mail:zhangrongwei916@sina.com。
