抗淋病LTB-PorB核酸疫苗与蛋白疫苗联合应用增强免疫应答的研究①
2010-02-06戴志兵胡四海刘清南王玉峰张愉快余敏君朱翠明李忠玉陆春雪
戴志兵 胡四海 刘清南 陈 敏 王玉峰 张愉快 余敏君 朱翠明 李忠玉 陆春雪
(南华大学病原生物学研究所,衡阳 421001)
抗淋病LTB-PorB核酸疫苗与蛋白疫苗联合应用增强免疫应答的研究①
戴志兵 胡四海 刘清南②陈 敏 王玉峰 张愉快 余敏君 朱翠明 李忠玉 陆春雪
(南华大学病原生物学研究所,衡阳 421001)
目的:初步探讨抗淋病LTB-PorB核酸疫苗与蛋白疫苗联合免疫的免疫增强效应,为研制抗淋病疫苗提供实验依据。方法:大量制备核酸疫苗(pcDNA3.1(-)/ltB-porB)及重组蛋白疫苗(rLTB-PorB);通过鼻饲途径将核酸疫苗和蛋白疫苗采用核酸初免-蛋白加强(DNA prime-p rotein boost)联合免疫以及分别单独免疫雌性BALB/c小鼠,同时设PBS及空质粒(pcDNA3.1(-))对照组,检测各组体液免疫和细胞免疫应答水平。结果:免疫后第56天,联合免疫组小鼠生殖道sIgA A450(1.083±0.179)、血清IgGA450(1.023±0.116)、脾淋巴细胞诱生的IL-4[(357.58±34.44)/pg/m l]和IFN-γ[(261.85±29.92)/pg/m l]水平均明显高于各对照组(P<0.01),小鼠脾淋巴细胞增殖率(SI:2.12±0.29)较对照组显著增高(P<0.05);核酸疫苗组、蛋白疫苗组和联合免疫组血清IgG亚类IgG2a/IgG1比值分别为1.678、0.455和0.693。结论:LTB-PorB核酸疫苗和蛋白疫苗联合免疫组诱导的特异性体液免疫应答和细胞免疫应答水平明显优于单独的核酸疫苗组和蛋白疫苗组,且以诱导Th2倾向性免疫应答为主。
淋病;孔蛋白B;大肠杆菌不耐热肠毒素 B亚单位;核酸疫苗;蛋白疫苗;联合免疫
淋球菌是引起淋病的病原菌,淋病是我国目前发病人数最多的性传播疾病,感染淋球菌还可增加HIV传播的危险性[1]。如何有效控制和预防淋病,成为全世界普遍关注的公共卫生问题,而研制出有效的疫苗,是预防和控制淋病的关键。淋球菌孔蛋白B(Porin B,PorB)是最具潜力的淋病疫苗候选抗原之一,大肠杆菌不耐热肠毒素B亚单位(B subunitof Escherichia coli heat-labile enterotoxin,LTB)是一种有效的粘膜佐剂[2],本课题组将二者结合构建LTBPorB融合基因的原核及真核表达载体。前期研究工作表明,单一LTB-PorB核酸疫苗免疫小鼠后能诱导一定水平的细胞免疫,单一LTB-PorB蛋白疫苗能诱导一定水平的体液免疫,但二者单独免疫均难以同时诱导高水平的体液免疫和细胞免疫应答。目前采用不同类型的疫苗联合免疫,如核酸初免-蛋白加强免疫(DNA prime-protein boost)策略被认为能有效提高疫苗的免疫效果[3]。本研究采用抗淋病LTBPorB核酸疫苗与蛋白疫苗联合鼻饲免疫雌性BALB/c小鼠,探讨其能否同时增强特异性体液免疫及细胞免疫应答水平,为研制高效抗淋病疫苗提供实验依据。
1 材料与方法
1.1 材料
1.1.1 菌株和实验动物 pcDNA3.1(-)、pcDNA 3.1(-)/ltB-porB的E.coliJM109重组克隆菌、pET-30a、pET-30a/ltB-porB的E.coliBL21重组表达菌均由本室保存;PorB蛋白由本室提供;SPF级4~6周雌性BALB/c小鼠购自南华大学实验动物学部。
1.1.2 主要试剂 质粒提取试剂盒(去内毒素)购自OMEGA公司;Ni-NTA6×His亲和层析纯化试剂盒购自Qiagen公司;一抗:兔抗淋球菌血清和兔抗霍乱弧菌肠毒素(Choleratoxin,CT)血清分别购自Abcam和Sigma公司;二抗:HRP标记羊抗鼠 IgG。gG1、IgG2a和sIgA分别购自Abcam和Sigma公司;Detoxi-GelTM内毒素去除胶购自Thermo Scientific公司;BCA蛋白浓度测定试剂盒购自碧云天公司。
1.2 方法
1.2.1 核酸疫苗及蛋白疫苗的制备 将本室保存的包含pcDNA3.1(-)、pcDNA3.1(-)/ltB-porB的E.coliJM109重组克隆菌扩增培养,提取质粒经PCR和BamHⅠ与HindⅢ双酶切鉴定正确后,去内毒素质粒提取试剂盒大量提取真核质粒,核酸蛋白定量分析仪测定浓度后,调整核酸浓度为2 500μg/ml。将本室保存的包含pET-30a、pET-30a/ltB-porB的E.coliBL21重组表达菌扩增培养,对温度、IPTG和时间等诱导表达条件进行系列摸索优化后,表达并获得包涵体蛋白。对表达后重组蛋白(rLTB-PorB)分别以兔抗淋球菌血清为一抗,兔抗CT血清(LT与CT具有80%以上的同源性且免疫学性质十分相似,可用兔抗CT血清代替兔抗LT血清[4])为一抗;HRP标记羊抗兔IgG为二抗,按文献[5]操作,行Western blot鉴定后大量诱导表达,Ni-NTA亲和层析纯化柱pH梯度洗脱法纯化蛋白并通过尿素梯度透析复性;去除重组蛋白内毒素后测定蛋白浓度并调整蛋白浓度为1 250 μg/ml。
1.2.2 动物免疫 将75只4~6周雌性BALB/c小鼠随机分成A、B、C、D、E 5组,每组 15只:A组(PBS对照组)、B组(空质粒 pcDNA3.1(-)对照组)、C组(核酸疫苗pcDNA3.1(-)/ltB-porB组)、D组(蛋白疫苗rLTB-PorB组)、E组(联合免疫 pcDNA3.1(-)/ltB-porB+rLTB-PorB组);PBS 40 μl/次、pcDNA3.1(-)及核酸疫苗100μg/次、蛋白疫苗50μg/次,各组均于0、14、28、42天采用鼻饲途径免疫 4次(联合免疫组0、14天为核酸疫苗,28、42天为蛋白疫苗)。
1.2.3 免疫小鼠标本的收集 于0、14、28、42、56天收集小鼠生殖道灌洗液100μl;收集小鼠尾静脉血50~80μl并分离血清,所有标本于-20℃保存;末次免疫结束后14天(第56天),无菌分离各组小鼠脾淋巴细胞。
1.2.4 小鼠生殖道粘膜sIgA的检测 用重组蛋白PorB抗原包被ELISA板,以各次收集的小鼠生殖道灌洗液为一抗,以酶标羊抗鼠sIgA为二抗,间接ELISA法检测PorB特异性sIgA水平。
1.2.5 血清总IgG和亚类IgG1、IgG2a的检测 用重组蛋白PorB抗原包被ELISA板,以各次收集的小鼠血清为一抗,以酶标羊抗鼠IgG为二抗,间接ELISA法检测PorB特异性IgG水平;以末次免疫后14天(第56天)小鼠血清为一抗,分别以酶标羊抗鼠IgG1、IgG2a为二抗,间接ELISA法检测PorB特异性IgG1、IgG2a 水平 。
1.2.6 脾淋巴细胞分泌细胞因子IFN-γ、IL-4的检测 末次免疫后14天(第56天)常规方法无菌分离各组小鼠脾脏淋巴细胞,细胞计数,调整细胞浓度至6×106m l-1,加入24孔培养板中,1m l/孔;每组的每个培养孔中加入PorB抗原 10μg,37℃、5%CO2培养箱中孵育48小时,小心吸出上清,以ELISA试剂盒分别检测上清中的IFN-γ、IL-4的水平,具体操作按试剂盒说明书进行。
1.2.7 脾淋巴细胞增殖实验 末次免疫后14天(第56天)常规方法无菌分离各组小鼠脾脏淋巴细胞,细胞计数,调整细胞浓度至1×106m l-1,加入96孔培养板中,200μl/孔;每只小鼠脾细胞重复8孔,其中4孔为空白对照组,不加抗原;另4孔为实验组,每孔加入 PorB抗原 2μg,混匀后,置 37℃、5%CO2培养48小时。于终止培养前4小时每孔加入5 mg/m l的噻唑蓝(MTT)20μl,继续培养4小时后弃上清,每孔加入二甲基亚砜(DMSO)150μl,震荡溶解15分钟,570 nm波长测定各孔的A570值。根据刺激指数(SI)大小来判断增殖程度。SI=试验组平均A570值/对照组平均A570值。
1.3 统计学处理 运用SPSS16.0软件进行分析。抗体水平、脾细胞刺激指数及细胞因子水平以±s表示,组间均数的比较采用方差分析,以P<0.05表示差异有统计学意义。
2 结果
2.1 核酸疫苗及蛋白疫苗的鉴定 本室保存的pcDNA3.1(-)/ltB-porB经PCR和BamHⅠ与HindⅢ双酶切均能得到预期目的条带(图1)。Western blot结果显示,重组质粒pET-30a/ltB-porB表达纯化产物(rLTB-PorB)与兔抗淋球菌血清和兔抗CT血清均能发生特异性反应,均在预期位置出现单一特异性目的条带,而阴性对照组则没有特异性条带(图2、3)。

图1 真核重组载体的PCR和酶切鉴定图谱Fig.1 PCR of eukaryotic recombinant and digested products with Bam HⅠ and H indⅢ

图2 rLTB-PorB的W estern blot鉴定(以兔抗淋球菌血清为一抗)Fig.2 Analysis of rLTB-PorB by W estern b lot(with rabbit serum of anti-Neisseria gonorrhoeae)
2.2 小鼠生殖道粘膜抗PorB特异性sIgA的检测PorB蛋白作为检测用抗原,包被 ELISA板,间接ELISA 法对0、14 、28、42、56天收集的小鼠生殖道灌洗液中的sIgA进行检测。结果显示:在4次不同时间的免疫中,C组(pcDNA3.1(-)/ltB-porB)、D组(rLTB-PorB)、E组(pcDNA3.1(-)/ltB-porB+rLTB-PorB)sIgA水平呈上升趋势,其中C组第 56天A450达0.542±0.040,效价高达 1∶320;D 组第 56 天A450达0.702±0.053,效价高达1∶1 280;E组第56天A450达1.083±0.179,效价高达1∶2 560;三组 sIgA 水平明均显高于A 组(PBS组,A450:0.132±0.013)、B组(pcDNA 3.1(-)组,A450:0.127±0.025),且 E组明显高于C、D组(P<0.01),见图4,结果说明诱导特异性粘膜免疫(sIgA)的水平,联合免疫组>蛋白疫苗组>核酸疫苗组。
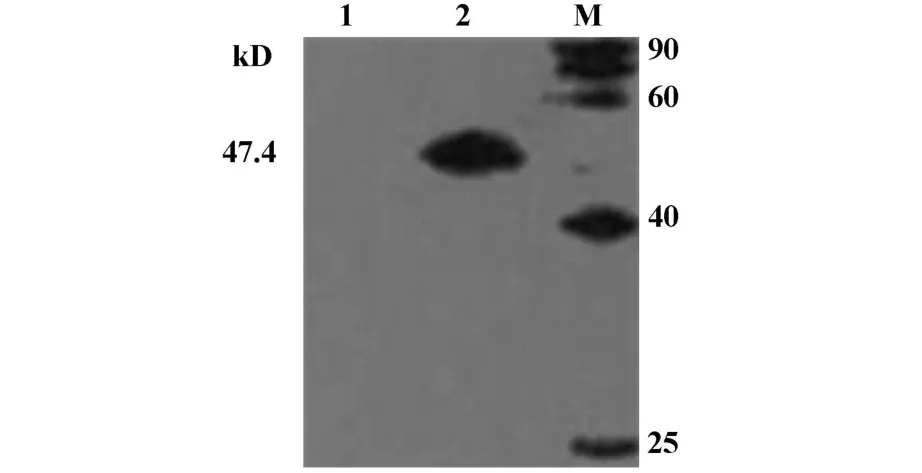
图3 rLTB-PorB的Western blot鉴定(以兔抗CT血清为一抗)Fig.3 Analysis of rLTB-PorB by Western blot(with rabbit serum of anti-CT)

图4 鼻饲小鼠生殖道灌洗液抗PorB特异性sIgA水平Fig.4 sIgA levels of PorB in five intranasally immunized groups

图5 鼻饲小鼠血清抗PorB特异性IgG抗体水平Fig.5 IgG levels of PorB in five intranasally immunized groups

图6 各组免疫小鼠IgG1、IgG2a水平Fig.6 IgG1 and IgG2a levels of PorB in five intranasally immunized groups
2.3 小鼠血清抗PorB特异性IgG的检测 PorB蛋白作为检测用抗原,包被ELISA板,间接ELISA法对0、14、28、42、56天收集的小鼠血清中的 IgG进行检测。结果显示:在4次不同时间的免疫中,C、D、E组 IgG水平呈上升趋势,其中C组第56天A450达0.541±0.054,效价高达1∶1 280;D组第42天达最高,A450为0.772±0.091,效价高达1∶5 120;E组第56天A450达1.023±0.116,效价高达1∶20 480;三组 IgG 水平明均显高于A组(A450:0.160±0.014)、B组(A450:0.151±0.037),且E组明显高于C、D组(P<0.01),见图5,结果说明诱导特异性血清IgG的水平,联合免疫组>蛋白疫苗组>核酸疫苗组。
2.4 小鼠血清抗PorB特异性IgG1、IgG2a的检测PorB蛋白作为检测用抗原,包被 ELISA板,间接ELISA法对末次免疫后14天(第56天)收集的小鼠血清中的 IgG1、IgG2a进行检测。结果显示:C组IgG1、IgG2a A450分别为0.345±0.054、0.579±0.055,IgG2a/IgG1为 1.678;D组 IgG1、IgG2a A450分别为0.789±0.202、0.359±0.080,IgG2a/IgG1为0.455,结果表明核酸疫苗组以诱导Th1型应答为主,而蛋白疫苗组以诱导Th2型应答为主;E组IgG1、IgG2a A450分别为 0.950±0.184、0.658±0.173,IgG2a/IgG1为0.693,结果表明联合免疫组IgG2a和IgG1水平较C组或D组均有较大幅度升高,其中IgG1亚类升高的程度更为显著,且C、D、E 、各组IgG1、IgG2a明显高于A 组(A450:0.086±0.016、A450:0.071±0.019)、B 组(A450:0.093 ±0.013、A450:0.121±0.021,P<0.01),见图6。

表1 免疫小鼠脾淋巴细胞刺激指数(SI)及鼠脾淋巴细胞培养上清IFN-γ、IL-4含量(pg/m l)Tab.1 Stimulation index,IFN-γand IL-4(pg/m l)in cultured supernatant of sp leen cells from immunizedm ice
2.5 MTT比色法检测脾淋巴细胞的增殖反应 小鼠脾淋巴细胞经PorB蛋白刺激后的结果表明:C、D、E各组刺激指数(SI)明显高于A组、B组(P<0.01);且E组明显高于C、D组(P<0.05);C组亦明显高于D组(P<0.05),见表1,说明小鼠脾淋巴细胞对PorB蛋白刺激的增值能力,联合免疫组>核酸疫苗组>蛋白疫苗组。
2.6 免疫小鼠脾淋巴细胞培养上清中IFN-γ,IL-4含量检测 按照说明书建立IFN-γ、IL-4标准方程,绘制标准曲线。检测结果显示:C、E两组IFN-γ含量明显高于A、B、D组(P<0.01),且E组明显高于C、D组(P<0.01),但D组与A、B组之间无显著性差异(P>0.05),见表1,说明小鼠脾淋巴细经PorB蛋白刺激诱导的IFN-γ水平,联合免疫组>核酸疫苗组>蛋白疫苗组,但蛋白疫苗组未诱生出高水平的IFN-γ。C、D、E、各组 IL-4含量明显高于A 组、B组(P<0.01),且E组明显高于C、D组(P<0.01),D组亦明显高于C组(P<0.01),见表1,说明小鼠脾淋巴细经PorB蛋白刺激诱导的IL-4水平,联合免疫组>蛋白疫苗组>核酸疫苗组。
3 讨论
DNA疫苗一经问世,就发现其可以诱发体液和细胞免疫应答,特别是在诱导CTL免疫应答方面是其它疫苗所不能比拟的。然而,在实际应用中,常因体内转染效率欠佳等原因,核酸疫苗所激发的免疫应答强度相对较弱,尤其在大动物以及人体内不足以引起足够的免疫保护效果[6]。用基因工程构建的重组蛋白疫苗一般均能诱导机体产生高滴度的抗体,但其诱导的细胞免疫水平常显不足,保护效果有限[7,8],究其原因,可能与重组蛋白疫苗主要诱导机体产生Th2倾向性免疫应答有关。Zhu等[9,10]在淋球菌疫苗的研究中发现用重组蛋白PorB免疫BALB/c小鼠后,产生了高水平的体液免疫,但其诱导的细胞免疫却相对不足;PorB核酸疫苗诱发的细胞免疫应答相对较强而体液免疫应答相对较弱。
目前,旨在提高疫苗免疫效果的方法有多种,其中将不同类型的疫苗采用初免-加强(Prime-Boost)策略是研究较多的一种方法。核酸疫苗和蛋白疫苗在诱导细胞免疫和体液免疫方面各有优势,一般认为核酸疫苗以诱导细胞免疫应答为主,蛋白疫苗以诱导体液免疫应答为主[11]。研究者们认为采用核酸疫苗与蛋白疫苗联合免疫,发挥两种疫苗在机体内诱导免疫应答的不同优势,可增强疫苗诱导机体产生特异性免疫应答的效果。近年来,在血吸虫病、布鲁杆菌病、疟疾、弓形虫病、日本脑炎、结核病、AIDS等疫苗的研究中发现,核酸疫苗初免后,继而用相应蛋白疫苗加强免疫,其免疫应答水平和保护性免疫效果均较单一核酸疫苗或单一蛋白疫苗增高[12-14]。
本研究采用LTB-PorB核酸疫苗与蛋白疫苗通过鼻饲途径联合免疫雌性BALB/c小鼠,初步探讨经核酸初免-蛋白加强(DNA prime-protein boost)联合免疫后对诱导体液免疫和细胞免疫应答的增强作用。结果显示:经4次免疫(联合免疫组第1、2次为核酸疫苗,第3、4次为蛋白疫苗)后,核酸疫苗组、蛋白疫苗组和联合免疫组小鼠的体液免疫及细胞免疫水平均明显高于PBS及pcDNA3.1(-)对照组(P<0.01)。核酸疫苗组在免疫后56天诱生了较高水平的细胞免疫应答:脾淋巴细胞诱生的 IFN-γ为175.70±23.68 pg/m l,脾淋巴细胞刺激指数(SI)为1.82±0.15;蛋白疫苗组诱生了较高水平的体液免疫应答:免疫后42天血清IgG A450为0.772±0.091,免疫后第56天生殖道sIgA A450为0.702±0.053,脾淋巴细胞诱生的IL-4为251.90±62.14 pg/m l;联合免疫组诱导的体液免疫及细胞免疫应答水平均明显高于核酸疫苗组或蛋白疫苗组(P<0.01或P<0.05):免疫后56天生殖道sIgA A450为1.083±0.179,血清IgGA450为1.023±0.116,IL-4为357.58±34.44 pg/m l;IFN-γ为 261.85±29.92 pg/m l,SI为 2.12±0.29。此外,检测血清IgG亚类,可以监测机体免疫应答类型的变化,IgG2a可反映Th1型细胞免疫应答水平,IgG1可反映Th2型体液免疫应答水平。本研究对免疫后56天各组小鼠血清IgG1、IgG2a的检测显示:核酸疫苗组IgG2a/IgG1比值(1.678)远大于蛋白疫苗组(0.455),结合SI、IFN-γ、sIgA、IgG 和 IL-4水平,初步表明LTB-PorB核酸疫苗主要诱导Th1型倾向性细胞免疫应答,而蛋白疫苗主要诱导Th2型倾向性体液免疫应答;联合免疫组IgG2a和IgG1水平较核酸或蛋白疫苗组均有较大幅度升高,其中IgG1亚类升高的程度更为显著,IgG2a/IgG1比值为0.693,IgG2a/IgG1 比值结合SI、IFN-γ、sIgA、IgG 和IL-4水平,初步表明联合免疫组(DNA prime-protein boost)与单一核酸或蛋白疫苗组比较,能同时促进Th1型和Th2型免疫应答,且以诱导Th2倾向性免疫应答为主,与Juliana等[15]的结果基本一致。
核酸-蛋白疫苗联合应用增强免疫应答的机制较为复杂,目前尚无明确定论。核酸-蛋白联合免疫方法作为一种有希望增强疫苗免疫应答的策略,还需进一步探索和完善。抗淋病免疫主要为体液免疫,尤其是粘膜免疫。本研究LTB-PorB核酸疫苗与蛋白疫苗通过粘膜途径联合免疫,所诱导的体液免疫(包括特异性IgG和sIgA)和细胞免疫应答水平均明显优于单一的核酸或蛋白疫苗,且以诱导Th2倾向性免疫应答为主,该研究结果可为研制高效抗淋病疫苗提供实验依据。
1 UnemoM,PalmerHM,Blackmore Tetal.Global transmissionofprolyliminopeptidase-negative Neisseriagonorrhoeaestrains:implications for changes in diagnostic strategies[J].Sex Transm Infect,2007;83(1):47-51.
2 PizzaM,GiulianiM M,Fontana M Retal.Mucosal vaccines:non toxic derivativesof LT and CT asmucosal adjuvants[J].Vaccine,2001;19(17-19):2534-2541.
3 Ramsay A J,KentS J,Strugnell RAetal.Genetic vaccination strategies for enhanced cellular,humoral andmucosal immunity[J].Immunol Rev,1999;171:27-44.
4 Spangler BD.Structure and function of cholera toxin and the related Escherichia coli heat-labile enterotoxin[J].Microbiol Rev,1992;56(4):622-647.
5 Sambrook J,Russell DW.黄培堂译.分子克隆实验指南[M].第 3版.北京:科学出版社,2002:1723-1726.
6 Zhengrong Cui.DNA vaccine[J].AdvGenet,2005;54:257-289.
7 戴志兵,胡四海,陈 敏etal.淋球菌porB和大肠杆菌ltB融合基因的构建、表达及其免疫活性[J].微生物学报,2010;50(4):517-523.
8 吴 丹,王庆敏,陈蕊雯etal.猪囊尾蚴抗原 cC1 DNA疫苗和蛋白质疫苗联合诱导小鼠免疫应答[J].第二军医大学学报,2004;25(1):34-36.
9 ZhuW,Thomas C E,Chen C Jetal.Comparison of immune responses to gonococcal PorB delivered as outermembrane vesicles,recombinant protein,orVenezuelan equine encephalitis virus replicon partic les[J].Infect Immun,2005;73(11):7558-7568.
10 Zhu W,Thomas C E,Sparling P F.DNA immunization of mice with a plasmid encoding Neisseria gonorrhea PorB protein by intramuscular injection and epidermal particle bombardment[J].Vaccine,2004;22(5-6):660-669.
11 戴志兵,胡四海.核酸疫苗与蛋白疫苗的免疫特点及其联合免疫的研究进展[J].国际免疫学杂志,2010;33(2):89-91,96.
12 Shang L,Liu Q,Liu Wetal.Protection inm ice immunized with a heterologous prime-boost regime using DNA and recombinant pseudorabies expressing TgSAG1 against Toxoplasma gondii challenge[J].Vaccine,2009;27(21):2741-2745.
13 Li P,Cao R B,Zheng Q Setal.Enhancement of humoral and cellular immunity inm iceagainst Japanese encephalitis virususing aDNA primeprotein boost vaccine strategy[J].Vet J,2010;183(2):210-216.
14 Wang S,Kennedy JS,West Ketal.Cross-subtype antibody and cellular immune responses induced bya polyvalent DNA prime-protein boostHIV-1 vaccine in healthy human volunteers[J].Vaccine,2008;26(8):1098-1110.
15 Juliana Cassataro,Carlos A Velikovsky,Laura Brunoetal.Improved immunogenicity of a vaccination regimen combining a DNA vaccine encoding brucellamelitensisoutermembrane protein 31(Omp31)and recombinant omp31 boosting[J].Clinical and Vaccine Immunology,2007;14(7):869-874.
[收稿2010-01-28 修回2010-05-26]
(编辑 许四平)
Improved immunologic responses of a vaccination regimen combining a DNA vaccine encoding LTB-PorB and recombinant LTB-PorB boosting
DAIZhi-Bing,HUSi-Hai,LIUQing-Nan,CHENMin,WANGYu-Feng,ZHANGYu-Kuai,YUMin-Jun,ZHUCui-Ming,LIZhong-Yu,LUChun-Xue.PathogenicBiologyInstitute,UniversityofSouthChina,Hengyang421001,China
Objective:To explore the improved immunological responses induced by a LTB-PorBDNA vaccine prime-p rotein boost immunization regimen.Methods:A LTB-PorBDNA vaccine(pcDNA3.1(-)/ltB-porB)and recombinant LTB-PorB(rLTB-PorB)were prepared.Female BALB/cmicewere inoculatedwith a LTB-PorBDNA vaccine followed by boosting with rLTB-PorB through intranasal immunization at the days 0,14,28,42.Then humoral and cellu llar immunological responses were detected in female BALB/c mice by enzyme linked immunosorbent assay(ELISA)andmethyl thiazolyl tetrazolium(MTT)colorimetric assay.Results:In the DNA vaccine prime-protein boostgroup at day 56,A450of sIgA in genital tract(1.083±0.179),serum IgGA450(1.023±0.116),levels of IL-4(357.58±34.44 pg/m l)and IFN-γ(261.85±29.92 pg/ml),both ofwhichwere inducedwith splenic lymphocytes,were significantly higher than in controls(P<0.01),and the stimulation index(2.12±0.29)of splenic lymphocyteswas also significantly higher than in controls(P<0.05).The ratios of serum IgG2a/IgG1 in the DNA vaccine group,recombinantp rotein group and the DNA vaccine prime-protein boostgroupwere 1.678,0.455 and 0.693 respectively.Conclusion:The DNA vaccine p rime-protein boost immunization regimen cou ld enhance both humoral and cellullar immunologic responses in BALB/cmice,especially for Th2 humoral immunological response,when comparedwith a LTB-PorBDNA vaccine or a recombinant protein immunization alone.
Gonorrhea;Porin B;LTB;DNA vaccine;Protein vaccine;Combined immunization
R392.12
A
1000-484X(2010)12-1059-06
10.3969/j.issn.1000-484X.2010.12.001
①本文为国家自然科学基金(30771931)和湖南省教育厅科研基金(08C745)资助项目
②湖南益阳医学高等专科学校,益阳413000
戴志兵(1980年-),男,在读硕士,主要从事淋球菌疫苗研究,现就职于湖南益阳市中心医院,E-mail:daizhibing1980@163.com;
及指导教师:胡四海(1957年-),男,教授,硕士生导师,主要从事抗感染免疫研究,E-mail:hhsshh-518@163.com。
·专题综述·
