脂质体介导的IDO基因转染未成熟树突状细胞对其成熟性及功能的影响①
2010-02-06安晓静钱桂生赵聪敏第三军医大学新桥医院儿科重庆400037
廖 伟 安晓静 钱桂生 赵聪敏 (第三军医大学新桥医院儿科,重庆 400037)
脂质体介导的IDO基因转染未成熟树突状细胞对其成熟性及功能的影响①
廖 伟 安晓静②钱桂生②赵聪敏 (第三军医大学新桥医院儿科,重庆 400037)
目的:探讨脂质体介导的IDO基因转染对未成熟树突状细胞(Immature dendritic cells,imDCs)的成熟性及功能的影响。方法:从BALB/c小鼠骨髓培养imDCs,形态学观察后用流式细胞术鉴定imDC后,将其分为IDO+-imDC组:重组pEGFPN1-IDO质粒在脂质体介导下转染imDCs;IDO--imDC组:pEGFP-N1空质粒转染imDCs;imDCs组:imDCs不做特殊处理;mDC组:将培养的imDC用TNF-α诱导成熟。流式细胞术检测IDO基因转染im DC细胞后细胞表型是否发生变化。Western b lot检测各组IDO蛋白表达。混合淋巴细胞反应检测各组在体外刺激T淋巴细胞增殖的能力。结果:BALB/c小鼠骨髓培养的细胞表面标志和细胞形态符合imDCs典型特征;Western blot结果显示IDO+-imDC组可见IDO蛋白表达;IDO+-imDC组细胞表面分子CD80、CD86、MHCⅡ表达率分别为(9.4±2.2)%、(8.7±1.1)%、(11.4±2.6)%,imDC 组分别为(8.5±1.8)%、(7.5±1.6)%、(10.2±2.1)%,两组比较无显著差异(P均>0.05),IDO+-imDC组在体外刺激T淋巴细胞增殖的能力明显低于imDC组(678±90.3vs1 199±275.5,P<0.01)。结论:脂质体介导的IDO基因转染imDCs能维持细胞于未成熟状态,在MLR中,对T细胞增殖有明显的抑制作用。
吲哚胺2,3-双加氧酶;树突细胞;脂质体;转染
吲哚胺2,3-双加氧酶(IDO)是色氨酸沿犬尿酸途径分解代谢的限速酶,而色氨酸是T细胞活化增殖过程中合成蛋白质所必需的氨基酸。已证实在小鼠体内表达IDO的抗原提呈细胞(Antigen presenting cell,APC)在局部组织微环境通过耗竭色氨酸而阻断T细胞周期使活化的T细胞凋亡,诱导抗原特异性T细胞耐受[1]。同时新近研究表明,未成熟树突状细胞(Immature dendritic cells,imDCs)通过刺激初始型T细胞分化成调节性T细胞(Treg)产生诱导免疫耐受形成[2,3]。因此本研究以脂质体介导IDO基因转染imDCs,观察IDO表达及imDCs成熟性及功能的变化,以便为同时应用IDO及imDCs来诱导气道的免疫耐受防治过敏性哮喘提供理论依据。
1 材料与方法
1.1 主要试剂与材料 含小鼠IDO基因的pEGFPN1-IDO重组质粒由本实验室构建;rmGM-CSF、rmTNF-α及 rmIL-4(Peprotech公司);脂质体 DOTAP(Roche 公司);FITC-MHC Ⅱ、FITC-CD80、FITC-CD86、PE-CD11c单克隆抗体(eBioscience公司);抗IDO抗体(SantaCruz公司);Western blot试剂盒、淋巴细胞分离液及HRP标记的羊抗兔IgG(北京鼎国公司)。
1.2 小鼠骨髓来源imDCs的分离、培养 参照文献[4]进行,颈椎脱臼法处死BALB/c小鼠,用皮试针抽吸 RPMI1640培养液冲洗髓腔,获得细胞悬液,2 500 r/min×25分钟离心,调整细胞浓度至2×106m l-1,接种于含10%胎牛血清的RPMI1640培养液中,内含rmGM-CSF(10 ng/m l)及 rm IL-4(10 ng/ml),37℃、5%CO2培养,以后隔天半量换液,共培养6~8天,去除悬浮细胞,轻轻吹打,收集残余贴壁细胞即为imDCs。
1.3 细胞形态学观察及表型鉴定 (1)扫描电镜观察:收集培养细胞,调整细胞浓度至1×106m l-1,PBS漂洗、甩干,2.5%戊二醛固定,扫描电镜观察并拍照。(2)透射电镜观察:收集约1×107个培养细胞离心,加入2.5%戊二醛固定液,1小时后弃去戊二醛,1%锇酸固定,常规脱水、包埋、切片,铀铅双染色,透射电镜观察并拍照。(3)细胞表型鉴定:收集培养的0.5×106~1×106细胞重悬于100μl PBS,每管加入PE-CD11c抗体0.5μl,再分别加入FITC-MHCⅡ、FITC-CD80、FITC-CD86各0.5μl,设空白对照管,4℃放置30分钟,然后加入PBS,2 000 r/min洗涤3次,重悬于0.4m l PBS中,上机分析,用流式细胞仪检测细胞表面标志CD11c、MHCⅡ、CD80和CD86的表达。
1.4 细胞处理及分组 将imDCs分为 IDO+-imDC组、IDO--imDC组、imDC组及 mDC组。IDO+-imDC组:用pEGFP-N1-IDO重组质粒转染培养的imDCs,方法如下:将pEGFP-N1-IDO质粒-HBS混合液50μl(含重组质粒5μg)与100μl DOTAP脂质体-HBS(含30μl DOTAP脂质体)混匀,加入2m l无血清的RPM I1640培养基中,再加入imDCs生长(70%融合)的培养瓶中,37℃、5%CO2培养8小时,更换含10%小牛血清的培养基继续培养24小时后,用G418选择性培养基筛选;IDO--imDC组:用脂质体介导pEGFP-N1质粒转染;mDC 组:加入TNF-α50μg/L继续培养3天;对照组:细胞不作特殊处理。
1.5 各组细胞表型鉴定 取IDO+-imDC组、imDC组及mDC组行细胞表型鉴定,方法同1.3。
1.6 Western blot检测IDO蛋白表达 将转染组细胞裂解,提取蛋白,按Western blot检测试剂盒说明书操作进行。一抗为兔抗小鼠IDO抗体,二抗为辣根过氧化物酶标记的山羊抗兔IgG抗体。
1.7 OVA致敏小鼠脾脏CD4+T细胞的分离 OVA致敏小鼠模型的建立:BALB/c小鼠分别于第0、5、10天腹腔内注射抗原混悬液1 ml(含OVA 1mg、氢氧化铝 200μg)致敏,第 24、25、26天鼻腔内滴入OVA抗原100μg激发。无菌条件下制备致敏小鼠脾细胞悬液,参照小鼠CD4+T细胞分离柱说明书进行CD4+T细胞分离。
1.8 混合淋巴细胞反应(MLR) 无菌条件下制备BALB/c小鼠脾脏细胞悬液,用尼龙毛法获得T淋巴细胞作为效应细胞,刺激细胞分别为imDC、IDO+-imDC、IDO-imDC及 imDC,另取BALB/c小鼠T淋巴细胞为对照组上述五组细胞均经丝裂霉素C灭活,将效应细胞分别与各组刺激细胞以10∶1比例混合培养于96孔板,每组设3个复孔,37℃、5%CO2条件下培养96小时,加入3H-TdR 37 kBq,继续培养24小时,收集细胞,β-液闪计数仪检测每分闪烁计数(cpm)值,各组结果以3孔均值表示。计算各组刺激指数(SI)=实验组CPM均值/对照组CPM值。
2 结果
2.1 imDCs形态学观察及表面分子表达 培养24小时后见细胞开始贴壁,4天后悬浮细胞增多,呈簇状生长,有毛刺状突起。扫描电镜观察显示,未成熟DC表面多皱褶,有大量的不规则突起,透射电镜观察显示DC内出现大量吞噬小泡,见图1。符合imDCs形态学特点。流式细胞技术检测结果示CD11c高表达(72.1%),CD80(8.5%)、CD86(7.5%)及MHCⅡ(10.2%)呈低水平表达,符合imDCs型特征。
2.2 IDO蛋白表达 Western blot结果表明:转染组可见一相对分子质量约为42 kD的条带,免疫印迹证实为IDO蛋白,而空质粒组及对照组未见目的条带,提示pEGFP-N1-IDO重组质粒转染imDCs后,imDCs能表达IDO蛋白,见图2。

图1 imDCs形态学观察Fig.1 Morphology and m icrostructure of immature DC

图2 各组IDO蛋白表达Fig.2 IDO p rotein expression detected by Western b lot in each group
表1 各组DCs表面分子表达率比较(%,±s)Tab.1 Compared the expression of surfacemolecules of DCs in each group(%,±s)

表1 各组DCs表面分子表达率比较(%,±s)Tab.1 Compared the expression of surfacemolecules of DCs in each group(%,±s)
Noge:1)P>0.05 vs imDC group;2)P<0.05 vs imDC group.
Groups n CD80 CD86 MHCⅡimDC group 3 8.5±1.8 7.5±1.6 10.2±2.1 IDO+-imDC group 3 9.4±2.21) 8.7±1.11) 11.4±2.61)mDC group 3 65.2±8.92)72.1±9.62) 80.5±7.82)
2.3 imDCs表型分析 IDO+-imDC组的CD11c表达为(79.5±12.6)%,CD80、CD86、MHC Ⅱ仍低表达,分别为(9.4±2.2)%、(8.7±1.1)%、(11.4±2.6)%,与imDC组比较,两组无显著差异(P>0.05);与mDC组比较,CD80、CD86、MHCⅡ两组表达有显著差异(P<0.05),说明脂质体介导pEGFP-N1-IDO真核表达载体转染对未成熟DC成熟性无影响,见表1。
2.4 MLR结果 imDC组的cpm值与对照组比较,无显著差异(P>0.05),只能微弱刺激T淋巴细胞增殖;mDC组cpm值明显增加,与对照组比较,有显著差异(P<0.05),能明显刺激T淋巴细胞增殖。IDO+-imDC组与imDC组及对照组比较cpm值及SI均明显降低比较,有显著差异(P<0.05),说明IDO基因转染的imDC对T淋巴细胞增殖有明显的抑制作用,见表2。
3 讨论
DC是最有效的APC,它不仅参与抗原的摄取及提呈,诱导免疫反应,而且可诱导免疫耐受。DC驾御免疫反应的方向和程度,目前认为与所处的成熟状态有关,成熟树突状细胞(Mature dendritic cells,mDC)能刺激免疫应答,而imDC因其表面缺乏MHCⅠ/Ⅱ类分子及低表达协同刺激分子,不能激活T细胞产生免疫反应,诱导免疫耐受[5]。Mahnke等[2]研究表明,imDCs通过膜上的DEC-205受体介导内吞作用而摄取外来抗原仍能保持其未成熟状态,并刺激初始型T细胞分化成CD4+CD25+调节性T细胞(CD4+CD25+Treg)生成,诱导免疫耐受。同时Megan等[3]证实人外周血初始型(naive)T细胞在负载抗原的异源 imDCs刺激下也可向Tr1转化(Treg的一种)。因此imDCs在免疫耐受中有重要的作用。
表2 各组DC在混合淋巴细胞反应中对小鼠T细胞的刺激作用(±s)Tab.2 The effects of T cell stimulation in m ixed lymphocyte reaction induced by different groups of DCs(±s)
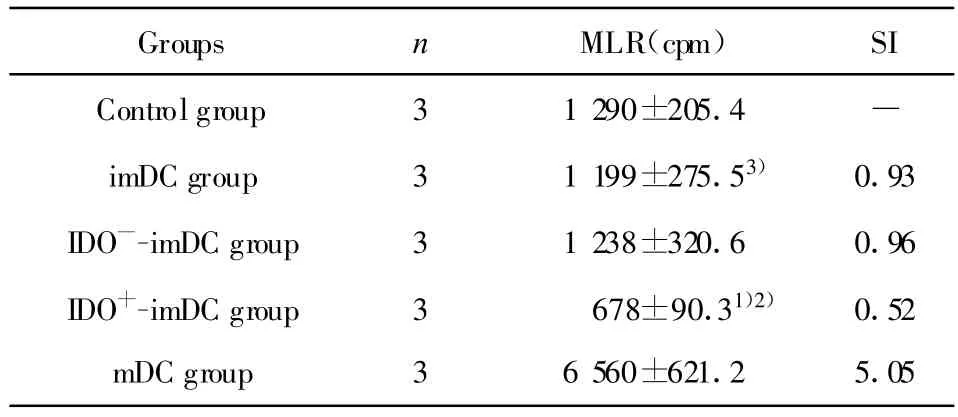
表2 各组DC在混合淋巴细胞反应中对小鼠T细胞的刺激作用(±s)Tab.2 The effects of T cell stimulation in m ixed lymphocyte reaction induced by different groups of DCs(±s)
Note:1)P<0.05 vs imDC group;2)P<0.05 vs controlgroup;3)P>0.05 vs controlgroup.
Groups n MLR(cpm) SI Controlgroup 3 1 290±205.4 —imDC group 3 1 199±275.53) 0.93 IDO--imDC group 3 1 238±320.6 0.96 IDO+-imDC group 3 678±90.31)2) 0.52 mDC group 3 6 560±621.2 5.05
IDO是色氨酸沿犬尿酸途径分解代谢的限速酶,能催化色氨酸氧化分解成犬尿酸等代谢产物。研究表明T细胞生长微环境中如果无外源色氨酸,被抗原提呈细胞提呈的抗原激活后,因不能合成足够的蛋白质而停滞于G1期,更易于经凋亡而死亡。IDO在机体免疫豁免器官大量表达,其在保护胎儿免遭母体排斥的妊娠过程、器官移植及自身免疫性疾病耐受中的作用已成为近年研究的热点,在过敏性哮喘中的免疫耐受中亦引起人们重视[6,7]。已有的研究表明表达IDO的DC能通过以下机制诱导外周免疫耐受:(1)IDO分解代谢局部微环境中的色氨酸而抑制激活T细胞分化、增殖,导致T细胞无能(Treg样反应)[8]。(2)通过IDO催化色氨酸分解代谢的产物,诱导T细胞凋亡,从而清除活化的抗原特异性T细胞克隆[9]。同时,Taher等[10]在大鼠体内模型中证实通过IDO分解代谢色氨酸分解代谢的产物犬尿酸等在Th2介导的过敏性气道炎症可诱导免疫耐受。
过敏性哮喘患者体内能检测到活化的T淋巴细胞凋亡不足,可能是哮喘发病机制存在着免疫耐受机制缺陷的证据。鉴于初始型(naïve)CD4+T细胞激活是其发病的始动因素,而且CD4+T细胞在哮喘发生发展过程中起重要作用,因此我们设想通过应用脂质体介导IDO修饰imDCs移入动物模型气道,imDCs在提呈抗原激活记忆性CD4+T细胞同时表达IDO,抑制活化的CD4+T细胞增殖,将可能诱导气道抗原特异性T细胞耐受,起到防治哮喘作用。欲达到上述目的,首先要将IDO基因转染到imDCs分泌表达IDO,同时不能改变其未成熟特性。目前最常用的腺病毒载体,本身有激活imDCs的可能[11]。
与腺病毒载体相比,脂质体载体本身对细胞无毒性。本项目用脂质体转移系统将IDO基因转染大鼠imDCs,观察到DC仍保持未成熟状态,与王永权等[12]的结论一致,避免了常用的腺病毒载体对imDCs成熟性的影响。同时在混合淋巴细胞反应中,转染了IDO基因的imDCs能明显地抑制T细胞的增殖,推测机制可能除了imDCS诱导的免疫抑制作用外,同时imDCs分泌表达的IDO分解代谢色氨酸,从而抑制了T细胞活化并诱导其凋亡有关。以上实验为我们同时应用IDO及imDCs诱导气道免疫耐受来防治过敏性哮喘提供了依据。但如何在体内避免其他炎性因子及抗原对 imDCs成熟性的影响,保持imDCs未成熟状态,起到imDCs与IDO的双重诱导气道免疫耐受作用来防治过敏性哮喘还有待继续深入研究。
1 Munn DH,Sharma M D,Lee JRetal.Potential regulatory function of human dendritic cells expressing indoleam ine 2,3-dioxygenase[J].Science,2002;297(5588):1867-1870.
2 Mahnke K,Qian Y,Knop Jetal.InductionofCD4+/CD25+regulatory T cellsby targeting of antigens to immature dendritic cells[J].Blood,2003;101(12):4862-4869.
3 Megan K L,Silvia G,Eleonora Tetal.Differentiation of Tr1 cells by immaturedendritic cells requires IL-10 but not CD25+CD4+Tr cells[J].Blood,2005;105(3):1162-1169.
4 丁英俊,程 翔,廖玉华etal.大鼠未成熟树突状细胞体外分离、扩增与鉴定[J].免疫学杂志,2008;24(4):249-251.
5 Zhang M,Wang Q,Liu Yetal.Effective induction of immune tolerance by portal venous infusion with IL-10 gene-modified immature dendritic cells leading to prolongation of allograft survival[J].JMolMed,2004;82(4):240-249.
6 Tan PH,Bharath A K.Manipulation of indoleamine 2,3 dioxygenase;a novel therapeutic target for treatment of diseases[J].Expert Opin Ther Targets,2009;13(8):987-1012.
7 Le A V,Broide DH.Indoleamine-2,3-dioxygenasemodulation of allergic immune responses[J].Curr Allergy Asthma Rep,2006;6(1):27-31.
8 Tan PH,BeutelspacherSC,WangYHetal.Immunolipoplexes:An efficient,nonviralalternative for transfectionofhumandendritic cellswith potential for clinical vaccination[J].Mol Ther,2005;11(5):790-800.
9 Tan PH,Bharath A K.Manipulation of indoleam ine 2,3 dioxygenase;a novel therapeutic target for treatment of diseases[J].Expert Opin Biol Ther,2008;8(11):1705-1719.
10 Taher Y A,Piavaux B J,Gras Retal.Indoleam ine,3-dioxygenase-dependent tryptophan metabolites contribute to tolerance induction during allergen immunotherapy in amousemodel[J].JA llergy Clin Immunol,2008;121(4):983-999.
11 Tan PH,Beutelspacher SC,XueSAetal.Modulation of human dendritic-cell function following transduction with viral vectors:implications for gene therapy[J].Blood,2005;105(10):3824-3832.
12 王永权,彭毅志,王 强etal.脂质体介导的基因转染对人未成熟树突状细胞成熟特性的影响[J].中华烧伤杂志,2006;22(3):203-206.
[收稿2010-05-27 修回2010-07-19]
(编辑 张晓舟)
Thematuration characteristics and function of immature dendritic cells transfected by liposome-mediated indoleam ine 2,3-dioxygenase(IDO)gene
LIAOWei,ANXiao-Jing,QIANGui-Sheng,ZHAOCong-Min.DepartmentofPediatricsXinqiaoHospital,ThirdMilitary MedicalUniversity,Chongqing400037,China
Objective:To investigate the influence of indoleam ine 2,3-dioxygenase(IDO)genemediated by liposome transfection on function of immature dendritic cells(imDCs).Methods:ImDCswere cultured from bonemarrow of BALB/cmouse.The cellswere identified by transmission electronm icroscope,scanning electronmicroscope,and flow cytometry.Then the imDCswere divided intoIDO+-imDC group(imDCs transfectedwith recombinant pEGFP-N1-IDO expression vector),IDO--imDC group(imDCswere transfected with recombinant pEGFP-N1 vector),control group(imDCswithout special processing)andm DC group((imDCs inducedwith TNF-α).IDO protein expression in each group was detected byWestern blot;The expression of cellmarkerwas determined with flow cytometry.Their ability to stimulate antigen-specificity T lymphocyte proliferation was determined with allogeneticmixed leukocyte reaction in each groups.Results:The cultured imDCs of BALB/c mouse bonemarrow exhibited typial characteristics of surfacemarkers and cellmorphology consistentwith imDCs;IDO protein exp ression was seen in transfection group.The expression rate of CD80,CD86,MHCⅡ was(9.4±2.2)%,(8.7±1.1)%and(11.4±2.6)%,respectively,whichwas exhibited no difference compared with those in imDC group(8.5±1.8)%,(7.5±1.6)%and(10.2±2.1)%,respectively,P>0.01.The ability of IDO+-imDCgroup to stimulate antigen-specificity T lymphocyte p roliferation in vitrowas distinctly lower than in imDC group(678±90.3vs1 199±275.5,P<0.01).Conclusion:ImDCs transfected by liposome-mediated IDO gene remain their immature state and can inhibit the proliferation of the T lymphocytes.
Indoleamine2,3-dioxygenase;Dend ritic cells;Liposomes;Transfection
R392.9
A
1000-484X(2010)12-1069-04
10.3969/j.issn.1000-484X.2010.12.003
①本文受国家自然科学基金资助(No.30500231)
②第三军医大学新桥医院全军呼吸研究所,重庆400037
廖 伟(1971年-),男,博士,副教授,副主任医师,主要从事哮喘发病的免疫机制研究,E-mail:liaowei01@163.com;
及指导教师:钱桂生(1954年-),男,教授,主任医师,主要从事呼吸窘迫综合征发病机制研究,E-mail:qianguisheng@163.com。
