HCV HLA-A2限制性复合多表位基因的构建、克隆表达及其免疫特性分析①
2010-02-06韦三华沈建军张利军刘昕阳张惠中
韦三华 董 轲 林 芳 王 希 李 斌 沈建军 张利军 刘昕阳 张惠中
(西安第四军医大学唐都医院临床实验与检验、输血科,西安 710038)
HCV HLA-A2限制性复合多表位基因的构建、克隆表达及其免疫特性分析①
韦三华 董 轲 林 芳 王 希 李 斌 沈建军 张利军 刘昕阳 张惠中②
(西安第四军医大学唐都医院临床实验与检验、输血科,西安 710038)
目的:构建丙型肝炎病毒(HCV)HLA-A2限制性复合多表位基因的原核表达载体,表达纯化,并观察其免疫原性。方法:分别合成HCV HLA-A2限制性多表位基因、人泛素基因,串联后得到融合基因Ub-Mep,克隆入原核表达质粒pRSETA,转化E.coliBL21,IPTG诱导融合蛋白表达,薄层扫描分析表达蛋白组成;可溶性分析后用Ni2+-NTA凝胶亲和层析柱纯化、透析并浓缩融合蛋白;Western blot分析纯化蛋白的特异性和抗原性;免疫小鼠分析其免疫原性。结果:成功构建复合多表位抗原基因的原核表达质粒pRSET-Ub-Mep,目的基因可高效表达,表达产物主要以包涵体形式存在,Ni2+-NTA纯化可获得目的蛋白,纯化蛋白具有良好的抗原性和免疫原性。结论:成功构建HCVHLA-A2限制性复合多表位基因并进行原核表达,表达的多表位基因抗原具良好的免疫原性,为进一步的HCV A2限制性复合多表位诱导的细胞免疫应答研究奠定基础。
丙型肝炎病毒(HCV);CTL;表位;表达
1 材料与方法
1.1 材料 原核表达载体pRSET-A、菌种DH5α、BL21均由本室保存;Trizol试剂购于Gibco BRL公司;脂质体购于Invitrogen公司;Taq DNA聚合酶、内切酶购于TaKaRa公司;逆转录试剂盒购于Promega公司;Ni2+-NTA凝胶亲和层析柱购自Qiagen公司;RPM IMedium 1640培养基、异硫氰酸荧光素标记的羊抗人IgG抗体、HRP标记羊人IgG、DNA分子标准和低分子蛋白质标准分别购自华美生物工程公司。
1.2 方法
1.2.1 HCV HLA-A2限制性复合多表位基因的构建
1.2.1.1 人泛素基因合成 根据人泛素基因序列(GeneBank:M 17524)。合成泛素基因,同时在上游引入BamHⅠ酶切位点,并在ATG前加一个kozak序列,下游引入PstⅠ酶切位点,并将第76位氨基酸进行替换(G acc变A tgc),全序列252 bp,交由北京奥科公司合成,克隆入pMD19-TSimple载体,记作Ub。
1.2.1.2 多表位基因的合成 选择4个CTL优势表位和一个CD4+Th表位(表1),每个表位两端各保留三个氨基酸,各表位间用AAY分隔连接,后端增加信号肽基序,以便于各表位保持独立性和能够有效呈递。5′和3′端分别引入PstⅠ和 HindⅢ酶切位点。全序列285 bp,交由北京奥科公司合成,得到多表位基因成表位序列,克隆入pMD19-TSimple载体,计作记作Mep。
1.2.1.3 多表位基因表达载体的构建 原核表达载体为pRSET-A,先将泛素基因Ub用BamHⅠ/PstⅠ双酶切后插入到pRSET-A载体中的相应位点,构建pRSET-Ub重组原核表达载体;再将多表位基因Mep用PstⅠ/HindⅢ双酶切后插入到pRSET-A载体中的相应位点,构建成pRSET-Ub-Mep重组原核表达载体,不改变其编码区的框架结构。重组质粒的鉴定采用双位点单酶切鉴定,酶切鉴定得到的阳性克隆,送TaKaRa公司进行核苷酸序列测定,用生物软件pcgene分析汇总结果。

表1 表位基因位置及氨基酸组成Tab.1 Source,position,and sequence of epitopeam ino acid
1.2.2 HCV HLA-A2限制性复合多表位基因原核表达
1.2.2.1 目的蛋白表达和可溶性分析 重组质粒,转化大肠杆菌BL21,挑取单菌落(同时设空载体质粒转化的大肠杆菌BL21为对照),置5ml LB培养液中(含氨苄青霉素50 g/L),37℃振摇过夜,次日1∶100转接5m l LB培养液中37℃振摇3小时,A600约0.4~0.6时加入IPTG至终浓度1mmol/L,继续振摇4~5小时,离心收菌。用PBS(pH8.0)悬浮离心收集的细菌,加入溶菌酶至终浓度0.1 r/min/L,4℃放置20分钟,超声破碎,4℃下10 000 r/min离心10分钟,收集上清和沉淀,分别加入等体积的2×样品缓冲液,沸水中加热5分钟,12 000 r/min离心5分钟,取上清,每孔15μl进行SDS-PAGE电泳,电泳在恒压下进行(浓缩胶中为160 V,分离胶中为120 V)。电泳结束后,将凝胶浸泡于考马斯亮蓝染色液中染色2小时,然后用脱色液脱色至背景清晰。薄层扫描分析目的蛋白表达带占菌体蛋白百分比。
1.2.2.2 表达蛋白的纯化 参照Qiagen公司镍离子亲和层析柱(Ni2+-NTA)操作说明进行。首先离心收集1 L诱导宿主菌,冰浴15分钟;按5 L/kg湿菌的比例加入含8 mol/L尿素 的Buffer B(pH8.0),室温下轻轻搅拌使细菌裂解至溶液清亮,4℃下10 000 r/min离心收集上清,弃去沉淀;将1m lNi2+-NTA树脂悬浮液与一定量清亮裂解上清于室温轻柔摇动混匀(100 r/min摇动15~60分钟)后,将其混合液装柱 ;依次用 Buffer C(pH6.3)、Buffer D(pH5.9)、Buffer E(pH4.5)洗脱,分别收集洗脱液。取各部分样品进行SDS-PAGE分析。
1.2.2.3 Western blot检测表达蛋白 将纯化蛋白进行SDS-PAGE凝胶电泳,然后将蛋白质进行电转移至NC膜上(滤膜孔径0.22μm,转移条件为恒流100V,1小时)。用丙型肝炎阳性患者混合血清(来自唐都医院检验科)作为一抗,HRP-羊抗人IgG作为二抗,DAB(0.6 g/L)显色,至目的条带染色清晰时终止反应。
1.2.3 HCV HLA-A2限制性复合多表位抗原免疫原性分析 表达蛋白用适量的PBS溶解,腹部皮下多点注射免疫6周龄BALB/c小鼠,剂量为100μg/(只·次)。隔两周加强免疫一次,共免疫3次。对照组小鼠每次用 PBS 免疫。免疫后第 0、2、4、6、8、10周尾静脉采集小鼠血清,-20℃冻存。用包被缓冲液将表达蛋白稀释到0.01μg/μl,每孔100μl包被微孔板,湿盒中4℃过夜。PBST(PBS,0.1%Tween20)洗涤后用封闭液(PBST,50 g/L脱脂奶粉)室温封闭1小时。PBST洗涤后拍干,每孔加入封闭液1∶100稀释的小鼠血清100μl,湿盒中37℃孵育1小时,PBST洗涤、拍干,加入以封闭液 1∶10 000稀释的HRP-羊抗鼠IgG 100μl,湿盒中37℃孵育1小时。PBST洗涤、拍干,每孔加入显色液(OPD 5mg pH 7.5柠檬酸盐缓冲液12.5ml,H2O 25μl)100μl,37℃孵育 10~20分钟,每孔加1滴2 mol/L硫酸终止反应。酶标仪测定OD490。
2 结果
2.1 重组质粒的鉴定 pRSET-Ub-Mep经BamHⅠ+HindⅢ双酶切得到537 bp的预期片段(图1)。酶切鉴定的阳性克隆,经测序,与设计序列完全一致。表明目的基因成功克隆入真核表达载体。
2.2 目的蛋白的表达与溶解形式分析 将重组质粒pRSET-Ub-Mep转化的BL21菌株用1 mmol/L IPTG诱导4小时后,收集菌体,溶菌酶作用后进行超声破碎,离心后分别收集沉淀和上清,经SDSPAGE电泳检测,在约20 kD处有一明显的条带,与预期的融合蛋白大小一致。该融合蛋白以包涵体形式存在于沉淀中,上清液中几乎无诱导表达的融合蛋白。薄层扫描显示其占菌体蛋白的25%(图2)。
2.3 融合蛋白的表达及纯化 用8mol/L尿素裂解菌体,然后将裂解上清通过Ni2+-NTA柱,收集各部分洗脱液。取少量B表达蛋白包涵体、8mol/L尿素裂解上清、Buffer B(pH8.0)、Buffer C(pH6.3)、Buffer D(pH5.9)、Buffer E(pH4.5)洗脱液进行 SDSPAGE,电泳结果显示目的蛋白在Buffer E(pH 4.5)洗脱液中,扫描显示纯度在90%以上(图3)。

图1 重组质粒pRSET-Ub-M ep的酶切鉴定Fig.1 Restrictive enzyme digestion analysis of pRSET-Ub-Mep
2.4 表达蛋白的Western blot结果 纯化后的蛋白透析、包埋浓缩后取少量该蛋白和未诱导菌体蛋白行SDS-PAGE,然后电转移至NC膜上。用HCV阳性患者血清作为一抗,同时以正常人血清为对照,HRP-羊抗人IgG为二抗,DAB显色后,预期大小处可见条带染色清晰,纯化的蛋白很好地保持了与HCV阳性患者血清的结合活性(图4)。
2.5 表达蛋白免疫原性分析 融合蛋白免疫BALB/c小鼠 3次后,ELISA分析小鼠抗体产生情况,结果显示(图5),3次免疫后,表达蛋白可在小鼠中诱发较高水平的抗体应答,其血清中的特异性抗体滴度平均为1∶640。说明表达蛋白具有良好的免疫原性。而生理盐水阴性对照组的小鼠血清抗体为阴性。
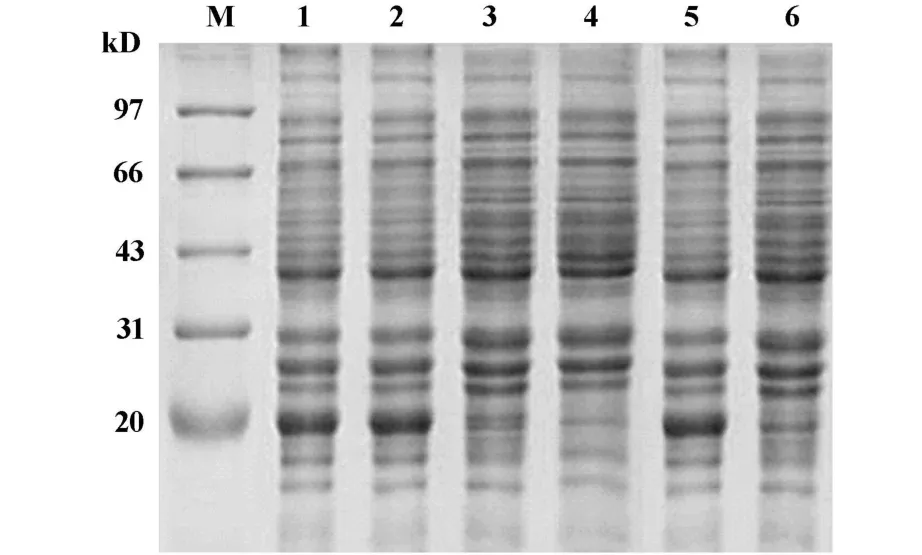
图2 表达蛋白SDS-PAGE和溶解形式分析Fig.2 SDS-PAGE analysis of fusion protein expression
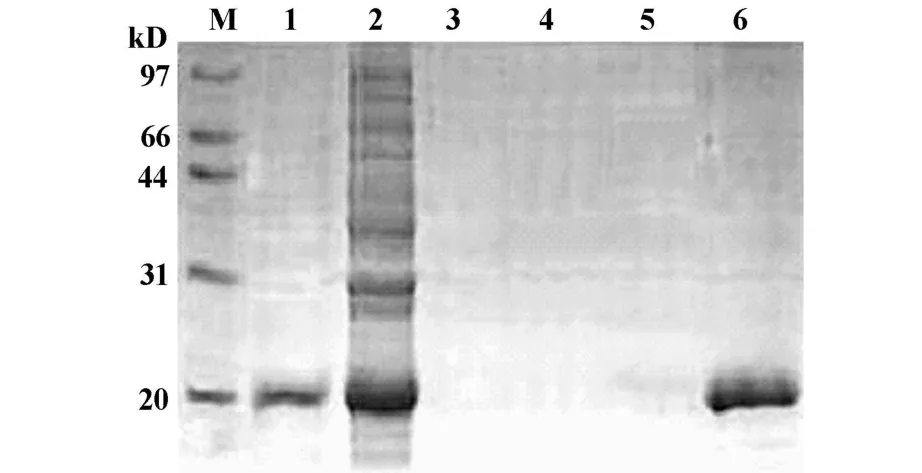
图3 N i2+-NTA凝胶纯化表达蛋白洗脱图Fig.3 Purification of the expressed protein in Ni2+-NTA column

图4 表达蛋白的W estern blot分析Fig.4 Western b lot of expressed protein
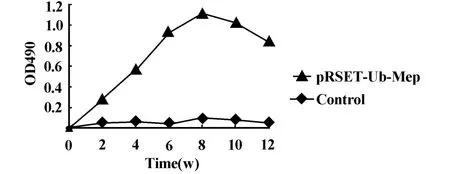
图5 免疫小鼠诱导的免疫应答Fig.5 Antibody response in m ice immunized w ith expressed protein
3 讨论
丙型肝炎病毒(HCV)是慢性肝炎、肝硬化等慢性肝病的主要致病因子之一,其感染后极易慢性化,而发展为肝硬化和肝癌的几率远高于乙型肝炎病毒。HCV感染已成为严重危害公众健康的感染性疾病之一。目前对于HCV感染的治疗,主要为peg-IFN-α联合利巴韦林,但其临床有效率尚不足50%,而且副作用很大,花费昂贵。亟需发展有效的预防性和治疗性疫苗以防止其传播。
HCV感染后,机体针对病毒产生了由中和抗体、CD4+辅助 T细胞和CD8+细胞毒性 T细胞(CTL)介导的适应性免疫反应。由于使用缺乏校对功能的RNA依赖的RNA多聚酶及HCV感染后快速复制可产生HCV各种准类群(准种),使HCV能够逃逸宿主的免疫应答;另外,由于存在中和抗原位点的E区基因高度变异(HRV1和HRV2),也使机体产生的中和抗体缺乏保护力,不能有效地清除病毒。这些可能都是造成HCV持续感染的原因。研究发现,HCV感染的患者若能在感染的早期产生较强的针对HCV各个蛋白的多表位特异性CTL,则患者的感染多表现为自限性[1],且病毒的清除与应答的强度、广度和维持时间有关[3];而当患者特异性CTL的活性较低或仅针对个别表位时,则可导致HCV感染的持续状态,并可造成肝组织的慢性损伤。黑猩猩感染实验也表明,CD8+T细胞在病毒清除和阻止慢性化过程中发挥关键作用,但同时CD4+辅助T细胞在CD8+T细胞清除病毒过程中也发挥着不可或缺的作用,缺乏CD4+辅助T细胞的作用,CD8+T细胞清除病毒的水平将大大下降,而且HCV感染复发的保护免疫依赖于CD4+和CD8+记忆性T细胞[4]。Form等[5]发现NS3特异性CD4+T细胞免疫反应对于病毒的清除似乎是必需的。近年来利用阳离子脂质体为载体的HCV NS3上CD4+辅助性T细胞表位疫苗,也诱导出显著的Th1型细胞免疫应答[6]。细胞介导的免疫反应,尤其是CD8+T细胞应答,在防御HCV慢性感染中有重要的作用。因此建立强大的多位点特异性细胞免疫是克服HCV免疫逃逸及发展HCV实验疫苗的首选策略。
多表位疫苗的显著特点是能有效应付病原微生物的变异和免疫反应中的一些不利因素,在诱生细胞免疫方面具有独特的优势,可发展成为多价疫苗。因此,多表位疫苗已成为疫苗的研究热点之一,并已在HIV、HBV、HPV和黑色素瘤等多种高变异的病原体及肿瘤疫苗中进行了实验性的探索,取得了令人满意的结果[7-9]。通过在表位间增加间隔、进行氨基酸替换和引入内质网定位信号肽基序,以及表位与泛素相连,把疫苗编码的蛋白导入泛素-蛋白酶体途径等,使各表位能够被有效呈递,诱导表位特异性的细胞免疫应答[7,10-13]。
我们将四个HCV保守的CTL表位和一个CD4+表位串联,前端添加人泛素序列,后端添加内质网信号肽序列。人泛素引物设计时引入在ATG前增加一个kozak序列,提高转录和翻译效率。并把泛素分子的最后一个氨基酸(76位)用A来替代原来的G,这样蛋白水解酶就不能把泛素分子从融合蛋白中水解下来,这种稳定的体系很容易被多聚泛素化,从而增强蛋白的降解率。利用我们以前多表位连接方法,在表位间增加丙-丙-酪氨酸(AAY)间隔和侧翼修饰,提高表位抗原能在体内被呈递的效率[14]。我们成功构建了丙型肝炎病毒(HCV)HLA-A2限制性复合多表位基因的原核表达载体pRSET-Ub-Mep,转化E.coliBL21,IPTG诱导融合蛋白表达,目的基因可高效表达,纯化蛋白具有良好的抗原性和免疫原性。为丙肝多表位疫苗的研究提供了靶抗原,为进一步的HCV A 2限制性复合多表位诱导的细胞免疫应答研究奠定基础。
1 Houshton M,Abrignani S.Prospects for a vaccine against the hepatitis C virus[J].Nature,2005;436:961-966.
2 韦三华,尹 文,雷迎峰etal.丙型肝炎病毒多表位基因核酸疫苗的构建及其免疫原性[J].中国生物制品学杂志,2007;20(9):633-636.
3 KawaiT,AkiraS.Innate immune recognitionofviral infection[J].Nat Immunol,2006;7:131-137.
4 FolgoriA,Capone S,Ruggeri Letal.A T-cell HCV vaccine eliciting effective immunity againstheterologous virus challenge in chimpanzees[J].NatMed,2006;12(2):190-197.
5 Form X,Bukh J,Purcell RH.The challenge of developing a vaccine against hepatitis C virus[J].JHepatol,2002;37:684-695.
6 Gao M,Wang H P,Wang Y Netal.HCV-NS3 Th1minigene vaccine based on invariant chain CLIP genetic substitution enhances CD4+Th1 cell responses in vivo[J].Vaccine,2006;24(26):5491-5497.
7 Isbilka G Y,Fikes J,Hermanson Getal.Utilization of MHC classⅠtransgenicm ice for developmentofm inigene DNA vaccinesencodingmultiple HLA-restricted CTL epitopes[J].J Immunol,1999;162(7):3915-3925.
8 Doan T,Herd K,Ramshaw Ietal.A polytope DNA vaccine elicitsmultiple effectorandmemory CTL responsesand protectsagainsthuman papillomavirus16 E7-expressing tumor[J].Cancer Immunol Immunother,2005;54(2):157-171.
9 John A,Huseyin F,Anne Petal.Enhancedmultiepitope-based vaccines elicit CD8+cytotoxic T cellsagainstboth immunodom inant and cryptic epitopes[J].Vaccine,2005;23:1085-1091.
10 Brian D,Livingston,Mark Newmanetal.Optimizationofepitopeprocessing enhances immunogenicity ofmultiepitope DNA vaccines[J].Vaccine,2001;19(32):4652-4660.
11 VeldersM P,SanneWeijzen,Eiben G Letal.Defined flanking spacers and enhanced proteolysis isessential for eradication of established tumors by an epitope string DNA Vaccine1[J].J Immunology,2001;166(9):5366-5373.
12 FiratH,TourdotS,Ureta-Vidal Aetal.Design ofa polyepitopeconstruct for the induction of HLA-A0201-restricted HIV 1-specific CTL responses using HLA-A*0201 transgenic H-2 classⅠKOmice[J].J Immunol,2001;31(10):3064-3074.
13 Pinchuk I,Starcher BC,Livingston Betal.A CD8+T cell heptaepitope m inigene vaccine induces protective immunity againstChlamydia pneumoniae[J].J Immunol,2005;1;174(9):5729-5739.
14 韦三华,尹 文,雷迎峰etal.丙型肝炎病毒多表位基因真核载体的构建及在真核细胞中的表达[J].中国生物制品学杂志,2006;19(1):24-27.
[收稿2009-09-21]
(编辑 张晓舟)
Genetic construction of HLA-A2 restricted multi-epitopes gene of hepatitis C virus,expression and purification in E.coli for antigenic analysis
WEISan-Hua,DONGKe,LINFang,WANGXi,LIBin,SHENJian-Jun,ZHANGLi-Jun,LIUXin-Yang,ZHANGHui-Zhong.DepartmentofClinicalLaboratoryandBloodTransfusion,TangduHospitalFourthMilitaryMedicalUniversity,Xi'an710038,China
Objective:To construct the recombinant prokaryotic p lasmid to express HCVHLA-A2 restrictedmulti-CTL epitopes and to purify the fused protein for antigenic analysis.Methods:The human ubiquitin gene andmu lti-CTL epitopes genewas synthesized respectively,and digested by restrictenzymebefore being cloned into pRSET-A.Then it was transformed intoE.coliDH5αand the positive recombinant plasmid named pRSET-Ub-Mepwas sequenced.Target protein was distinctly expressed after transformed intoE.coliBL21 and induced with IPTG.Thus the proteinwas scanned and purified on Ni2+-NTA column aswellasWestern b lot performed after solubility analysis.Results:The recombinant plasmid pRSET-Ub-Mep was successfu lly constructed and it could efficiently exp ress the targetgene.Protein productionwasmain ly in inclusion body and could be purified through Ni2+-NTA column.The purified protein kept theantigen activity.Conclusion:Thegene encoding for HCVHLA-A2-restrictedmulti-CTL epitopes is efficiently exp ressed and the target protein is purified,which establishes a foundation of further research to evaluate the cellular immune response induced by the targetgene.
Hepatitis C virus(HCV);Cytolytic T lymphocyte;Epitope;Gene expression
韦三华(1972年-),男,博士,副教授,主要从事分子病毒学方面的研究。对HCV各个蛋白的多表位特异性CTL,则患者的感染多表现为自限性(Nature 2005)[1],提示CTL活性对HCV感染的控制具有重要作用。越来越多研究也表明,特异性的CTL反应在清除HCV和阻止病毒传播中起着关键的作用。因此,HCV的CTL免疫优势表位有利于预防和治疗性疫苗的研制开发。我们在前期HCV多表位基因免疫特性研究的基础上[2],选择优势的CTL表位进行串联,通过间隔和侧翼修饰,前后端分别加上泛素(Ubiquitin)和内质网定位信号肽基序,以提高各个独立表位被抗原呈递细胞的递呈效率。我们把合成表位,信号肽基序和泛素序列克隆入原核表达载体,观察其表达情况和免疫原性。为进一步分析多表位基因诱导细胞免疫应答研究奠定基础。
R373.21
A
1000-484X(2010)03-0201-05
丙型肝炎病毒(HCV)感染后55%~85%转为慢性病毒性肝炎,并可导致肝纤维化及肝细胞癌(HCC)。目前对HCV感染的治疗除了重组α干扰素(IFN-α)有一定疗效外,仍无有效的抗病毒治疗方法。尤其是包膜糖蛋白E2的中和性抗原位点存在高变区(HVR),从而使以体液免疫为主的预防HCV感染的疫苗研究长期以来进展甚微。研究发现,HCV感染的患者若能在感染的早期产生较强的针
①本文为国家自然科学基金项目(No.C0700760)
②通讯作者
