热处理淋巴瘤细胞增强树突状细胞介导的抗瘤效应研究
2010-02-06艾丽梅孙园园辽宁医学院附属第一医院血液科锦州121001
艾丽梅 潘 静 孙园园 (辽宁医学院附属第一医院血液科,锦州 121001)
热处理淋巴瘤细胞增强树突状细胞介导的抗瘤效应研究
艾丽梅 潘 静 孙园园 (辽宁医学院附属第一医院血液科,锦州 121001)
目的:探讨淋巴瘤细胞热处理后作为抗原,冲击树突状细胞而引发的抗淋巴瘤免疫效应。方法:用健康人外周血分离出单核细胞,体外培养树突状细胞(Dendritic cells,DCs),将淋巴瘤细胞株热处理(42℃,2小时)培养24小时后负载于DCs,在流式细胞仪上检测DCs的免疫表型变化;负载抗原后的DCs与淋巴细胞混合反应,以MTT法评价细胞毒性及在流式细胞仪上检测淋巴细胞的免疫表型;ELISPOT法检测细胞内因子IFN-γ的释放。结果:在两实验组中,DCs负载了热处理的淋巴瘤抗原后,细胞表面的共刺激分子和MHCⅡ类分子表达水平较对照组明显增加(P<0.05),而两组之间差别无显著性(P>0.05);经热处理的肿瘤细胞负载于DCs后,与淋巴细胞混合后IFN-γ的释放量明显增加;混合淋巴细胞反应后,细胞毒性实验(MTT法)和流式细胞仪检测结果均显示两实验组的杀瘤作用强于对照组(P<0.05),两组之间无显著差别(P>0.05)。结论:用热处理的淋巴瘤细胞作为肿瘤抗原冲击DC,能够增强抗淋巴瘤效应。
热处理;淋巴瘤;树突状细胞
淋巴瘤(Lymphoma)是一类异常复杂的疾病,近十年来患病率逐年增加,因此人们对其研究也不断深入,从而推动了治疗方法上的改进。免疫学技术和分子生物学技术的飞速发展促进了肿瘤免疫治疗的研究,特别是淋巴瘤的治疗,更是突破了传统的放疗、化疗手段,结合生物治疗突显其优势,而生物治疗包括了大部分的免疫治疗,可见,淋巴瘤的免疫治疗具有重要性和远大的应用前景[1-3]。
抗肿瘤免疫应答产生的重要条件是具备有效加工和通过合适MHC分子提呈的肿瘤特异抗原。树突状细胞(DC)是引起有效的T细胞免疫的最强的抗原提呈细胞。随着近年对大量扩增人DC技术的成熟,使利用这些抗原负载后的DC作为治疗性疫苗成为可能[4,5]。目前由于肿瘤抗原的限制性,多用整个细胞抗原负载DC使其经过“自然”加工和选择抗原表位,引发包含CD4+T细胞和细胞毒性淋巴细胞(CTL)克隆产生的免疫反应。热处理肿瘤细胞可诱导热休克蛋白(HSP)表达增加,而近年来人们发现HSP具有参与抗原呈递、诱导 DC成熟等作用[6],本实验基于上述观点而将淋巴瘤细胞热处理后负载于DC,对其抗肿瘤的免疫效应进行研究。
1 材料与方法
1.1 主要仪器和试剂 IMDM培养基(Iscove's Modified Dulbecco'smedium,IMDM)和胎牛血清均为美国Gibco公司产品;人淋巴细胞分离液为天津灏洋生物公司产品;细胞因子GM-CSF、rIL-4为厦门特宝生物药业有限公司产品;CD4、CD8、CD25、CD56、CD83、CD80、CD86 、HLA-DR等单克隆抗体和流式细胞仪(FACSCalibur)均为美国Becton Dickinson公司产品;MTT(噻唑盐)购自Sigma公司;ELISPOT试剂盒为瑞典Mabtech公司产品;人淋巴瘤细胞株(Daudi和Namalva)为北大医院血液科细胞治疗室馈赠。
1.2 体外培养树突状细胞 取健康志愿者外周血分离单核细胞。将50ml新鲜外周血缓慢加到淋巴细胞分离液(Ficoll液)表面,与其比例为1∶3,离心(2 000 r/min,20分钟),吸取中间白膜层到另一离心管中,用PBS液洗一遍(1 250 r/min,10分钟)后,用IMDM培养液重悬细胞,按每瓶细胞数为1×107个接种到25 cm2培养瓶中。于37℃、5%CO2孵育箱中放置2小时,使细胞贴壁。将悬浮细胞用尼龙毛柱法[7,8]分离出T淋巴细胞,放置液氮中冻存,留作效应细胞。已接种了细胞的培养瓶中加入细胞因子GM-CSF(终浓度1 000U/m l)、IL-4(终浓度500U/m l)。每3天更换一次相同的培养体系。
1.3 热处理肿瘤细胞 分别取生长状态良好的Daudi和Namalva细胞株(1×106个)进行热处理,即在恒温42℃下培养2小时后,离心(800 r/min,5分钟)、用PBS重悬细胞、再离心(800 r/min,5分钟)、加入IMDM 培养液重悬细胞,在37℃、5%CO2孵育箱中继续培养。
1.4 抗原负载 将热处理的肿瘤细胞培养24小时后取出,按照不同的实验组与DC混合,即:热处理的Daudi细胞负载DC组(H1),热处理的Namalva细胞负载DC组(H2),无热处理的Daudi细胞负载DC组(Control 1),无热处理的Namalva细胞负载DC组(Control 2)。肿瘤细胞与DC混合比例为1∶10。
1.5 流式细胞仪检测 抗原负载DC 48小时后,在流式细胞仪上检测DC分化抗原CD83、CD80、CD86、HLA-DR的表达;负载抗原后的DC与淋巴细胞混合培养4天后,收集悬浮细胞液,检测各组CD4、CD8、CD25、CD56的表达水平。
1.6 ELISPOT检测胞内IFN-γ释放 先将淋巴细胞悬液加到ELISPOT 96孔板中(细胞数2.5×105个/well),再按不同效靶比例加入各组经抗原刺激的DC细胞,在37℃、5%CO2孵育箱中培养24小时后,按照试剂盒操作步骤说明,进行洗板、加入生物素标记
抗体、再洗板、加酶标亲和素、显色,最后在读板机上扫描和计数IFN-γ产生细胞。
1.7 细胞毒性实验(MTT法) DC细胞与淋巴细胞混合反应4天后收集细胞悬液,按不同浓度等级(每浓度复3孔)加到96孔板中(按效靶比为10∶1、20∶1、50∶1),靶细胞为Daudi和Namalva细胞。在37℃、5%CO2箱中孵育 48小时,每孔加MTT液10μl(5 g/L),继续孵育4小时。离心弃上清,每孔加入二甲基亚砜(DMSO)100μl终止反应,震荡溶解颗粒,用酶标检测仪于波长570 nm处测定吸光度(A值),并计算杀伤率。计算公式为:杀伤率=[1-(效靶实验组A值-效细胞对照A)/靶细胞对照组A值]×100%。
1.8 统计学分析 应用SPSS11.5统计软件分析实验结果,数据以均数±s表示,组间比较采用方差分析,P<0.05为差别有统计学意义。
2 结果
2.1 树突状细胞的免疫表型 如图1所示,H1组和H2组的CD80、CD86、HLA-DR均较对照组明显增加,而两组之间无明显差别。结果表明,热处理24小时的Daudi和Namalva细胞冲击DC后,均使其表面共刺激因子和MHCⅡ类分子表达增加,加速抗原呈递和促DC的成熟。
2.2 检测细胞内IFN-γ的释放 肿瘤细胞经或未经热处理后负载到DC上,再与自身淋巴细胞进行共培养后检测IFN-γ的释放。结果表明(图2),IFN-γ产生细胞的数量随着效靶比例增大而增加,并且实验组均大于对照组(P<0.05)。尤以效靶比是1∶10时,与对照组之间比较差别显著(P<0.05)。
2.3 淋巴细胞的免疫表型 表1结果显示,H 1组和H2组的CD8+、CD25+和CD56+细胞数较对照组明显增加(P<0.05),而两组之间无明显差别;结果也表明,实验组中细胞毒性淋巴细胞(CTLs)的生成增加。
2.4 细胞毒性实验分析 如图3所示,各组的杀伤活性均随效靶比(E∶T)增大而增加;H1和H2组的杀伤毒性明显高于对照组(P<0.05),而两组之间无明显差别。
表1 淋巴细胞免疫表型分析(%,n=3,±s)Tab.1 Lym phocy tic immunophenotyping(%,n=3,±s)

表1 淋巴细胞免疫表型分析(%,n=3,±s)Tab.1 Lym phocy tic immunophenotyping(%,n=3,±s)
Note:1)Compared with Control 1 and Control 2 group respectively,P<0.05.
CD4+ CD8+ CD25+ CD56+H 1 33.65±1.04 41.46±1.081) 5.24±0.091) 7.78±0.291)H 2 35.99±0.42 41.52±0.721) 5.13±0.101) 7.71±0.351)Control l 163.88±0.51 22.56±0.65 1.55±0.04 1.24±0.07 Control2 265.84±0.57 23.26±0.88 1.35±0.06 1.29±0.05
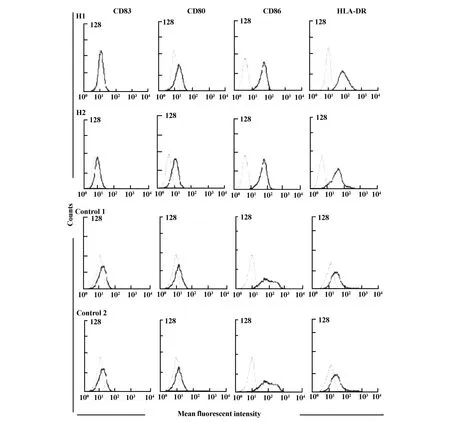
图1 树突状细胞(DC)免疫表型Fig.1 Immunophenotype for dend ritic cells
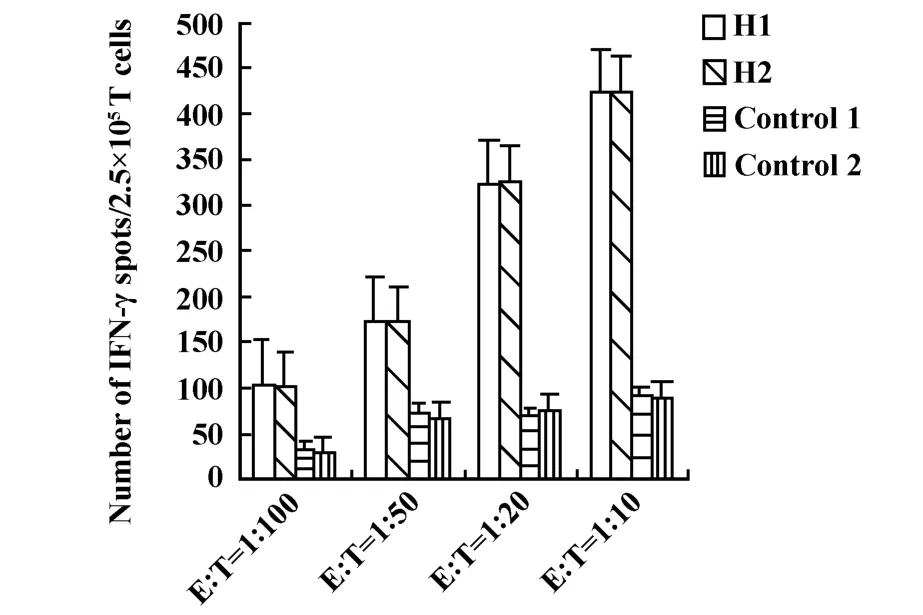
图2 ELISPOT法检测细胞因子IFN-γ的释放Fig.2 Detection of IFN-γsecretion by ELISPOT
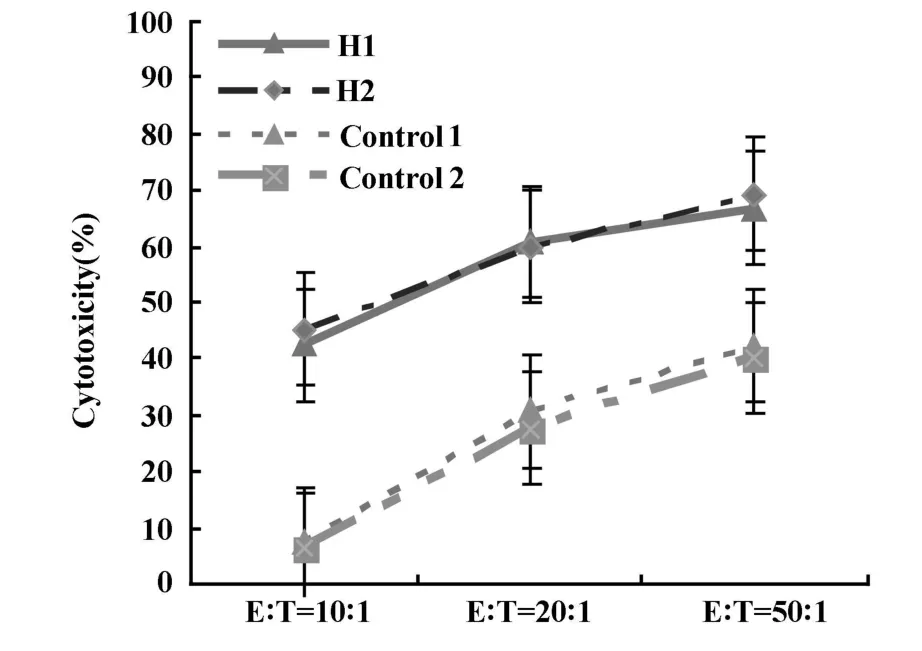
图3 细胞毒性分析Fig.3 Cytotoxicity analysis
3 讨论
本研究将热处理的淋巴瘤细胞作为肿瘤抗原冲击树突状细胞(DC),通过细胞免疫引发了抗淋巴瘤效应;同时比较对照组的结果,说明确实发生了增强的抗瘤作用。
DC随着捕获抗原而成熟,同时抗原被加工成小肽(抗原肽)递呈给初始T细胞和引发细胞免疫,包括CD4+T(Th1)和细胞毒性CD8+T细胞。因此,明确促发理想DC成熟的刺激很重要,它会诱导肿瘤特异性CTL生成。近年来的研究表明,热休克蛋白(HSP)具有重要的免疫学意义,包括可以结合于肿瘤抗原肽,协助其提呈。而热处理可诱发HSP高表达[9,10]。
热休克蛋白是一种执行管家功能和细胞保护功能的细胞内蛋白,近20年来,越来越多的证据显示,它还具有重要的免疫学意义。其中,热休克蛋白的抗肿瘤效应颇值得关注。人们陆续发现多种热休克蛋白可以参与这种抗肿瘤免疫[11]。HSP对免疫系统的作用不仅是一种分子伴侣,还是一种强有力的佐剂。如Blachere等[12]的实验表明,热处理后形成的抗原肽可以被MHCⅠ类分子提呈,激活针对该肿瘤的CD8+T细胞。本实验结果也表明,经热处理后肿瘤细胞抗原能增强树突状细胞的抗原表达,可以提高抗原提呈能力,最终使抗瘤效应增强,如我们观察到细胞毒性淋巴细胞在热处理组产生增多,即标志CTL的CD8+、CD25+和 CD56+细胞率明显增加,由此推断,热休克蛋白在树突状细胞介导的抗肿瘤免疫效应机制中能发挥重要作用。我们通过试验组和对照组的比较发现,由于肿瘤细胞经过热处理,可能会裂解形成较多的抗原片段来刺激树突状细胞,产生的CTL细胞明显增加,而未经热处理的肿瘤抗原的作用则不充分。
热处理后的肿瘤细胞作为抗原冲击树突状细胞,促进其抗原提呈能力并增强抗瘤效应,其中涉及的机制不仅是细胞毒性淋巴细胞数量增加,同时也伴随细胞因子(干扰素-γ)的释放量增加,协同阻碍肿瘤细胞的增殖,增强了抗瘤效应。综上所述,我们由本研究可以得出结论,体外热处理淋巴瘤细胞株作为肿瘤抗原能增强树突状细胞抗淋巴瘤的免疫效应。
1 Borchmann P,Schnell R,Engert A.Immunotherapy of Hodgkin′s lymphoma[J].Eur JHaematol,2005;75(Suppl 66):159-165.
2 Hainsworth JD,Litchy S,Burris H A 3rdetal.Rituximab as first-line and maintenance therapy for patients with indolent non-Hodgkin′s lymphoma[J].JClin Oncol,2002;20(20):4261-4267.
3 Schnell R,Borchmann P,Staak JOetal.Clinical evaluation of ricin A-chain immunotoxins in patients with Hodgkin′s lymphoma[J].Ann Oncol,2003;14(5):729-736.
4 ZeisM,Siegel S,Wagner Aetal.Generation of cytotoxic responses in mice and human individualsagainsthematologicalmalignanciesusing survivin-RNA-transfected dendritic cells[J].J Immunol,2003;170(11):5391-5397.
5 Bchler T,Michalek J,Kovarova Letal.Dendritic cell-based immunotherapy for the treatment of hematological malignancies[J].Hematology,2003;8(2):97-104.
6 UdonoH,SrivastaraPK.Heatshock protein 70-associated peptideselicits specific cancer immunity[J].JExpMed,1993;178(4):1391-1396.
7 周正任,叶晓卉,杨晓临.小鼠小肠上皮内淋巴细胞的提取与抗原表型测定和功能的初步研究[J].中国免疫学杂志,2001;17(3):135-137.
8 祁赞梅,吕昌龙,刘北星etal.肠上皮内淋巴细胞促L929细胞增殖活性的研究[J].中国医科大学学报,2005;34(4):292-293.
9 HayashiY,Tohnai J,KobayashiTetal.Trans-location ofhsp-70 and protein synthesis during countinousheating atm ild temperatures in Hela cells[J].Radio Res,1991;125:80-88.
10 王 莉.肿瘤热疗与免疫治疗[J].国际肿瘤学杂志,2006;5(33):357-359.
11 Wang X Y,Kazim L,Repasky E Aetal.Characterization of heat shock protein 110 and glucose-regulated protein 170 as cancer vaccinesand the effectof fever-range hypertherm ia on vaccine activity[J].J Immunol,2001;166(1):490-497.
12 Blachere N E,LiZ,Chandawarkar RYetal.Heat shock protein-peptide complexes,reconstituted in vitro,elicit peptide-specific cytotoxic T lymphocyte response and tumor immunity[J].JExp Med,1997;186(8):1315-1322.
[收稿2009-07-05 修回2009-12-21]
(编辑 倪 鹏)
Enhancement of antitumor immunity of dendritic cells pulsed w ith hypertherm ia lymphoma cells
AILi-Mei,PANJing,SUNYuan-Yuan.DepartmentofHematology,LiaoningMedicalUniversityFirstHospital,Jinzhou121001,China
Objective:To investigate the immuno-effects triggered by dendritic cells(DCs)pulsed with Heat-treated lymphoma cells.Methods:Mononuclear cells from healthy human peripheralblood(PBMC)were isolated and DCswere generated in vitrowith normalmethods.Lymphoma cellswere heated(42℃,2 h)and then loaded onto DCs.Immunotypes of DCs and lymphocyteswere detected with flow-cytometric analysis.IFN-γreleasing was detected by ELISPOT,lymphocyte cytotoxicity was analyzed by MTTmethod aftermixing with DC reaction.Results:After pulsing DCswith hyperthermia lymphoma cells,CD80+,CD86+and HLA-DR existed higher than those of the control group,IFN-γ releasing and cytotoxicitieswere also strengthened,but there was no difference between them,cytotoxitic lymphocytes(CTLs)were produced more as CD8+,CD25+and CD56+cells by flow-cytometric analysis.Conclusion:Anti-lymphoma immuno-effects could be strengthened by loading DCwith hypertherm ia lymphoma cells.
Hyperthermia;Lymphoma;Dendritic cell
R730.51
A
1000-484X(2010)03-0232-04
艾丽梅(1968年-),女,医学博士,副教授,主任医师,主要从事血液肿瘤免疫治疗方面的研究。
·神经内分泌与免疫·
