Ghrelin活化人T细胞翻译起始分子通过m TOR信号转导通路①
2010-02-06崔天盆胡必成武汉市第一医院临床免疫学实验室武汉430022
崔天盆 胡必成 (武汉市第一医院临床免疫学实验室,武汉 430022)
Ghrelin活化人T细胞翻译起始分子通过m TOR信号转导通路①
崔天盆 胡必成 (武汉市第一医院临床免疫学实验室,武汉 430022)
目的:探讨Ghrelin活化人T细胞翻译起始分子的信号转导机理。方法:采用微柱法分离人外周血T细胞,采用Western blot方法检测mTOR信号通路分子和蛋白质翻译调控分子的磷酸化状态和含量。采用mTOR抑制剂:雷帕霉素,PI3KⅠ抑制剂:LY294002,PI3KⅢ抑制剂:3-甲基腺嘌呤,Ghrelin拮抗剂:Des-Lys-3-GHRP6和AKT抑制剂:A443654和Ghrelin研究相应信号通路。结果:①人T细胞表面有Ghrelin受体(GHSR1a)表达。②Ghrelin与GHSR1a结合后可活化mTOR。③Ghrelin磷酸化两个mTOR下游靶分子4E-BP-1和P70S6K,P70S6K进一步磷酸化核糖体S6蛋白。④Ghrelin磷酸化蛋白质翻译起始帽子结构的两个重要分子eIF4E和eIF4G。结论:Ghrelin促进人T细胞mRNA翻译起始的机理是活化mTOR信号转导通路。
Ghrelin;哺乳类雷帕霉素靶蛋白;T细胞;蛋白质翻译
Ghrelin是由胃X/A样内分泌细胞分泌的胃肠肽激素,饥饿时血中浓度最高,进食1小时后最低。GHRP-6是最早发现的不与生长激素释放激素受体结合的促进生长激素分泌的多肽,随后发现一系列肽类和非肽类促生长激素分泌的化合物,称之为生长激素促分泌素(growth hormone secretagogues,GHSs),1995年Howard[1]从垂体和下丘脑克隆到可与GHS结合的孤儿受体——生长激素促分泌素受体1a(GH secretagogue receptor 1a,GHSR1a)。然而直到1999年Kojima[2]才从胃中克隆纯化GHSR1a内源性配体——Ghrelin。Ghrelin是含 28个氨基酸的多肽,Ghrelin氨基端第三位丝氨酸被辛烷化,且目前认为辛烷化Ghrelin可与GHSR结合,是Ghrelin的活化形式。Ghrelin能促进进食和体重的增加,其促进进食的效应强于目前已知的神经肽Y(neuropeptide Y,NPY),而且长期应用Ghrelin能增加体重。此外Ghrelin/GHSR1a还有其他中枢和外周功能,如激素分泌、血糖稳定、胰腺功能、生殖、胃肠蠕动、心血管功能、细胞分化和生存、免疫和炎症、骨代谢、记忆和睡眠等。Ghrelin的系列功能是通过Ghrelin与GHSR1a结合从而启动胞内信号转导来实现的。
不同作者对Ghrelin与GHSR1a结合后启动的信号转导机理进行研究[3,4]。发现一些信号分子参与Ghrelin的信号转导。使用HEK293和CHO细胞表达GHSR1a,通过同位素结合分析、激光共聚焦显微镜分析,受体活化后胞内Ca2+浓度升高。Ghrelin作用于猪生长激素细胞通过AC/PKA、PLC/PKC和胞内钙通路转导信号。除了Ghrelin介导的离子电流效应,Ghrelin通过MAPK介导细胞分化功能,采用CHO细胞稳定表达GHSR1a模型,研究发现Ghrelin通过PLC、PKCε活化 ERK1/2通路。然而在3T3-L1前脂肪细胞,Ghrelin通过PI-3K/AKT和百日咳毒素敏感G蛋白(Gi/o)活化MAPK。在胰腺癌细胞也发现通过PI3-K/AKT通路。在人和大鼠肾上腺小球细胞(adrenal zona glomerulosa cells),Ghrelin促进细胞分化通过ERK1/2,而不依赖PKA和PKC。在肝细胞,Ghrelin磷酸化IRS-1和结头蛋白-生长因子受体结合蛋白2及MAPK,因此在这种细胞GHSR的信号转导与胰岛素的信号分子交叉,Ghrelin和胰岛素联合应用可增加IRS-1的磷酸化。
人T细胞和单核细胞表达Ghrelin和Ghrelin受体,Ghrelin通过Ghrelin受体特异性抑制前炎性细胞因子如IL-1β、IL-6和TNF-α的表达。Ghrelin以剂量依赖方式抑制瘦素诱导的前炎性细胞因子表达。用Ghrelin治疗LPS诱导鼠内毒素模型,发现Ghrelin有抗炎效应。应用Ghrelin或GHSR激活有助于改善疾病相关的恶液质。
随着年龄增长,胸腺表达Ghrelin和Ghrelin受体减低,用Ghrelin治疗14月龄小鼠可显著改善胸腺结构和增加胸腺细胞数量,增加胸腺流出和改善外周T细胞TCR多样性[5,6]。
本文旨在研究Ghrelin作用T细胞的信号转导机理,由于Ghrelin的基本功能是调节机体进食、代谢和能量平衡,因此我们选择哺乳类雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号转导通路作为研究对象。
1 材料与方法
1.1 研究对象 健康献血者,年龄35~55岁,不吸烟,无过敏史。采集外周血200m l。
1.2 试剂 高纯度人Ghrelin(纯度=98.7%)购自EZbiolab公司(EZbiolab Inc.Westfield,IN 46074,USA);(D-Lys3)-GHRP-6(纯度>95%,Phoenix Pharmaceuticals Inc.Burlingame,CA 94010,USA)。PI3K 抑制剂—LY294002(Calbiochem,La Jolla,CA),雷帕霉素(rapamycin,Sigma-Aldrich,St.Louis,MO,USA)。3-甲基腺嘌呤(Sigma:M 9281);Akt inhibitor(2S)-1-(1HIndol-3-yl)-3-[5-(3-methyl-2H-indazol-5-yl)pyridin-3-yl]oxypropan2-amine(A443654,Invitrogen),RIPA缓冲液(Sigma R0278,Saint Louis,M issouri 63103),蛋白酶抑制剂(Protease inhibitor cocktail,Sigama P8340),磷酸酶抑制剂(Phosphatase inhibitor cocktail1,Sigma P8340和Phosphatase inhibitor cocktail2,Sigma P5726)。
1.2 研究方法
1.2.1 人T细胞分离 首先用Ficoll分离液分离人外周血单个核细胞(包括淋巴细胞和单核细胞),用R&D公司(R&D Systems,Minneapolis,Minnesota,USA)的T细胞富集柱(Cat#:HTCC-25)用高亲和阴性选择法分离T细胞,具体参照R&D公司的使用说明书,T细胞纯度为95%。简言之,外周血单个核细胞通过抗免疫球蛋白包被的T细胞富集柱,B细胞通过BCR与抗体结合,而单核细胞通过Fc受体结合后留在富集柱上,用相应缓冲液洗涤三次,得到纯度大于95%的T细胞。
1.2.2 免疫印迹(Western blot) 人外周血T细胞加入含青霉素、链霉素的RPMI,37℃5%CO2培养箱中,血清饥饿过夜。使用Ghrelin或适当抑制剂,每10×106人外周血T细胞加入0.1 ml含蛋白酶抑制剂和磷酸酶抑制剂的RIPA缓冲液,T细胞RIPA裂解液置冰上15分钟,4℃14 000 r/min离心15分钟,上清转入另一近洁净EP管,采用BCATM(PIERCE,23227,Rockford,IL,USA)蛋白定量分析检测蛋白含量。2~20μg蛋白采用Invitrogen公司的4%~12%梯度Bis-Tris聚丙烯酰胺凝胶电泳分离蛋白,电转移到0.22μm PVDF膜。已转印的PVDF膜置5%脱脂奶粉-TBST室温中振荡封闭 1小时。已转印的PVDF膜置于适当稀释的第一抗体中4℃旋转过夜;然后在室温下用1×TBST洗膜三次,每次10分钟;将膜置于适当稀释的含辣根过氧化物酶标记的二抗(horseradish peroxidase-labeled Goat anti-Rabbit IgG(H+L),Southern Biotech.Birmingham,Alabama 35209;或donkey anti-mouse IgG-HRP,Santa Cruz Biotech,sc-2096)的1×TBST中,室温振荡 1小时;室温条件下用1×TBST洗膜三次,每次10分钟。最后采用ECLplus化学发光底物(ECLplus,Amersham Place,Little Chalfont,Buckinghamshire,UK),具体根据使用说明书操作。用PIERCE公司X线胶片曝光记录结果,使用Alpha Innotech Imaging system公司扫描。所用抗体如下:GHS-R1 antibody(D-16)(Santa Cruz Biotechnology Inc.sc-10362,Santa Cruz,CA95060).PhosphomTOR(Ser2448)antibody(Cell Signaling,#2971,Danvers,MA01923),mTOR antibody(Cell Signaling,#2972);Phospho-p70 S6 kinase(Thr389)rabbitmonoclonal antibody(Cell Signaling#9234),Anti-p70 S6 kinase antibody(Upstate,#06-926);Anti-phospho-ribosomal protein S6(Ser235)antibody(Upstate,#05-795),S6 ribosomal protein(54D2)mousemAB(Cell signaling,#2317),Phospho-4E-BP1(Ser65)antibody(Cell Signaling,#9451),4E-BP1 antibody(Cell Signaling,#9452);Phospho-eIF4E(Ser209)antibody(Cell Signaling,#9741),eIF4E antibody(Santa Cruz,sc-9976););Phospho-eIF4G(Ser1108)antibody(Cell Signaling,#2441),eIF4G antibody(SantaCruz,sc-11373)。
2 结果
2.1 人T细胞表达GHSR1a T细胞富集柱分离的T细胞,采用免疫印迹法检测,人T细胞表达GHSR1a。具体见图1。
2.2 Ghrelin与GHSR1a结合诱导mTOR磷酸化 哺乳类雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是保守的丝氨酸-苏氨酸蛋白激酶,在细胞信号转导中有重要作用,mTOR可调控正常细胞或癌细胞蛋白质合成、细胞分化和细胞体积增大。
100 ng/mlGhrelin诱导mTOR 2448位丝氨酸磷酸化和活化,10分钟开始活化,30分钟达高峰,进一步活化下游P70 S6激酶389位苏氨酸磷酸化和活化;活化的P70 S6激酶进一步活化更下游的核糖体S6蛋白的235位丝氨酸的磷酸化和活化,见图2。雷帕霉素则抑制Ghrelin诱导的磷酸化和活化,见图3,表明Ghrelin诱导的信号转导依赖mTOR的活化。
2.3 Ghrelin诱导mTOR磷酸化通过GHSR1a、PI3K和AKT 人 T细胞与 1μmol/L Des-Lys-3-GHRP6(ghrelin拮抗剂),50μmol/L LY294002(PI3KⅠ抑制剂),4 mmol/L 3-甲基腺嘌呤(3-Methyladenine,PI3KⅢ抑制剂),1μmol/LA443654(AKT抑制剂),20 ng/m l雷帕霉素(mTOR抑制剂)37℃孵育1小时;采用Ghrelin分别治疗未处理和抑制剂处理人T细胞,37℃15分钟。采用免疫印迹检测mTOR 2448位丝氨酸磷酸化强度,见图3。Ghrelin诱导mTOR 2448位丝氨酸磷酸化和P70S6激酶389位苏氨酸磷酸化可被Des-Lys-3-GHRP6、LY294002、3-甲基腺嘌呤和雷帕霉素所抑制。
2.4 Ghrelin诱导mRNA翻译起始调控分子4E-BP-1、eIF4E和eIF4G磷酸化 Ghrelin诱导mTOR 2448位丝氨酸磷酸化和活化,进一步磷酸化下游mRNA翻译抑制因子—真核翻译起始因子4结合蛋白-1(4E-BP-1),15分钟开始活化,30分钟达高峰,4E-BP-1的65位丝氨酸磷酸化后,4E-BP-1与eIF4E的结合解除,4E-BP-1对eIF4E的抑制也解除,eIF4E与eIF4G和eIF4A组成复合物称之为eIF4F,eIF4F与mRNA帽子结构结合启动翻译。
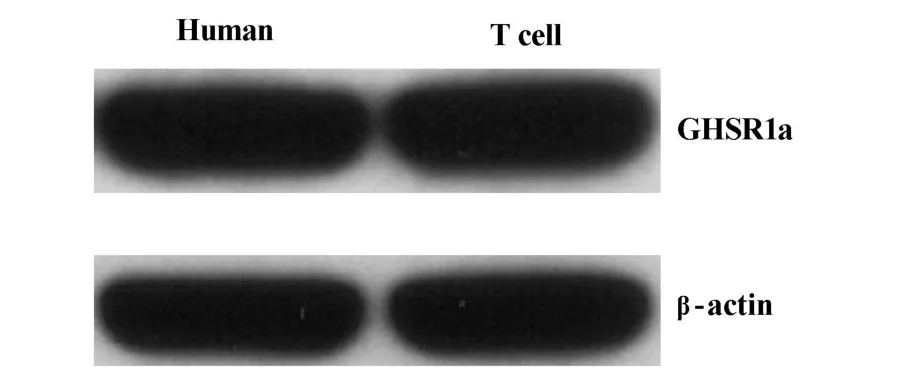
图1 人T细胞表达Ghrelin受体Fig.1 Human T cells express GHSR1a
Ghrelin快速诱导eIF4E 209位丝氨酸磷酸化,5分钟即达高峰,而eIF4G 1108位丝氨酸磷酸化15分钟则达到高峰。eIF4E 209位丝氨酸磷酸化和eIF4G 1108位丝氨酸磷酸化也有助于蛋白质翻译起始,见图4。
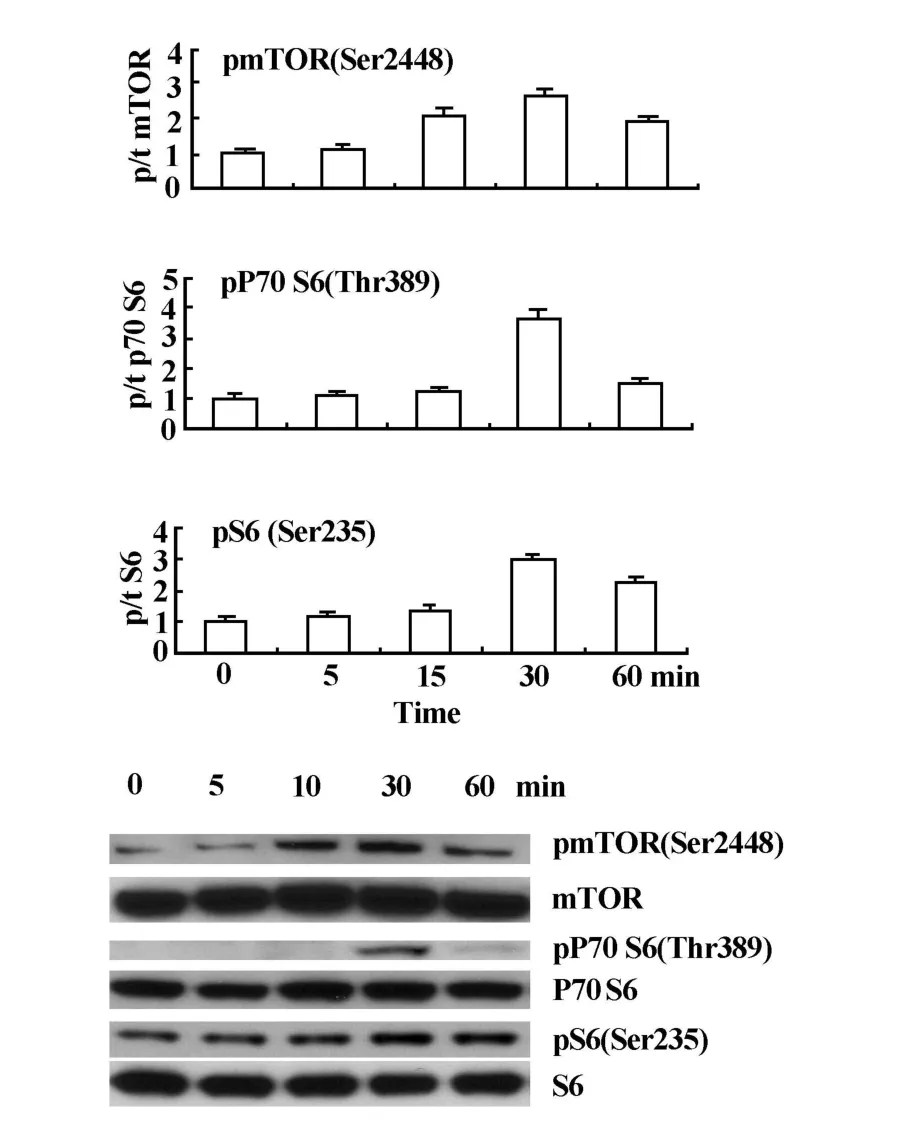
图2 Ghrelin诱导人T细胞m TOR、p70 S6K和核糖体S6蛋白的磷酸化Fig.2 Ghrelin induces phosphorylation of m TOR,p70 S6K and S6 ribosomal p rotein in human p rimary T cells

图3 Ghrelin诱导人T细胞m TOR,P70 S6K和核糖体S6蛋白的磷酸化依赖GHSR1a,PI3K,AKTFig.3 Ghrelin-mediatedm TOR P70S6 phosphorylation isGHSR1a,PI3K,AKT dependent

图4 Ghrelin诱导人 T细胞4E-BP-1、eIF4E和 eIF4G的磷酸化Fig.4 Ghrelin induces phosphorylation of 4E-BP1,eIF4E and eIF4G
3 讨论
Ghrelin是28个氨基酸组成的多肽,其第3位丝氨酸在Ghrelin酰化酶(GOAT)作用下辛烷化,且3位丝氨酸的辛烷化对其发挥生物活性来说是必需的[7]。到目前为止,Ghrelin被中链脂肪酸修饰在激素中是唯一的。血清中也存在去酰化Ghrelin(Desacyl-Ghrelin),其含量远高于Ghrelin。正常人血清Ghrelin浓度是10~20 pmol/L,而总Ghrelin(包括Ghrelin和去酰化Ghrelin)的浓度是100~150 pmol/L,短期饥饿情况下血浆Ghrelin浓度升高,进食后血浆Ghrelin浓度降低。McCowen和Shiiya等研究表明口服或静脉注射葡萄糖可降低血浆Ghrelin浓度;喝水则不改变血浆Ghrelin浓度。肥胖者Ghrelin浓度低而消瘦者高。肿瘤、心衰或慢性消耗性疾病所致恶病质Ghrelin浓度升高。
免疫和神经内分泌系统具有双向调节作用,生长激素和饥饿激素Ghrelin表达于不同的免疫细胞,如T细胞、B细胞、单核细胞和中性粒细胞;免疫细胞也有生长激素受体和Ghrelin受体[8,9]。像Ghrelin作用于垂体细胞一样,Ghrelin作用于免疫细胞表达生长激素。然而调节免疫细胞表达生长激素分泌与其他作用于垂体不同,细胞因子和丝裂原促进免疫细胞分泌生长激素,Ghrelin的生物活性包括减轻内毒素休克和抗炎作用,调节吞噬和增加胸腺生成。
mTOR是保守的丝氨酸-苏氨酸蛋白激酶,在细胞信号转导中有重要作用,mTOR可调控细胞蛋白质合成、细胞分化和细胞体积的增大[10]。mTOR对T细胞蛋白质合成也有重要作用[11]。
本文研究发现人T细胞表达Ghrelin受体,Ghrelin通过GHSR1a活化T细胞mTOR通路。Ghrelin诱导mTOR和P70 S6磷酸化可被Des-Lys-3-GHRP6、雷帕霉素、LY294002、3-甲基腺嘌呤和A443654所抑制,表明Ghrelin活化T细胞mTOR通路是通过GHSR1a、mTOR、PI3K I和 Ⅲ以及AKT。
Ghrelin诱导mTOR 2448位丝氨酸磷酸化和活化,进一步磷酸化下游mRNA翻译抑制因子—真核翻译起始因子4结合蛋白-1的65位丝氨酸磷酸化后,4E-BP-1与eIF4E的结合解除,4E-BP-1对eIF4E的抑制也解除,eIF4E与eIF4G和eIF4A组成复合物称之为eIF4F,eIF4F与mRNA帽子结构结合启动翻译。eIF4E 209位丝氨酸磷酸化和eIF4G 1108位丝氨酸磷酸化也有助于翻译起始。因此Ghrelin活化T细胞mTOR通路有助于蛋白质翻译起始。
总之,Ghrelin促进人T细胞mRNA翻译起始的机理是活化mTOR信号转导通路,这也是第一个报道Ghrelin可在细胞水平活化mTOR信号转导通路,将细胞代谢与免疫联系起来。
1 Howard A D,Feighner SD,Cully D Fetal.A receptor in pituitary and hypothalamus that functions in growth hormone release[J].Science,1996;273(5277):974-977.
2 KojimaM,Hosoda H,Nakazato Metal.Ghrelin is a growth-hormone-releasing acylated peptide from stomach[J].Nature,1999;402(6762):656-660.
3 Mousseaux D,LeGallic L,Ryan Jetal.RegulationofERK1/2 activity by ghrelin-activated growth hormone secretagogue receptor 1A involves a PLC/PKCepsilon pathway[J].Br JPharmacol,2006;148(3):350-365.
4 Camina JP,LodeiroM,Ischenko Oetal.Stimulation by ghrelin of p42/p44mitogen-activated protein kinase through the GHS-R1a receptor:role ofG-proteins and beta-arrestins[J].JCell Physiol,2007;213(1):187-200.
5 Dixit V D,Schaffer EM,Pyle RSetal.Ghrelin inhibits leptin-and activation-induced proinflammatory cytokine expression by human monocytes and T cells[J].JClin Invest,2004;114:57-66.
6 DixitV D,YangH,Sun Yetal.Ghrelin promotes thymopoiesis duringaging[J].JClin Invest,2007;117(10):2778-2790.
7 Yang J,Brown M S,Liang Getal.Identification of the acyltransferase that octanoylates ghrelin,an appetite-stimulating peptide hormone[J].Cell,2008;132(3):387-396.
8 HattoriN.Expression,regulation and biological actionsof growth hormone(GH)and ghrelin in the immune system[J].Growth Horm IGF Res,2009;19(3):187-197.
9 HattoriN,Saito T,Yagyu Tetal.GH,GH receptor,GH secretagogue receptor,and ghrelin expression in human T cells,B cells,and neutrophils[J].JClin EndocrinolMetab,2001;86(9):4284-4291.
10 Tobias Schmelzle,Michael N Hall.TOR,a central controller of cell growth[J].Cell,2000;103(2):253-262.
11 Beretta L.Translational control in T lymphocytes[J].Int Rev Immunol,2004;23(3-4):347-363.
[收稿2009-09-03 修回2009-11-29]
(编辑 许四平)
Ghrelin activates translation initiate factor in human T cells through m TOR pathway
CUITian-Pen,HUBi-Cheng.LaboratoryofClinicalImmunology,WuhanNo.1Hospital,Wuhan430022,China
Objective:Ghrelin is a brain-gut peptide with GH-releasing,apetide-inducing and anti-inflammation activities and with widespread tissue distribution.Ghrelin is the endogenous ligand of GH secretagogue receptor(GHSR),and both ghrelin and theGHSR are expressed in T cells.We therefore examined the effectofGhrelin on human T celland its signal transduction.Methods:Ghrelin-activatingmTOR pathway in human primary T cellwas studied using immunoblotting and inhibitors of the PI3K(LY294002,3-Methyladenine)ormTOR(rapamycin)and antagonistof GHSR1a(Des-Lys-3-GHRP6).Results:The results showed thatGHSR1a was expressed on T cells.Ghrelin caused a significant increase in the phosphorylatedmTOR,P70S6K,S6K,4E-BP-1,eIF4G,eIF4Eby immunoblotting.While the phosphorylatedmTOR,P70S6K were abolished by themTOR inhibitor rapamycin and PI3K inhibitor LY294002,3-methyladenine and alsoantagonistof GHSR1a,Des-Lys-3-GHRP6.Conclusion:The data document thatGhrelin activates translation of T cells throughmTOR pathway.
Ghrelin;mTOR;T cell;Translation
R392
A
1000-484X(2010)03-0205-05
①本课题为武汉市人事局留学回国人员创新专项资助
崔天盆(1967年-),男,博士,副主任技师,主要从事临床免疫学研究,E-mail:Tianpencui@hotmail.com。