下调HMGA2基因表达对改善骨肉瘤U2OS细胞恶性表型的实验研究①
2010-02-06曲珊珊李荣贵张海英史艳芬李玉林
曲珊珊 李荣贵 张海英 王 洋 史艳芬 吕 慧 李玉林
(吉林大学白求恩医学院病理生物学教育部重点实验室,长春 130021)
下调HMGA2基因表达对改善骨肉瘤U2OS细胞恶性表型的实验研究①
曲珊珊 李荣贵 张海英 王 洋 史艳芬 吕 慧 李玉林
(吉林大学白求恩医学院病理生物学教育部重点实验室,长春 130021)
目的:研究HMGA2表达在维持人骨肉瘤U2OS细胞恶性表型中的作用,为基因靶向治疗提供理论依据。方法:采用基于DNA的shRNA表达载体HMGA2-shRNA,稳定转染人骨肉瘤U2OS细胞,下调其HMGA2表达水平,并应用RT-PCR技术检测其对HMGA2基因的沉默效果;经Cell Counting Kit-8(CCK8)测定、Hoechst33342染色荧光显微镜观察及Boyden小室法分别检测细胞增殖、凋亡及迁移情况;实时定量RT-PCR检测m RNAs表达水平。结果:稳定转染靶向HMGA2的shRNA可特异性下调U2OS细胞HMGA2mRNA表达水平;其作用结果使细胞的增殖和迁移能力受到明显抑制,自发凋亡率及Caspase 3和Caspas 9基因表达水平显著升高。结论:HMGA2基因异常表达在维持人骨肉瘤U2OS细胞恶性表型中起重要作用,靶向HMGA2的基因治疗可能为骨肉瘤治疗带来新希望。
HMGA2基因;shRNA;骨肉瘤U2OS;细胞增殖;细胞凋亡
骨肉瘤发病率快速增长并趋于年轻化,恶性程度高,预后差,化疗或放疗效果欠佳,可于数月内出现肺部转移。因此,寻找骨肉瘤有效的治疗方法是骨肿瘤研究的焦点,靶向基因治疗被认为是最佳的治疗方法之一,寻找有效的治疗靶基因极为重要。高迁移率族蛋白A2(Highmobility group A2,HMGA 2)是HMGA家族成员之一,可选择性结合到DNA特异构像中,调节复制、转录及DNA修复。HMGA2是胚胎发育期表达的转录因子,在正常成人组织中几乎无表达。但在一些恶性肿瘤中则呈现高表达,例如乳腺癌、非小细胞肺癌、胰腺癌、视网膜母细胞瘤、鳞状细胞癌等[1-5],提示其在肿瘤细胞恶性转化中起重要作用[6]。越来越多的研究显示,在白血病和一些实体恶性肿瘤细胞群体中只有一少部分细胞具有形成新肿瘤的能力而被称之为肿瘤起始细胞(Tumor initiating cells,TIC)或癌肿干细胞(Cancer stem cell,CSC)。CSC对化疗、放疗均不敏感,是恶性肿瘤难以治愈、早期转移及容易复发的根源[7]。研究表明,HMGA2和H-Ras基因的高表达抑制乳腺癌干细胞分化,而利于其自我更新的维持[8]。miRNAs let-7通过抑制两者的表达,促使乳腺癌干细胞分化,达到治疗乳腺癌的目的[8]。关于HMGA2在人骨肉瘤细胞的表达及作用的研究则尚少见报道。本研究拟通过靶向HMGA2的shRNA真核表达载体稳定转染人骨肉瘤U2OS细胞,观察其对U2OS细胞恶性表型的影响,为骨肉瘤的HMGA2靶向基因治疗提供依据。
1 材料与方法
1.1 实验材料、仪器 U2OS细胞株为吉林大学基础医学院病理学系保存。DMEM培养基购自Gibco公司;优级胎牛血清购自北京元亨金马生物公司;LipofectamineTM2000购自美国Invitrogen公司;Trizol试剂盒、RT-PCR试剂盒购自Takara公司;Cell Counting Kit-8(CCK8)为日本 Dojindo公司产品;Hoechst33342细胞凋亡试剂盒购自鼎国生物科技公司;Boyden小室为美国BD公司产品;鼠尾胶原Ⅰ型购自Sigma公司;2×SYBR GreenⅠ试剂购自ABI公司。Real time-PCR仪为美国ABI7300。
1.2 靶向HMGA2的shRNA真核表达载体HMGA 2-shRNA的构建根据GeneBank中HMGA2人全长cDNA序列(No.003483),参考文献[9],选取特异性序列 5′-CGCCAACGTTCGATTTCAT-3′为干扰作用的靶点,加入9 bp的loop环结构,设计模板为Sence+Loop+Antisence,退火后插入pGenesil质粒(含GFP荧光蛋白及G418筛选标志),形成shRNA表达载体(HMGA2-shRNA), 其 序 列 为 :5′-CGCCAACGTTCGATTTCATTTCAAGAGATAGAAATCGAACGTTGGCG-3′。另行设计一条与人的任何基因序列均无同源关系的随机乱码scrambled DNA序列,其形成的shRNA不对任何人源mRNA进行干扰。上述质粒载体由上海吉凯基因化学技术有限公司构建。
1.3 细胞培养及稳定转染 人骨肉瘤U2OS细胞培养在含10%胎牛血清的DMEM培养基,置于37℃、5%CO2及饱和湿度的细胞培养箱中培养。转染前一天接种细胞于24孔板,每孔5×104个细胞。具体操作步骤按Lipofectamine2000脂质体转染试剂厂家说明书进行,分别将HMGA2-shRNA及scrambled载体转染U2OS细胞。将转染细胞按照25个细胞/m l密度接种于6孔板内,每孔 2m l细胞悬液,并以600μg/L的G418进行筛选,2周后胰酶消化法挑取转染成功的克隆,获得克隆株。
1.4 RNA提取及RT-PCR 分别按照产品说明书,应用Trizol试剂提取细胞总 RNA;RT-PCR试剂盒(Two-Step Reverse Transcription-PCR法)分析HMGA2 mRNA。反应程序为:94℃预变性2分钟;94℃变性30秒,54℃退火30秒,72℃延伸30秒,循环30次;最后72℃延伸5分钟。RT-PCR产物经1.5%琼脂糖凝胶电泳分离后紫外灯下观察并用凝胶成像系统进行扫描和图像分析。凋亡相关基因表达分析采用实时定量RT-PCR(SYBRGreen法)进行。反应程序为:50℃2分钟;95℃10分钟;92℃10秒,60℃30秒,共50个循环。上述引物由上海生工生物工程公司合成,见表1。
1.5 细胞生长曲线测定 采用CCK8试剂盒检测各组细胞增殖反应。取指数生长期细胞,以1×103细胞/孔接种于96孔板,100μl/孔,按照实验分组进行标记,每组 6个复孔,于接种 1天、2天、3天、4天、5天、6天每孔加入CCK8液10μl,置于 37℃、5%CO2及饱和湿度的细胞培养箱继续培养1小时,室温下振荡5min,静置10分钟;酶标仪490 nm处测定吸光度,绘制细胞生长曲线。
1.6 细胞凋亡检测 采用Hoechst33342荧光染色法检测各组细胞凋亡。呈指数生长期的细胞经胰酶消化后,收集每组细胞(1 000 r/min,离心5分钟),PBS洗2次,调整细胞密度为1×105细胞/m l,Hoechst33342(10mg/L)避光染色10分钟,取10μl细胞悬液涂片室温干燥后,4%多聚甲醛固定10分钟,然后PBS洗2次,室温干燥,荧光显微镜350 nm波长下观察并拍照。
1.7 细胞迁移测定 采用Boyden小室(孔径为8 μm)测定各组细胞迁移。用0.1%鼠尾胶原Ⅰ型溶液包被Boyden小室,37℃结合1小时之后弃去溶液4℃保存。无血清培养基水化Boyden小室10分钟,再以含1%血清的培养基水化90分钟。常规胰酶消化各组细胞,PBS洗2次,无血清培养基调整细胞密度为5×104细胞/ml,6孔板内加入3T3细胞条件培养基1.6ml/孔,将 Boyden小室置于其内,上室加入800μl细胞悬液,于37℃,5%CO2条件下培养2.5小时,弃去上室培养基,4%多聚甲醛溶液固定20分钟,HE染色,用生理盐水棉签轻轻拭去小室上层的细胞,倒置显微镜下观察,200×视野下选取5个不重复视野照相,并数迁移细胞数量。

表1 PCR扩增所用引物及序列Tab.1 Primer sequence used for the PCR amp lification
1.8 统计学处理 所有数据采用SPSS10.0软件进行统计学分析,所得结果用±s表示,采用方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 转染HMGA2-shRNA可下调U2OS细胞HMGA2 mRNA表达 琼脂糖凝胶电泳结果显示,各实验组细胞样本均可在250 bp处见亮度一致的β-actin条带。在未转染组和scrambled组可在270 bp处见明显的HMGA2目的条带,而转染HMGA2-shRNA组HMGA2表达明显受到抑制,经灰度值测定HMGA2 mRNA下调达60%~75%(图1)。
2.2 转染HMGA2-shRNA可抑制U2OS细胞增殖细胞生长曲线显示,未转染组和scrambled组细胞生长无显著差异,转染HMGA 2-shRNA质粒的U2OS细胞生长缓慢,生长受到明显的抑制,4、5和6天的细胞数均明显低于scrambled组(P<0.05)(图2)。
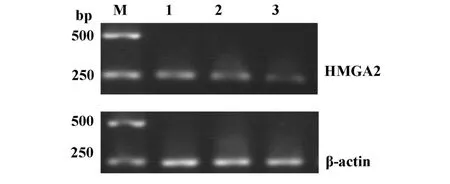
图1 HMGA2-shRNA下调U2OS细胞HMGA2 mRNA表达的RT-PCR结果Fig.1 Result of down regulation of HMGA2m RNA exp ression in U2OS cells transfected with HMGA2-shRNA
2.3 转染HMGA2-shRNA可促进U2OS细胞凋亡荧光显微镜下观察可见,与未转染组和scrambled组相比,转染HMGA2-shRNA组U2OS细胞凋亡细胞数量明显增加。凋亡细胞表现为细胞核浓缩及细胞核碎裂等典型改变,未转染组和scrambled组细胞无显著细胞凋亡形态学改变,代表性的图片如图3所示。
2.4 转染HMGA 2-shRNA可降低U2OS细胞迁移能力 Boyden小室迁移实验结果显示,细胞在接种2.5小时后,未转染组和scrambled组迁移细胞数分别为(118±22.1)个和(96±18.6)个,两者无显著差异,而HMGA2-shRNA组细胞移至微孔膜下层的细胞数为(47±11.9)个,与scrambled组相比迁移细胞数明显减少,差异显著(P<0.01,图4)。
2.5 转染HMGA2-shRNA对细胞凋亡相关基因表达的影响 与未转染组和scrambled组比较,转染HMGA2-shRNA组U2OS细胞的凋亡基因Caspase 3和Caspase 9mRNA表达水平上调(图5)。
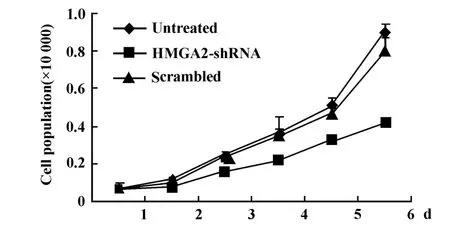
图2 HMGA2-shRNA抑制U2OS细胞生长Fig.2 Proliferation of U2OS cells transfected with HMGA2-shRNA was inhibited
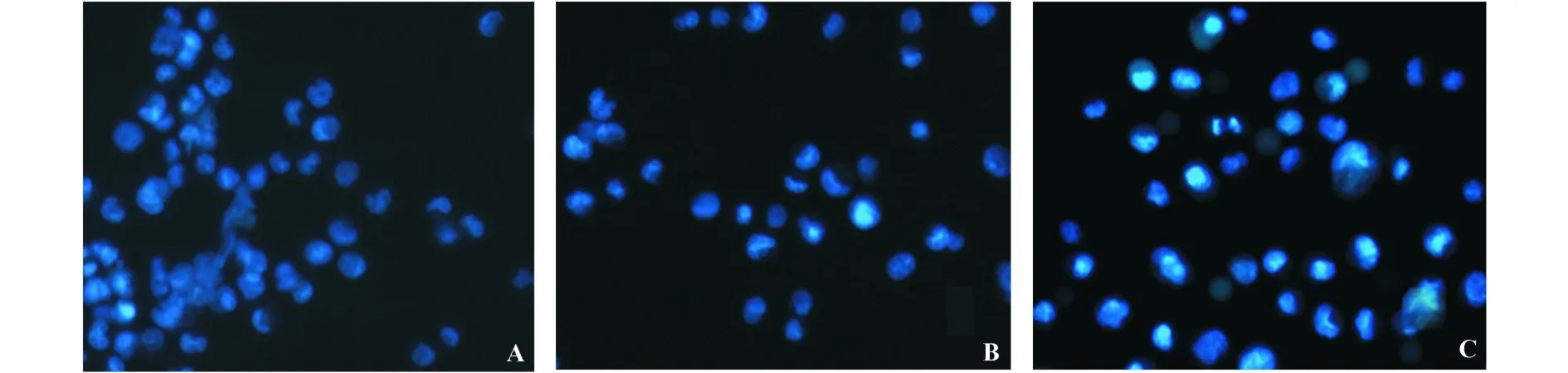
图3 各组U2OS细胞的凋亡荧光显微镜观察图(Hoechst33342荧光染色,×200)Fig.3 The apop tosis of U2OS cells(Hoechst33342 fluorescent staining,×200)
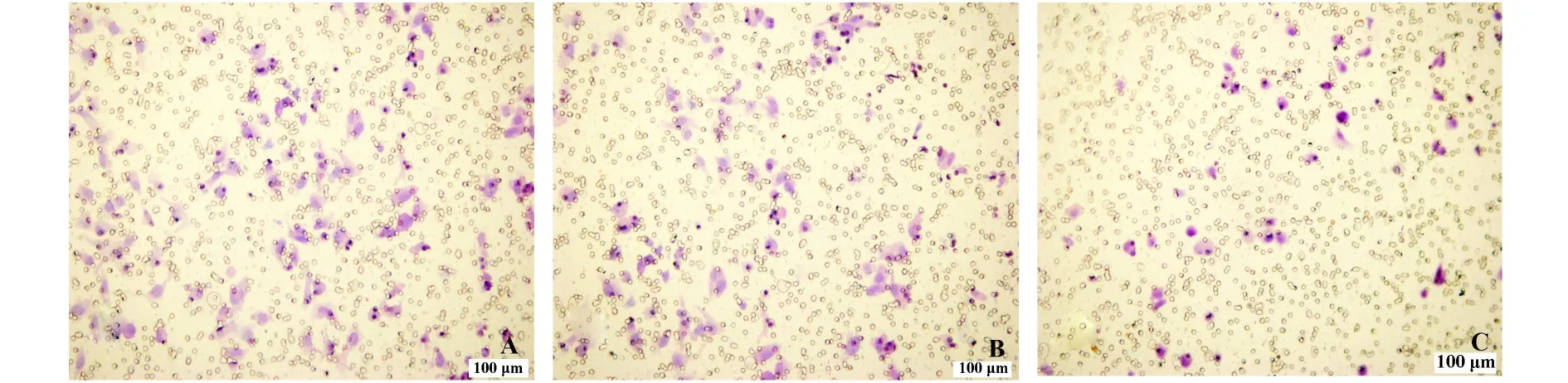
图4 HMGA2-shRNA降低U2OS细胞迁移能力(×200)Fig.4 Themigratory ability of U2OS cells transfected with HMGA2-shRNA was degraded(×200)

图5 转染HMGA2-shRNA对U2OS细胞凋亡相关基因表达的影响Fig.5 Effect of HMGA2-shRNA on exp ression of apoptosis related gene in U2OS cells transfected with HMGA2-shRNA
3 讨论
本研究结果显示,稳定转染靶向HMGA2的shRNA表达载体有效地下调了U2OS细胞中HMGA 2 mRNA水平,但不影响β-actin的表达水平,表明其沉默基因表达的特异性。表达质粒介导的shRNA在人骨肉瘤细胞的持续表达及对靶向基因的特异负向调控,提示这一技术在骨肉瘤治疗中具有可行性。本研究特异下调HMGA2表达引起U2OS细胞增殖和迁移能力的明显抑制,显示HMGA 2的异常高表达对该细胞增殖和迁移能力的维持具有十分重要作用。细胞增殖能力是决定恶性肿瘤生长速度的关键因素,而肿瘤的侵袭和转移力则决定于肿瘤细胞迁移能力。上述结果提示,HMGA2的表达失调可能是导致骨肉瘤恶性程度高、侵袭能力强、病程进展快和容易早期转移的主要原因。本研究结果中,下调HMGA 2表达也引起U2OS细胞凋亡的明显增加,表明其异常表达可能也参与了U2OS细胞逃逸免疫监视功能有关。细胞凋亡是机体清除突变细胞维持自身稳定的重要机制,肿瘤细胞通过避免细胞凋亡及免疫机制的监控才得以生存。化疗药物也多是通过诱导细胞凋亡以来达到治疗目的。获得对药物诱导凋亡的抗性是多数恶性肿瘤对化疗药物治疗不敏感的根本原因。总之,本研究结果表明HMGA2的异常高表达在维持U2OS细胞恶性表型的多方面发挥作用,提示靶向HMGA2的基因疗法在临床骨肉瘤的治疗中具有很好的应用前景。
1 Rogalla P,Drechsler K,Kazmierczak Betal.Expression of HMGI-C,a member of thehighmobility group protein family,ina subsetof breastcancers:relationship to histologic grade[J].Mol Carcinog,1997;19(3):153-156.
2 Meyer B,Loeschke S,Schultze Aetal.HMGA 2 over expression in nonsmall cell lung cancer[J].MolCarcinog,2007;46(7):503-511.
3 Abe N,Watanabe T,Suzuki Yetal.An increased highmobility group A2 expression level is associated withmalignant phenotype in pancreatic exocrine tissue[J].Br JCancer,2003;89(11):2104-2109.
4 Chau K Y,Manfioletti G,Cheung-Chau KWetal.Derepression of HMGA 2 gene expression in retinoblastoma is associated with cell proliferation[J].M olMed,2003;9:154-165.
5 M iyazawa J,Mitoro A,Kawashiri Setal.Expression ofmesenchyme-specific gene HMGA 2 in squamous cell carcinomas of the oral cavity[J].Cancer Res,2004;64(6):2024-2029.
6 Wisniewski JR,Schwanbeck R.High mobility group I/Y:multifunctional chromosomal proteins causally involved in tumor progression andmalignant transformation(review)[J].Int JMolMed,2000;6(4):409-419.
7 Reya T,Morrison S J,Clarke M Fetal.Stem cells,cancer,and cancer stem cells[J].Nature,2001;414(6859):105-111.
8 Yu F,Yao H,Zhu Petal.let-7 regulates self renewal and tumorigenicity of breast cancer cells[J].Cell,2007;131(6):1109-1123.
9 Malek A,Bakhidze E,Noske Aetal.HMGA 2 gene is a promising target for ovarian cancer silencing therapy[J].Int JCancer,2008;123(2):348-356.
[收稿2009-12-19]
(编辑 许四平)
Down regulation of HMGA2 expression changesmalignant phenotypes themalignant phenotype of human osteosarcoma U2OS cells
QUShan-Shan,LIRong-Gui,ZHANGHai-Ying,WANGYang,SHIYan-Fen,LÜHui,LIYu-Lin.KeyLaboratoryof Pathobiology,MinistryofEducation,SchoolofBasicMedicalScience,JilinUniversity,Changchun130021,China
Objective:The roles of HMGA2 inmaintainingmalignantphenotypes of theosteosarcoma U2OS cellswas studied to explore the possibilities for it to be developed as a target for gene therapy.Methods:U2OS cellswere stab ly transfectedwith a DNA based shRNA expression vectorwhich targeted to HMGA2.The exp ression of HMGA2mRNA was proved by RT-PCR;Cell growth,migration and apoptosiswere determined with CCK8,hoechst33342 staining and Boyden ventricle,respectively.ThemRNA levels of Caspase 3 and Caspase 9 were determined by real time quantitative RT-PCR.Results:The transfectionwith shRNA exp ression vector significantly decreased HMGA2m RNA levels of U2OS cells.Cellgrow th andm igration were decreased,but apoptosis and themRNA levels of Caspase 3 and Caspas 9were increased following the decrease of HMGA2m RNA.Conclusion:The abnormal expression of HMGA2 plays an important role inmaintaining themalignant phenotypes of U2OS cells.Gene therapy targeted to HMGA2 could be helpfu l in the treatmentof human osteosarcoma.
HMGA 2;shRNA;U20S;Proliferation;Apoptosics
R730
A
1000-484X(2010)03-0228-04
①本文为国家自然科学基金(30872193)
曲珊珊(1980年-),女,在读博士,主要从事肿瘤生物学研究;
及指导教师:李荣贵(1952年-),男,教授,博士生导师,主要从事肿瘤分子病理学研究。
