利用小鼠感染模型筛选与鉴定幽门螺杆菌外膜蛋白抗原①
2010-02-06陶好霞袁盛凌展德文王令春王艳春刘纯杰
陶好霞 王 袁盛凌 展德文 王令春 王艳春 刘纯杰
(军事医学科学院生物工程研究所,北京 100071)
利用小鼠感染模型筛选与鉴定幽门螺杆菌外膜蛋白抗原①
陶好霞②王②袁盛凌 展德文 王令春 王艳春 刘纯杰③
(军事医学科学院生物工程研究所,北京 100071)
目的:利用小鼠感染模型筛选与鉴定幽门螺杆菌SS1株的外膜蛋白抗原。方法:提取SS1株的外膜蛋白进行双向电泳,用幽门螺杆菌感染的小鼠血清作免疫印迹实验,将阳性反应蛋白点进行质谱鉴定分析,将肽质量指纹谱数据输入互联网上的蛋白质数据库进行检索。结果:获得32种抗原相关蛋白。通过与已有报道的幽门螺杆菌感染人抗原比较分析,发现大部分典型的保护性抗原在本实验中都可以检测到。结论:幽门螺杆菌感染的小鼠模型适用于人用保护性幽门螺杆菌抗原的筛选;而且此研究中得到的相关抗原蛋白对于寻找与鉴定幽门螺杆菌未知保护性抗原也有参考价值。
幽门螺杆菌;动物模型;双向电泳;免疫方法;抗原筛选
幽门螺杆菌(Helicobacterpylori,Hp)是一种革兰氏阴性微需氧菌,寄生于人胃粘膜表面的粘液层。目前全世界一半以上的人感染Hp,而且最终有近1%~2%的感染者会发展为胃癌[1]。Hp感染的药物治疗可以采用抗生素、质子泵抑制剂和铋剂联合用药来进行,但这些药物的有效率只有80%~90%,并且对细菌清除后并不能防止Hp的再次感染,而现在面临的最大问题就是Hp耐药株的出现[2]。考虑到目前全球感染Hp需要治疗的人数大大超过了三联抗生素用药可以治疗的人数,因此研制出Hp疫苗成为控制Hp全球感染的唯一可行的途径。已经证明的具有免疫保护作用的Hp抗原包括尿素酶(UreA和UreB)、VacA、CagA、过氧化氢酶(KatA)、分子伴侣GroES和GroEL[3-6]。但还没有一种抗原可以在人体中实现100%的保护作用,在动物模型中的实验表明多个抗原的联合应用可以提高免疫保护效果。为了得到具有高效保护作用的Hp疫苗,首要任务是在Hp的蛋白质组中找到可以引发较强免疫反应的保护性抗原。Hp定植于胃粘膜层和胃上皮细胞的顶端,因此它的位于细菌外膜的蛋白和分泌性蛋白更易于激发宿主的CD4+T细胞反应,而且大部分已知的Hp保护性抗原都是位于外膜或是分泌性的[7]。
大多数的Hp疫苗临床前研究都用小鼠作为感染治疗模型。小鼠并不是Hp的天然宿主,但有一些Hp的菌株经过几代驯化后可以定植于小鼠的胃中,如本实验中用到的HpSS1株。在小鼠模型中有一些研究的疫苗能够在Hp攻毒时产生较好的免疫保护效果,但用于临床受试者时效果却不十分理想。为了了解Hp的外膜蛋白在小鼠体内的表达情况,从而对小鼠模型用于Hp人类疫苗研究的可行性作出评价,我们采用了蛋白质组学的方法将Hp的外膜蛋白进行双向电泳,然后用Hp感染的小鼠血清对得到的双向分离蛋白点进行免疫印迹实验,对得到免疫反应蛋白点进行鉴定分析,与已有报道的Hp感染病人的数据结果进行比较分析,从而对小鼠模型在用于Hp感染人类的保护性抗原的筛选的可行性上进行初步的研究。
1 材料与方法
1.1 材料 幽门螺杆菌HpSS1(Sydney strain1)由广州中山医科大学陈湖教授惠赠。免疫用Hp小鼠血清通过对小鼠进行活菌口服灌胃获得。
1.2HpSS1外膜蛋白的制备及含量测定[8]采用空肠弯曲菌琼脂基础培养基(其中含10μg/ml盐酸万古霉素,2.5μg/ml多粘菌素B,2μg/m l两性霉素B及7.5%脱纤维羊血),复苏和扩增SS1菌种,用20 mmol/LTris·Cl(pH7.4)溶液收集和洗涤菌体2次,菌体沉淀用20mmol/LTris·Cl(pH 7.4)溶液悬浮,冰浴超声之后加入RNA酶和DNA酶室温消化核酸,离心弃去沉淀,将上清于4℃离心1小时。沉淀中加入10ml 20mmol/L Tris·Cl(pH7.4)和 2%十二烷基肌氨酸钠(SKL),于4℃离心1小时。沉淀中加入30m l纯水悬浮,离心,收集沉淀,用300μl纯水彻底溶解,用2-D Quanti-kit试剂盒对蛋白进行定量分装,1mg/支。直接上样或-70℃保存备用。
1.3 双向电泳 参照操作手册[9],并根据Görg等[10,11]的文献进行了一些改进。
具体方法是:取两份外膜蛋白各400μl(1mg)加入IPG缓冲液和水化液至总体积为350μl,然后于室温振荡30分钟,使溶解彻底。4℃离心轻取上清,加于IPG phor电泳槽中,轻覆以 IPG干胶条(pH3-10),按照如下条件于17℃进行等电聚焦:水化0 V,6小时;30V,6小时;500 V,1小时;1 000 V,1小时;8 000 V,24小时。当电压时间积达到4-6万Vhrs时终止等电聚焦程序。第二向SDS-聚丙烯酰胺凝胶(SDS-PAGE):在Bio-Rad ProteanⅡXi垂直电泳仪上进行。将两个胶条依次用100 mg DTT加入10 ml平衡缓冲液和450mg碘乙酰胺加入10m l平衡缓冲液中进行平衡,再将两个胶条同时转入两块12.5%SDS-PAGE胶面上端进行第二向SDS-PAGE电泳。其中一块SDS-PAGE胶用考马斯亮兰G-250染色,再用ImageScanner进行扫描,所用扫描软件为LabScan;考染凝胶扫描后用保鲜膜包裹,4℃保存以便取点时使用。图像分析用ImageMaster 2D Elite 3.1和ImageMaster 2D Elite Platnum进行。蛋白质点的分子量根据同步电泳的标准蛋白的位置计算,等电点直接按所用IEF胶条的pH范围计算,并通过软件获取每个蛋白点的丰度值。
1.4 Western blot 将平行操作的另一块SDS-PAGE胶电转1小时至硝酸纤维素膜。然后用丽春红室温染色10分钟,纯水冲洗脱色至清晰,扫描图像。加入5%脱脂奶粉于4℃封闭过夜,加入用SS1免疫的小鼠血清,37℃轻摇1小时,用TBST洗膜3次后,加入用5%脱脂奶粉稀释的二抗,37℃轻摇1小时,用TBST洗膜3次后,进行ECL显色。
1.5 胶内酶切、MALDI-TOF-MS质谱鉴定与数据库检索[12]将与Western blot中起反应的免疫反应蛋白点对应于SDS-PAGE胶上的点切下,放入50μl脱色液中脱色,真空离心干燥,再分别用 5%三氟乙酸、2.5%三氟乙酸/50%乙腈和100%乙腈抽提,真空离心干燥,用0.5%三氟乙酸充分溶解沉淀,用于质谱分析。将a-氰基-4-羟基肉桂酸(a-CCA)溶于含0.1%三氟乙酸的50%乙腈溶液中,制成饱和溶液,离心,取1μl上清与1μl肽段提取液等体积混合,取1μl点在Scorce384靶上,送入离子源中进行检测。检测:反射检测方式;飞行管长 3m;氮激光器:波长337 nm;加速电压20 kV;反射电压为23 kV。登陆http://www.matrixscience.com,用 Mascot程序对MALDI-TOF质谱检测得到的肽质量指纹图谱进行检索。数据库选NCBInr或MSDB,种属选Proteobacteria。氨基酸固定修饰方式一般选择Carbam idomethyl(C)修饰(或选择为可能修饰)、可能的修饰方式选Oxidation(M)修饰。检索时选取单同位素峰,一个误切,可接受的肽段分子量误差一般设为0.3 Da。为使鉴定结果更可靠,一般情况下要求至少有5个肽匹配,在蛋白质整个序列的覆盖率至少15%,但对于小于20 kD的蛋白质,则要求至少3个肽匹配和20%的覆盖率。
1.6 蛋白质表达情况的分析 根据基因组注释(www.tigr.org)所预测的等电点和分子量与电泳凝胶上蛋白质点在不同区段的分布,分析双向电泳参考图谱的覆盖情况;根据所鉴定蛋白质点在凝胶中的等电点、分子量值与预测的等电点、分子量作图,分析二者之间的符合情况及可能的翻译后修饰情况;根据基因组注释所提供的蛋白质功能分类及定位情况,统计所鉴定的蛋白质在不同的功能分类及细胞内定位中的分布和覆盖情况。
2 结果
2.1Hp外膜蛋白双向电泳图谱的建立 使用pH值为3~10的IPG干胶条,通过3次相对独立的实验提取Hp的外膜蛋白进行电泳,得到重复性较好的Hp外膜蛋白双向电泳图谱(图1)。
2.2 免疫蛋白点的筛选和鉴定 先用丽春红进行可逆染色对蛋白质点进行定位,然后将自制的用HpSS1株全菌灌胃提取的小鼠血清进行Western blot(图2);从考马斯亮兰染色凝胶上找出显色的点所对应的蛋白质点,切取该点经胰蛋白酶胶内酶切后,使用MALDI-TOF质谱成功鉴定了32个免疫反应蛋白点(表1)。这些蛋白点可以归为以下几类:与细胞泳动相关的蛋白(T1、T7、T8、T30);细胞加工蛋白(T3、T4、T9);酶类(T5、T11、T16、T17、T19、T20、T22、T25、T26、T29、T32);翻译相关蛋白(T2、T6、T12、T13、T24);假想 蛋白(T15、T23、T27、T31);调控 蛋白(T21);金属螯合相关蛋白(T28);细胞分裂相关蛋白(T10);胞壁合成相关蛋白(T18、T14)。
2.3 免疫结合蛋白与人血清鉴定到的抗原的比较将鉴定到的32个蛋白的全称,或者蛋白TIGR号(如HP0072)作为搜索关键词,在网站PubMed(www.pubmed.com,www.ncbi.nlm.nih.gov)中进行文献检索,经过比较分析共有17种作为抗原在Hp感染的人类血清中也可以检测到。将这些抗原的名称,在细胞中的位置及与人血清反应的特异性列于表2中。
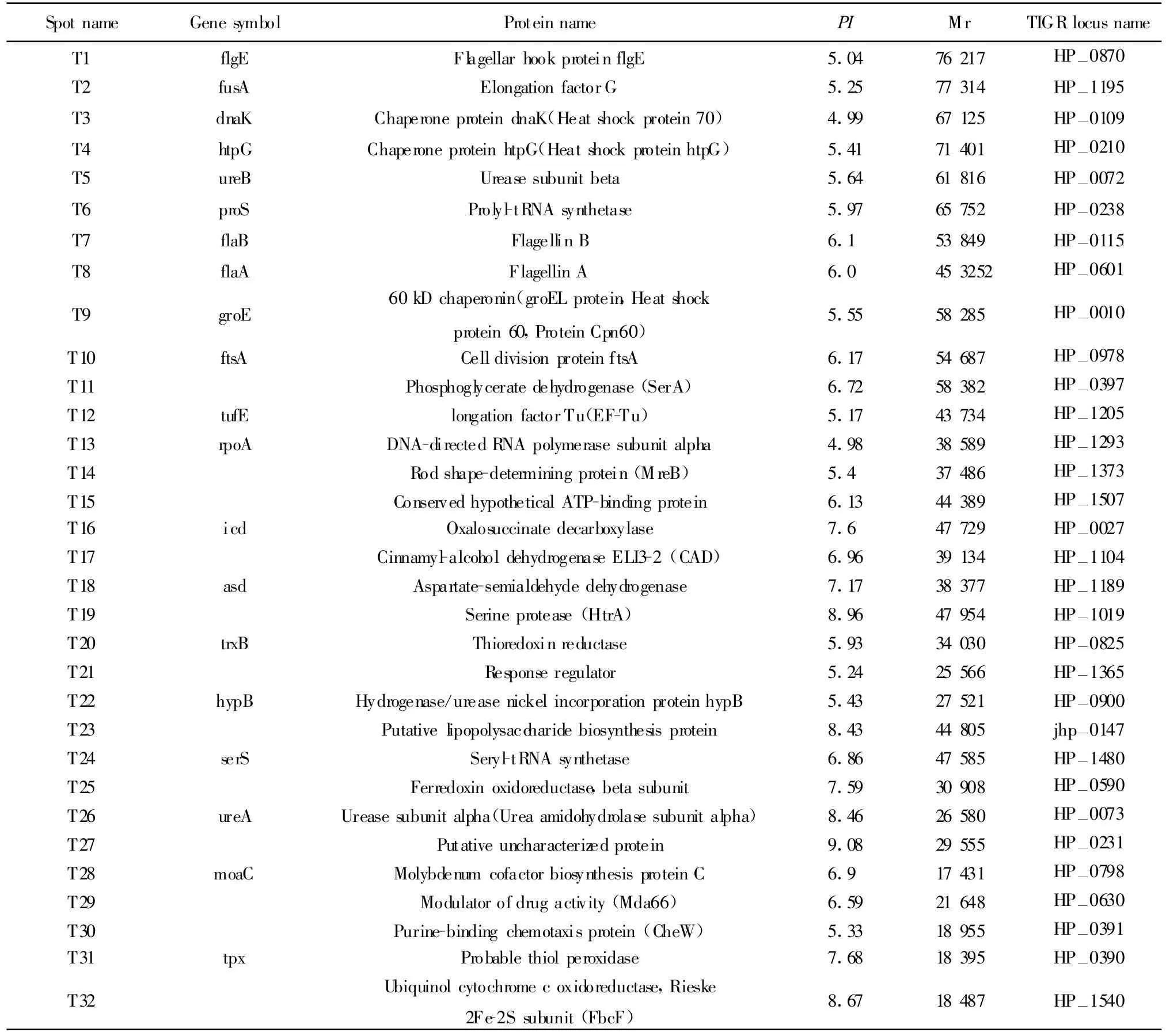
表1 质谱鉴定的免疫反应蛋白点Tab.1 Identification of immunogenic H.pylori p roteins by Immuno blotand M S
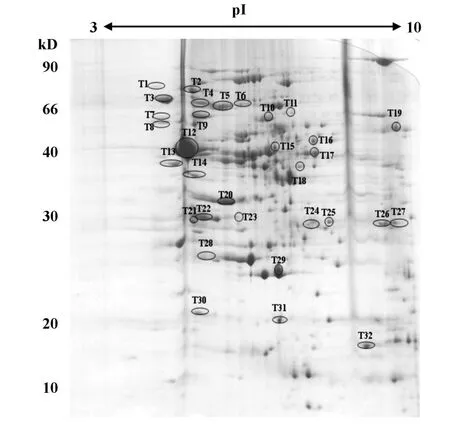
图1 Hp SS1外膜蛋白双向电泳图Fig.1 2D map(pH 3 to10)of outer membrane proteins of Hp SS1
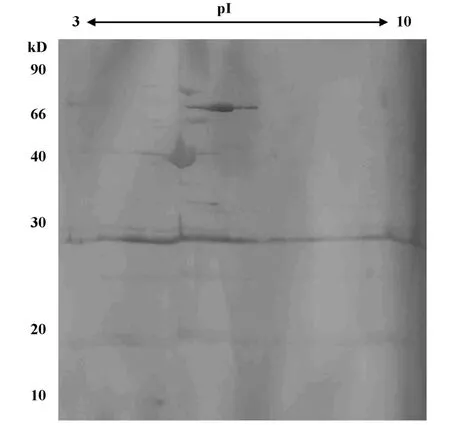
图2 Hp SS1胞外膜蛋白的小鼠血清W estern blotFig.2 W estern blot of a 2D gel hybridized with serum from murinemodel
3 讨论
双向电泳的一块PAGE胶上可以分辨100×100个点,结合Western blot方法可以大大提高抗原蛋白的检出率,因此免疫蛋白质组学是寻找抗原的良好技术平台。本研究运用该技术体系,在HpSS1株的外膜蛋白中成功鉴定了32个与小鼠血清进行免疫反应的蛋白点。
细菌的泳动和趋化能力与它的毒力密切相关。本研究鉴定出了与Hp鞭毛合成和细菌趋化作用相关的有4个蛋白:FlgE(HP0870)、FlaA(HP0601)、FlaB(HP0115)和CheW(HP0391)。FlaA和FlaB是位于细胞外的鞭丝的组成亚基。FlaA和FlaB是研究较多的Hp鞭毛抗原,它们可以在宿主体内引发较强的免疫反应[13,14]。FlgE位于外膜,它组成了细菌鞭毛鞭丝与基体动力装置相连接的弹性结构,flgE基因的缺失会导致鞭毛钩体无法形成,进而使细菌丧失泳动能力。CheW是假想嘌呤结合的趋化蛋白,它可以将趋化因子的受体信号跨膜传送到鞭毛的动力系统[15]。cheW基因缺失的Hp的趋化能力丧失,并且在小鼠胃内引发的炎症反应减弱[16]。
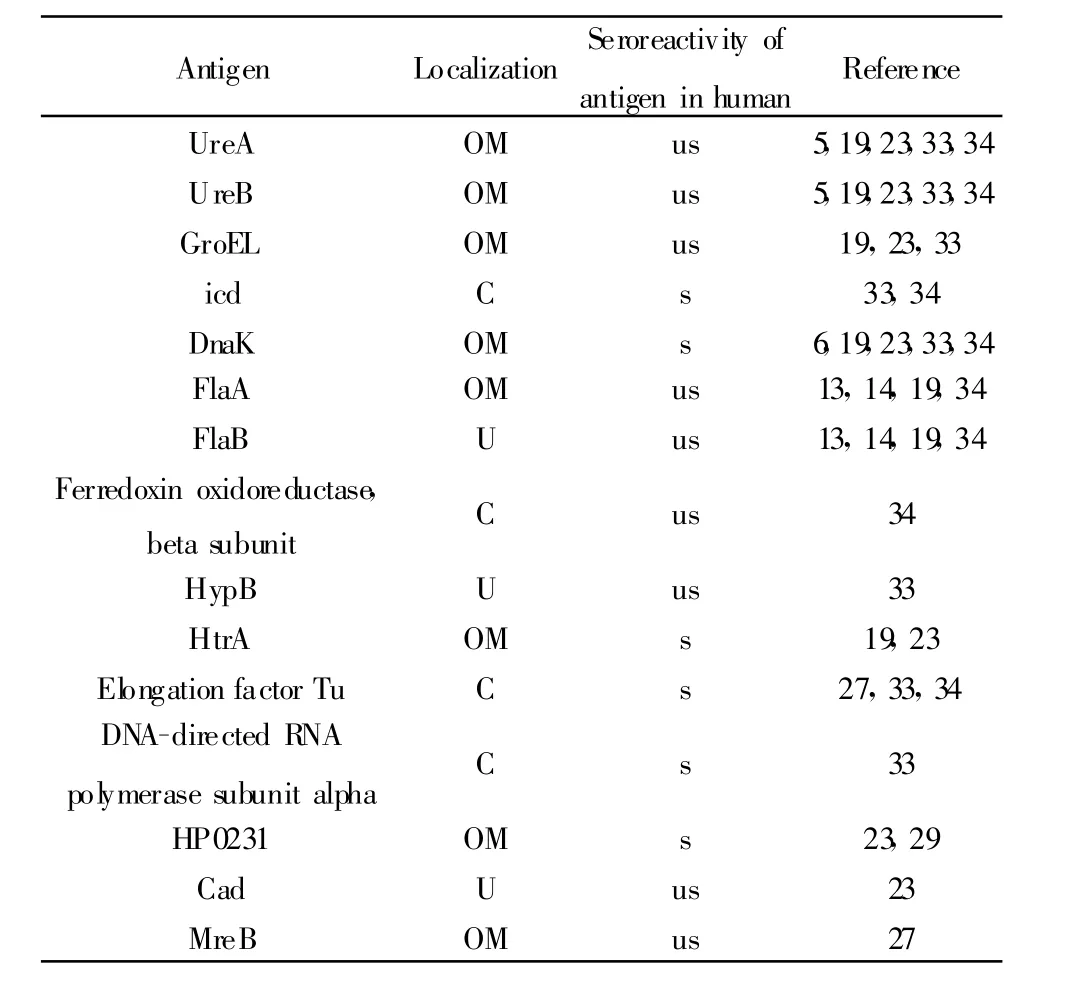
表2 小鼠血清中检测到的幽门螺杆菌抗原的相关特性Tab.2 Characteristic of Helicobacter pylori antigen from murinemodle
在Hp中,热休克蛋白(HSP)可以介导关键蛋白的分泌和折叠,使蛋白活性部位不会暴露于酸性环境中,从而对细菌起到保护作用。共鉴定到了3个具有免疫原性的属于HSP家族的蛋白:DnaK(hsp70,HP0109)、HtpG(hsp90,HP0210)和 GroEL(hsp60,HP0010)。GroEL在调控尿素酶活性上起到一定作用[17],DnaK还可以起到粘附素的作用[18],对抗不利的外界环境介导Hp定植于胃粘膜。DnaK和GroEL都可以引发机体胃表皮慢性炎症的发生,它们都可以作为Hp的备选保护性抗原[19]。
鉴定的蛋白中很多具有酶活性,大致可以把它们分为五类:(1)毒力相关酶类。尿素酶是Hp的重要毒力蛋白,它能够中和胃酸,对细菌起到保护作用。尿素酶由UreA和UreB两个亚单位组成,它们均为Hp保护性抗原,在实验中也鉴定到了这两种蛋白。而蛋白HypB(HP0900)是作为镍特异性的金属分子伴侣起作用的,它参与镍离子的固定和将镍离子转移至尿素酶的金属结合区[20]。(2)物质代谢相关酶类。其中磷酸甘油酸脱氢酶(SerA,HP0397)是细菌甘油代谢的重要酶。草酰琥珀酸脱羧酶(HP0027)参与了细菌的三羧酸循环。桂醇脱氢酶(CAD,HP1104)催化p-羟基桂醇类物质向其相应醇类物质的可逆转换,HP1104编码的CAD还具有歧化酶活性,它可以催化苯甲醛为苯甲醇或苯甲酸,从而降低细菌细胞内的醛类物质的浓度,利于细菌在氧应激条件下生存,在酸刺激条件下,Hp的CAD产物上升了24倍[21,22];并且有研究者在胃癌患者的血清中检测到了HpCAD的抗体[23]。(3)氧化还原作用酶类。Hp在宿主胃粘膜上生存必然要应对外界环境中物理、化学或生物因素的刺激,应对于此,细菌自身具有氧化还原功能的酶类的分泌会提高,从而对有杀伤细菌作用的蛋白分子产生还原作用,保护细菌免受伤害。本实验中的相关酶包括硫氧化还原蛋白还原酶(TrxB,HP0825),它能够特异还原胰岛素、粘液素、IgG和IgA内部的二硫键,另外研究证实TrxB能够帮助Hp通过接触性还原反应将胃粘膜层中连接粘蛋白单体之间的半胱氨酸连接区的二硫键打破,从而使Hp通过难以穿越的胃粘液层在胃粘膜层得以定植[24]。还有Mda66,它是一种NADPH醌还原酶蛋白,能够将醌还原为苯二酚,细胞内的醌代谢对于细菌应对环境的氧化应激反应有着直接的影响,因此Mda66的还原形态在应对氧化应激反应中发挥了重要作用。有报道称mda66的基因突变株对于氧化应激反应敏感并且能够降低在鼠胃部中的定植能力[25]。除此之外,我们还鉴定到的具有氧化还原作用的酶包括铁氧化还原蛋白氧化还原酶的β亚基(HP0590)和细胞色素c氧化还原酶(HP1504),它们都是细菌呼吸链的重要成分。(4)蛋白酶类。HP1019为假想的丝氨酸蛋白酶和分子伴侣H trA,实验证明HtrA是一种具有蛋白水解活性的分泌酶,作为一种功能蛋白它既存在于细胞周质中起热应激降解作用,也存在于胞外基质中起毒力因子的作用[26]。
我们还鉴定了与蛋白质翻译相关的5种蛋白,它们是延伸因子 EF-G(FusA,HP1195)、EF-Tu(HP1205)、脯氨酸 tRNA合成酶(ProS,HP0238)、丝氨酸tRNA合成酶(SerS,HP1480)、DNA介导的RNA聚合酶α亚基(RpoA,HP1293)。其中EF-G、EF-Tu和RpoA都可以作为抗原蛋白与感染Hp病人的血清进行抗原抗体结合反应[19,27]。在我们鉴定到的蛋白中,有四种为假想蛋白,它们分别是假想的ATP结合保守蛋白(HP1507)、假想的脂多糖合成蛋白(Jhp0147)、假想的功能不明蛋白(HP0231)、假想的巯基过氧化物酶Tpx(HP0390)。其中Jhp0147编码的酶证明具有葡萄糖转移酶功能,与α-1,6-葡聚糖聚合体的合成有关,该聚合体是细菌核心LPS的一部分[28]。HP0231是近年来研究的比较多的一个蛋白,实验证明它是一种保护性抗原,用重组表达的HP0231免疫小鼠然后用Hp攻毒,其保护效果接近Hp免疫实验的金标准的4倍剂量[29]。Tpx蛋白体外实验能够还原H2O2,Hp的tpx突变株比野生株更易被过氧化物和超氧化物杀死,并且tpx突变株在小鼠胃内的定植能力降低[30]。
本实验中我们鉴定到了二元调控系统HP1364/HP1365中的调控蛋白HP1365,该二元系统对于铜诱导的CrdA的转录和Hp对于铜离子的抗性是必须的,而且在小鼠模型中证明它们对于Hp在胃中的定植是必须的[31]。鉴定到的另一种与铜离子代谢有关的蛋白称为铜离子辅助合成蛋白C(MoaC,HP0798),它参与铜离子的摄取。鉴定到的蛋白还有与细胞分裂相关的蛋白FtsA(HP0978),以及与胞壁合成相关的蛋白,这包括M reB(HP1373),它编码假想的盘尼西林结合蛋白1A,并且参与细胞壁的合成[32];以及天冬氨酸半醛脱氢酶(Asd,HP1189),它是细菌DAP合成途径的关键酶,而DAP是革兰氏阴性菌细胞壁的主要成分。
经过与文献比对,本研究鉴定到的蛋白中有17种蛋白与已有报道的与人血清有抗原抗体结合反应的Hp蛋白相一致。而其中之所以存在有胞内蛋白,是因为Hp具有自发裂解的特性,会使一些胞内蛋白释放到胞外,从而使该蛋白也具有抗原性[35]。
本研究通过将HpSS1菌株的外膜蛋白中与细菌感染的小鼠血清呈阳性反应的蛋白用双向电泳和免疫印迹的方法进行总体的筛选和鉴定,得到蛋白点经过文献检索发现很大一部分都与Hp的毒力和在宿主内的定植能力密切相关,再把得到的蛋白与已有报道的与Hp感染的人血清反应阳性抗原进行比较,结果发现两者具有较高的相似性,说明小鼠感染的模型适于临床应用前的Hp抗原候选蛋白的筛选,而且本实验中所得到的一些蛋白点于未知的Hp的保护性抗原的选择也有借鉴意义。
1 Peek RM Jr,BlaserM J.Helicobacter pyloriand gastrointestinal tractadenocarcinomas[J].Nat Rev Cancer,2002;2:28-37.
2 BuckleyM JM,Deltenre M.Therapy of H.pylori infection[J].Curr Opin Gastroenterol,1997;13:56-62.
3 Ferrero R L,Thiberge JM.TheGroEShomologofHelicobacter pyloriconfers protective immunity againstmucosal infection inmice[J].Proc Natl A-cad Sci USA,1995;92:6499-6503.
4 Marchetti M,Rossi M.Protection against Helicobacter pylori infection in miceby intragastric vaccinationwith H.pylori antigens isachieved using a non-toxicmutant of E.coli heat-labile enterotoxin(LT)as adjuvant[J].Vaccine,1998;16:33-37.
5 Pappo J,ThomasW D,Kabok Z.Effectoforal immunizationwith recombinant urease onmurineHelicobacter felisgastritis[J].Infect Immun,1995;63:1246-1252.
6 Radcliff F J,HazellS L,Kolesnikow Tetal.Catalase,a novel antigen for Helicobacter pylori vaccination[J].Infect Immun,1997;65:4668-4674.
7 Sutton P.Progress in vaccination against Helicobacter pylori[J].Vaccine,2001;19:2286-2290.
8 UttM,Nilsson I,LjunghAetal.Identification of novel immunogenic proteinsof Helicobacter pylori by proteome technology[J].JImmunolMethods,2002;259:1-10.
9 Tom B,Tirra S.2-D Electrophoresis:using immobilized pH gradients,Principles&Methods[M].Upsala:Amersham Pharmacia Biotech,Inc.,1998.
10 Görg A,ObermaierC,Boguth Getal.The current stateof two-dimensional electrophoresis with immobilized pH gradients[J].Electrophoresis,2000;21(6):1037-1053.
11 Görg A,Weisss W,Dunn M J.Current two-dimentional electrophoresis technology for proteomics[J].Proteomics,2004;4(12):1-21.
12 Cordwell S J.Acquisition and archiving of information for bacterial proteomics:from sample preparation to database[J].Methods:Enzymol,2002;358:207-227.
13 Tang RX,Luo D J,Sun AHetal.Diversity of Helicobacter pylori isolates in expression of antigens and induction of antibodies[J].World J Gastroenterol,2008;14(30):4816-4822.
14 Yan J,Liang XH,Mao Y Fetal.Construction of expression systems for flaA and flaB genes of Helicobacter pylori and determination of immunoreactivity and antigenicity of recombinant proteins[J].World JGastroenterol,2003;9(10):2240-2250.
15 Fredrick K L,Helmann JD.Dual chemotaxis signaling pathways in Bacillus subtilis:a sigmaD-dependentgene encodesa novel proteinwith both CheW and CheY homologous domain[J].J Bacteriol,1994;176:2727-2735.
16 Williams SM,Chen Y T,Andermann TMetal.Helicobacter pylori chemotaxismodulates inflammation and bacterium-gastric epithelium interactions in infectedmice[J].Infect Immun,2007;3747-3757
17 EvansD J,Evans D G,Engstrand Letal.Urease-associated heat shock protein ofHelicobacter pylori[J].Infect Immun,1992;60:2125-2127.
18 HuescaM,Borgia S,Hoffman Petal.Acidic pH changes receptor binding specificity of Helicobacter pylori:a binary adhesion model in which surface heat shock(stress)proteinsmediate sulfatide recognition in gastric colonization[J].Infect Immun,1996;64:2643-2648.
19 Lin Y F,Chen CY,TsaiM Hetal.Duodenalulcer-related antigens from Helicobacter pylori[J].MolCell Proteom ics,2007;6:1018-1026,
20 Stephane Benoit,Maier R J.Dependence ofHelicobacter pyloriurease activity on thenickel-Sequestering ability of theureE accessory protein[J].JBacteriol,2003;185:4787-4795
21 Ang S,Lee C Z,Peck Ketal.Acid-induced gene expression in Helicobacter pylori:study in genom ic scale bymicroarray[J].Infect Immun,2001;69:1679-1686.
22 Blanaid M,Dermot K,Jesus Fetal.Characterization of cinnamyl alcohol dehydrogenase ofHelicobacter pylori[J].FEBS,2005;272:1255-1264.
23 HaasG,Karaali G,Ebermayer Ketal.ImmunoproteomicsofHelicobacter pylori infection and relation to gastric disease[J].Proteomics,2002;2:313-324.
24 Henry JW,Fox A,Eidhin D Netal.The Thioredoxin system of Helicobacter pylori[J].JBiol Chem,2000;275(7):5081-5089.
25 Huang Z G,Duan G C,Fan Q Tetal.Mutation of cytotoxin-associated gene A affects expressions of antioxidant proteins of Helicobacter pylori[J].World JGastroenterol,2009;7:599-606.
26 Martin L,ChristianeW,Metzler Detal.Prediction of extracellular proteasesof thehuman pathogen helicobacter pylori reveals proteolytic activity of the Hp1018/19 Protein HtrA[J].PLoSONE,2008;3(10):e3510.
27 Lin Y F,Wu M S,Chang CCetal.Comparative immunoproteom icsof identification and characterization of virulence factors from helicobacter pylori related to gastric cancer[J].Mol Cell Proteomics,2006;5:1484-1496.
28 Susan M L,Eleonora A,Oksana Metal.Novelbiosynthetic functions of lipopolysaccharide rfaJ homologs from Helicobacter pylori[J].Glycobiology,2005;15(7):721-733.
29 Sabarth N,HurwitzR,Meyer T Fetal.Multiparameter selection ofHelicobacter pylori antigens identifies two novel antigenswith high protective efficacy[J].Infect Immun,2002;70:6499-6503.
30 WangG,O lczak A,Walton JPetal.Contribution of theHelicobacterpylori thiol peroxidase bacterioferritin com igratory protein to oxidative stress resistance and host colonization[J].Infect Immun,2005;73:378-384.
31 BarbaraW,KlausM,Frank N Setal.The Helicobacter pylori CrdRS two-component regulation system(HP1364/HP1365)is required for copper-mediated induction of the copper resistance determ inant CrdA[J].J Bacteriol,2005;187:4683-4688.
32 Kwon DH,DoreM P,Kim JJetal.High-levelβ-Lactam resistanceassociated with acquired multidrug resistance in Helicobacter pylor[J].Antimicrob AgentsChemother,2003;47:2169-2178.
33 Kimmel B,Bosserhoff A,Frank Retal.Identification of immunodom inant antigens from Helicobacter pylori and evaluation of their reactivities with sera from patientswith differentgastroduodenal pathologies[J].Infect Immun,2000;68:915-920.
34 M cAteeCP,Lim M Y,Fung Ketal.Identification ofpotentialdiagnostic and vaccine candidates of Helicobacter pylori by two-dimensional gel electrophoresis,sequence analysis,and serum profiling[J].Clin Diagn Lab Immunol,1998;5:537-542.
35 Phadnis SH,Parlow M H,Levy Metal.Surface localization of Helicobacter pylori urease and aheatshock protein homolog requiresbacterial autolysis[J].Infect Immun,1996;64:905-912.
[收稿2009-11-20]
(编辑 许四平)
Antigen screening and identification of Helicobacter pyloriouter membrane proteins from murine infection model
TAOHao-Xia,WANGPeng,YUANSheng-Ling,ZHANDe-Wen,WANGLing-Chun,WANGYan-Chun,LIUChun-Jie.BeijingInstituteofBiotechnology,InstituteofBiotechnology,MilitaryMedicalSciences,Beijing100071,China
Objective:To screen antigen of Helicobacter pylorioutermembrane proteins bymurine infectionmodel.Methods:Parallel two-dimensional gel electrophoresis(2D)of outermembrane p roteins extracted from Helicobacter pyloristrain SS1 was performed.Western blot of a duplicate2D gelhybridized with serum fromH.pylori-infectedmurinewas employed.ImmunogenicH.pyloriproteins identified in this way were digested ingel by trypsin and themass of generated peptidesweremeasured bymatrix assisted laser desorption ionization timeof flight mass spectrometry(MALDI-TOF-MS).The data obtained from peptidemass finger-printing(PMF)were searched using the internet availab le database.Results:32 proteinswere identified and they are in good agreementwith typical protectiveantigenswhich reacted with serum fromH.pylori-infected patients.Conclusion:The results suggest thatmurinemodel ofH.pylorimay be valid to screen antigens forhuman vaccination and the proteins identified in this paper are valuable for the selection ofH.pyloriprotective antigens aswell.
Helicobacterpylori;Animal diseasemodel;Two-dimensional gel electrophoresis;Immunology;Antigen screening
R391.2
A
1000-484X(2010)03-0195-06
①本文为“十一五”国家863重大项目(2006AA 02A219)
②共同并列第一作者
③通讯作者,E-mail:liucj@nic.bm i.ac.cn
陶好霞(1968年-),女,实验师;王 (1976 年 -),女,博士,助理研究员。
