中国小型猪细菌分离鉴定及药敏试验*
2010-01-24高正琴贺争鸣岳秉飞
高正琴,张 强,贺争鸣,岳秉飞,叶 强
中国小型猪细菌分离鉴定及药敏试验*
高正琴,张 强,贺争鸣,岳秉飞,叶 强
目的 对小型猪携带的细菌种群分布情况及耐药性进行调查分析。方法对小型猪采样进行细菌分离培养、生化鉴定和细菌16S rRNA基因PCR扩增、测序分析,并进行药敏试验。结果从25只小型猪中共分离到45株细菌。结果显示,小型猪携带的细菌种群主要有弯曲菌属(空肠弯曲菌)、螺杆菌属(幽门螺杆菌)、克雷伯菌属(肺炎克雷伯氏菌);肠杆菌属(阴沟肠杆菌);埃希菌属(大肠埃希菌、弗格森埃希菌);假单胞菌属(铜绿假单胞菌);窄食单胞菌属(嗜麦芽窄食单胞菌);葡萄球菌属(金黄色葡萄球菌、溶血葡萄球菌、模仿葡萄球菌);链球菌属(肺炎链球菌、猪链球菌、前庭链球菌、缓症链球菌、麻疹孪生球菌、绿色气球菌);肠球菌属(粪肠球菌);芽孢杆菌属(枯草芽孢杆菌、地衣芽孢杆菌、蜂房芽孢杆菌、巨大芽孢杆菌)。这些菌株对氨曲南、头孢噻吩等药物敏感,而对痢特灵等药物不敏感。结论小型猪携带的细菌种群具有多样性,研究结果为我国小型猪细菌学检测以及质量标准的制定提供了科学依据。
小型猪;细菌分离;鉴定;16S rRNA
小型猪(M iniature pig)属于哺乳纲、偶蹄目、野猪科、猪属。五指山小型猪是我国培育比较早的小型猪之一,遗传检测结果显示,理论群体近交系数高达0.95以上,遗传稳定,未发现严重的遗传分离现象。巴马小型猪具有体型矮小、性成熟早、多产、品系内个体间具有较好的遗传一致性和遗传稳定性。贵州小型香猪是我国较早正式报道的小型猪之一,在组织解剖和白化突变体等方面做了大量的研究工作。
小型猪作为实验动物在科学研究领域具有较大的应用价值。利用小型猪复制的人类疾病模型已用于肿瘤、心血管病、糖尿病、外科、牙科、皮肤烧伤、血液病、遗传病、营养代谢病的研究之中,并在新药安全评价中得到应用。小型猪作为人类器官移植的供体,有望在一定程度上解决人源器官紧缺的状况。另外,猪的组织、细胞或其他成分作为人用生物制品的生产基质,已开发出多种人用生物制品和功能食品等生物技术产品〔1-3〕。
国外用于医学研究和相关制品生产用的商品化小型猪普遍达到了SPF(无特定病原体)的水平,排除了可能干扰小型猪实验结果的病原体,极大的提高了小型猪的微生物学质量,保证了相关研究的水平和产品质量,而我国实验动物国家标准中至今还没有小型猪的质量标准,使得小型猪在生命科学研究中凸现应用不足,独特优势不突出,应用特点不明显,这一状况既影响到实验用小型猪的质量提升,限制了比较医学资料的形成,同时也影响了小型猪的推广应用〔4〕。
本研究目的是为了了解目前我国培育的实验用小型猪的微生物携带情况,为小型猪的生物净化、种群建立、质量标准以及动物模型的建立奠定基础。
1 材料和方法
1.1 动物来源 本研究中的小型猪来自“国家实验用小型猪种质资源基地”,其中:五指山小型猪和广西巴马小型猪种群规模均为200头,饲养与于屏障系统和普通环境中,各剖杀10头;贵州小型香猪饲养于普通环境中,剖杀5头。所剖杀的小型猪性别和年龄见表1。
1.2 培养基和试剂 血琼脂、SP琼脂、DHL琼脂、普通营养琼脂、M H琼脂、脑心浸液、M H肉汤、葡萄糖、硝酸盐、尿素等生化反应培养基,由本所培养基室提供。哥伦比亚血琼脂基础、2号营养肉汤为英国Oxoid公司产品。微厌氧培养系统由日本三菱瓦斯化学株式会社提供。药敏纸片购自北京天坛药物生物技术开发公司。DNA提取试剂盒、dN TPs,Ta KaRa EX Taq、DNA纯化试剂盒为宝生物工程(大连)有限公司产品。
1.3 细菌分离培养 活体采集小型猪鼻拭子样本,投入装有1 m L脑心浸液的小试管内,再接种支原体半流体培养基,置37℃培养14 d。取肛拭子样本,划线接种哥伦比亚血琼脂(已加相关抗生素,为选择性培养基),置37℃微需氧(85%N2,10%CO2,5%O2)培养 5 d。
活体采集小型猪心脏全血,取2 m L全血,注入装有5m L 2号营养肉汤的中试管内(液面以液体石蜡封闭,已加相关抗生素和促生长剂,为选择性培养基),置37℃微需氧培养5 d,如有疑似菌落生长,再转种哥伦比亚血琼脂。5 m L全血经抗凝处理后,用作小型猪血液学生理生化指标的测定。8 m L全血,离心分离血清,用作者研制的空肠弯曲菌、幽门螺杆菌IFA和EL ISA抗体检测试剂盒进行血清抗体检测,并分别用国内外3个厂家(1个国外,2个国内)提供的3个不同批次的9种病毒(猪瘟、口蹄疫、圆环、细小、伪狂犬、蓝耳、乙脑、胃肠炎、水疱)和弓形体的EL ISA抗体检测试剂盒进行血清抗体检测(另文发表)。
将小型猪麻醉放血完全后剖解,采集其气管、扁桃体、淋巴结、心、肺、肝、脾、胃、肾、肠、脑组织和回盲部内容物样本,用作细菌、病毒和寄生虫的分离、鉴定。取气管、淋巴结、肺、胃、肠组织样本,分别划线接种血琼脂培养基、SP琼脂、DHL琼脂、普通营养琼脂,置37℃恒温培养48 h。取气管、肺组织样本,接种支原体培养基,置37℃培养14 d。取胃、肠组织样本,划线接种哥伦比亚血琼脂,置37℃微需氧培养5 d。
根据平板上的菌落生长的形态、大小、颜色、气味、溶血性等进行分类,对每一类典型菌落进行革兰氏染色镜检,初步区分革兰氏阴性和阳性菌。再根据革兰氏染色特性和菌体形态,初步判定细菌类属,并将其进一步纯化培养,准备生化鉴定。
1.4 生化鉴定 将分离纯化得到的几十株细菌大致分类:革兰氏阳性球菌、革兰氏阳性芽孢杆菌、革兰氏阴性杆菌。将这些菌株分别接种脑心浸液,增菌培养24 h后,接种生化试验用反应管,置于37℃恒温培养24~48 h,观察记录结果,参考文献判定细菌种类〔5-6〕。
用全自动细菌鉴定仪BBB128 Phoenix100(美国)进行细菌种属的确认。
1.5 分子生物学鉴定 分离纯化细菌后,抽提基因组DNA,利用细菌通用引物 (上游引物:5’-AGAGTTGA TCCTGGCTCAG-3’;下游引物:5’-CTACGGCTACCTTGTTACGA-3’),扩 增 16S rRNA基因片段,预期扩增的目的片段长度为1 506 bp〔7〕。
经优化后得到16S rRNA基因片段PCR扩增的最佳反应体系如下:5μL 10×EX Taq Buffer(M g2+Plus),4μL dN TP M ixture(各 2.5 mmol/L),1μL上游引物(20μmo l/L),1μL下游引物(20 μmol/L),5.0μL模板DNA,0.25μL TaKaRa EX Taq(5 U/μL),33.75μL dd H2O。
PCR反应参数为94℃预变性30 s;94℃30 s,55℃30 s,72℃1 m in,共30次循环;最后一次循环后72℃再延伸1 min。
反应结束后,取5μL扩增产物,用1%(w/v)琼脂糖凝胶(含0.5μg/m L EB)电泳检测 PCR产物。在紫外灯下观察,用数字凝胶成像系统记录实验结果。将阳性PCR扩增产物回收纯化后送宝生物工程(大连)有限公司测序。
对于微需氧菌(疑似空肠弯曲菌或幽门螺杆菌的分离菌株),则用作者制备的空肠弯曲菌、幽门螺杆菌抗血清与分离菌株进行血清凝集试验,进行相关生化鉴定后,再抽提细菌基因组DNA,用细菌通用引物和特异性引物进行 PCR扩增及序列测定〔8-9〕,并与 GenBank中参考菌株相关基因核苷酸序列进行同源性比较分析(另文发表)。
1.6 药敏试验 药敏试验根据WHO推荐的 K-B琼脂法进行。将0.5麦氏单位的纯化菌悬液用灭菌棉拭子均匀涂布于4 mm厚的M H药敏平板上,37℃恒温培养24 h后观察有无抑菌环或抑菌圈(直径mm),抑菌环的边缘以肉眼见不到细菌明显生长为准。按美国临床实验室标准化研究所(CLSI)的标准判定为敏感、中敏或耐药。试验所选择药物包括下列30种抗菌药物:青霉素 G、氨苄西林、阿莫西林、阿莫西林/克拉维酸、头孢唑林、头孢西丁、头孢噻吩、氨曲南、妥布霉素、阿奇霉素、克拉霉素、红霉素、四环素、多西环素、环丙沙星、氧氟沙星、克林霉素、苯唑西林、萘啶酸、万古霉素、链霉素、复方新诺明、磷霉素、氯霉素、多粘菌素B、利福平、利福平、卡那霉素、杆菌肽、痢特灵、交沙霉素。药敏试验的结果参考文献进行判定〔10〕。
2 结 果
2.1 细菌分离鉴定结果 本研究从25只小型猪中共分离鉴定出45株细菌(表2),其中:空肠弯曲菌2株、幽门螺杆菌2株;肺炎克雷伯氏菌2株;阴沟肠杆菌2株;大肠埃希菌2株、弗格森埃希菌1株;莫拉氏菌1株;嗜麦芽窄食单胞菌2株;金黄色葡萄球菌1株、溶血葡萄球菌1株、模仿葡萄球菌1株;肺炎链球菌1株、猪链球菌2株、前庭链球菌1株、缓症链球菌2株、麻疹孪生球菌1株、绿色气球菌4株;戊糖片球菌1株;粪肠球菌2株;枯草芽孢杆菌6株、地衣芽孢杆菌5株、蜂房芽孢杆菌1株、巨大芽孢杆菌1株;少见沃特菌1株。分离菌株的培养特性及形态特征见表3。分离菌株的生化试验结果表4。细菌分离鉴定结果表明,小型猪所携带的细菌,主要为弯曲菌属、螺杆菌属、克雷伯菌属、肠杆菌属、埃希菌属、窄食单胞菌属、葡萄球菌属、链球菌属、肠球菌属和芽孢杆菌属的细菌。
2.2 药敏试验结果 对主要细菌:如大肠埃希氏菌、金黄色葡萄球菌、肺炎链球菌等进行药敏试验,结果表明,这些菌株对氨曲南、头孢噻吩等药物敏感,而对痢特灵等药物不敏感。结果见表5。
2.3 分子鉴定结果 对分离菌株(空肠弯曲菌、幽门螺杆菌、肺炎克雷伯氏菌、金黄色葡萄球菌、溶血葡萄球菌、肺炎链球菌、猪链球菌)16S rRNA基因PCR扩增产物,进行1%琼脂糖凝胶电泳观察,在1 500 bp处均出现一条明亮的目的条带(图1)。将PCR产物回收纯化后,送宝生物工程(大连)有限公司测序。将测序结果与 GenBank中参考菌株16S rRNA基因核苷酸序列序列进行同源性比较分析。结果,小型猪空肠弯曲菌、幽门螺杆菌、肺炎克雷伯氏菌、金黄色葡萄球菌、溶血葡萄球菌、肺炎链球菌、猪链球菌等分离菌株与 GenBank中相关参考菌株16S rRNA基因的核苷酸序列同源性为99%~100%。根据不同属细菌16S rRNA基因同源性为70%~90%,而同一种内不同株间基因同源性大于99%的判定标准,证实分离株的16S rRNA基因序列均与各自种属的16S rRNA基因序列相一致,确证是各自种属的细菌。

表1 25只小型猪性别与年龄Tab.1 The sex and age of 25 m in iature pigs
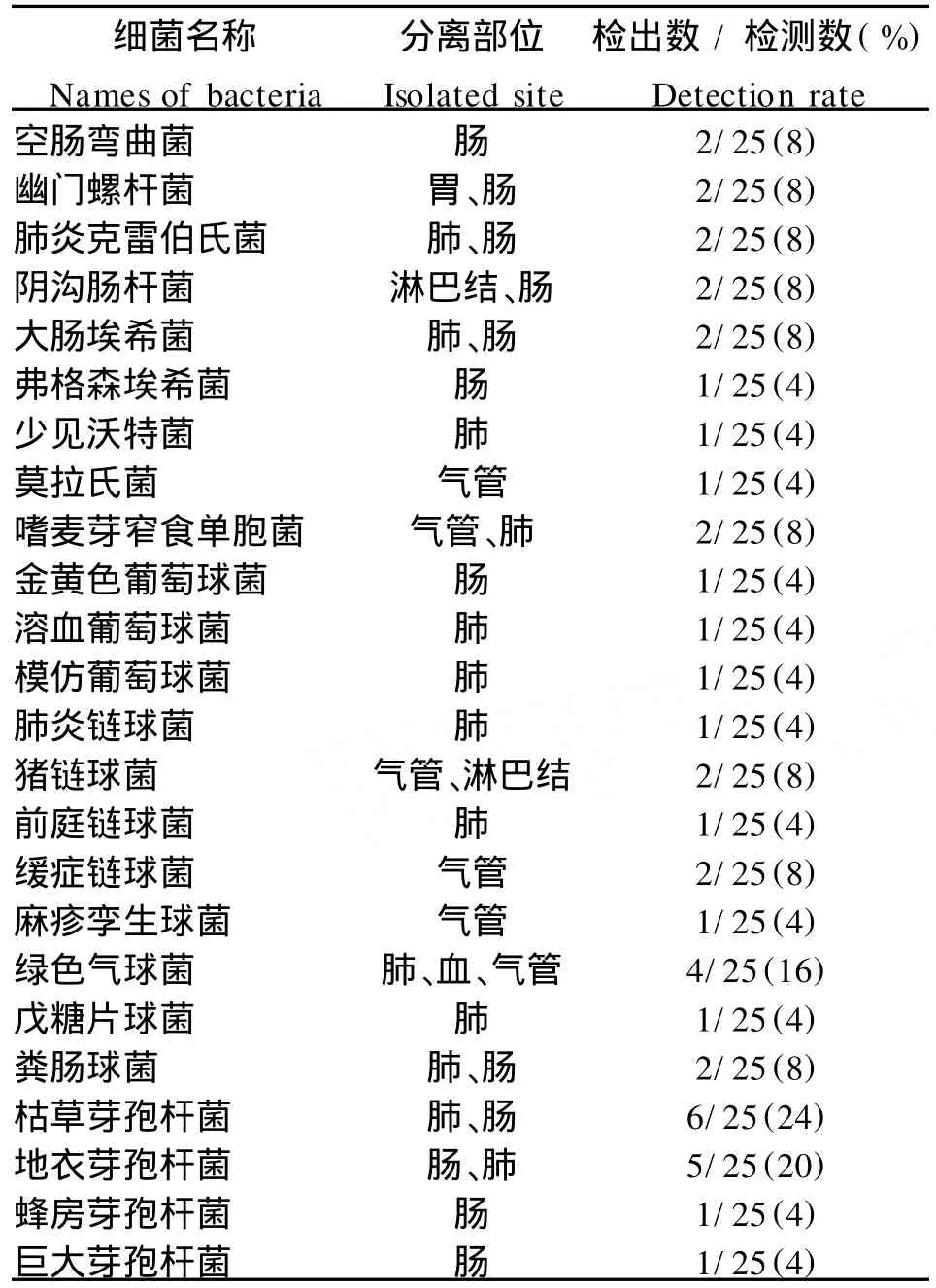
表2 小型猪分离菌株的检出数及检出率Tab.2 Detection number and detection rate of the isolated bacterial strains of m in iature pigs
3 讨 论
本研究首次对中国三个品系的小型猪进行了活体采样、剖解观察、现场接种、常规细菌学分离培养、生化鉴定、药敏试验、血清抗体检测等全面的细菌学检查,并进行细菌16S rRNA基因 PCR扩增、序列测定、分析比对等方面的分子鉴定。结果,从25只小型猪中共分离鉴定出45株细菌,其中:空肠弯曲菌2株、幽门螺杆菌2株;肺炎克雷伯氏菌2株;阴沟肠杆菌2株;大肠埃希菌2株、弗格森埃希菌1株;莫拉氏菌1株;嗜麦芽窄食单胞菌2株;金黄色葡萄球菌1株、溶血葡萄球菌1株、模仿葡萄球菌1株;肺炎链球菌1株、猪链球菌2株、前庭链球菌1株、缓症链球菌2株、麻疹孪生球菌1株、绿色气球菌4株;戊糖片球菌1株;粪肠球菌2株;枯草芽孢杆菌6株、地衣芽孢杆菌5株、蜂房芽孢杆菌1株、巨大芽孢杆菌1株;少见沃特菌1株。药敏试验结果表明,大肠埃希氏菌对氨曲南(30 mm)、磷霉素(28 mm)高度敏感;溶血葡萄球菌对青霉素 G(38 mm)、头孢噻吩(40 mm)高度敏感。
在上述细菌中有一些是人畜共患病的病原菌,如:空肠弯曲菌、幽门螺杆菌、肺炎克雷伯氏菌、金黄色葡萄球菌、溶血葡萄球菌、肺炎链球菌、猪链球菌等,对人和动物都有一定的危害。有一些则是潜在的条件致病菌,在动物机体抵抗力下降、饲养环境改变或运输等应激反应情况下就可能使动物发病甚至死亡,如:溶血葡萄球菌、嗜麦芽窄食单胞菌、前庭链球菌、阴沟肠杆菌等;而其他大部分菌株都是动物体内正常的有益菌群,如:大肠埃希氏菌、枯草芽孢杆菌、地衣芽孢杆菌。
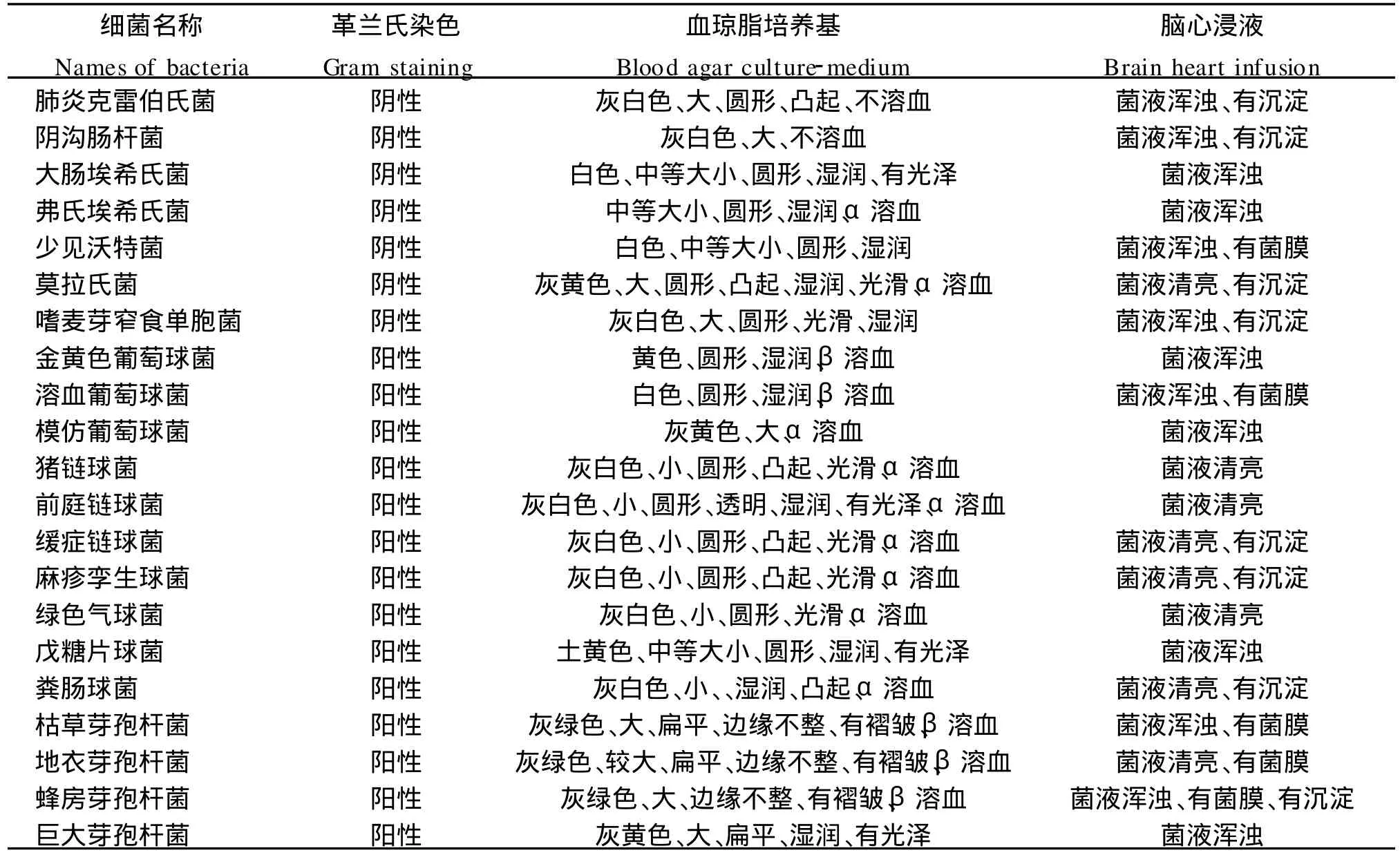
表3 小型猪分离菌株的培养特性及形态特征Tab.3 The cultural and morphologic characteristics of the isolated bacterial strains of m in iature pigs

表4 小型猪分离菌株的生化特征Tab.4 The biochem ical characteristics of the isolated bacterial strains of m iniature pigs
16S rRNA编码基因是指细菌染色体上编码rRNA相对应的DNA序列,存在于所有细菌的染色体基因组中,它具有以下特点:多拷贝(每个细菌约含5~10个拷贝,这使得对该基因的检测具有敏感性)、多信息(16S rRNA编码基因内部结构由可变区和保守区组成。保守区为所有细菌所共有,细菌间无差别,有“分子化石”之称。可根据保守区设计各种细菌的通用引物,也可根据可变区设计特定细菌的特异引物或探针)。16S rRNA编码基因长度适中,约1500 bp,便于序列测定分析比对。16S rRNA编码基因的这些特点使之成为较理想的细菌基因分类的靶序列,逐渐成为细菌鉴别、分类的金标准〔11〕。
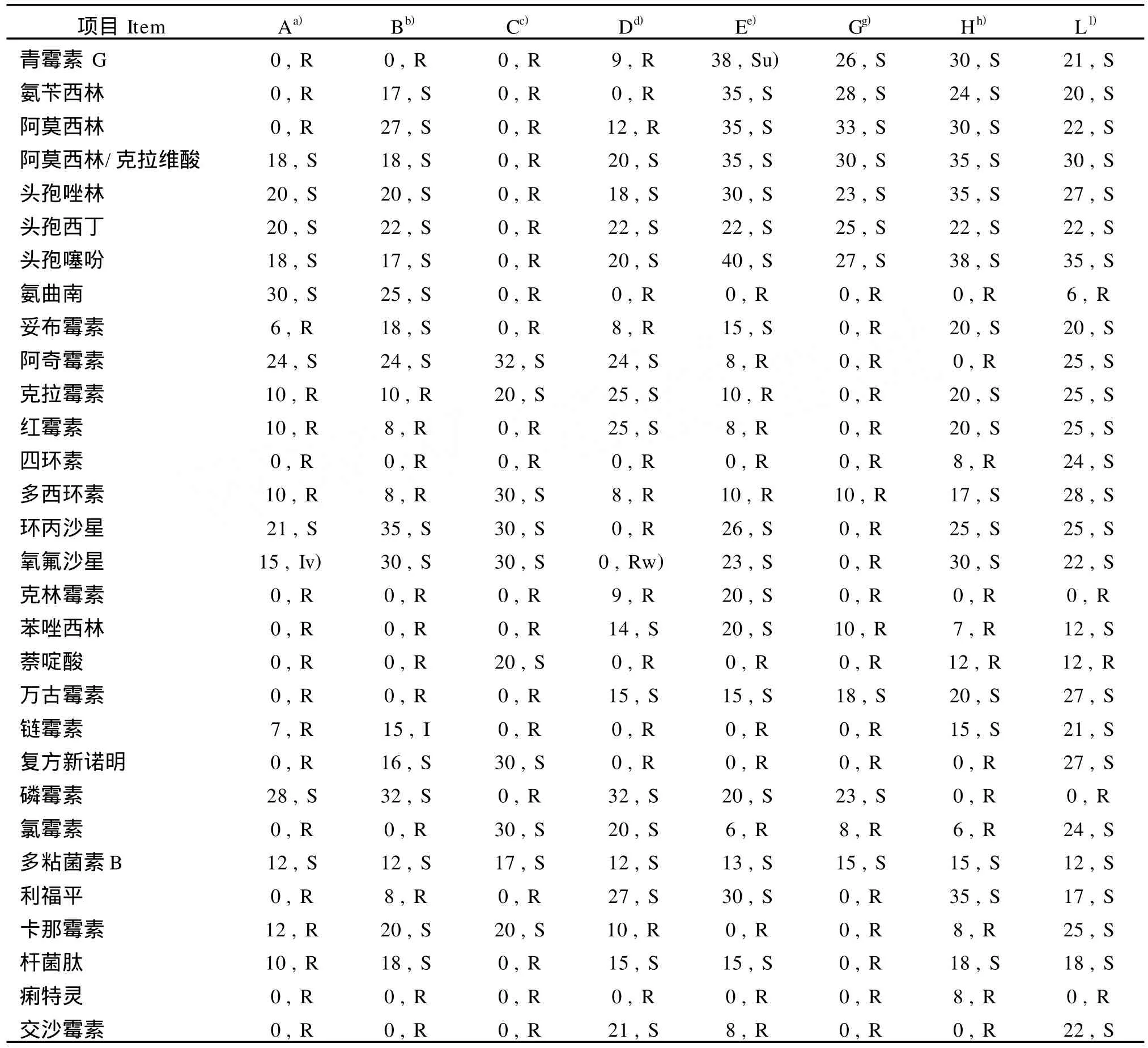
表5 小型猪分离菌株的药敏试验结果Tab.5 Susceptibility test of the isolated bacterial strains of m iniature pigs
作者通过对我国小型猪分离菌株的16S rRNA基因的PCR扩增、测序分析,直接将细菌鉴定到种的水平,从而在分子水平上提供了一种对细菌进行鉴定的有效方法,对传统的细菌学分离培养、生化鉴定方法进行了有力的确证、补充。在对25只剖解的小型猪肺脏进行肉眼观察时发现,有5只小型猪的肺脏有不同程度的病变:肺脏体积肿大、充血、肺实质病变;切开肺脏后发现,细支气管内充斥着诸多浅灰色粘液样物质;从肺门处取样进行细菌分离培养后,检出了肺炎克雷伯氏菌、肺炎链球菌等致病菌。对1只临床表现为腹泻的小型猪和另1只生长发育异常迟缓的小型猪剖解后,取其胃、肠样本,选用特殊培养基进行微需氧培养,分离鉴定出了幽门螺杆菌、空肠弯曲菌等致病菌。此外,作者在剖解时还发现,有5只小型猪的淋巴结异常,出现体积肿大、充血、出血现象,结果从淋巴结样本中分离到了阴沟肠杆菌、猪链球菌等条件致病菌。
本研究的细菌学分离培养和16S rRNA基因的分子鉴定结果表明,我国小型猪携带的细菌种群具有多样性。这为小型猪质量标准的制定提供了可靠科学依据,为制订与国际接轨、符合我国目前研究水平和应用要求的实验用小型猪微生物学标准,为培育高品质、标准化的实验用小型猪,满足生命科学研究的需要奠定基础。同时,也为进一步完善我国实验动物标准化管理体系,提升实验动物对科技创新的支撑能力,为实验动物行政许可、行政执法和实验动物及相关条件的质量控制和评价提供技术保障和科学依据。
〔1〕Silva GV,Fernandes MR,Madonna R,et al.Comparative healing response after sirolimus-and paclitaxel-eluting stent implantation in a pig model of restenosis〔J〕.Catheter Cardiovasc Interv,2009,73(6):801-808.
〔2〕Pieri F,Lucarelli E,Corinaldesi G,et al.Effect of mesenchymal stem cells and p latelet-rich plasma on the healing of standardized bone defects in the alveolar ridge:a comparative histomorphometric study in m inipigs〔J〕.J Oral Maxillofac Surg,2009,67(2):265-272.
〔3〕Lee L,Alloosh M,Saxena R,,et al.Nutritional model of steatohepatitis and metabolic syndrome in the Ossabaw miniature swine〔J〕.Hepatology,2009,50(1):56-67.
〔4〕Kim H I,Lee SY,Jin SM,et al.Parameters for successful pig islet isolation as determined using 68 specific-pathogen-freeminiature pigs〔J〕.Xenotransplantation,2009,16(1):11-18.
〔5〕Holt JG,Krieg NR,Sneath DHA,et al.Bergey’smanualof determinative bacteriology(ninth edition)〔M〕.International edition,1994:39-334.
〔6〕Murray PR,Baron EJ,Pfaller MA,et al.Manualof clinicalmicrobiology(7th edition)〔M〕.American Society for Microbiology,2005,193-200.
〔7〕Kim SB,Yoon JH,Kim H,et al.A phylogenetic analysisof the genus Sacccharomonospora conducted with 16S rRNA gene sequences〔J〕.International Journal of Systematic Bacteriology,1995,45(2):351-356.
〔8〕高正琴,张强,邢进,等.空肠弯曲菌套式PCR检测方法的建立及初步应用〔J〕.中国比较医学杂志,2006,21(4):7-10.
〔9〕Clinical and Laboratory Standards Institute.Performance standards for antimicrobial susceptibility testing〔S〕.Seventeenth Information Supplement,2007,27(1):44-49.
〔10〕Monteiro L,Gras N,Vidal N,et al.Detection of Helicobacter pylori DNA in human feces by PCR:DNA stability and removal of inhibitors〔J〕.J Microbiol Methods,2001,45:89-94.
〔11〕Hooper SJ,Crean SJ,Fardy MJ,et al.A molecular analysis of the bacteria p resent within oral squamous cell carcinoma〔J〕.J Clin Microbiol.2007,56:1651-1659.
Iden tification and susceptibility test of bacteria isolated from m in iature pigs in China
GAO Zheng-qin,ZHANG Qiang,HE Zheng-m ing,YUE Bing-fei,YE Qiang
(N ationa l Institute for the Control of Pharmaceutical and Biologica l Products,Beijing 100050,China)
To investigate the p revalence and the antibiotic resistance of bacteria isolated from 25 miniature pigs.45 bacterial strains were isolated,which were identified by biochemical assays,amp lification of 16S rRNA genes by PCR and sequence analysis,and were evaluated for resistance to 30 antibio tics.The identification results showed that these bacteria belonged to Campylobacter(Cam py lobacter jejuni),Helicobacterium(Helicobacter pylori),Klebsiella(K lebsiella pneumoniae),Escherichia(Escherichia coli,Escherichia fergusonii),Pseudomonas(Pseudom onas aeruginosa),Stenotrophomonas(Stenotrophom onas maltophilia),Staphy lococcus(Staphy lococcus aureus,Staphy lococcus haemoly ticus,Staphy lococcus simulans),Strep tococcus(Streptococcus pneumoniae,Streptococcus suis,Streptococcus vestibularis,Streptococcus m itis,Gemella measles,Aerococcus viridans)and Bacillus(Bacillus subtilis,Bacillus licheni form is,Bacillus a lvei,Bacterium megaterium).These bacteria were all susceptible to aztreonam and cephalothin.However,the resistence to furazolidonewas found.Microbial population carried by miniature pigs in China had characters of diversity.Results of this study provided scientifical acco rdance for the microorganism monito ring of miniature pigs in China.
miniature pig;bacteria isolation;identification;16S rRNA
S852.61
A
1002-2694(2010)01-0046-07
*北京市科委公益应用项目(D07080200720701)
1.中国药品生物制品检定所,北京 100050;
2.首都医科大学附属北京佑安医院,北京 100069
2009-07-18;
2009-11-20
