马尔尼菲青霉菌耐氟康唑的蛋白质组初步分析
2010-01-24刘栋华谭升顺
刘栋华,梁 铭,罗 虹,谭升顺
马尔尼菲青霉菌耐氟康唑的蛋白质组初步分析
刘栋华1,梁 铭1,罗 虹1,谭升顺2
目的 探索马尔尼菲青霉菌耐氟康唑的相关蛋白质组。方法将11株菌丝相和酵母相对氟康唑均敏感的马尔尼菲青霉菌菌株在体外含8μg/mL氟康唑的沙氏液基进行耐药诱导培养。E-test法检测各菌株诱导培养前后氟康唑的M IC值,分别筛选菌丝相和酵母相M IC值增加最显著的菌株,通过CM 10蛋白质芯片检测菌体药物诱导培养前后蛋白质表达的差异。结果11株菌株的菌丝相和2株菌株的酵母相能耐受8μg/mL氟康唑生长,而且诱导培养7d后菌丝相M IC值显著升高,M IC几何均值由1.22μg/m L上升到55.56μg/mL;菌丝相在耐受氟康唑中16个蛋白质表现为高表达且特异性表达4581.1 Da和6109.7Da蛋白质,酵母相则在8μg/mL氟康唑诱导培养下22个蛋白质表现为高表达且特异性表达3575.2 Da,8507.0Da和8563.3 Da蛋白质。结论马尔尼菲青霉菌菌丝相比酵母相更能耐受氟康唑,该菌对氟康唑的抵抗可能和某些特异性蛋白质相关。
马尔尼菲青霉菌;抗真菌药;耐药性;蛋白质组
马尔尼菲青霉菌在1956年从野生竹鼠体内分离出来,是目前已知青霉菌类中唯一具有双相性的真菌,25℃表现为菌丝相而37℃表现为酵母相。马尔尼菲青霉菌感染主要在中国的南方和东南亚地区呈地方性流行,特别是从上世纪80年代后期,随着艾滋病的流行,马尔尼菲青霉菌感染病例急剧增多,成为H IV阳性患者中最为常见的双相性真菌感染,目前被认为是艾滋病标志性诊断疾病之一〔1-3〕。马尔尼菲青霉菌感染的治疗主要依赖抗真菌药物,在临床常根据病情选择使用氟康唑、两性霉素B及伊曲康唑联合用药或单独用药,患者感染急性期控制以后还需要长期口服氟康唑和伊曲康唑维持治疗〔4〕。长期口服抗真菌药物的过程中易导致耐药菌株的产生,目前缺乏有关马尔尼菲青霉菌的耐药性机制研究报道。有研究报道在体外药敏马尔尼菲青霉菌对氟康唑的敏感性较伊曲康唑、酮康唑等抗真菌药物低〔5〕,这种双相性真菌如何对氟康唑产生抵抗性,其机制并未清楚。本研究针对这一问题,采用蛋白质芯片技术,从比较蛋白质组学的角度对马尔尼菲青霉菌抵抗氟康唑的蛋白质分子机制作初步探讨。
1 材料和方法
1.1 实验菌株 11株菌丝相和酵母相对氟康唑均敏感的马尔尼菲青霉菌(PM)菌株(E-test法证实),对应的编号为 PM 1、PM 2、PM 3、PM 4、PM 5、PM 7、PM 16、PM 19、PM 20、PM 23、PM 25。
1.2 主要试剂和仪器 细胞裂解液Ⅰ(9 mol/LU rea,4%CHAPS,40 mmol/L Tris,1%w/v DTT,0.8%p H3~10两性电解质,裂解液中每25m L加入蛋白酶抑制剂(Roche Germany)一片),细胞裂解液Ⅰ(7 mol/LU rea,2 mol/L硫脲,2%CHAPS,40 mmol/L Tris,1%w/v D TT,0.8%p H3~10两性电解质,裂解液中每25m L加入蛋白酶抑制剂一片)。氟康唑购自法国 PFIZER公司。CM 10蛋白质芯片,PBSIIC型蛋白质芯片阅读机和Proteinchip Software 3.2.0分析软件购自美国Ciphergen Biosystem s公司。
1.3 体外耐药诱导 挑取在SDA(沙堡琼脂培养基)上培养的单个菌落的菌丝相马尔尼菲青霉菌,用2m LSDB(沙氏液基)制成菌悬液,分别取1m L菌液接种于不含氟康唑和含8μg/mL氟康唑的30mL SDB中,放置25℃培养。挑取在SDA上培养的单个菌落的酵母相马尔尼菲青霉菌,用2m L SDB制成菌悬液,分别取1m L菌液接种于不含氟康唑和含8μg/m L氟康唑的30m L SDB中,放置37℃培养。分别吸取含氟康唑和不含氟康唑SDB中培养7d的菌悬液,用2m L无菌生理盐水在麦氏比浊仪上调整浊度为0.5麦氏单位。分别用无菌棉拭蘸取制备的菌悬液均匀涂布在SDA培养基平皿上,待培养基表面干后,用无菌眼科镊子镊取氟康唑 E-test药敏试纸条,置于平皿中央。菌丝相置25℃培养,酵母相置37℃培养。48h后,抑菌环与试纸条刻度交界处既为受试菌株的M IC值。
1.4 菌体裂解蛋白制备 根据体外耐药诱导的结果选取 PM 16和 PM 7菌株。挑取 PM 16菌株在25℃的SDA斜面培养基上生长5d的菌丝相菌落,在2mL灭菌注射用水中用无菌棉拭子研磨成菌悬液,分别取1m L转种于100 m L不含氟康唑和含8μg/m L氟康唑的100 m L SDB中,置25℃下培养。挑取PM 7菌株在37℃的SDA斜面培养基上生长5d的酵母相菌落,在2m L灭菌注射用水中用无菌棉拭子研磨成菌悬液,分别取1m L转种于100 mL不含氟康唑和含8μg/m L氟康唑的100 m L SDB中,置37℃下培养。上述菌株培养7d以后,菌液用两层滤纸以布氏漏斗,真空泵抽滤,经双蒸水充分洗涤,抽干水分。将收获的菌体分别放入陶瓷研钵中,反复加液氮速冻后研磨成粉末。加入细胞裂解液I,快速混匀,冰上振荡30min,12 000r/min 4℃离心90min,分离出上清,沉淀再用细胞裂解液 II振荡混匀后12 000 r/min 4℃离心30min,取上清,2次分离上清混合,取少量用考马斯亮蓝染色法测定蛋白质含量,其余分装置-70℃冻存备用。
1.5 蛋白芯片上样步骤 CM 10芯片装入芯片处理器,每孔加入200μL芯片处理缓冲液(50mmol/L醋酸钠,p H 4.0),置于振荡器600 r/m in室温振荡5min,甩掉缓冲液。重复上述操作一次。在每孔中加入100μL处理好的样品(加有 SPA(50%ACN+0.5%TFA)饱和溶液和 U 9(9mol/L尿素,2%CHAPS,1%D TT)缓冲液,蛋白质上样终浓度均为0.05μg/μL),以不含蛋白质样的U 9缓冲液做空白对照,600 r/min室温振荡60min,甩出样品,每孔加入200μL芯片处理缓冲液,600 r/min振荡5min,甩去孔中液体。再次加入200μL芯片处理缓冲液,重复1次。每孔加入 HEPES(1mmol/L,p H4.0)200μL,立刻甩出。尽快拆开芯片处理器,取出芯片风干后,立即在每孔加上 SPA饱和溶液0.5μL,待全干后,重复加SPA饱和溶液0.5μL。待全干后即可上机测定。
1.6 蛋白质峰检测和数据采集 采用 PBSIIC型蛋白质芯片阅读机读取芯片数据。仪器用Ciphergen公司的加有A ll-in-one标准蛋白质的NP-20芯片作为外参照校正,系统的质量偏差为0.1%。芯片检测时芯片阅读机设置如下:激光强度185,检测敏感度为8,优化分子量范围3 000~10 000 Da,最高分子量50 000 Da,信号噪声比(S/N)大于5为有效波峰。采用Ciphergen proteinchip 3.2.0和Biomark W izard软件自动采集分析数据。两个蛋白质谱比较时,特异性蛋白质界定为其蛋白质峰在对应的另一个蛋白质谱上无与之相匹配的蛋白质蜂,质荷比(M/Z)范围相差5%以上。两个相同的蛋白质峰比较时,表达有差异的标志蛋白定义为蛋白质峰相对强度相差1倍以上。所有样品均在不同时间
进行重复测定两次,以保证结果的可靠性。
2 结 果
2.1 菌株经氟康唑诱导培养后M IC值的变化 在体外25℃SDB中培养,11株菌株的菌丝相均能耐受8μg/mL氟康唑生长。在 25℃不含氟康唑的SDB中培养7d的马尔尼菲青霉菌的 M IC值在0.064~8μg/mL 范围 ,几何平均值为 1.22μg/mL。在25℃含氟康唑的SDB中培养7d的马尔尼菲青霉菌的 M IC值在 16~128μg/m L,几何平均值为55.56μg/m L,比不加氟康唑诱导培养的 M IC值明显升高(表1),两者统计学比较有显著性差异(t=10.656,P=0.000)。11株菌株只有PM 7和PM 16的酵母相在37℃能耐受8μg/mL氟康唑生长,氟康唑诱导前后的 M IC值,PM 7分别为 2μg/mL和32μg/m L,PM 16分别为2μg/m L 和 16μg/m L。
2.2 菌丝相在氟康唑诱导培养后的蛋白质组差异PM 16菌株菌丝相在无氟康唑和含8μg/m L氟康唑诱导培养的菌丝体裂解总蛋白质经CM 10芯片检测,共检测到74个蛋白质峰。在氟康唑诱导培养的菌丝体中,其中16个蛋白质表现为高表达,4581.1 Da,6109.7Da蛋白质特异性表达。(表2,图1,图2)

表1 25℃氟康唑(FLC)诱导培养前后马尔尼菲青霉菌的M IC值 (μg/mL)Table 1 The M ICagainst P.m a rne f f ei beforeand after cultured with FLC at 25℃
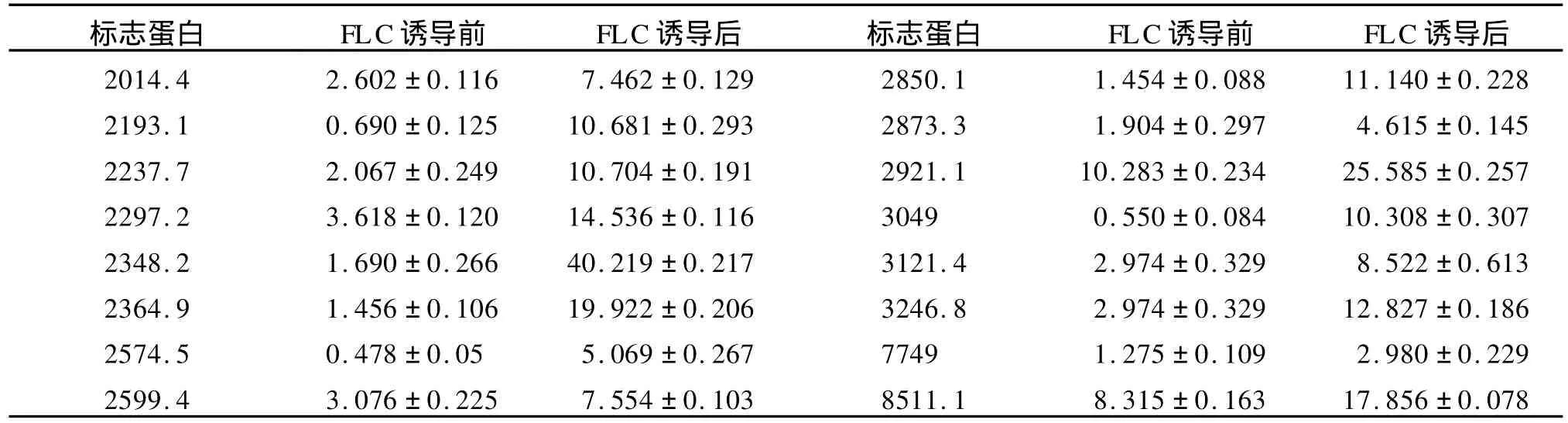
表2 PM 16菌株菌丝相经氟康唑诱导培养后高表达的蛋白质(Da)Table 2 Up-expressed proteins of mycelial form of isolate PM 16 after cultured with FLC

图1 PM 16菌株菌丝相经氟康唑诱导培养后特异性表达的蛋白质Fig.1 The specific expressed proteinsof mycelial form of isolate PM 16 cultured with FLC X-axis was molecular weight for each spectrum(M/Z values),and Y-axis was relative intensity,the arrow s from left to right indicate 4581.1Da and 6109.7 Da proteins respectively.A:before cultured with FLC;B:after cultured with FLC;C:blank control

图2 PM 16菌株菌丝相经氟康唑诱导培养前后在7500~15000的蛋白质谱Fig.2 The proteome between 7500 Da~15000Da of mycelial form of isolate PM 16 before and after cultured with FLC The arrow indicates 8511.1Da protein up-expressed.A:before cultured with FLC;B:after cultured with FLC;C:blank control
2.3 酵母相在氟康唑诱导培养后的蛋白质组差异
PM 7菌株在无氟康唑和含8μg/m L氟康唑诱导培养的细胞体裂解总蛋白质经CM 10芯片检测,共检测到74个蛋白质峰。在氟康唑诱导培养的细胞体中,3575.2 Da,8507.0Da,8563.3 Da蛋白质特异性表达,其中22个蛋白质表现为高表达(表3,图3,图 4)。
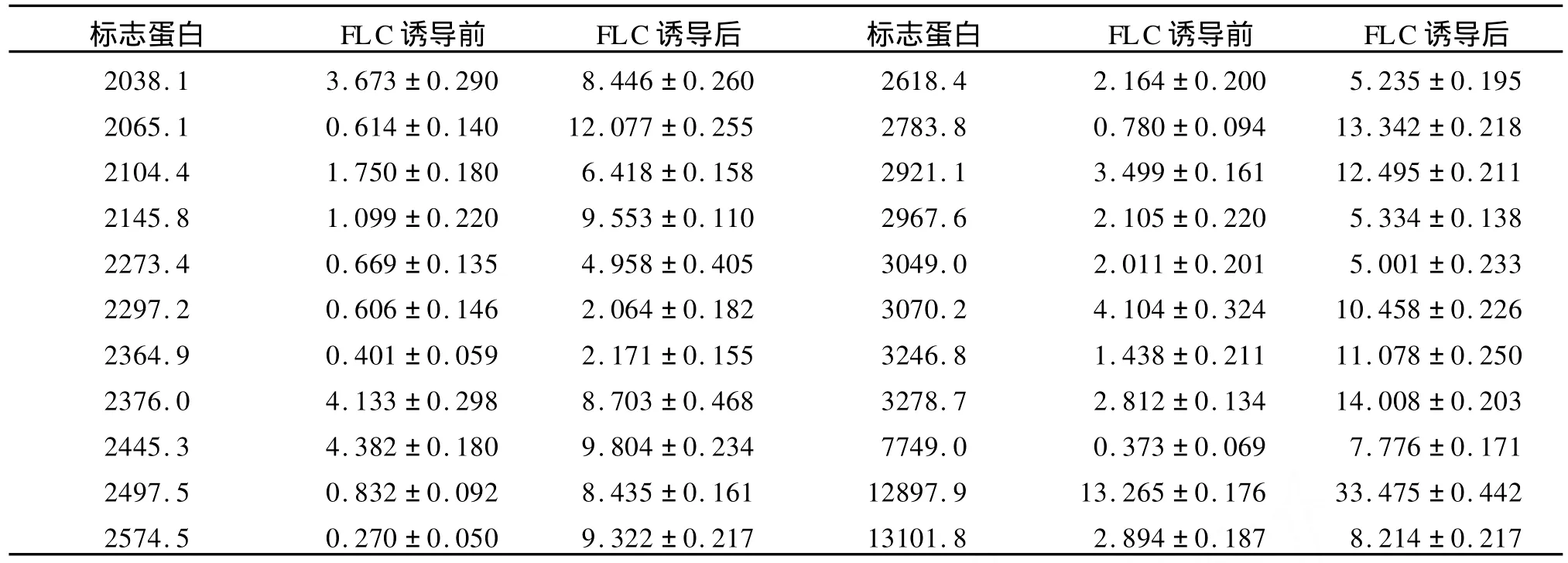
表3 PM 7菌株酵母相经氟康唑诱导培养后高表达的蛋白质(Da)Table 3 Up-expressed proteins of yeast form of isolate PM 7 after cultured with FLC
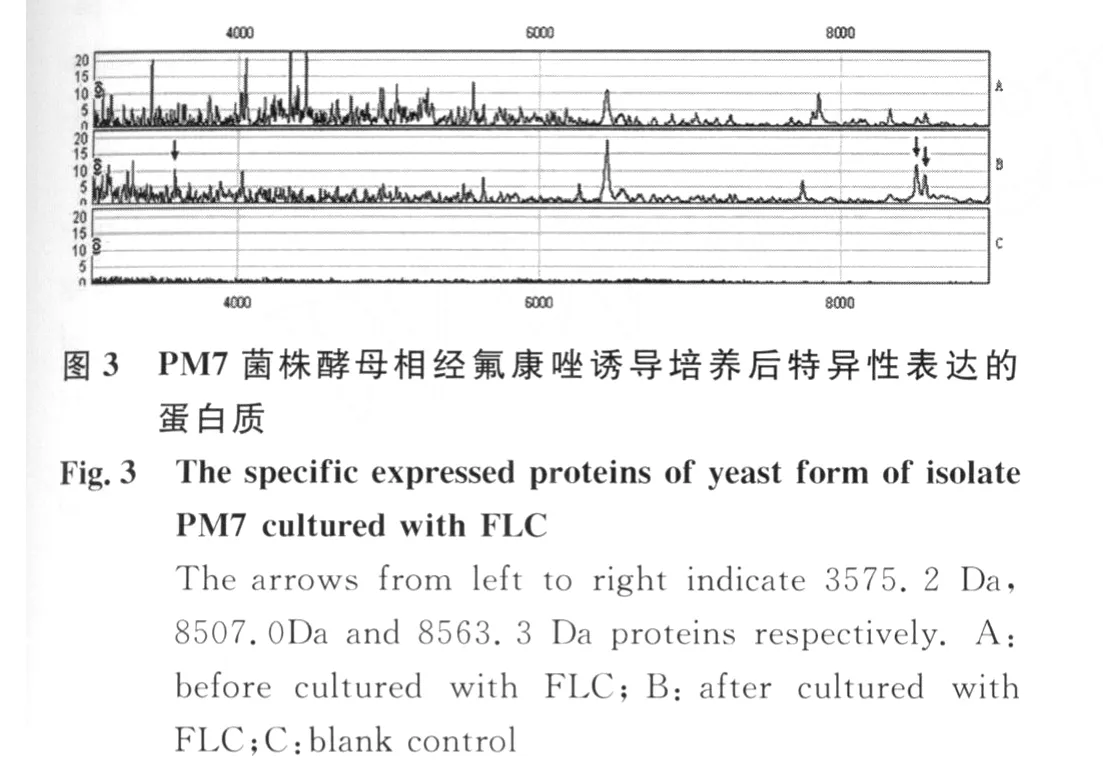
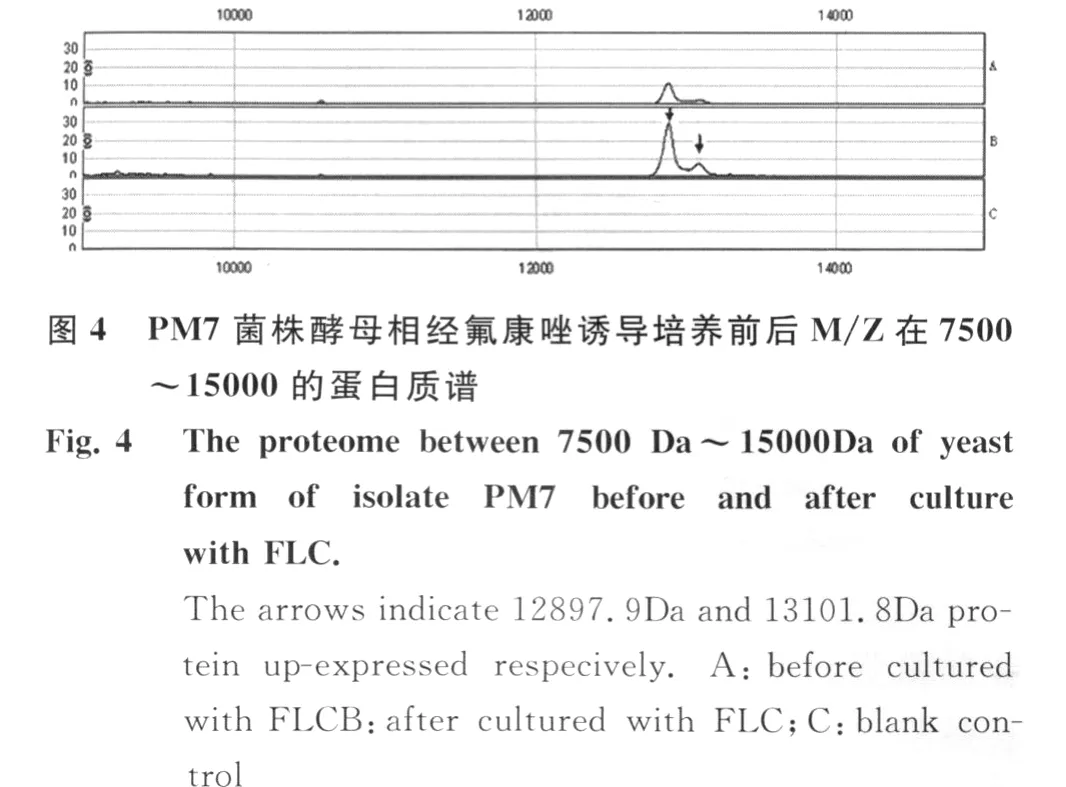
3 讨 论
Supparatpinyo〔6〕与 Sar〔5〕的研究均显示马尔尼菲青霉菌对氟康唑的敏感性较其他抗真菌药物低。马尔尼菲青霉菌为双相性真菌,哪个生长相更能耐受氟康唑呢?临床上氟康唑以常用剂量(成人400mg/d)给药后,血药峰浓度约为 6.5μg/m L,参考此血药浓度本研究曾采用16μg/m L的氟康唑浓度进行体外耐药诱导,菌株不能耐受生长,改选取8μg/m L的氟康唑浓度进行体外耐药诱导,11株马尔尼菲青霉菌在25℃均能耐受8μg/m L氟康唑生长,仅有2株菌能在 37℃耐受 8μg/m L氟康唑生长。此外,菌丝相经过8μg/m L氟康唑7d的诱导培养,其M IC几何平均值达 55.56μg/m L,已经接近耐药的临界M IC值,有3株菌株的氟康唑M IC值均超过耐药临界M IC值(64μg/m L),这些说明菌丝相比酵母相更能耐受氟康唑,亦提示菌丝相在8μg/m L氟康唑的诱导下容易在短期内出现获得性高耐药性。从体外诱导耐药情况看,仍有M IC值小于8μg/m L的敏感酵母相菌株能在含8μg/m L氟康唑的SDB中生长,且经短期诱导培养后其M IC值亦迅速上升,提示在治疗马尔尼菲青霉菌感染时,短期内使用氟康唑可以见效,但有可能很快出现耐药性导致最终治疗失败。Supparatpinyo临床上观察11例马尔尼菲青霉菌感染患者使用氟康唑治疗,7例患者治疗失败〔6〕,这些亦提示马尔尼菲青霉菌在体内对氟康唑的高耐药性。本研究结果显示体外马尔尼菲青霉菌菌丝相对氟康唑的易产生诱导耐药性,提示从菌丝相着手可能更容易发现双相性真菌马尔尼菲青霉菌耐氟康唑的调控机制。
马尔尼菲青霉菌PM 16菌株菌丝相和PM 7菌株酵母相经8μg/m L氟康唑诱导培养7d后,其氟康唑的M IC值增加最显著,所以选取这两株菌进行诱导耐药的蛋白质组比较分析。氟康唑诱导培养以后的菌丝相和酵母相都有蛋白质特异性表达,两者不同,菌丝相表达4581.1Da和 6109.7Da蛋白质,酵母相表达3575.2Da、8507.0Da和8563.3 Da蛋白质,在高表达的蛋白质谱中除2364.9Da、2921.1Da和3246.8Da相同外,其余高表达的蛋白质不同。这些提示菌丝相和酵母相在对氟康唑的耐受机制方面有所不同,故菌丝相和酵母相在体外对氟康唑的耐受能力亦不同。氟康唑为双三唑类抗真菌药,通过抑制真菌的细胞色素 P-450酶,阻滞羊毛甾醇向麦角固醇转化,从而导致真菌细胞膜的损伤。白念珠菌耐氟康唑的机制可以通过几种机制实现,在这些机制中包括药物作用靶酶高表达或变异、抗真菌药物在真菌细胞内聚集的减少及生物膜形成等,其中的重要机制是白念珠菌细胞膜上存在着多种外排泵,由于白念珠菌对药物的外排,导致细胞内药物累积浓度的下降而使药物治疗失败并产生了多重耐药〔7-8〕。马尔尼菲青霉菌对氟康唑耐受机制是否与白念珠菌相似,目前尚未见有关研究的文献报道。本研究结果显示即使对氟康唑敏感的菌株,其菌丝相在8μg/mL氟康唑诱导培养后,氟康唑的M IC值迅速上升,之前的研究实验已报道在8μg/mL氟康唑诱导培养下菌丝体可分泌红色色素和67.5kDa蛋白质〔9〕,蛋白质芯片检测的结果亦示氟康唑诱导后菌丝体有特异性蛋白质表达,这些特异性蛋白质和红色色素分泌是否相关值得进一步研究。有研究采用双向电泳技术分析马尔尼菲青霉菌酵母相和菌丝相的蛋白质表达差异,发现约有500个蛋白质在酵母相和菌丝相表达有差异〔10〕,本研究采用SELD I技术分析示菌丝相和酵母相马尔尼菲青霉菌经氟康唑诱导培养后均有特异性蛋白质表达和多蛋白质表达的上调,这些结果提示该菌对氟康唑的抵抗可能和某些特异性蛋白质相关。
〔1〕Wong KH,Lee SS.Comparing the first and second hundred A IDS cases in Hong Kong〔J〕.Singapore Med J,1998,39(6):236-240.
〔2〕Ustianow ski AP,Sieu TP,Day JN.Penicillium marneffei infection in H IV〔J〕.Current Opinion in Infectious Diseases,2008,21(1):31-36.
〔3〕Maniar JK,Chitale AR,Miskeen A,et al.Penicillium marneffei infection:an A IDS-defining illness〔J〕.Indian J Dermatol Venereol Lep rol,2005,71(3):202-204.
〔4〕韦高,吴易,李菊裳.4种抗真菌药物对马尔尼菲青霉感染体外药敏试验与临床疗效相关性研究〔J〕.临床皮肤科杂志,2005,34(9):577-579.
〔5〕Sar B,Boy S,Keo C,et al.In vitro antifungal-drug suscep tibilities of mycelial and yeast forms of Penicillium marneffei isolates in Cambodia〔J〕.J Clin Microbiol,2006,44 (11):4208-4210.
〔6〕Supparatpinyo K,Nelson KE,Merz WG,et al.Response to antifungal therapy by human immunodeficiency virus-infected patients with disseminated Penicillium marneffei infections and in vitro susceptibilitiesof isolates from clinical specimens〔J〕.Antimicrob Agents Chemother,1993,37(11):2407-2411.
〔7〕Jha S,Karnani N,Dhar SK,et al.Purification and characterization of the N-terminal nucleotide binding domain of an ABC drug transpo rter of Candida albicans:uncommon cysteine 193 of Walker A is critical for A TP hydrolysis〔J〕.Biochemistry,2003,42(36):10822-10832.
〔8〕Loeffler J,Einsele H,Hehart H,et al.Phospholipid and sterol analysis of plasma membranes of azole-resistant Candida albicans strains〔J〕.FEMSMicrobiol Lett,2000,185(1):59-63.
〔9〕刘栋华,谭升顺,罗红,等.氟康唑诱导菌丝相马尔尼菲青霉菌产67.5kDa蛋白〔J〕.中国皮肤性病学杂志,2006,12(20):718-720.
〔10〕Xi L,Xu X,Liu W,et al.Differentially expressed proteins of pathogenic Penicillium marneffei in yeast and mycelial phases〔J〕.JMed Microbiol,2007,56(3):298-304.
A prelim inary proteome analysis on the fluconazole-resistan t strains of Penicillium marne f f ei
L IU Dong-hua,L IANGM ing,LUO Hong,TAN Sheng-shun
(Department of Dermatology,First A ffiliated Hospital of Guangxi M edical University,N anning 530021,China)
The co rrelated p ro teome of Penicillium m arneffei resistant to fluconazole was investigated in the p resent study,in which 11 strainsof P.m arneffei of both the mycelial and yeast form s sensitive to fluconazole were cultivated in Sabouraud’s liquid medium containing 8 g fluconazole and the M ICs of fluoconazile to P.marneffei before and after inducing cultures were tested by E-testmethod.The strainsof the mycelial and yeast form s showing the most significant increase in M IC value were selected and the protein clip CM 10 was used to detect the proteome differences before and after inducing cultures.It was found that 11 strains of themycelial form s and 2 strains of the yeast form s could tolerate the action of fluconazole and could grow at a drug concentration of 8μg/m L.Furthermore,the MICs of fluoconazole to the mycelial form s were significantly increased after 7 days of inducing culture and the geometric means of M ICs were increased from 1.22μg/mL to 55.56μg/mL.After the mycelial forms had been induced to be resistant,16 proteins were highly expressed with specific expression of the 4581.1 Da and 6109.7 Da proteins;w hereas 22 resistant yeast form were highly expressed with specific expression of the 3575.2 Da,8507.0 Da and 8563.3 Da proteins.These results suggest that the mycelial form of P.narnef fei seems to bemo re tolerant to the action of fluconazole than the yeast form.The resistance of these o rganism s to fluconazolemay be associated to some specific proteins.
Penicillium marnef fei;antifungal drug;drug resistance;proteome
R256.6
A
1002-2694(2010)01-0036-05
*广西青年科学基金(0542047)资助项目
1.广西医科大学第一附属医院皮肤科,南宁 530021
2.西安交通大学第二医院皮肤科,Email:ldhys@sohu.com
2009-06-18;
2009-11-12
