基于抗氧化活性的龙眼核标准汤剂提取工艺研究
2025-02-15蒋佳丽王艺洁谢谭芳王志萍


关键词龙眼核;标准汤剂;抗氧化活性;正交实验;提取工艺
龙眼核为无患子科Sapindaceae植物龙眼DimocarpuslonganLour.的干燥成熟种子,性平,味微苦、涩,具有止血定痛、理气化湿的功效,可用于创伤出血、瘿疾、瘰疬、疝气等疾病的治疗[1]。由于龙眼核未被《中国药典》收录,且暂无质量标准,造成其质量控制难度增加、药效难以保证、临床应用受限以及广大患者权益难以保障等问题。据统计,全国每年作为加工副产品而被丢弃的龙眼核超过2万吨[2],给环境造成了巨大压力。研究表明,龙眼核中含有丰富的多酚类、黄酮类等抗氧化活性成分[3],这些抗氧化活性成分不仅可通过活化凝血因子激活凝血系统从而改善出血症状[4],还可通过清除体内自由基,减少细胞氧化损伤,起到减轻炎症反应和缓解炎症反应引起的疼痛的作用[5]。中医理论认为,气机不畅、湿邪阻滞会引起自由基代谢紊乱,导致机体过氧化和抗氧化失衡,具体表现为氧自由基增加、超氧化物歧化酶(superoxidedismutase,SOD)减少、丙二醛(malondialdehyde,MDA)增加[6]。龙眼核中的抗氧化成分有较强的自由基清除能力,有助于保持机体气机的通畅和促进湿气的运化,这也提示龙眼核药用价值较大。
标准汤剂是一种以中医理论为基础,结合现代制药技术而形成的标准化提取制剂,具有无辅料干扰、质量稳定、疗效可控等优点,可以保障用药的准确性和剂量的一致性[7],是配方颗粒以及其他剂型的基础。在中药提取工艺研究中,加水量、提取时间、提取次数对中药有效成分的溶出均具有一定的影响[8]。为全面考察龙眼核标准汤剂工艺合理性,本研究采用单因素实验结合正交实验,以出膏率、没食子酸含量、柯里拉京含量、鞣花酸含量及自由基清除能力为评价指标,结合层次分析法(analytichierarchyprocess,AHP)法和基于指标相关性的权重赋权系数(criteriaimportancethoughinter-criteriacorrelation,CRITIC)法进行提取工艺研究,旨在为龙眼核标准汤剂的质量控制和临床应用奠定基础。
1 材料
1.1 主要仪器
本研究所用主要仪器包括LC-2030Plus型高效液相色谱(HPLC)仪(日本Shimadzu公司)、SQP型万分之一电子天平(北京赛多利斯科学仪器有限公司)、XSR205DU/A型十万分之一电子天平(瑞士Mettler-Toledo公司)、KQ-800DE型数控超声波清洗器(昆山市超声仪器有限公司)、HWS-28型电热恒温水浴锅(上海齐欣科学仪器有限公司)、InfiniteM200pro型多功能酶标仪(瑞士Tecan公司)、UPH-Ⅳ-20TN型优普系列超纯水机(四川优谱超纯科技有限公司)、SCIENTZ-12N型冷冻干燥机(宁波新芝生物科技股份有限公司)等。
1.2 主要药品与试剂
本研究所用龙眼核药材于2023年8月采集于福建莆田,经广西中医药大学药学院田慧教授鉴定为无患子科Sapindaceae植物龙眼D.longanLour.的干燥成熟种子。
对照品没食子酸(批号MUST-22112411,纯度99.96%)、柯里拉京(批号MUST-23060211,纯度99.99%)、鞣花酸(批号MUST-23033114,纯度99.89%)均购自成都曼斯特生物科技有限公司;2,2′-联氮双(3-乙基苯并噻唑啉-6-磺酸)二胺盐[2,2′-azino-bis(3-ethylbenzothiazoline-6-sulfonicacid)ammoniumsalt,ABTS]试剂(批号B2308190,纯度98%)购自上海阿拉丁生化科技有限公司;1,1-二苯基-2-苦基肼(1,1-diphenyl-2-picryl-hydrazylradical,DPPH)试剂(批号S041S224966,纯度98%)购自上海源叶生物科技有限公司;乙腈、甲醇、磷酸均为色谱纯,水为纯化水。
2 方法与结果
2.1 出膏率的测定
将龙眼核标准汤剂浓缩至500mL,精密吸取浓缩液10mL到已干燥至恒重的蒸发皿中,蒸干,再于105℃下干燥3h,转移至干燥器中冷却30min,迅速称质量,按下片质量,m1为空皿恒重,m2为含浓缩液蒸发皿恒重后质量)。
2.2 指标成分含量测定
2.2.1 色谱条件
采用岛津ShimNexCSC18(250mm×4.6mm,5μm)色谱柱,以乙腈(A)-0.1%磷酸溶液(B)为流动相进行梯度洗脱(0~10min,5%A;10~20min,5%A→13%A;20~50min,13%A→17%A;50~60min,17%A→20%A;60~80min,20%A→50%A;80~90min,50%A→5%A);流速为1.0mL/min;柱温为30℃;检测波长为270nm;进样体积为10μL。
2.2.2 混合对照品溶液的制备
精密称取没食子酸、柯里拉京、鞣花酸对照品适量,加甲醇溶解,制成质量浓度依次为413.43、409.56、531.81μg/mL的混合对照品溶液。
2.2.3 冻干粉供试品溶液的制备
取龙眼核100g,加8倍水浸泡30min后提取30min,收集滤液;药渣加6倍水提取20min,合并滤液并浓缩至500mL。将浓缩液于-80℃冰箱中预冻12h,真空冷冻干燥机中冻干,得龙眼核标准汤剂冻干粉。取冻干粉0.2g,精密称定,置于50mL具塞锥形瓶中,加甲醇25mL,精密称定,超声15min,放冷,加甲醇补足减失的质量,摇匀,过0.45μm微孔滤膜,取续滤液,即得冻干粉供试品溶液。
2.2.4 方法学考察
参照2020年版《中国药典》(四部)分析方法验证指导原则进行方法学考察。系统适用性试验结果显示,冻干粉供试品溶液与混合对照品溶液在相同保留时间处有相同色谱峰出现(图略),各待测成分色谱峰与相邻色谱峰的分离度均大于1.5,理论板数均不少于5000,且空白溶液(甲醇)对测定无干扰,表明本方法系统适用性较好。以各对照品质量浓度为横坐标(X)、峰面积为纵坐标(Y)绘制标准曲线,得没食子酸、柯里拉京、鞣花酸的线性回归方程分别为Y=32191.00X+36752.00(r=0.9999)、Y=19671.00X+5411.20(r=1.0000)、Y=50255.00X-1512.90(r=0.9997),线性范围分别为10.33~413.43、10.24~409.56、13.30~531.81μg/mL。上述3种成分精密度试验的RSD分别为0.81%、0.62%、0.68%(n=6);重复性试验的RSD分别为1.36%、1.01%、0.90%(n=6);稳定性试验的RSD分别为1.44%、1.67%、1.73%(n=6);平均加样回收率分别为97.04%、94.73%、101.04%,RSD分别为2.21%、2.24%、2.09%(n=6)。
2.3 DPPH自由基清除实验
2.3.1 溶液的配制
精密称取龙眼核标准汤剂冻干粉适量,加甲醇制成质量浓度为0.05、0.1、0.2、0.4、0.8、1mg/mL的供试品溶液。取DPPH适量,加甲醇制成质量浓度为0.3mg/mL的DPPH甲醇溶液。上述溶液均避光保存,备用。
2.3.2 DPPH自由基清除率的测定
参考文献[9]方法,取“2.3.1”项下不同质量浓度的供试品溶液与DPPH甲醇溶液各100μL于同一孔中,作为实验组。以甲醇溶液代替DPPH甲醇溶液,其余操作同实验组,作为对照组;以甲醇溶液代替供试品溶液,其余操作同实验组,作为标准组。将各组样品置于暗处反应30min,使用酶标仪于517nm波长处测定各组吸光度(A),按下式计算DPPH自由基清除率:DPPH自由基清除率=1-(A2-A1)/A(0式中,A2为实验组A,A1为对照组A,A0为标准组A)。运用GraphPadPrism8.3.0软件计算样品对DPPH自由基的半数清除浓度(halfclearanceconcentration,IC50),记为DPPH自由基IC50。
2.4 ABTS自由基清除实验
2.4.1 溶液的配制
精密称取龙眼核标准汤剂冻干粉适量,加甲醇制成质量浓度为0.05、0.1、0.2、0.4、0.8、1mg/mL的供试品溶液。将3.84mg/mL的ABTS溶液与1.34mg/mL的过硫酸钾溶液按体积比1∶1混合,于室温、暗处静置16h后得ABTS自由基储备液。使用前,以磷酸盐缓冲液(PBS,pH7.4)稀释约20倍,得ABTS自由基工作液。
2.4.2 ABTS自由基清除率的测定
参考文献[10]方法并适当修改后进行测定。取“2.4.1”项下不同质量浓度的供试品溶液20μL和ABTS自由基工作液180μL于同一96孔板中,作为实验组。以PBS代替ABTS工作液,其余操作同实验组,作为对照组。以PBS代替供试品溶液,其余操作同实验组,作为标准组。将各组样品置于暗处反应30min,使用酶标仪于734nm波长处测定各组吸光度(A),按下式计算ABTS自由基清除率:ABTS自由基清除率=1-(A2-A1)/A0(式中,A2为实验组A,A1为对照组A,A0为标准组A)。运用GraphPadPrism8.3.0软件计算样品对ABTS自由基的IC50,记为ABTS自由基IC50。
2.5 单因素实验筛选提取工艺条件
称取龙眼核药材,每份100g,捣碎表皮及种仁,浸泡30min,按表1水平分别对加水量、提取时间、提取次数进行系统考察。将龙眼核标准汤剂浓缩至500mL,分别按“2.1”~“2.4”项下方法测定出膏率、指标成分含量、DPPH自由基IC50和ABTS自由基IC50。结果(表1)显示,在加水量为10~14倍时,出膏率变化不大,没食子酸含量、柯里拉京含量、鞣花酸含量增加较为明显,DPPH、ABTS自由基IC50较低,故选择加水量为10~14倍进行正交实验。在提取时间为50min时出膏率最高,没食子酸含量在提取90min时最高,提取时间为30min时柯里拉京含量、鞣花酸含量最高并且DPPH、ABTS自由基IC50最低,结合时间成本,选择提取时间为15~50min进行正交实验。出膏率随提取次数的增加而升高,没食子酸含量在提取4次时最高;柯里拉京含量、鞣花酸含量均在提取5次时最高,但与提取2~4次含量相差不大;ABTS自由基IC50变化趋势亦如此,但在提取2次时DPPH自由基IC50最低。综合时间、耗能等因素选择提取2~4次进行正交实验。
2.6 AHP-CRITIC法结合正交实验优选提取工艺
2.6.1 AHP法计算权重
多项研究结果表明,龙眼核具有良好的抗氧化活性[11―12],为确保龙眼核标准汤剂的抗氧化效果,故将龙眼核标准汤剂对DPPH、ABTS自由基的清除能力作为第一重要指标。多酚类成分为龙眼核抗氧化作用主要化学成分[3],故将龙眼核标准汤剂中3种多酚类成分(没食子酸、柯里拉京、鞣花酸)含量作为第二重要指标。出膏率虽然是判断提取工艺稳定性的重要指标,但未直接反映龙眼核标准汤剂抗氧化效果和化学信息[13],故将其作为第三重要指标。按DPPH自由基IC50=ABTS自由基IC50>没食子酸含量=柯里拉京含量=鞣花酸含量>出膏率的顺序,采用SPSSPRO在线系统(https://www.spsspro.com/)对评价指标进行两两比较,构建判断矩阵并进行一致性评价。一致性检验结果显示,最大特征根为6,一致性指标为0,平均随机一致性指标为1.25,一致性比例=0<0.1,表明该判断矩阵一致性良好[14]。根据该比较矩阵,得到出膏率、没食子酸含量、柯里拉京含量、鞣花酸含量、DPPH自由基IC50、ABTS自由基IC50的权重分别为7.692%、15.385%、15.385%、15.385%、23.077%、23.077%。故AHP法的综合得分=出膏率实测值/最大值×7.692%+没食子酸含量实测值/最大值×15.385%+柯里拉京含量实测值/最大值×15.385%+鞣花酸含量实测值/最大值×15.385%+DPPH自由基IC50最小值/实测值×23.077%+ABTS自由基IC50最小值/实测值×23.077%。
2.6.2 CRITIC法计算权重
根据文献[15]方法,先对数据予以标准化处理,然后采用SPSSPRO在线系统(https://www.spsspro.com/)计算各指标权重,得到出膏率、没食子酸含量、柯里拉京含量、鞣花酸含量、DPPH自由基IC50、ABTS自由基IC50的权重分别为19.823%、12.663%、20.759%、12.040%、14.754%、19.963%。故CRITIC法的综合得分=出膏率实测值/最大值×19.823%+没食子酸含量实测值/最大值×12.663%+柯里拉京含量实测值/最大值×20.759%+鞣花酸含量实测值/最大值×12.040%+DPPH自由基IC50最小值/实测值×14.754%+ABTS自由基IC50最小值/实测值×19.963%。
2.6.3 AHP-CRITIC法计算综合权重
根据AHP法、CRITIC法所得权重计算综合权重(G综合)∶G综合ij=(WAHPij×WCRITICij)/Σ(WAHPij×WCRITICij);式中,WAHPij表示用AHP法计算得到的权重,WCRITICij表示用CRITIC法计算得到的权重,i、j分别表示指标i和指标j。经计算,出膏率、没食子酸含量、柯里拉京含量、鞣花酸含量、DPPH自由基IC50、ABTS自由基IC50的G综合分别为9.224%、11.784%、19.320%、11.206%、20.597%、27.869%。
2.6.4 3种权重方法比较
分别按AHP法、CRITIC法及AHP-CRITIC法计算综合得分,并采用SPSS27.0.1软件对3种方法计算所得的综合得分进行相关性分析。经计算,AHP法与CRITIC法、AHP法与AHP-CRITIC法、CRITIC法与AHP-CRITIC法的相关系数分别为0.983、0.999、0.986,三者两两比较均具有显著相关性(P<0.01),说明3种评分方法具有良好的一致性。同法对3种方法的权重进行相关性分析,结果显示,AHP法与CRITIC法权重的相关系数为-0.119,且不具有显著性(P=0.823>0.05),表明二者所呈现的信息不存在重叠。由于AHP-CRITIC法同时兼顾主观判断与客观数据,因此本研究最终采用AHP-CRITIC法计算综合得分,即综合得分=出膏率实测值/最大值×9.224%+没食子酸含量实测值/最大值×11.784%+柯里拉京含量实测值/最大值×19.320%+鞣花酸含量实测值/最大值×11.206%+DPPH自由基IC50最小值/实测值×20.597%+ABTS自由基IC50最小值/实测值×27.869%。
2.6.5 正交实验设计
根据前期单因素结果,以加水量(A)、提取时间(B)、提取次数(C)为影响因素,以出膏率、没食子酸含量、柯里拉京含量、鞣花酸含量、DPPH自由基IC50、ABTS自由基IC50为评价指标,以AHP-CRITIC法计算各评价指标综合得分,采用L(934)正交实验优化龙眼核标准汤剂提取工艺。因素与水平见表2,正交实验设计与结果见表3,方差分析结果见表4。
由表3可知,各因素对提取工艺的影响顺序为C>B>A,且A3>A2>A1、B2>B3>B1、C2>C3>C1。由表4可知,因素C对提取工艺的影响显著(P<0.05),而因素A和B的影响不显著(P>0.05)。故确定最佳提取工艺为A3B2C2,即第1次提取加14倍水,提取30min,第2、3次提取均加12倍水,提取20min。
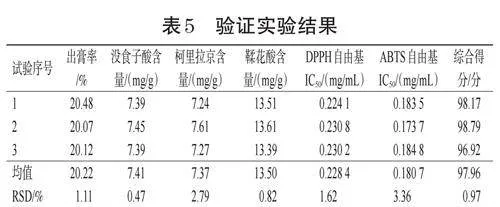
2.6.6 提取工艺验证
按“2.6.5”项下工艺制备3批样品,进行工艺验证,并按“2.1”~“2.4”项下方法测定各项指标,结果见表5。由表5可知,3批验证实验数据一致性较高,证明所选的提取工艺稳定可靠,具备良好的可重复性。
3 讨论
3.1 色谱条件
本研究前期分别对冻干粉的提取条件(提取方式、提取溶剂种类、提取溶剂用量)以及液相色谱条件进行了系统考察。最终确定冻干粉最佳提取条件为25mL甲醇超声提取15min。色谱条件考察结果显示,在270nm波长处各指标成分吸收好,在流动相体系为乙腈-0.1%磷酸溶液时基线平稳、各峰峰形尖锐且对称,当柱温为30℃、流速为1.0mL/min时各色谱峰分离度较好。
3.2 龙眼核破碎程度
传统煎煮认为“逢壳必捣,逢子必破”。龙眼核为龙眼干燥成熟种子,呈类球形,表皮呈红褐色,剖开后有2片子叶,质坚硬。本研究前期对龙眼核破碎程度进行了考察,在仅捣碎龙眼核表皮、不捣碎子叶的情况下,龙眼核标准汤剂出膏率为6.54%,没食子酸、柯里拉京、鞣花酸含量分别为5.26、2.89、5.50mg/g,DPPH、ABTS自由基的IC50分别为0.2844、0.3700mg/mL,该情况下多酚类成分含量少,抗氧化效果较差,也不易冻干。结合实验现象和文献[16]分析,可能原因是此时提取液中化学成分多为龙眼核多糖,使得提取液较为黏稠,从而导致样品在冻干和升华过程中扩散困难,影响冻干效率;当龙眼核表皮及子叶均被捣碎时,溶剂更易进入药材内部,促使多酚类有效成分溶出,增强了抗氧化效果,也更易冻干,此时出膏率为18.44%,没食子酸、柯里拉京、鞣花酸含量分别为6.42、6.65、11.38mg/g,DPPH、ABTS自由基的IC50分别为0.2466、0.2433mg/mL。故本研究在进行提取之前,将龙眼核表皮及子叶捣碎,并浸泡30min,以便有效成分溶出。
3.3 评价指标及方法选择原因
以往提取工艺研究多以出膏率、指标成分含量作为评价指标[17―18],但中药成分复杂,仅通过控制出膏率及有效成分含量无法确保得到的是最佳提取工艺。因此,为了更全面、深入地进行评价,本研究在以关键指标含量和出膏率为评价指标的基础上,将2个抗氧化药效实验结果作为主要评价指标。AHP法是一种主观的评价方法,主要由研究者根据评价指标的重要性进行打分确定权重,CRITIC法则基于数据自身的变异性和指标间的冲突性来确定权重[19]。本研究将AHP法与CRITIC法相结合,相较于单一的评分方法,既体现了研究者的主观判断,也反映了数据的客观特征,可以减少单一评分方法所带来的偏差和局限性,使评价结果更为科学、合理。再通过对加水量、提取时间、提取次数3个因素的综合考察,优化出龙眼核标准汤剂最佳提取工艺为第1次提取加14倍水,提取30min;第2、3次提取均加12倍水,提取20min。用此条件进行3批验证实验,平均综合得分为97.96分,RSD为0.97%,表明该工艺稳定、可行。
综上,本研究基于抗氧化活性,采用AHP-CRITIC法结合正交实验优化的龙眼核标准汤剂提取工艺稳定可行。本研究结果可为龙眼核标准汤剂的深入开发利用提供依据。
