云南核桃分心木总黄酮纯化工艺研究
2025-02-14夏文茜何旭华阚欢刘云

摘 要:采用大孔树脂吸附法对云南核桃分心木黄酮粗提物进行纯化处理。以吸附率和解吸率为考核指标,从6种大孔树脂(NKA-9、AB-8、XAD-7HP、HPD-500、HP-20及D-101)中进行筛选,并通过动态吸附与解吸实验初步探讨云南核桃分心木中黄酮的纯化条件。结果表明,D-101大孔树脂吸附和解吸效果最佳。在粗提物上样液浓度为10 mg·mL-1、上样液pH值为6、上样液流速为2 mL·min-1、上样液体积为40 mL以及洗脱液为体积分数50%的乙醇溶液、洗脱液pH值为6、洗脱液流速为2 mL·min-1、洗脱液体积为75 mL时,采用D-101大孔树脂纯化后的总黄酮含量从41%提高至72%。该工艺条件适用于云南核桃分心木黄酮的纯化。
关键词:云南核桃;分心木;黄酮纯化;大孔树脂
Purification and Adsorption of Flavonoids from Diaphragma juglandis fructus in Juglans sigillata D. by Macroporous Resin
XIA Wenxi, HE Xuhua, KAN Huan, LIU Yun*
(School of Life Sciences, Southwest Forestry University, Kunming 650224, China)
Abstract: The crude extracts of flavonoids from Diaphragma juglandis fructus in Juglans sigillata D. were purified by the adsorption method using macroporous resins. Six macroporous resins (NKA-9, AB-8, XAD-7HP, HPD-500, HP-20 and D-101) were screened with adsorption and desorption rates. The purification conditions of Diaphragma juglandis fructus from Juglans sigillata D. were studied by dynamic adsorption and desorption experiments. The results showed that D-101 macroporous resin had the best adsorption and desorption effect. When the concentration of crude extract was 10 mg·mL-1, the sample pH value was 6, the flow rate was 2 mL·min-1, and the sample volume was 40 mL, the eluent was 50% ethanol solution by volume, the elution pH value was 6, the elution flow rate was 2 mL·min-1, the elution volume was 75 mL, and the total flavonoid content was increased from 41% to 72% after purification with D-101 macroporous resin. In conclusion, the process conditions were suitable for the purification of flavonoids from Diaphragma juglandis fructus in Juglans sigillata D..
Keywords: Juglans sigillata D.; Diaphragma juglandis fructus; flavonoid purification; microporous resin
云南核桃(Juglans sigillata D.)品质优良、核仁饱满、蛋白质及脂肪含量较高,营养丰富,深受国内外消费者的喜爱[1]。目前,核桃加工以果仁基础加工为主[2],而产生的大量分心木通常被丢弃,造成了极大的浪费。分心木(Diaphragma juglandis fructus)是生长在核桃内部的干燥木质隔膜组织[3],味道苦涩、食性平和[4-5]。分心木中主要含有黄酮类、醌类和酚酸类化学成分[6],其中黄酮类成分的含量最高,通常在7%~13%[7]。目前,大孔树脂因具有成本低、设备简单、溶剂消耗少、易再生等优点被广泛应用于富集植物类黄酮[8],但关于大孔树脂纯化云南核桃分心木黄酮的研究却鲜有报道。本文旨在初步确定分心木总黄酮的纯化工艺,以期为分心木黄酮的高效利用提供相关理论依据。
1 材料与仪器
1.1 材料与试剂
云南核桃分心木,云南磨浆农业有限公司。
NKA-9、AB-8、XAD-7HP、HPD-500、HP-20大孔树脂,北京惠德易科技有限责任公司;HP-20、D-101大孔树脂,天津市光复精细化工研究所;芦丁(分析纯),上海源叶生物科技公司;无水乙醇、亚硝酸钠、硝酸铝、氢氧化钠、盐酸(均为分析纯)。
1.2 仪器与设备
SHZ-82恒温振荡器,常州智博瑞仪器制造有限公司;SG5200HD超声波清洗机,上海冠特超声仪器有限公司;UV-2600紫外可见分光光度计,日本岛津公司;TG16-WS离心机,湖南迈克尔实验仪器有限公司;RV8旋转蒸发仪,艾卡仪器设备有限公司;SHZ-D(Ⅲ)循环水式多用真空泵,上海力辰邦西仪器科技有限公司;LX-JY0304蠕动泵,广州市家有乐宠电子商务有限公司。
1.3 实验方法
1.3.1 云南核桃分心木黄酮粗提物的制备
称取一定量云南核桃分心木粉,按照液料比60∶1(mL∶g),加入体积分数为50%的乙醇溶液,在温度51 ℃、功率160 W的条件下超声提取
39 min,经过抽滤、减压浓缩、冻干后,即可得到黄酮粗提物,用纯水溶解配制成不同浓度的粗提物水溶液,备用。
1.3.2 总黄酮含量的测定
参考赵娟娟等[7]的方法绘制芦丁标准曲线。配制不同浓度的芦丁标准液,于510 nm波长下测定吸光值,芦丁质量浓度(x)和吸光值(y)的线性回归方程为y=13.185 7x+0.018 7,R2=0.999。按照绘制标准曲线的方法处理黄酮样品,依次测量吸光度。云南核桃分心木黄酮粗提液或纯化液中总黄酮含量的计算公式为
(1)
式中:X为黄酮含量,%;C为溶液中总黄酮浓度,mg·mL-1;V为溶液体积,mL;N为稀释倍数;M为黄酮粗提物或纯化物质量,g。
1.3.3 大孔树脂预处理
6种大孔树脂均进行以下预处理。①用纯水浸泡去除6种大孔树脂的杂质,滤干。②用无水乙醇浸泡24 h后用纯水洗净,滤干。③用5%盐酸浸泡4 h后用纯水洗净,滤干。④用5% NaOH浸泡4 h,再用纯水洗至中性,备用[9]。
1.3.4 大孔树脂筛选
分别取3 g预处理后的6种大孔树脂置于锥形瓶中,加入20 mL一定浓度的云南核桃分心木黄酮粗提物水溶液,在25 ℃、120 r·min-1的恒温振荡器中振荡24 h,过滤,取滤液测定吸光值,按照公式(2)计算吸附率。随后取20 mL体积分数为50%的乙醇溶液与滤干树脂混匀,在25 ℃、120 r·min-1的恒温振荡器中解吸24 h,过滤,测定滤液的吸光值,按照公式(3)计算解吸率[10-11]。
(2)
(3)
式中:K为吸附率,%;F为解吸率,%;C0为粗提物水溶液中总黄酮浓度,mg·mL-1;C1为吸附饱和后滤液中总黄酮浓度,mg·mL-1;V0为吸附液总体积,mL;C2为解吸液中总黄酮浓度,mg·mL-1;V2为解吸液总体积,mL。
1.3.5 大孔树脂D-101动态吸附和解吸实验
(1)大孔树脂D-101动态吸附实验。设置基础吸附条件为上样液浓度10 mg·mL-1、上样液pH值6、上样液流速2 mL·min-1,以每5 mL为收集单元,收集流出液,计算吸附率。分别考察上样液浓度(5、10、15、20 mg·mL-1和25 mg·mL-1)、上样液pH值(1、2、3、4、5、6、7和8)对吸附率的影响。通过泄露曲线考察上样液流速和上样液体积对黄酮浓度的影响。
(2)大孔树脂D-101动态解吸实验。以最佳上样条件对黄酮粗提物水溶液进行吸附后,设置基础解吸条件为洗脱液体积分数50%、洗脱pH值为6、洗脱流速2 mL·min-1,以每5 mL为收集单元,收集流出液,计算解吸率。分别考察洗脱液体积分数(20%、30%、40%、50%、60%、70%、80%和90%)、洗脱液pH值(1、2、3、4、5、6、7和8)、洗脱流速(1、2 mL·min-1和3 mL·min-1)对解吸率的影响。通过洗脱曲线考察洗脱液流速和洗脱液体积对黄酮浓度的影响。
1.4 数据处理
采用Origin 2018软件进行绘图,采用IBM SPSS Statistics 20进行显著性分析。
2 结果与分析
2.1 大孔树脂筛选结果
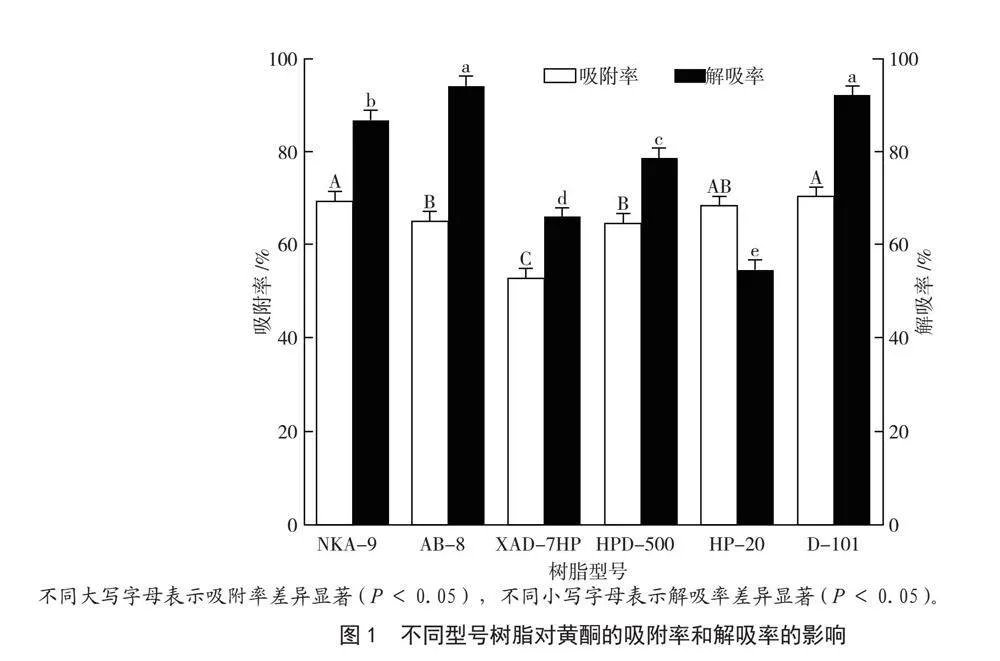
由图1可知,D-101大孔树脂对黄酮的吸附率(70.23%)略高于NKA-9(69.37%)及HP-20(68.46%),三者无显著差异(P>0.05),但显著高于(P<0.05)AB-8(65.08%)、HPD-500(64.43%)及XAD-7HP(53.00%);AB-8大孔树脂对黄酮的解吸率(93.97%)略高于D-101大孔树脂(92.02%),二者无显著差异(P>0.05),但显著高于(P<0.05)NKA-9(86.71%)、HPD-500(78.61%)、XAD-7HP(66.15%)及HP-20(54.60%)。综合吸附与解吸效果,选择D-101大孔树脂作为后续纯化实验的材料。
2.2 大孔树脂动态吸附实验结果
2.2.1 上样液浓度的确定
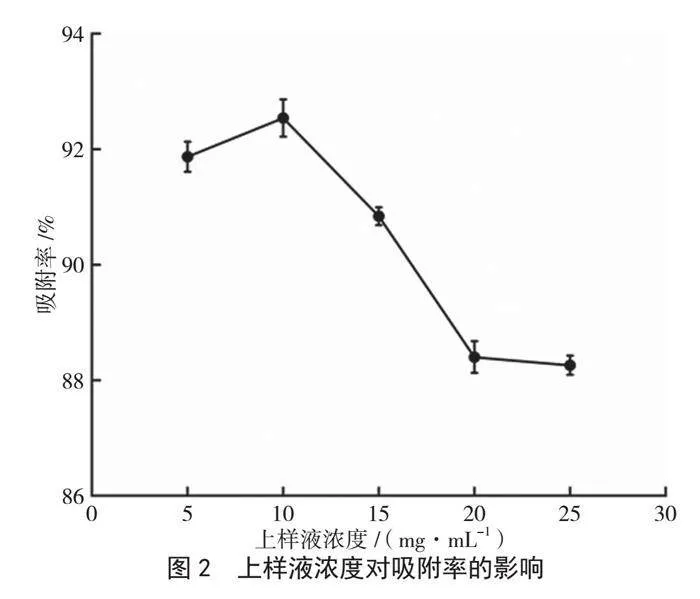
由图2可知,在D-101大孔树脂动态吸附过程中,吸附率随上样液浓度的增大而先升高后降低。当上样液浓度小于10 mg·mL-1时,吸附率持续增大,直至浓度为10 mg·mL-1时达到峰值,而后吸附率开始减小。这可能是由于上样液浓度较小时,所产生的吸附推动力小,导致吸附速率低,体系中的树脂在同时间内对黄酮的吸附率较小;上样液浓度过大时,杂质含量增加,其与黄酮竞争树脂的吸附活性位点,且易堵塞层析柱滤膜,导致吸附率降低[12]。因此,选择10 mg·mL-1为最佳上样液浓度。
2.2.2 上样液pH值的确定
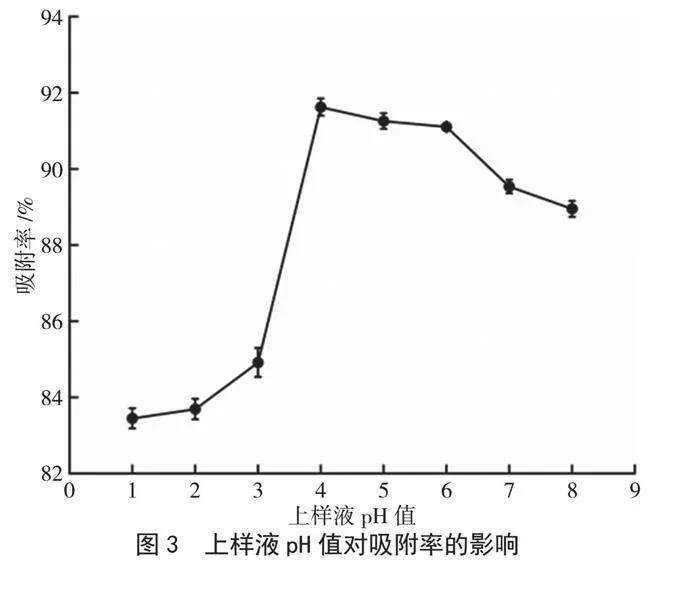
由图3可知,在D-101大孔树脂动态吸附过程中,吸附率随上样液pH值的增加呈现先上升后下降的趋势。当pH值在4~6时,吸附率在91.62%~91.11%,变化不明显;当pH值大于6时,吸附率明显降低。这可能是由于黄酮类化合物结构中存在大量酚羟基,呈弱酸性,当酸度过高时,易以“佯盐”形式存在;当酸度过低时,便会形成离子态,两种情况都会影响树脂对云南核桃分心木黄酮的吸附[13]。由于云南核桃分心木黄酮粗提物水溶液的pH值为6,综合考虑,选择pH=6进行上样。
2.2.3 上样液流速和体积的确定
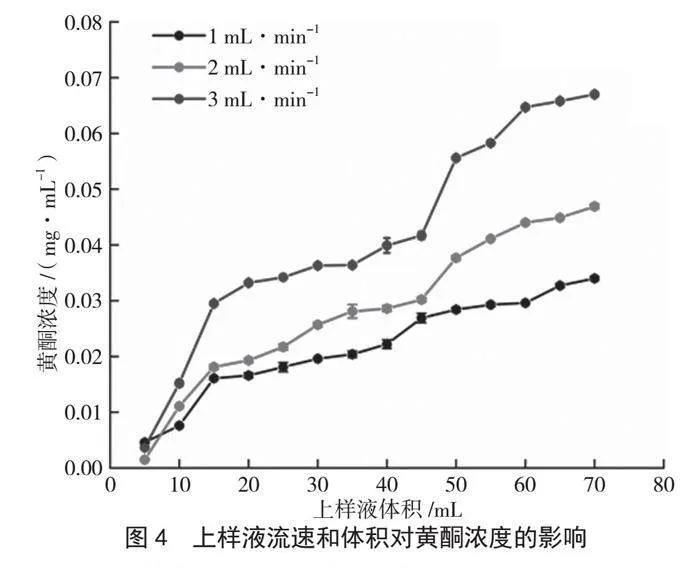
通常,流出液中黄酮浓度达到上样液中黄酮浓度10%时认为开始泄漏[13](当上样液浓度为
10 mg·mL-1时,上样液中黄酮浓度为0.22 mg·mL-1,故泄漏点为0.022 mg·mL-1)。由图4可知,上样液流速为3 mL·min-1时,因速率过快,泄漏点最早出现,此时云南核桃分心木黄酮可能与树脂未充分接触;上样液流速为1 mL·min-1时,泄漏点最晚出现,此时云南核桃分心木黄酮被树脂充分吸附,但周期较长,会降低纯化过程的效率[14]。因此,选择2 mL·min-1为最适上样液流速。在该流速下,上样液体积为
25 mL时达到泄漏点。上样液体积为25~40 mL时,黄酮浓度未发生明显变化(上样液体积为40 mL时,流出液中黄酮浓度为0.029 mg·mL-1),表明泄露量变化不明显。考虑到实验操作效率与时间成本,选择40 mL为上样液体积,此时泄露率不超过3%。
图4 上样液流速和体积对黄酮浓度的影响
2.3 大孔树脂动态解吸实验结果
2.3.1 洗脱液体积分数的确定
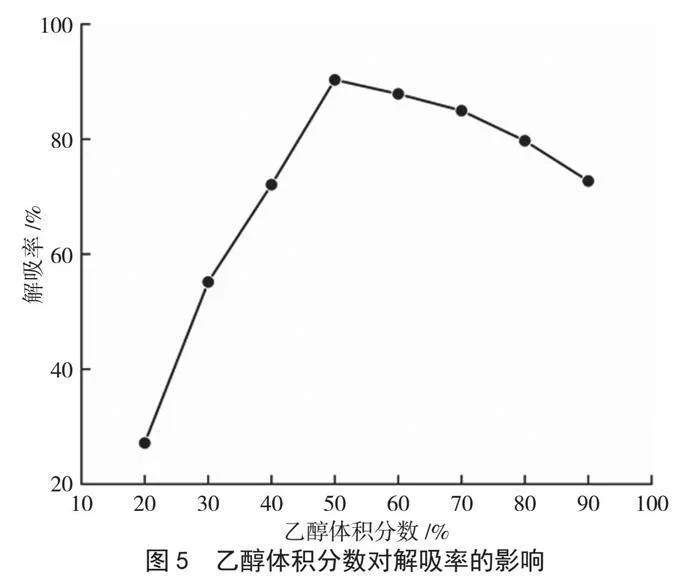
由图5可知,乙醇体积分数在20%~50%时,云南核桃分心木黄酮的解吸率逐渐升高;当体积分数为50%时,解吸率达到最高(90.31%);继续增大乙醇体积分数,树脂中醇溶性杂质大量溶出至洗脱液,从而降低了黄酮的解吸率。树脂与黄酮间存在一定的范德华力,二者的极性越相近,范德华力越大[14]。因此推测体积分数为50%的乙醇溶液可能与云南核桃分心木黄酮的极性最相近,洗脱效果较好。
图5 乙醇体积分数对解吸率的影响
2.3.2 洗脱液pH值的确定
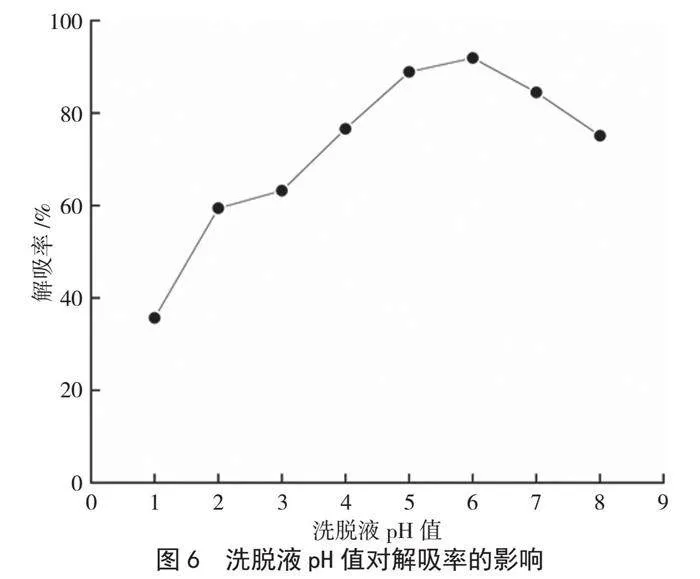
由图6可知,洗脱液pH值在1~8时,树脂中云南核桃分心木黄酮的解吸率随洗脱pH值的增大呈现先升高后降低的趋势,当洗脱液pH值为6时,解吸率达到峰值,继续增大洗脱pH值,解吸率呈现下降趋势。这可能是由于云南核桃分心木黄酮粗提物水溶液pH值为6,呈现弱酸性,弱酸性的条件有助于D-101大孔树脂对黄酮的解吸。因此,选择pH=6进行洗脱。
图6 洗脱液pH值对解吸率的影响
2.3.3 洗脱液流速和体积的选择
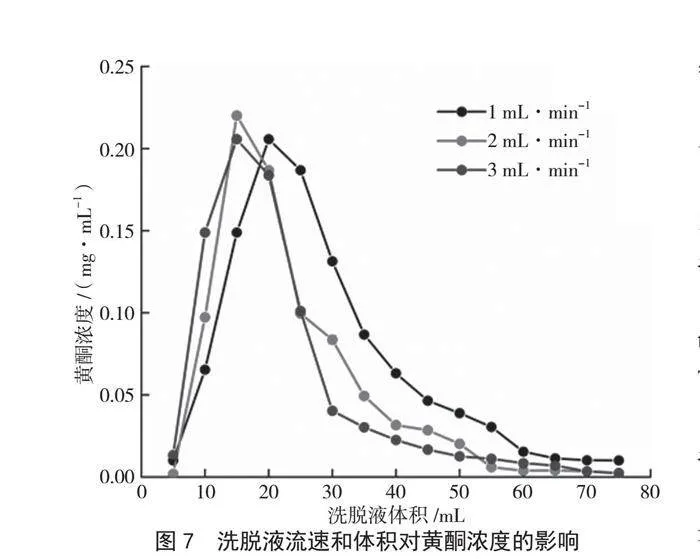
由图7可知,当洗脱液流速为1 mL·min-1时,流速较慢,洗脱时间较长;当洗脱液流速为
3 mL·min-1时,流速较快,洗脱时间短,但洗脱效果不及2 mL·min-1。因此,选择2 mL·min-1为最适洗脱液流速。当流速控制在2 mL·min-1,洗脱液体积消耗至75 mL时,溶液中黄酮浓度为0.002 mg·mL-1,表明吸附在树脂上的黄酮已基本被洗脱完全。为了保证产物的回收率,选择洗脱液体积为75 mL,洗脱液流速控制在2 mL·min-1。
2.4 纯化前后总黄酮含量的变化
以上述纯化工艺条件进行实验,纯化前后溶液中总黄酮含量从41%提高至72%。结果表明,该工艺条件分离纯化效果较好,操作可行。
3 结论
本研究采用6种大孔树脂对云南核桃分心木黄酮进行静态吸附及解吸实验,筛选出吸附率及解吸率较好的D-101大孔树脂并进行云南核桃分心木总黄酮纯化工艺研究。结果表明,当上样液浓度为10 mg·mL-1、上样液pH值为6、上样液流速为
2 mL·min-1、上样液体积为40 mL以及乙醇洗脱液体积分数为50%、洗脱液pH值为6、洗脱液流速为
2 mL·min-1、洗脱液体积为75 mL时,云南核桃分心木总黄酮含量从41%提高至72%。本研究可为云南核桃分心木黄酮的纯化工艺提供一定理论支撑。但本研究只通过单因素实验初步确定了黄酮的纯化工艺,后续可进行响应面实验进一步对实验条件进行优化,以期提高云南核桃副产物的加工利用水平。
参考文献
[1]谢蕾,李贤忠,宁德鲁,等.深纹核桃种质资源评价与挖掘研究进展[J].林业科技通讯,2021(11):26-31.
[2]何旭华,王超,彭小伟,等.云南核桃分心木不同极性提取物纯化及抗氧化活性分析[J].食品科技,2022,47(10):217-224.
[3]TAN J Y,CHENG Y G,LI J L,et al.New taraxasterane-type triterpenes from Diaphragma juglandis fructus[J].Tetrahedron Letters,2022,100:153868.
[4]何旭华,阚欢,黄陆繄,等.云南核桃分心木黄酮提取及抗氧化性研究[J].现代食品,2020(19):204-209.
[5]MENG Q R,WANG Y Q,CHEN F,et al.Polysaccharides from Diaphragma juglandis fructus: extraction optimization, antitumor, and immune-enhancement effects[J].International Journal of Biological Macromolecules,2018,115:835-845.
[6]王丹.核桃分心木化学成分分离鉴定及抗炎活性研究[D].泰安:山东农业大学,2018.
[7]赵娟娟.分心木黄酮超声-微波协同提取及抗氧化性研究[J].食品研究与开发,2018,39(18):70-76.
[8]王玲玲,边祥雨,高蔚娜,等.植物类黄酮提取纯化技术研究进展[J].营养学报,2019,41(6):606-610.
[9]罗磊,姬青华,马丽苹,等.NKA-9大孔树脂对绿豆皮黄酮的纯化研究[J].中国食品学报,2019,19(6):157-167.
[10]陈素雯,邱思娃,蔡延渠,等.大孔树脂对龙脷叶总黄酮的纯化工艺及其吸附特性研究[J].应用化工,2021,50(2):340-344.
[11]晏俊玲,樊扬,秦川,等.苦竹笋总黄酮大孔树脂纯化工艺及其体外抗炎活性研究[J].食品与发酵工业,2020,46(23):184-192.
[12]马娟娟.山楂叶黄酮的提取、纯化及分离技术研究[D].泰安:山东农业大学,2016.
[13]WU S H,WANG Y Y,GONG G L,et al.Adsorption and desorption properties of macroporous resins for flavonoids from the extract of Chinese wolfberry (Lycium barbarum L.)[J].Food and Bioproducts Processing,2015,93:148-155.
[14]金慧鸣,郭红英,谭兴和,等.大孔吸附树脂—聚酰胺联用纯化茅岩莓总黄酮工艺优化[J].食品科学,2016,37(12):13-18.
