基于生物信息学验证海桐皮-透骨草抑制炎性软骨细胞铁死亡的作用机制
2025-02-13徐梦雨吴天菊黄璐刘鑫赵佳荣游元元



摘要:基于生物信息学验证海桐皮-透骨草(复方海桐皮)抑制脂多糖(LPS)诱导的大鼠炎性软骨细胞铁死亡的作用机制。通过生物信息学工具预测骨关节炎铁死亡的相关作用机制,确定待验证通路。利用相关试剂盒检测亚铁离子浓度、还原型谷胱甘肽(GSH)质量分数;利用酶联免疫法(ELISA)检测加药后细胞活力和相关细胞因子IL-1β、IL-6、TNF-α的质量浓度;蛋白免疫印迹法(Western -Blot)检测各组NLRP3炎症小体通路相关的蛋白NLRP3、Caspase-1、ASC以及抑制铁死亡的基因GPX4蛋白表达水平。结果发现亚铁离子浓度显著降低,GSH质量分数显著升高;ELISA实验结果显示,药物各组与模型组相比IL-1β、IL-6、TNF-α炎症因子质量浓度均降低;WB结果显示,药物各剂量组与模型组相比,NLRP3、Caspase-1、ASC蛋白表达水平显著降低,GPX4蛋白表达水平显著升高。复方海桐皮可以通过介导NLRP3炎症小体通路对炎性软骨细胞的铁死亡进行干预,从而达到治疗骨关节炎的目的。
关键词:骨关节炎;铁死亡;海桐皮-透骨草;生物信息学;NLRP3炎症小体通路
中图分类号:R285;R289""" 文献标志码:A""" 文章编号:1002-4026(2025)01-0023-09
开放科学(资源服务)标志码(OSID):
DOI:10.3976/j.issn.1002-4026.20240049【药理与毒理】
收稿日期:2024-03-30
基金项目:国家中医药管理局全国名老中医药专家传承工作室建设项目(国中医药人教函[2019]41号);成都医学院应用开发与成果转化培育项目(CYCG19-01);四川省大学生创新训练项目(S202313705037)
作者简介:徐梦雨(2003—), 女,本科,研究方向为药学。E-mail:2459331059@qq.com
*通信作者,游元元(1974—),女,博士,教授,研究方向为中药品质与药效。E-mail:ym633@sina.com,Tel:15308089262
Bioinformatics-based verification of the mechanism of Haitongpi-Tougucao
in inhibiting ferroptosis in inflammatory chondrocytes
XU Mengyu,WU Tianju,HUANG Lu,LIU Xin,ZHAO Jiarong,YOU Yuanyuan*
(School of Pharmacy, Chengdu Medical College, Chengdu 610500, China)
Abstract∶Based on bioinformatics, this study validates the mechanism of action of Haitongpi-Tougucao (compound Haitongpi) in inhibiting lipopolysaccharide (LPS)-induced ferroptosis in rat inflammatory chondrocytes. Bioinformatics tools were used to predict the mechanism of action of ferroptosis in osteoarthritis and identify pathways for validation. The key techniques used were as follows: the detection of ferrous ion content and reduced glutathione (GSH) content using relevant kits; the detection of cell viability and the levels of related cytokines IL-1β, IL-6, and TNF-α using the enzyme-linked immunosorbent assay (ELISA) after dosing; and the use of protein immunoblotting (western blot, WB) to detect the protein expression levels of NLRP3, Caspase-1, ASC, and GPX4, a gene that inhibits ferroptosis, related to the NLRP3 inflammasome pathway in each group. The results revealed that the ferrous ion content was significantly decreased,while the GSH content was significantly increased; the ELISA experiment showed that the levels of inflammatory factors IL-1β, IL-6, and TNF-α were decreased in each group administered with the drug compared with those in the model group; the WB results showed that the expression levels of NLRP3, Caspase-1, and ASC proteins were significantly decreased and GPX4 protein expression levels were significantly increased in each group administered with a specific dosage of the drug compared with those in the model group. Therefore, the compound Haitongpi can intervene in the ferroptosis of inflammatory chondrocytes by mediating the NLRP3 inflammasome pathway, thereby achieving the purpose of osteoarthritis treatment.
Key words∶osteoarthritis; ferroptosis; Haitongpi-tougucao; bioinformatics; NLRP3 inflammasome pathway
骨关节炎(osteoarthritis,OA)是一种好发于中老年人的慢性关节性疾病,临床表现为关节部位的疼痛、僵硬、肿胀或畸形[1],其发病率随年龄增长而增高。我国已步入老龄化社会,叠加肥胖等危险因素,OA患病人群会进一步增加[2]。目前OA尚无根治方法,西医临床的用药目标是以控制疼痛、缓解症状为主,但长期用药毒副作用较明显[3-4]。
骨关节炎属中医理论中的“骨痹”,中医临床有丰富的治疗经验,其中海桐皮、透骨草两味中药既是熏洗法治疗OA的经典名方“海桐皮汤”中的主要药味[5],也是与其它中药配伍外治OA的高频药物[6-7]。海桐皮为袪风逐湿之品,能除风湿之害,理腰膝之疼[8];透骨草具暖筋透骨之效,可洗风寒湿痹,缓筋骨疼痛[9]。但二者治疗OA的作用机制尚不明确。
现代研究发现OA与铁死亡具有一定相关性[10-11]。铁过载可调动关节软骨细胞的氧化应激反应,使细胞内活性氧含量激增,激活NLRP3炎症小体通路,继而诱导细胞铁死亡[12-13]。本研究借助生物信息学手段筛选OA与铁死亡相关的潜在靶点与通路,并通过细胞学实验验证海桐皮-透骨草抑制炎性软骨细胞铁死亡的作用机制,以期为两味中药的临床合理应用提供依据。
1" 实验材料
1.1" 药材
海桐皮采自成都医学院校园内,凤仙透骨草购自荷花池药材市场。经成都医学院药学院游元元教授鉴定,分别为豆科植物刺桐Erythrina variegata L.的树皮、凤仙花科植物凤仙花Impatiens balsamina L.的干燥茎。
1.2" 细胞株
SD大鼠膝关节软骨细胞购于广州吉妮欧生物科技有限公司。
1.3" 试剂
细胞增殖活性检测试剂盒(Cell Counting Kit-8,批号K1018,APEXBIO);TNF-α酶联反应试剂盒(R1393H061,20220606,FineTest);IL-1β酶联反应试剂盒(R1393G059,20220606,FineTest);IL-6酶联反应试剂盒(R1393G062,20220606,FineTest);还原型谷胱甘肽(GSH)含量检测试剂盒(20221221,索莱宝);亚铁离子比色法测试盒(20230627,Elabscience);BCA蛋白浓度测定试剂盒(BL521A,20221101,Biosharp);兔抗鼠GPX4单克隆抗体(20230109R,DF6701,Affinity Biosciences);兔抗鼠NLRP3单克隆抗体(20230109R,DF5418,Affinity Biosciences);兔抗鼠Caspase-1单克隆抗体(20230109R,DF6252,Affinity Biosciences);兔抗鼠TMA1/ASC单克隆抗体(20230109R,DF6304,Affinity Biosciences);兔抗鼠IL-18单克隆抗体(20230109R,DF6346,Affinity Biosciences);羊抗兔 IgG(H+L)二抗试剂盒(20230109R,DF5096,Affinity Biosciences)。
1.4" 仪器
荧光倒置显微镜(AE2000,中国Motic);多功能酶标仪(SpectraMax Mini,美国Molecular Devices);流式细胞仪(NovoCyte 2060R,艾森生物);生物安全柜(1300型I级A2型,美国Thermo Fisher Scientific);CO2培养箱(Thermo Froma 3111,美国Thermo Fisher Scientific);垂直电泳仪及转印系统(Mini-PROTEAN Tetra,美国Bio-Rad );凝胶图像处理系统(Universal Hoof V,美国Bio-Rad);恒温培养振荡器(ZHWY-200B,上海智城公司)。
2" 实验方法
2.1 "生物信息学处理方法获取研究靶点
利用FerrDb v2数据库(http://www.zhounan.org/ferrdb/)检索铁死亡相关靶点基因,包括Driver(促进铁死亡的基因)、Suppressor(抑制铁死亡的基因)、Marker(指示铁死亡发生的基因)。利用GeneCard数据库(https://www.genecards.org/)、DisGeNET数据库( https://www.disgenet.org/)OMIM 数据库(https:// www.Omim. org/)、PharmGKB数据库(https://www. pharmgkb. org/)、TTD数据库(http://db. idrblab. net/ttd/)搜集OA的相关靶点基因。利用UniProt数据库将查询到的疾病靶点转换为UniProt ID,通过BioinfoGP数据库(https://bioinfogp.cnb.csic.es/tools.html)的在线工具Venny 2.1软件对铁死亡相关靶点与OA的相关靶点基因整合取合集,得到铁死亡与OA相关联的靶点,通过KEGG分析后筛选得到潜在信号转导通路。
2.2 "药液制备
取海桐皮、透骨草粗粉各约2.0 g,1:1配伍,采用体积分数75%乙醇加热回流提取两次,每次60 min,浓缩提取液为干浸膏。取浸膏50 mg,精密称定,二甲基亚砜(DMSO)溶解。按照DMSO占比千分之一的比例,加入99.9 mL含血清完全培养基配制成含药0.5 μg/mL的培养基,0.22 μm微孔滤膜过滤除菌后作为给药组的含药母液,4 ℃低温冷藏。
将母液浓度为100 mmol/mL的N-乙酰-L-半胱氨酸配置成浓度为10 mmol/mL的含药培养基过滤除菌后作为阳性对照组细胞的培养液,4 ℃低温避光冷藏。
2.3" 实验分组和炎症模型的建立
第8代软骨细胞铺于6孔板和96孔板于37 ℃培养箱中孵育培养48 h,待细胞铺满各孔底80%~90%后观察其细胞形态并记录。结合预实验确定由脂多糖诱导的炎性关节软骨细胞的最佳造模质量浓度为200 μg/mL。将6孔板细胞分别设置为空白组(Blank)、阳性对照组(Positive Control)、模型组(Model)、高剂量组(High)、中剂量组(Middle)及低剂量组(Low)。96孔板细胞分别设置为空白组、阳性对照组、模型组以及17个梯度浓度组。除空白组加入空白培养基外,其余各组孔均加入200 μg/mL脂多糖的细胞培养液,培养箱培养24 h后观察并记录细胞形态。
2.4" 药物最佳治疗浓度确定
待2.3节铺得的96孔板细胞培养24 h,使用PBS洗涤后向空白组和模型组中加入空白培养基100 μL,向阳性对照组中加入浓度为10 mmol/mL的阳性药物培养基100 μL。其余17个药物梯度浓度组分别加入预设定药物质量浓度的培养液100 μL(预设质量浓度分别为1、2、5、10、20、30、40、50、60、70、80、90、100、200、300、400、500 ng/mL),除空白组和模型组复孔数为3外,其余药物组复孔数为5。培养24 h后使用Cell Counting Kit-8(CCK-8)法检测细胞增殖毒性指标以确定最适药物浓度范围。
2.5" 细胞分组给药
根据CCK-8实验所测得结果,选取OD值前三的药物组分别设置为本实验给药方案中的高剂量、中剂量、低剂量组。使用2.2节所铺6孔板细胞分组给药。
2.6" 铁死亡指标检测
2.6.1" ELISA检测炎症因子指标
按照检测试剂盒方法检测各药物组细胞上清液中IL-1β、TNF-α及IL-6的表达量。
从室温平衡 20 min 后的铝箔袋中取出所需板条。设置标准品孔和样本孔,标准品孔各加不同质量浓度的标准品50 μL。样本孔先加待测样本10 μL,再加样本稀释液40 μL,空白孔不加。除空白孔外,标准品孔和样本孔中每孔加入辣根过氧化物酶(HRP)标记的检测抗体100 μL,用封板膜封住反应孔,37 ℃恒温箱温育 60 min。弃去液体,吸水纸上拍干,每孔加满洗涤液,静置1 min,甩去洗涤液,吸水纸上拍干,如此重复洗板5次。每孔加入底物A、B各50 μL,37 ℃避光孵育15 min。每孔加入终止液50 μL,15 min 内在450 nm 波长处测定各孔的OD值。在Excel 工作表中,以标准品质量浓度作横坐标,对应OD 值作纵坐标,绘制出标准品线性回归曲线,按曲线方程计算各样本质量浓度值。
2.6.2" 亚铁离子浓度检测
按照亚铁离子比色法测试盒说明书测定样品中亚铁离子浓度。
收集细胞到离心管内,离心后弃上清,取约5×106个细胞加入1 mL 提取液,超声波破碎细胞(冰浴,功率200 W,超声3 s,间隔10 s,重复30次),12 000 r/min,4 ℃离心10 min,取上清测定。酶标仪预热 30 min, 设定波长到562 nm。所有试剂解冻至室温,在测定管中加入样本120 μL、试剂二
260 μL、试剂三20 μL;标准管中加入标准品120 μL、试剂二260 μL、试剂三20 μL;空白管中加入蒸馏水120 μL、试剂二260 μL、试剂三20 μL。充分混匀,置室温15 min 后,取200 μL上清液至96孔板中,于波长 562 nm 处读取各管吸光度。按照下式计算亚铁离子浓度(μmol/L):
亚铁离子浓度=[(y-b)/a]×4,
其中,a、b、y为标准品拟合曲线y=ax+b。
2.6.3" 还原型谷胱甘肽含量检测
按照谷胱甘肽测定试剂盒说明书测定样本中谷胱甘肽的质量分数。
按照细胞数量(106个):试剂一体积(mL)10:1的比例反复冻融3次,8 000 r/min离心10 min,取上清置于冰上待测。酶标仪预热30 min以上,调节波长至412 nm。吸取10 mg/mL 标准溶液,用蒸馏水稀释至300、200、100、50、25 μg/mL。在测定孔中加入样本20 μL、试剂二140 μL、试剂三40 μL;标准孔中加入标准溶液20 μL、试剂二140 μL、试剂三40 μL;空白孔中加入蒸馏水20 μL、试剂二140 μL、试剂三40 μL。混匀后常温静置2 min 后测定412 nm 处各孔的
光密度,分别记为ODm(测量孔光密度)、ODb(空白孔光密度)、ODs(标准孔光密度),计算△OD=ODm-ODb,△ODs=ODs-ODb。 据标准管的质量浓度(x,μg/mL)和吸光度△OD标准(y,△ODs),建立标准曲线。
GSH质量分数(μg/mg) =x ×V样/(V样×Cpr) =x/Cpr,
其中,V样为加入体系中上清液体积,mL;Cpr为上清液蛋白质质量浓度,mg/mL,需要另外测定。
2.6.4" 蛋白免疫印迹法测定软骨细胞NLRP-3炎症小体蛋白表达
提取细胞蛋白,使用BCA蛋白定量试剂盒测定蛋白浓度。取定量后等质量的6组蛋白上样,电泳仪电压设置为100 V,运行20 min后降为150 V,运行70 min至分
离胶底部结束电泳。以100 mA的稳定电流、90 min的运行条件将蛋白转移至PVDF膜上后置于封闭液中,摇床室温封闭1.5 h,TBST清洗6次,每次5 min。分别置于NLPRP-3(稀释比例为1∶
2 000)、ASC(稀释比例为1∶2 000)、Caspase-1(稀释比例为1∶2 000)的一抗溶液中,4 ℃摇床孵育16 h。TBST清洗6次,每次5 min。置于二抗溶液(稀释比例为1∶5 000),摇床常温孵育2 h,TBST清洗6次,每次5min。化学凝胶成像发光仪曝光测定目的蛋白的表达程度。
2.7" 统计分析
使用SPSS 21.0统计软件对实验样品进行统计数据分析,x±s表示计量的数据资料,方差分析比较两个样本之间的差异性,以样本数据中的Plt;0.05或Plt;0.01表示得出的差异资料具有统计学意义。
3" 结果与结论
3.1" ROS-NLRP3炎症小体信号
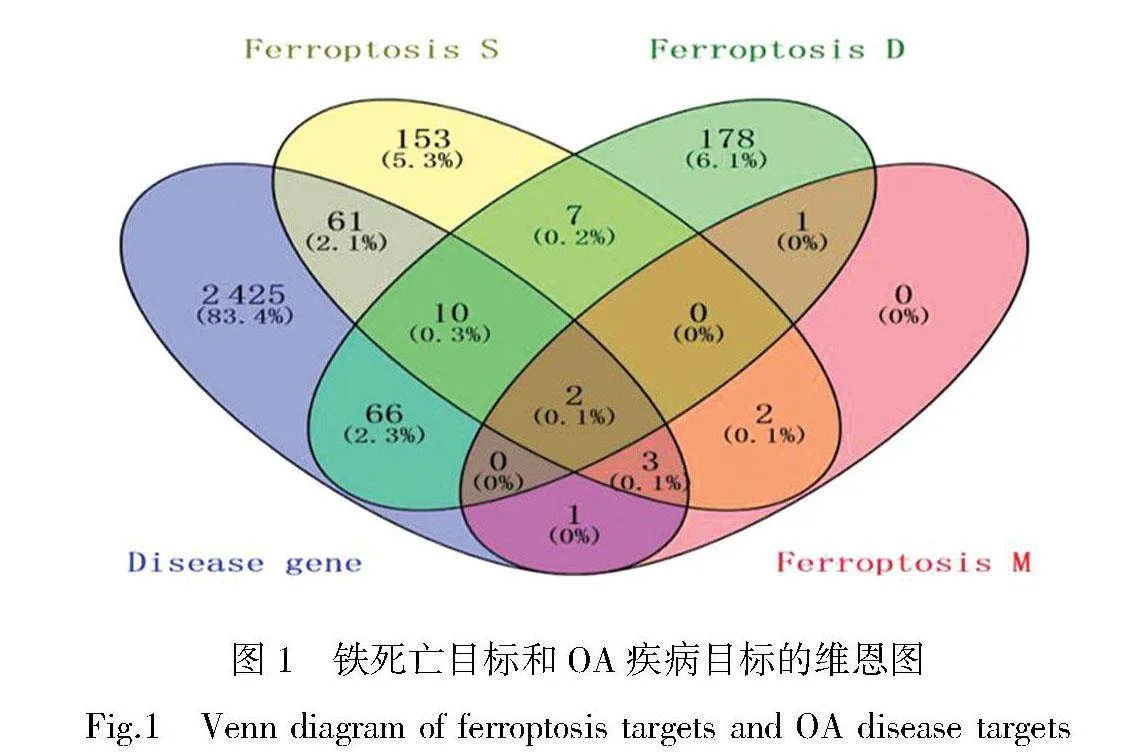
从FerrDb v2数据库中共搜集整合到与铁死亡有关的靶点486个。从5个疾病靶点数据库中搜集、整合、筛选到2 568个共有靶点与OA的发生或发展有关。Venny 2.1软件对铁死亡靶点与OA的相关靶点基因取交集,得到铁死亡与OA关联靶点分析网络并绘制Venn 图(图1),分析结果得到潜在交集靶点共有143个,交集程度较高的几个靶点为IL-6、HIF1A、TP53、PIK3CA、HMOX1、SMPD1、TF、G6PD、ATF4、IL-1β、IL-18、TNF-α等。KEGG通路富集分析结果筛选得到66条信号转导通路,包括生理代谢通路、激素生成调节通路、坏死通路、NLRP3炎症小体通路、癌症信号通路、胃泌素通路、细胞对氮化合物的反应等,其中NLRP3炎症小体信号通路与骨关节炎铁死亡、凋亡、焦亡、氧化应激、坏死等多种生物过程有关,骨关节炎发展过程的NLRP3炎症小体信号通路包含NLRP3炎症小体/IL-1β通路和NLRP3炎症小体级联通路,NLRP3炎症小体通路图结果见OSID科学数据与内容附图1。
3.2" 确定海桐皮-透骨草的最佳给药质量浓度
根据OD值设置高、中、低剂量组,利用荧光倒置显微观测正常软骨细胞和LPS诱导炎症24 h后的软骨细胞形态,与正常软骨细胞相比,诱导后软骨细胞多呈球状,而正常细胞多呈现梭形。通过细胞形态的变化可判断炎症造模成功。
选取造模成功的细胞96孔板孵育40 min,使用酶标仪重复测量细胞OD值3次,取3次测量结果的平均值,结果如图2所示。模型组细胞OD值明显低于空白组,说明细胞存活率明显降低。药物质量浓度为1~100 ngmL范围内的药物组细胞OD值均大于模型组,说明在该质量浓度范围内的药物有一定抗炎作用。其中质量浓度为20和10 ng/mL的实验组测定OD值均大于阳性对照组,推测海桐皮配伍透骨草的最佳治疗浓度在此范围之间。选取OD值前三的药物质量浓度20、10、2 ng/mL分别设置为高、中、低剂量组,为后续试验探究复方海桐皮对炎性软骨细胞铁死亡的干预作用是否呈现量效关系提供依据。
3.3" 药物组存活率随药物浓度增大而提高
各组给药24 h后,利用流式细胞仪检测细胞存活状态,结果如图3所示。阳性对照组存活率最高,模型组存活率最低,空白组存活率低于阳性对照组,高于药物组。药物组存活率随浓度增加而增加。
3.4" 炎症因子水平变化
按照测定结果,绘制标准曲线得
IL-1β: y=1.375 63+8.656 35 x+15.670 34 x2,r=0.999 0;
IL-6: y=0.434 58+14.595 3 x+9.532 53 x2,r=0.999 6;
TNF-α: y=0.102 74+58.531 36 x+46.017 06 x2,r=0.999 4。
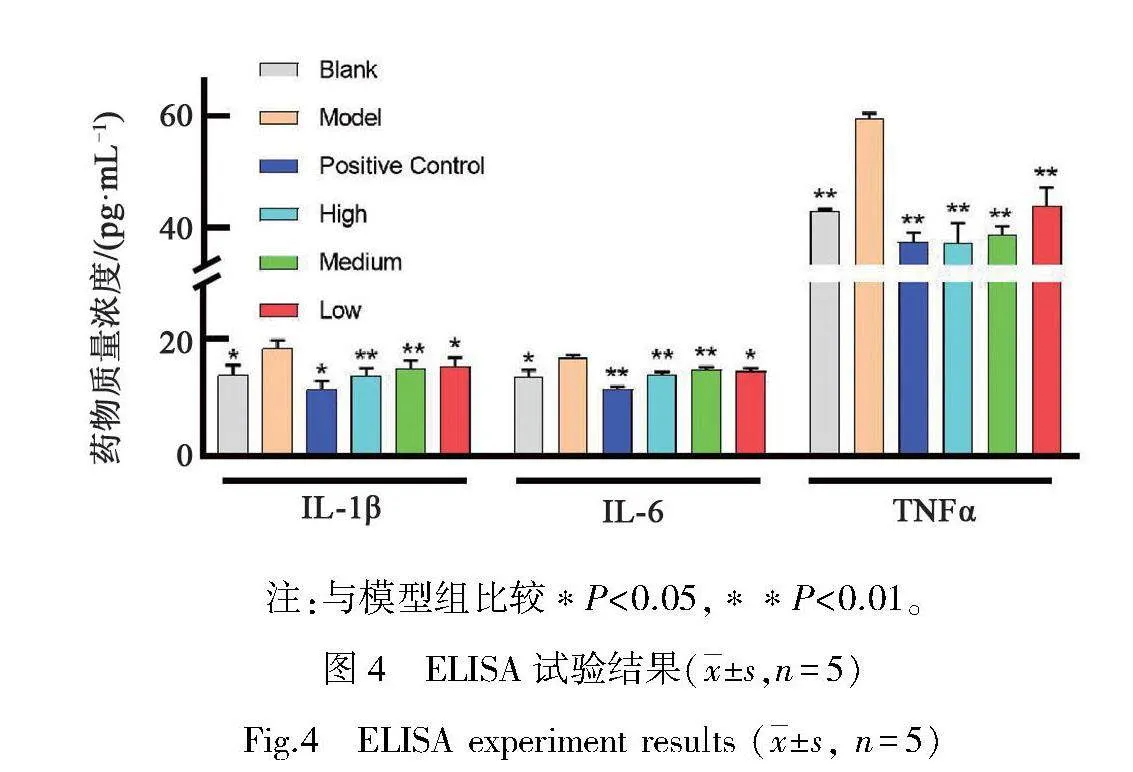
根据标曲和吸光度值计算各实验组炎症因子表达情况,模型组软骨细胞中IL-1β、IL-6、TNF-α质量浓度明显高于各组。用阳性药物或者不同质量浓度药物进行干预后,各药物组软骨细胞中IL-1β、IL-6、TNF-α表达量均明显下降,各炎症因子含量下降趋势呈现一定量效关系,含药质量浓度越高下降趋势越明显,结果见图4所示。
3.5" 铁死亡相关指标检测结果
3.5.1" 亚铁离子浓度变化
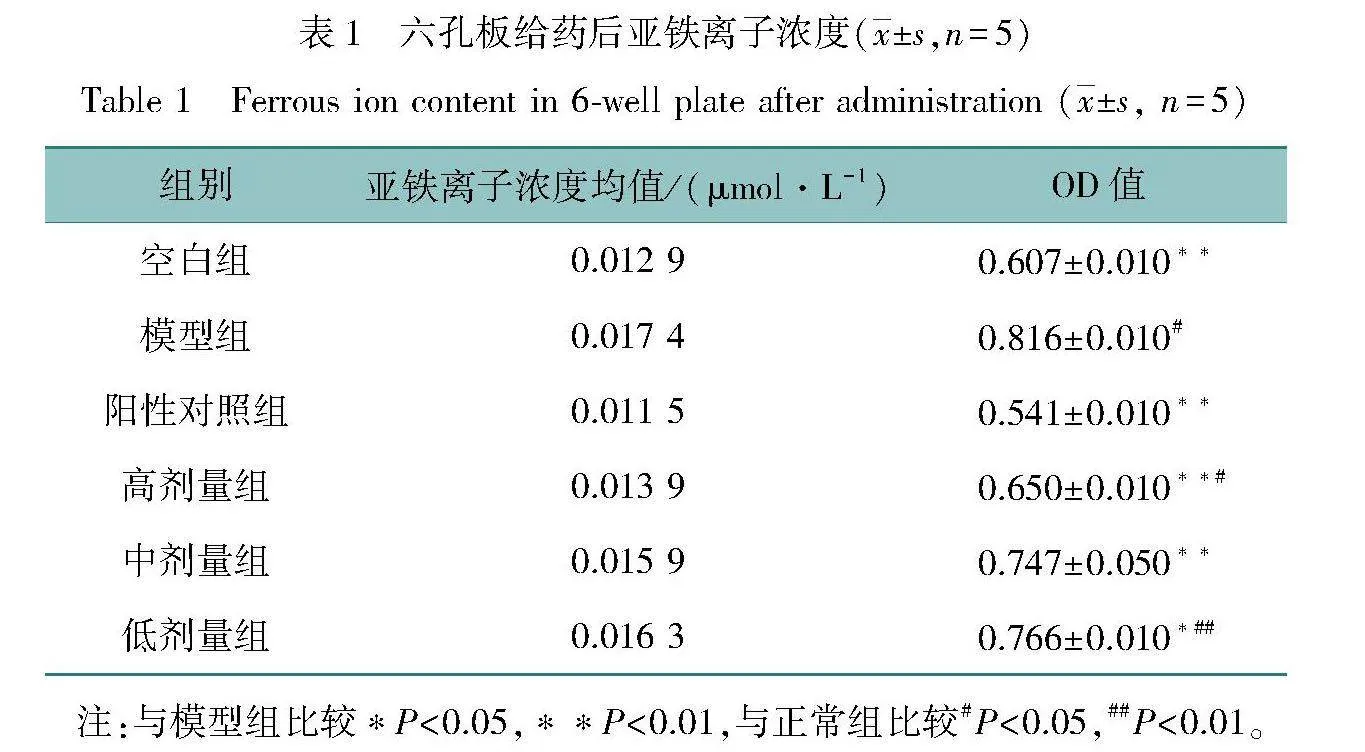
测定不同亚铁离子浓度标准样品OD值,绘制标准曲线y=0.018 7x -0.002 5,r=0.999。按同样方法测定待测样品OD值,并计算样品亚铁离子浓度,结果如表1所示。模型组的亚铁离子浓度较空白组有显著提高,阳性组在阳性药物干预下亚铁离子浓度下降较为明显,药物组降低亚铁离子浓度具有一定量效关系,随给药剂量提高,亚铁离子降低趋势更明显。
3.5.2" GSH(谷胱甘肽)质量分数变化
测定GSH不同质量分数标准样品OD值,绘制标准曲线y=0.002 1x -0.002 6,r=0.999 8(y为△OD=ODm-ODb)。按同样方法测定待测样品OD值,并根据实验试剂盒结果计算方法,计算样品GSH质量分数,结果如表2所示。模型组的GSH质量分数较空白组有显著降低,阳性组在阳性药物干预下GSH质量分数升高较为明显,实验药物组升高GSH质量分数具有一定量效关系,随给药剂量提高,GSH升高趋势更明显。
3.6" 药物质量浓度对ROS-NLRP3炎症小体信号的影响
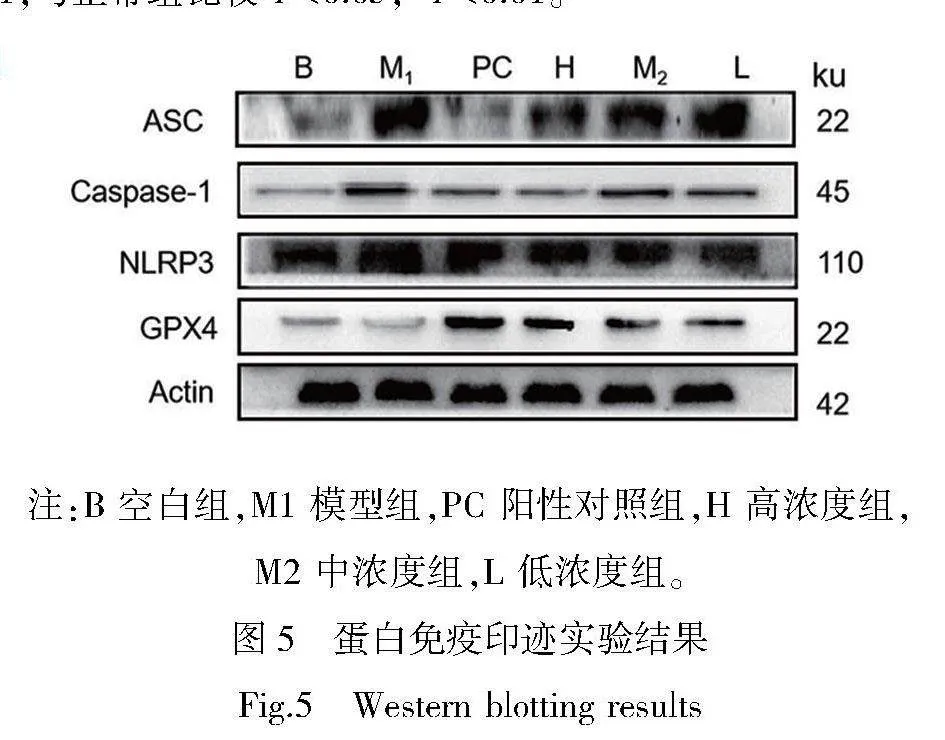
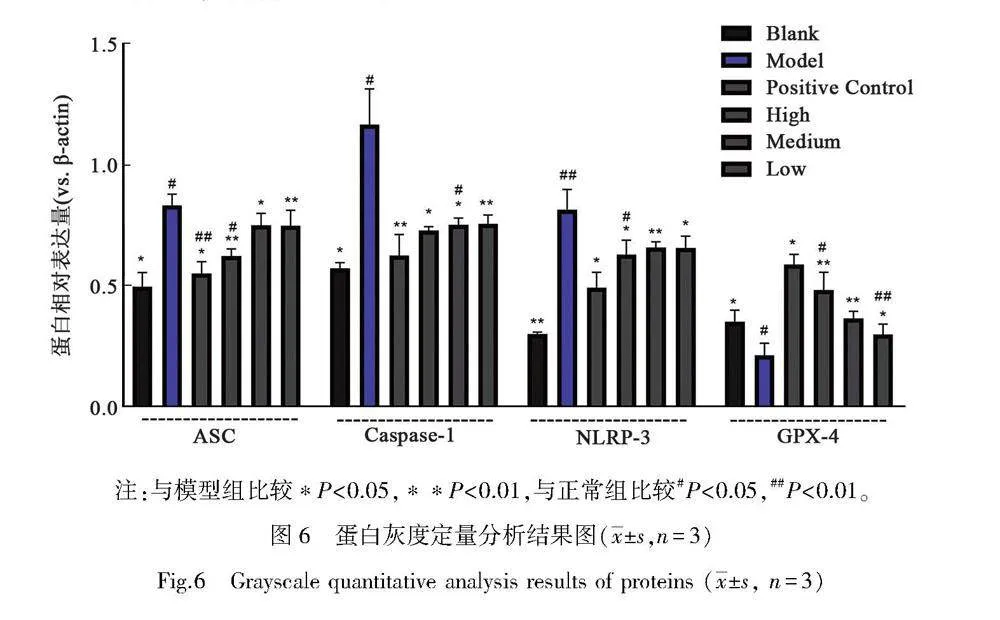
WB条带结果如图5所示,灰度定量分析结果如图6所示。模型组中NLRP3、Caspase-1、ASC蛋白表达量上调,高于正常组,说明ROS-NLRP3通路蛋白表达较高。灰度分析发现,阳性对照组中蛋白表达量与空白组接近,说明阳性对照药物对LPS致炎的软骨细胞ROS-NLRP3通路表达有抑制作用。3个剂量的药物组,NLRP3、caspase-1、ASC蛋白表达量均有所下降。除Caspase-1组的中剂量组表达略高于低剂量组,其他通路蛋白表达下调趋势与浓度有关,药物质量浓度越高,蛋白下调作用越强。而GPX4表达情况与通路蛋白相反,模型组GPX4表达量较低且略低于空白组;阳性对照组GPX4表达上调明显,高于药物组;药物组表达上调趋势呈现浓度依赖,高剂量组促进表达作用更强。说明药浓度较高可能会抑制ROS-NLRP3炎症小体信号通路,抑制炎症进一步发展。同时可能通过该信号通路,调节GPX4的表达,抑制铁死亡的发生与发展。
4" 讨论
中医理论认为OA是因正气亏虚、瘀血阻络、风寒湿邪侵袭等病因病机引起的筋骨失养,常以活血化瘀、祛风散寒、除湿止痛之品疗之。海桐皮通络止痛、祛风除湿,透骨草温经通络、活血止痛,二者均为OA外治法的高频使用药物。清代吴谦所著《医宗金鉴》中收载的经典名方“海桐皮汤”即以此两味药为组方之根本。
与OA病变高相关性通路中,NLRP3炎症小体通路一方面通过激活NF-κB通路,进而上调与炎症小体相关蛋白的表达;另一方面促进炎症小体传感蛋白与炎症小体接头蛋白的聚集,启动NLRP3、IL-1β、IL-18等基因的转录表达,进而引发促炎性细胞死亡[14-16]。另外,斑点样蛋白ASC、Caspase-1等多种基因分子在炎症、细胞凋亡等方面同样发挥着重要作用。本实验主要探讨的机制是基于核苷酸结合寡聚化结构域样受体蛋白3(NLRP3)炎
症小体通路进行。NLRP3 是其炎症小体中关键调控蛋白之一,其激活及其相关分
子调控信号通路与多种疾病的发生、发展密切相关,是临床药物研究开发的前沿热点方向[17-19]。
结合生物信息学工具分析,NLRP3炎症小体通路对于炎性软骨细胞的炎症反应有一定调控作用,且与铁死亡相关联。实验验证该通路的方法是利用蛋白免疫印迹法(WB)验证NLRP3、Caspase-1、ASC等3个蛋白的表达水平,实验结果表明复方海桐皮可显著性降低软骨细胞中上述3种蛋白的表达,当上述3种蛋白表达下调时,细胞炎症因子表达也会相应下调,由此证明复方海桐皮确实可介导NLRP3炎症小体通路实现抗炎目的。但具体是NLRP3炎症小体/IL-1β通路主导还是NLRP3炎症小体级联通路主导仍有待进一步验证。由实验结果推测复方海桐皮可通过介导NLRP3炎症小体通路影响软骨细胞的铁死亡,从而影响细胞炎症发生和发展[20-22]。实验围绕铁死亡和NLRP3炎症小体通路上调进而激发炎症反应的两种机体反应机制探讨复方海桐皮对炎性软骨细胞铁死亡的干预作用,为海桐皮配伍透骨草的临床使用提供了实验依据。
综上所述,海桐皮配伍透骨草可介导NLRP3炎症小体通路抑制炎性软骨的铁死亡。但该实验中海桐皮配伍透骨草发挥上述治疗作用的相关成分靶点尚未完全明确,结合当前研究推测复方海桐皮对炎性软骨细胞铁死亡的干预作用是通过多成分、多靶点、多途径共同调控的结果,后续还需进一步探究。
参考文献:
[1]JIANG Y. Osteoarthritis year in review 2021: Biology[J]. Osteoarthritis and Cartilage, 2022, 30(2): 207-215. DOI: 10.1016/j.joca.2021.11.009.
[2]SUN X S, ZHEN X M, HU X Q, et al. Osteoarthritis in the middle-aged and elderly in China: Prevalence and influencing factors[J]. International Journal of Environmental Research and Public Health, 2019, 16(23): 4701. DOI: 10.3390/ijerph16234701.
[3]KATZ J N, ARANT K R, LOESER R F. Diagnosis and treatment of hip and knee osteoarthritis: A review[J]. JAMA, 2021, 325(6): 568-578. DOI: 10.1001/jama.2020.22171.
[4]RANNOU F, PELLETIER J P, MARTEL-PELLETIER J. Efficacy and safety of topical NSAIDs in the management of osteoarthritis: Evidence from real-life setting trials and surveys[J]. Seminars in Arthritis and Rheumatism, 2016, 45(Suppl 4): S18-S21. DOI: 10.1016/j.semarthrit.2015.11.007.
[5]蓝子江, 毛琦, 吴元元, 等. 海桐皮汤治疗膝骨性关节炎临床研究[J]. 新中医, 2020, 52(17): 38-40. DOI: 10.13457/j.cnki.jncm.2020.17.011.
[6]史鹏博,李慧英,汪利合. 治疗膝骨关节炎方药应用规律探析:基于数据挖掘技术[J].亚太传统医药,2023,19(2):181-185.
[7]张传成, 沈美花, 陈利锋, 等. 中药外用辅助关节镜治疗膝骨关节炎疗效的Meta分析[J]. 华南国防医学杂志, 2022, 36(11): 916-921. DOI: 10.13730/j.issn.1009-2595.2022.11.015.
[8]陆华芳, 沃时佳. 不同浓度及熏洗时间的海桐皮汤治疗膝骨关节炎的临床研究[J]. 全科医学临床与教育, 2022, 20(11): 1035-1037. DOI: 10.13558/j.cnki.issn1672-3686.2022.011.020.
[9]经山. 中药透骨草的化学成分和药理活性研究[J]. 化工设计通讯, 2023, 49(2): 197-199. DOI: 10.3969/j.issn.1003-6490.2023.02.066.
[10]YANG J, HU S S, BIAN Y Y, et al. Targeting cell death: Pyroptosis, ferroptosis, apoptosis and necroptosis in osteoarthritis[J]. Frontiers in Cell and Developmental Biology, 2022, 9: 789948. DOI: 10.3389/fcell.2021.789948.
[11]张雨, 魏志昊, 颜冰. 铁死亡在骨关节炎发生机制和治疗中的研究进展[J]. 中国中西医结合外科杂志, 2023, 29(3): 397-402. DOI: 10.3969/j.issn.1007-6948.2023.03.023.
[12]YAO X D, SUN K, YU S N, et al. Chondrocyte ferroptosis contribute to the progression of osteoarthritis[J]. Journal of Orthopaedic Translation, 2020, 27: 33-43. DOI: 10.1016/j.jot.2020.09.006.
[13]ZHANG S Y, XU J W, SI H B, et al. The role played by ferroptosis in osteoarthritis: Evidence based on iron dyshomeostasis and lipid peroxidation[J]. Antioxidants, 2022, 11(9): 1668. DOI: 10.3390/antiox11091668.
[14]谷依檬, 汤紫薇, 吴艳艳,等. Inflammasomes/caspases通路与细胞焦亡、细胞凋亡在动脉粥样硬化中的不同作用[J]. 中国中医基础医学杂志, 2022(8):1378-1382.
[15]闻雨雅, 董婷, 江张胜, 等. 肝豆灵片通过调节TLR4/NF-KB/NLRP3信号通路减轻肝豆状核变性神经炎症的机制[J]. 山东科学, 2023, 36(4): 42-51. DOI: 10.3976/j.issn.1002-4026.2023.04.006.
[16]陈茜, 刁庆春, 韩晓凤, 等. 加减枇杷清肺饮对ICR小鼠痤疮模型NLRP3炎性小体及其下游因子的影响[J]. 中国中医基础医学杂志, 2019, 25(1): 52-55.
[17]DENG H H, CHEN F Z, WANG Y H, et al. The role of activated NLRP3 inflammatory body in acute kidney injury in rats caused by sepsis and NLRP3-TXNIP signaling pathway[J]. Saudi Journal of Biological Sciences, 2020, 27(5): 1251-1259. DOI: 10.1016/j.sjbs.2020.03.018.
[18]戴婷婷,张芳. 基于NLRP3炎症小体与NF-B信号通路探讨单味中药治疗痛风研究进展[J]. 湖北中医杂志,2022,44(4):51-54.
[19]WANG Y,FAN L,ZHANG JF,et al. Resveratrol inhibited the formation of NLRP3 inflammatory body by activating autophagy signal pathway in atherosclerosis[J]. International Journal of Clinical and Experimental Medicine. 2017,10:16762-16770.
[20]YANG S X, WANG L S, ZENG Y, et al. Salidroside alleviates cognitive impairment by inhibiting ferroptosis via activation of the Nrf2/GPX4 axis in SAMP8 mice[J]. Phytomedicine: International Journal of Phytotherapy and Phytopharmacology, 2023, 114: 154762. DOI: 10.1016/j.phymed.2023.154762.
[21]韩佳瑞,彭紫凝,王学艺,等. 糖尿病肾病血瘀证大鼠铁死亡相关基因GPX4、ACSL4表达水平变化[J]. 安徽中医药大学学报,2023,42(2):78-84.
[22]路丽祯,何双,温菲菲,等. 结直肠癌中Keap1、Nrf2、Gpx4表达与铁死亡的相关性分析及临床意义[J]. 临床与实验病理学杂志,2023,39(2):139-145.
