西洋参中皂苷类成分表征和炮制导致成分转化的研究进展
2025-02-06刘忠英李瑜刘舒后宗汪戎锦











摘要: 西洋参富含多种药理活性物质, 具有保护心血管系统、 改善神经系统疾病和降血糖等多种药理作用, 目前对西洋参中皂苷类成分的结构表征及炮制转化研究取得了显著进展. 总结概括西洋参中皂苷类活性成分的分类和分布、 现代主流分析技术以及炮制加工对皂苷类成分的转化机制, 为西洋参皂苷类成分的深入挖掘和创新炮制技术等提供有效的技术支撑和指导方法, 从而扩大其在医疗和保健等方面的应用.
关键词:" 西洋参; 皂苷; 串联质谱; 炮制加工
中图分类号: R917" 文献标志码: A "文章编号: 1671-5489(2025)01-0229-12
Research Progress on" Characterization of Saponin Components
in American Ginseng and" Component Transformation
Caused by Processing
LIU Zhongying1, LI Yu1, LIU Shu2, HOU Zong2, WANG Rongjin1
(1. College of Pharmacy," Jilin University," Changchun 130021," China;
2. Key Laboratory of Traditional
Chinese Medicine Chemistry and Mass Spectrometry Jilin Province," Changchun Institute of Applied Chemistry,
Chinese Academy of Sciences," Changchun 130022, China)
Abstract:nbsp;" American ginseng was rich in various pharmacological active substances," which had" various" pharmacological effects such as protecting the cardiovascular system," improving neurological diseases," and lowering blood sugar," significant progress had been made in the structural characterization and processing transformation research of saponin components in American ginseng. We summarized the classification and distribution of saponin active components in American ginseng," modern mainstream analytical techniques," and the transformation mechanism of saponin components by processing,"" providing effective technical support and methodological guidance for the in-depth exploration of saponin components in American ginseng and innovative processing techniques," thereby expanding its applications in medical treatment," health care" and other aspects.
Keywords: American ginseng;" saponin;" tandem mass spectrometry; processing and preparation
西洋参为五加科人参属植物西洋参(Panax quinquefolium L.)的干燥根, 也称为西洋人参、 洋参、 美国人参、 花旗参和广东参, 原产于加拿大以及美洲中东部一带, 于20世纪80年代在我国引种成功[1]. 清代儒医汪昂所著《补图本草备要》中首次将西洋参收载入医药文献, 称其: “苦、 甘、 凉、 味厚、 气薄, 补脾降火, 生津液, 除烦倦, 虚而有火者相宜”[2]. 研究表明, 西洋参中具有多种活性成分, 包括皂苷类、 多糖类、 微量元素、 脂肪酸类、 聚炔类、 氨基酸类、 甾醇类、 黄酮类、 无机元素类及挥发油类等[3], 其中皂苷类成分是西洋参中药理活性最显著的药效物质[4], 已证实具有保护心血管系统[5]、 改善神经系统疾病[6]、 抗肿瘤[7]、 抗氧化[8]和降血糖等药理作用. 基于此, 为明确西洋参的药效物质基础以及炮制加工后西洋参活性成分改变导致的药效差异, 研究人员利用现代分析技术表征皂苷类成分的化学结构, 并关注炮制加工对皂苷类成分间相互转化的影响, 已取得较多研究成果. 本文对现有相关研究成果进行系统的总结概括, 为人们更科学、 全面地进行西洋参皂苷类物质的相关研究提供依据.
1 基于现代分析技术的西洋参中皂苷类成分研究进展
目前, 常采用色谱法对西洋参提取物中皂苷类成分进行分离鉴定, 包括薄层色谱法(TLC)、 气相色谱法(GC)[9]、 高效液相色谱法(HPLC)[10]、 高速离心分配色谱法(HSCPC)和高效逆流色谱法(HPCCC)等. 其中, HPLC因其分析速度快、 灵敏度高和对非挥发性极性化合物的适应性而成为分析皂苷类成分的理想选择. HPLC常配置不同检测器以适应不同化合物的分析, 其中紫外(UV)和蒸发光散射(ELSD)等检测器已广泛用于检测皂苷类活性成分, 但仍存在特异性和灵敏度低等问题, 且UV检测器无法检测到24(R)-拟人参皂苷F11等不包含任何可被UV检测器识别合适发色团的皂苷类成分.
质谱(MS)技术的不断发展使对西洋参中皂苷类成分进行高灵敏度、 高选择性、 高分辨率和高通量的分析成为可能[11]. HPLC和质谱联用可定性和定量分析皂苷类成分, 是阐明西洋参皂苷类成分结构并进行定量分析的重要工具[12-13], 如超高效液相色谱-四极杆静电场轨道阱高分辨质谱(UHPLC-Q-exactive orbitrap HRMS)[14]、 快速分辨液相色谱-四极杆飞行时间质谱(RRLC-Q-TOF-MS)[15]、 超高效液相色谱-高分辨质谱(UPLC-HRMS)[16]、 超高效液相色谱-四极杆飞行时间质谱(UPLC-Q-TOF-MS)[17]、 高效液相色谱-四极杆飞行时间质谱(HPLC-Q-TOF-MS)[18]、 超高效液相色谱-串联三重四极杆飞行时间质谱(UPLC-Triple-TOF-MS/MS)[19]、 高效液相色谱-光电二极管阵列检测-质谱法(HPLC-DAD-ESI-MS)[20]和超高效液相色谱-离子淌度四极杆飞行时间质谱联用法(UHPLC/IM-QTOF-MS)[21]等. 在上述质谱技术中, 电喷雾电离(ESI)是适合西洋参中皂苷类成分分析的常用离子化方法, 大气压电离(APCI)对热不稳定的人参皂苷可进行有效的补充鉴定[22]. 离子化后, 常采用正负离子模式相互补充以鉴定皂苷类成分的结构. 在正离子模式下获得的人参皂苷结构信息更多, 可观察到两条主要碎裂途径, 即糖苷键裂解和H2O的消除. 负离子模式下人参皂苷的离子敏感性更高, 观察到的主要碎裂途径为糖苷键裂解[23]. 此外, 多种扫描模式也可应用于西洋参中皂苷结构的表征, 如增强质量扫描-信息依赖性数据采集-增强产物离子扫描模式(EMS-IDA-EPI)可用于非靶向识别皂苷类成分[24], 母离子-信息依赖性数据采集-增强产物离子扫描模式(Prec-IDA-EPI)可针对关键成分选定的离子进行更灵敏和选择性扫描, 以系统了解样品中的成分[25], 多反应监测-信息依赖性数据采集-增强产物离子扫描模式(MRM-IDA-EPI)可提高“焦点”类型人参皂苷的通量, 从而补充Prec-IDA-EPI的扫描信息[26].
2 西洋参中皂苷类成分分类和结构的表征方法
2.1 西洋参中皂苷类成分的结构和分类
人参皂苷是西洋参的主要药理活性成分[27], 由糖苷配基和糖基侧链组成, 如图1所示. 由图1可见, 人参皂苷可分为糖基侧链连接在C-3和/或C-20上的原人参二醇型(PPD)、 糖基侧链连接在C-6和/或C-20处的原人参三醇型(PPT)、 在C-20处具有五元环氧环的Ocotillol(OCO)型、 具有非甾体结构的齐墩果烷(OLE)型以及母核部分侧链略有不同的其他类型[13]. OCO型人参皂苷是西洋参的特征性成分[11], 其中24(R)-拟人参皂苷F11仅存在于西洋参中, 其同分异构体人参皂苷Rf仅存在于人参中, 二者可用于区分西洋参和人参[28]. 在PPD型和PPT型皂苷结构中, C-20羟基空间位置不同导致20(S)和20(R)人参皂苷产生立体异构体: 20(S)-OH在几何上接近人参皂苷的C-12羟基, 20(R)-OH远离C-12羟基, 大多数天然存在的皂苷为20(S)型[29]. 人参皂苷分子量的增加在很大程度上取决于糖苷配基上糖的延伸(图1), 常见的糖取代基有葡萄糖(Glc)、 木糖(Xyl)、 阿拉伯糖(Ara)、 鼠李糖(Rha)和葡萄糖醛酸(GlurA)[30]等, 糖取代基中的羟基与乙酰基(Acetyl)、 丁烯酰基(But)或丙二酰基(Malonyl)连接时, 形成酰基化人参皂苷, 其中高分子量的丙二酰基人参皂苷(也被称为酸性人参皂苷)和乙酰人参皂苷分别是鲜西洋参和干西洋参的特征成分[11].
2.2 西洋参中皂苷类成分的含量差异
西洋参取材部位或生长环境不同导致皂苷类活性成分种类和含量不同," 如PPD型和PPT型人参皂苷在根中含量最高, OLE型人参皂苷在西洋参的茎和叶中显著富集[26]; PPD型人参皂苷及丙二酰基皂苷在栽培型西洋参中含量较高, OCO型人参皂苷在野山参中含量较高[16,31]." 西洋参的地下部分(细根、 根茎和主根)中Rb1的浓度最高, 其次为Malonyl-ginsenoside Rb1,Re和Rg1, 西洋参茎叶中Re含量最高, 其次为拟人参皂苷F11[32-33]. 此外, Rg2,F1,Rd2和F2等部分稀有人参皂苷仅存在于茎中(Rh1和Rh7)或在茎中含量最高[26], 因此西洋参茎叶也是人参皂苷的优质来源.
2.3 西洋参中皂苷类成分的表征方法
2.3.1 西洋参皂苷类成分的质谱表征方法
在质谱分析过程中, 西洋参提取物中皂苷类成分经液相色谱柱分离, 在质谱仪的离子源中被离子化后进入质量分析器, 通过全扫描获得皂苷类物质在正负离子模式下的准分子离子, 从而获得相对分子质量和分子式等信息, 进一步利用子离子扫描获得皂苷类物质的二级或多级碎裂质谱图, 通过与数据库匹配或对二级碎片进行结构解析, 得出定性筛查结果. 西洋参提取物中含有酰基化人参皂苷时, 离子化过程中糖链会先失去酰化部分形成中性人参皂苷, 其特征是42(-Acetyl),68(-But)和86(-Malonyl)处的峰消除[34], 反应释放的丙二酸和乙酸等可提供酸性环境, 促进中性人参皂苷进一步降解. 中性人参皂苷是西洋参皂苷提取物中的主要皂苷类成分," 在正负离子模式下, 中性人参皂苷表现出糖单元连续损失, 直至形成糖苷配基离子[35]. 因此, 需掌握人参皂苷糖基侧链与糖苷配基质谱碎裂规律, 通过计算中性损失的相对分子质量以初步鉴定结构中糖基侧链的组成, 进而结合其[糖苷配基-H]-碎片离子表征皂苷的类型[26], 最终进行综合分析并确定人参皂苷结构. 糖基侧链与糖苷配基的质谱碎裂规律总结如下.
1) 糖残基的碎裂规律. 在低能量碰撞诱导解离-串联质谱(CID-MS/MS)中, 前体离子通过连续或同时损失各种糖基团形成特征糖片段产物离子, 产生162(-Glc),146(-Rha),132(-Xyl/-Ara),176(-GluA)的单个或连续中性丢失, 而相对较高的碰撞诱导解离(CID)能量可确定m/z=70~400内的糖链组成, 如Glc-可在m/z=179,161,143,131,119,113,101处产生碎片离子; Rha-可在m/z=131,149处产生碎片离子; Ara-或Xyl-可在m/z=145,163处产生共有离子; Glc-可在m/z=203,221,323处产生碎片离子; Glc-Arap/Xly可在m/z=191,293处产生碎片离子; Arap/Xly可在m/z=131,149处产生碎片离子, 由此可推导侧链中连接的糖分子量、 数量、 组成和连接顺序[13,36].
2) 糖苷配基的碎裂规律. 在负离子模式下, 如流动相中存在甲酸, 一级质谱常产生典型的溶剂加合物[M+HCOO]-和去质子化分子离子\ 因此很容易根据质谱离子碎片信息确定糖苷配基类型. 在正离子模式下, [M+H]+和[M+NH4]+在高于250 ℃的毛细管温度下完全降解, 脱糖基后产生的糖苷配基还会进行负离子模式下观察不到的系列脱水行为[13], 基于正离子模式下能提供质子(H)并促进脱水过程, 使PPD型糖苷配基在m/z=443,425,407处, PPT型糖苷配基在m/z=441,423,405处, OCO型糖苷配基在m/z=457,439,421处及OLE型糖苷配基在m/z=439处产生独特碎片离子[36].
2.3.2 西洋参中皂苷类成分同分异构体的鉴定方法
西洋参中皂苷类物质存在较多同分异构体, 其中一些同分异构体由于色谱保留行为存在差异, 因此通过液相色谱保留行为即可进行区别, 如Δ20(21)-几何异构体比其相关Δ20(22)-异构体更早洗脱, 如Rk1,Rg5和Rk2,Rh3, 而人参皂苷Rg2,Rh1,Rg3和Rs3的(20S)差向异构体比其对应的(20R)差向异构体更早洗脱[11,37]. 部分同分异构体虽然具有相似的色谱保留行为, 但因糖基侧链中糖的种类或连接顺序不同, 或糖苷配基结构的差异等导致质谱碎裂规律不同, 可根据质谱信息进行鉴别. 以人参皂苷Rf和20(R)-拟人参皂苷F11(P-F11)为例: Rf和P-F11具有相同的相对分子质量及相似的色谱保留行为, 但在一级质谱中, Rf的前体离子m/z=799.48[M-H]-和m/z=845.49[M+HCOO]-的丰度几乎相等, 而P-F11的前体离子m/z=845.59[M+HCOO]-的丰度约是m/z=799.48[M-H]-的7倍; 在二级质谱中, 通过两个糖基的连续损失, Rf在m/z=637,475处产生特征离子, P-F11在m/z=654,491处产生特征离子, 以此进行区分. 因此, 在鉴定西洋参中皂苷类同分异构体成分时, 可与标准品色谱保留行为进行比对, 并结合质谱碎裂信息进行化合物的准确表征. 西洋参中糖基侧链与糖苷配基已明确部分的皂苷类成分分别列于表1~表7.
3 西洋参炮制过程中皂苷类成分变化和机制研究
3.1 蒸制对西洋参中皂苷类成分的影响
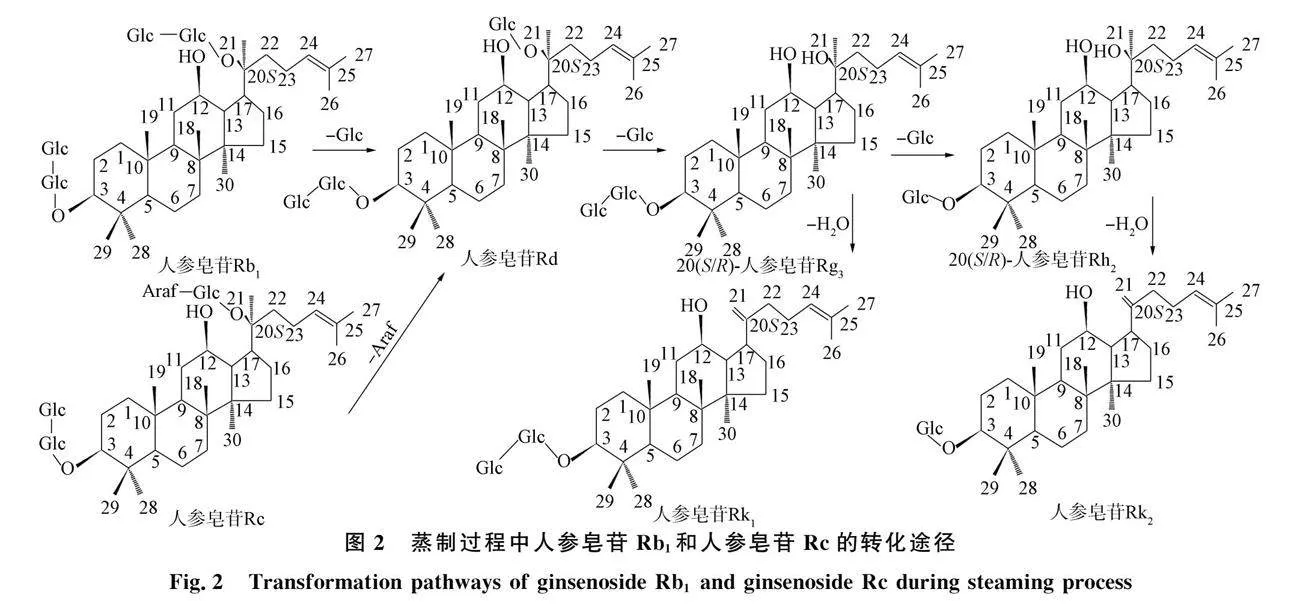
蒸西洋参是近年来除干西洋参外研究最多的西洋参加工方式[17-18], 经蒸制后鲜西洋参发生Maillard反应导致颜色变红, 称为红西洋参. 西洋参生品中酰基化人参皂苷具有热不稳定性, 蒸制时因受热先脱酰基化产生中性人参皂苷[11]后, 转化为生品中不易检测到的低相对分子质量稀有人参皂苷, 如中性人参皂苷Rb1和Rc分解可产生并非天然存在于西洋参生品中的人参皂苷Rg3和Rh2[42](图2). 因此, 西洋参生品中特有成分主要为酰基化皂苷成分, 而蒸制品中特有成分主要为低相对分子质量的稀有皂苷成分[43]. 在蒸制过程中, 除通过大分子中性皂苷糖基的中性丢失产生稀有人参皂苷外, 还存在一些特殊的转化途径, 包括20(R)人参皂苷异构体的产生, 如20(R)-Rg3,20(R)-Rg2,20(R)-Rh2; PPD型与PPT型人参皂苷在Δ20(21)或Δ20(22)脱水形成系列脱水离子[44], 如人参皂苷Rg6,Rk1,F4,Rh4; PPT型人参皂苷在C-24和C-25位形成水合PPT型人参皂苷(m/z=493)[11], 如20(S/R)-Rf2. 此外, Δ20(21)或Δ20(22)脱水离子还可进一步转化为同分异构体, 以20(S/R)-Rg3为例, 在C-20处脱水生成20(21)和Δ20(22)异构体Rk1和Rg5, 随后Rk1和Rg5可转化为20(21)和Δ20(22)异构体Rk2和Rh3(图2). 综上, 蒸西洋参主要成分为中性高相对分子质量人参皂苷, 特定成分为由中性高相对分子质量人参皂苷转化的20(R)-人参皂苷、 脱水人参皂苷、 水合人参皂苷和其他低相对分子质量、 低极性的稀有人参皂苷等[11,13,41,45]组成.
3.2 其他加工方式对西洋参中皂苷类成分的影响
西洋参的加工方式还有干燥和加辅料炮制等, 不同加工条件也可能导致西洋参中各型皂苷的种类和含量差异. 郭娜[46]考察了包括生晒干燥(ND)、 蒸制干燥(SD)和真空冷冻干燥(VFD)3种不同干燥方式对西洋参成分的影响, 发现这些因素均导致了3种加工产物中人参皂苷的转化: SD样品高于VFD和ND样品中人参皂苷Rb1的含量; ND和VFD样品高于SD样品中丙二酰基人参皂苷和人参皂苷Rg1含量. 此外, 加姜汁炮制西洋参是一种新型加工方法, 胡明欣[47]筛选出姜制西洋参的最佳工艺: 取经净选后的西洋参去芦、 润透、 切薄片和干燥, 每100 g西洋参加入10 mL姜汁, 姜汁加入前加4倍量水稀释至50 mL, 拌匀, 室温闷润4 h, 至姜汁吸尽润透, 80 ℃干燥即可. 王文娟[48]对姜西洋参的物质基础进行了表征, 发现西洋参经姜制后比西洋参增加6-gingerdione,6-gingerol,8-gingerol和10-gingerol共4种生姜成分, 姜汁成分在姜制过程中可干预西洋参皂苷类成分代谢转换, 如促进人参皂苷Rb1发生去糖基化反应脱去3分子葡萄糖水解产生Rh2和大分子人参皂苷Ra0发生去糖基化反应转化生成其他小分子化合物. 杜培霞[49]将鲜西洋参通过九蒸九晒制得西洋参黑参, 发现稀有皂苷累积量的最高值随温度增高呈先增加后减少的趋势.
3.3 加工对西洋参药理活性的影响
西洋参中皂苷类成分的结构多样性决定了西洋参可通过多靶点和多通路发挥药理作用, 每种单体皂苷的药性活性具有特异性, 其中稀有人参皂苷的功效更显著[50], 如稀有人参皂苷C-K具有抗肿瘤、 抗炎、 抗糖尿病和降血糖作用[51], Rh1具有增强学习记忆[52]等作用(表8). 因此将加工后产生更多低相对分子质量和低极性的稀有皂苷视为期望的结果, 如蒸西洋参中极性较低的人参皂苷具有强大的生物活性, 包括自由基清除、 血管舒张、 神经保护和抗肿瘤等活性[53]. 姜制西洋参优于西洋参生品的抗糖尿病作用[47]. 西洋参中大分子皂苷, 如丙二酰基人参皂苷对糖尿病高血脂症具有有益作用[54].
4 总结与展望
西洋参的物质基础研究技术已渐趋成熟, 尤其是液相色谱-串联质谱联用方法, 可有效分离并表征西洋参的皂苷类化学成分. 西洋参作为珍稀药材, 为扩大其应用范围, 研究人员探索出多种加工方式, 如经蒸制获得红西洋参、 经多次蒸烘加工获得黑西洋参[66]、 真空冷冻干燥西洋参、 经姜汁制/炒获得姜制西洋参或姜炙西洋参[47]等, 主要期望产生小分子稀有皂苷或新型皂苷, 但因研究尚不成熟和系统而未载入《中华人民共和国药典》. 物质基础研究是评估药材质量及进一步研究功效、 药理和毒理的基础, 因此完善西洋参的物质基础表征有助于评估西洋参及其加工品的药效差异, 是西洋参系统研究的关键步骤. 尽管已有方法可表征大部分的西洋参皂苷类成分, 但对糖基种类和数量以及糖苷配基均一致且难以获得标准品的西洋参皂苷同分异构体的鉴定方法尚不成熟, 因此需进一步开发.
参考文献
[1] 马晓北. 西洋参 [M]. 天津: 天津科学技术出版社, 2009: 1-154. ( MA X B. American Ginseng [M]. Tianjin: Tianjin Science and Technology Press, 2009: 1-154.)
[2] 张正海, 雷慧霞, 钱佳奇, 等. 西洋参的引种简史 [J]. 人参研究, 2020, 32(2): 59-62. (ZHANG Z H, LEI H X, QIAN J Q, et al. Introduction History of Panax quinquefolium L. [J]. Ginseng Research, 2020, 32(2): 59-62.)
[3] 王蕾, 王英平, 许世泉, 等. 西洋参化学成分及药理活性研究进展 [J]. 特产研究, 2007, 29(3): 73-77. (WANG L, WANG Y P, XU S Q, et al. A Review on Studies of the Components Pharmacological Activity of Panax quinquefolium L. [J]. Specialty Wild Economic Animal and Plant Research, 2007, 29(3): 73-77.)
[4] JIN Y P, YU Y Z, LIU C, et al. Variation in Ginsenoside Content and Composition within the American Ginseng Population [J/OL]. Natural Product Research, (2024-10-22)[2024-12-03]. https://doi.org/10.1080/14786419.2024.2417353.
[5] 王蕾, 于晓风, 王耀振, 等. 西洋参总皂苷对心肌缺血再灌注损伤大鼠血液流变学的影响 [J]. 人参研究, 2017, 29(2): 22-24. (WANG L, YU X F, WANG Y Z, et al. The Effect of American Ginseng Total Saponins on Hemorheology in Myocardial Ischemia-Reperfusion Injury in Rats [J]. Ginseng Research, 2017, 29(2): 22-24.)
[6] 张阔, 张真, 杨静玉, 等. 拟人参皂苷-F11对SAMP8小鼠认知障碍的改善作用及机制 [J]. 中国药理学与毒理学杂志, 2019, 33(6): 467. (ZHANG K, ZHANG Z, YANG J Y, et al. The Ameliorative Effect and Mechanism of Pseudo-ginsenoside-F11 on Cognitive Impairment in SAMP8 Mice [J]. Chinese Journal of Pharmacology and Toxicology, 2019, 33(6): 467.)
[7] 张慧琼, 李刚敏, 陈俊仁, 等. 西洋参总皂苷联合顺铂对Luc-A549肺癌小鼠瘤体生长的影响 [J]. 中药药理与临床, 2021, 37(3): 50-55. (ZHANG H Q, LI G M, CHEN J R, et al. Effect of Total Saponins in Panacis Quinquefolii Radix Combined with Cisplatin on Tumor Growth in Mice Bearing Luc-A549 Cells [J]. Pharmacology and Clinics of Chinese Materia Medica, 2021, 37(3): 50-55.)
[8] 张馨妍, 洪新悦, 高连丛, 等. 六种人参皂苷的制备及体外抗氧化活性研究 [J]. 世界最新医学信息文摘, 2018, 18(102): 14-17. (ZHANG X Y, HONG X Y, GAO L C, et al. Study on Preparation of Six Ginseng Soaps and Their Antioxidant Activity in vitro [J]. World Latest Medicine Information, 2018, 18(102): 14-17.)
[9] SHUAI M Y, YANG Y, BAI F Q, et al. Geographical Origin of American Ginseng (Panax quinquefolius L.) Based on Chemical Composition Combined with Chemometric [J]. Journal of Chromatography A, 2022, 1676: 463284-1-463284-10.
[10] 安琪, 郭梅, 申亚君, 等. 西洋参蒸制前后人参皂苷类成分变化及活性比较研究 [J]. 中国中药杂志, 2020, 45(18): 4404-4410. (AN Q, GUO M, SHEN Y J, et al. Comparative Study on Changes of Ginsenosides and Activities of American Ginseng before and after Steaming" [J]. China Journal of Chinese Materia Medica, 2020, 45(18): 4404-4010.)
[11] HUANG X, LIU Y, ZHANG Y, et al. Multicomponent Assessment and Ginsenoside Conversions of Panax quinquefolium L.Roots before and after Steaming by HPLC-MSn" [J]. Journal of Ginseng Research, 2019, 43(1): 27-37.
[12] WANG Y P, CHOI H K, BRINCKMANN J A, et al. Chemical Analysis of Panax quinquefolius (North American Ginseng): A Review [J]. Journal of Chromatography A, 2015, 1426: 1-15.
[13] QI L W, WANG H Y, ZHANG H, et al. Diagnostic Ion Filtering to Characterize Ginseng Saponins by Rapid Liquid Chromatography with Time-of-Flight Mass Spectrometry [J]. Journal of Chromatography A, 2012, 1230: 93-99.
[14] DU Z X, LI J H, ZHANG X, et al. An Integrated LC-MS-Based Strategy for the Quality Assessment and Discrimination of Three Panax Species [J]. Molecules, 2018, 23(11): 2988-1-2988-20.
[15] 赵乐凤, 焦传新, 李慧, 等. RRLC-Q-TOF-MS研究人参二醇型皂苷Rb1,Rb2和Rc的化学转化 [J]. 高等学校化学学报, 2018, 39(4): 667-673. (ZHAO L F, JIAO C X, LI H, et al. Chemical Transformation of Protopanaxadiol Type Ginsenoside Rb1,Rb2 and Rc Analyzed by RRLC-Q-TOF-MS [J]. Chemical Journal of Chinese Universities, 2018, 39(4): 667-673.)
[16] LIU Z H, MOORE R, GAO Y, et al. Comparison of Phytochemical Profiles of Wild and Cultivated American Ginseng Using Metabolomics by Ultra-high Performance Liquid Chromatography-High-Resolution Mass Spectrometry [J]. 2023, 28(1): 9-1-9-17.
[17] 李慧芝, 赵燕芳, 王岱杰, 等. 基于UPLC-Q-TOF-MS/MS和MALDI-MSI的参蒸西洋参皂苷识别及可视化分析 [J]. 中国中药杂志, 2024, 49(6): 1526-1539. (LI H Z, ZHAO Y F, WANG D J, et al. Identification and Visual Analysis of Ginsenosides in Multi-steamed Roots of Panax quinquefolium Based on UPLC-Q-TOF-MS/MS and MALDI-MSI [J]. China Journal of Chinese Materia Medica, 2024, 49(6): 1526-1539.)
[18] FAN J L, LIU F, JI W H, et al. Comprehensive Investigation of Ginsenosides in the Steamed Panax quinquefolius with Different Processing Conditions Using LC-MS [J]. Molecules, 2024, 29(3): 623-1-623-16.
[19] SUN Y Z, FU X J, QU Y, et al. Characterization of Ginsenosides from the Root of Panax ginseng by Integrating Untargeted Metabolites Using UPLC-Triple TOF-MS [J]. Molecules, 2023, 28(5): 2068-1-2068-12.
[20] HSU B Y, JEN C T, INBARAJ B S, et al. A Comparative Study on Analysis of Ginsenosides in American Ginseng Root Residue by HPLC-DAD-ESI-MS and UPLC-HRMS-MS/MS [J]. Molecules, 2022, 27(10): 3071-1-3071-16.
[21] LI W, WU X L, WU M F, et al. Ultrahigh-Performance Liquid Chromatography Coupled to Ion Mobility Quadrupole Time-of-Flight Mass Spectrometry Profiling and Unveiling the Transformation of Ginsenosides by the Dual Conditions of Citric Acid and High-Pressure Steaming [J]. Rapid Communications in Mass Spectrometry, 2022, 36(20): e9363-1-e9363-11.
[22] LIU Z, QU C Y, LI J X, et al. Hypoglycemic and Hypolipidemic Effects of Malonyl Ginsenosides from American Ginseng (Panax quinquefolius L.) on Type 2 Diabetic Mice [J]. Acs Omega, 2021, 6(49): 33652-33664.
[23] MIAO X S, METCALFE C D, HAO C Y, et al. Electrospray Ionization Mass Spectrometry of Ginsenosides [J]. Journal of Mass Spectrometry, 2002, 37(5): 495-506.
[24] GONG P X, ZONG W L, LI H H, et al. Comprehensive Analysis of Different Types of Ginsenosides in the Different Parts of American Ginseng by Targeted and Nontargeted MS/MS Scanning [J]. Journal of Food Science, 2023, 88(12): 5063-5077.
[25] LI C, YANG J H, TONG X, et al. Precursor Ion Scan Enhanced Rapid Identification of the Chemical Constituents of Danhong Injection by Liquid Chromatography-Tandem Mass Spectrometry: An Integrated Strategy [J]. Journal of Chromatography A, 2019, 1602: 378-385.
[26] GONG P X, ZONG W L, LI H H, et al. Comprehensive Analysis of Different Types of Ginsenosides in the Different Parts of American Ginseng by Targeted and Nontargeted MS/MS Scanning [J]. Journal of Food Science, 2023, 88(12): 5063-5077.
[27] LI L, LUO G A, LIANG Q L, et al. Rapid Qualitative and Quantitative Analyses of Asian Ginseng in Adulterated American Ginseng Preparations by UPLC/Q-TOF-MS [J]. Journal of Pharmaceutical and Biomedical Analysis, 2010, 52(1): 66-72.
[28] LEUNG K S Y, CHAN K, BENSOUSSAN A, et al. Application of Atmospheric Pressure Chemical Ionisation Mass Spectrometry in the Identification and Differentiation of Panax Species [J]. Phytochemical Analysis, 2007, 18(2): 146-150.
[29] JEONG S M, LEE J H, KIM J H, et al. Stereospecificity of Ginsenoside Rg3 Action on Ion Channels [J]. Molecules and Cells, 2004, 18(3): 383-389.
[30] YUAN J B, CHEN Y, LIANG J, et al. Component Analysis and Target Cell-Based Neuroactivity Screening of Panax ginseng by Ultra-performance Liquid Chromatography Coupled with Quadrupole-Time-of-Flight Mass Spectrometry [J]. Journal of Chromatography B, 2016, 1038: 1-11.
[31] ZHU H L, LIN H Q, TAN J, et al. UPLC-QTOF/MS-Based Nontargeted Metabolomic Analysis of Mountain-and Garden-Cultivated Ginseng of Different Ages in Northeast China [J]. Molecules, 2019, 24(1): 33-1-33-24.
[32] CHEN W, BALAN P, POPOVICH D G. Comparison of Ginsenoside Components of Various Tissues of New Zealand Forest-Grown Asian Ginseng (Panax Ginseng) and American Ginseng (Panax Quinquefolium L.) [J]. Biomolecules, 2020, 10(3): 372-1-372-15.
[33] 李青, 许伟沂, 彭丽诗, 等. 人参和西洋参提取物中皂苷组分比例分析及其在参类产品鉴别中的应用研究 [J]. 食品科技, 2024, 49(5): 225-233. (LI Q, XU W Y, PENG L S, et al. Analysis of Proportion of Saponins Components in Extracts of Ginseng and American Ginseng and Its Application on Identification of Ginseng Products [J]. Food Science and Technology, 2024, 49(5): 225-233.)
[34] SHI X J, YANG W Z, QIU S, et al. An in-Source Multiple Collision-Neutral Loss Filtering Based Nontargeted Metabolomics Approach for the Comprehensive Analysis of Malonyl-Ginsenosides from Panax ginseng, P.quinquefolius, and P.notoginseng [J]. Analytica Chimica Acta, 2017, 952: 59-70.
[35] DU Z X, LI J H, ZHANG X, et al. An Integrated LC-MS-Based Strategy for the Quality Assessment and Discrimination of Three Panax Species [J]. 2018, 23(11): 2988-1-2988-20.
[36] WAN J Y, LIU P, WANG H Y, et al. Biotransformation and Metabolic Profile of American Ginseng Saponins with Human Intestinal Microflora by Liquid Chromatography Quadrupole Time-of-Flight Mass Spectrometry [J]. Journal of Chromatography A, 2013, 1286: 83-92.
[37] WU W, QIN Q J, GUO Y Y, et al. Studies on the Chemical Transformation of 20(S)-Protopanaxatriol (PPT)-Type Ginsenosides Re,Rg2,and Rf Using Rapid Resolution Liquid Chromatography Coupled with Quadruple-Time-of-Flight Mass Spectrometry (RRLC-Q-TOF-MS) [J]. Journal of Agricultural and Food Chemistry, 2012, 60(40): 10007-10014.
[38] QI L W, WANG C Z, YUAN C S. Ginsenosides from American Ginseng: Chemical and Pharmacological Diversity [J]. Phytochemistry, 2011, 72(8): 689-699.
[39] FUZZATI N. Analysis Methods of Ginsenosides [J]. Journal of Chromatography B, 2004, 812(1/2): 119-133.
[40] KEUM Y S, PARK K K, LEE J M, et al. Antioxidant and Anti-tumor Promoting Activities of the Methanol Extract of Heat-Processed Ginseng [J]. Cancer Letters, 2000, 150(1): 41-48.
[41] KWON S W, HAN S B, PARK I H, et al. Liquid Chromatographic Determination of Less Polar Ginsenosides in Processed Ginseng [J]. Journal of Chromatography A, 2001, 921(2): 335-339.
[42] POPOVICH D G, KITTS D D. Generation of Ginsenosides Rg3 and Rh2 from North American Ginseng [J]. Phytochemistry, 2004, 65(3): 337-344.
[43] 黄宝泰. 西洋参蒸制前后皂苷类成分变化和心肌损伤保护作用研究 [D]. 长春: 长春中医药大学, 2023. (HUANG B T. Study on the Changes of Saponins and the Protective Effect of Myocardial Injury before and after Steaming American Ginseng [D]. Changchun: Changchun University of Chinese Medicine, 2023.)
[44] 杨远贵. 红参加工过程皂苷类成分变化规律及其质量标准研究 [D]. 上海: 上海中医药大学, 2021. (YANG Y G. Study on the Processing-Induced Transformation Dynamics of Ginsenosides and Quality Criteria of Red Ginseng [D]. Shanghai: Shanghai University of Traditional Chinese Medicine, 2021.)
[45] RYU J H, PARK J H, EUN J H, et al. A Dammarane Glycoside from Korean Red Ginseng [J]. Phytochemistry, 1997, 44(5): 931-933.
[46] 郭娜. 不同加工方式对西洋参化学成分的影响研究 [D]. 长春: 长春中医药大学, 2023. (GUO N. Effects of Different Processing Methods on the Chemical Constituents of American Ginseng [D]. Changchun: Changchun University of Chinese Medicine, 2023.)
[47] 胡明欣. 姜西洋参炮制及降糖活性研究 [D]. 长春: 吉林大学, 2020. (HU M X. Study on the Processing and Hypoglycemic Activity of Ginger-Processed American Ginseng [D]. Changchun: Jilin University, 2020.)
[48] 王文娟. 姜西洋参和西洋参化学成分及防治顺铂所致急性肾损伤作用的比较研究 [D]. 长春: 吉林大学, 2023. (WANG W J. Comparative Study on the Chemical Constituents and the Prevention and Treatment of Acute Renal Injury Induced by Cisplatin of Ginger-Processed American Ginseng and American Ginseng [D]. Changchun: Jilin University, 2023.)
[49] 杜培霞. 不同制备工艺对西洋参黑参品质特性及成分变化的影响研究 [D]. 济南: 山东师范大学, 2020. (DU P X. Effects of Different Preparation Processes on Quality Characteristics and Composition Changes of Black Ginseng [D]. Jinan: Shandong Normal University, 2020.)
[50] 郑艺. 稀有人参皂苷的制备与质谱鉴定研究 [D]. 哈尔滨: 哈尔滨工业大学, 2020. (ZHENG Y. Preparation of Rare Ginsenosides and Mass Spectrometry Identification Research [D]. Harbin: Harbin Institute of Technology, 2020.)
[51] SINGH P, SINGH H, CASTRO ACEITUNO V, et al. Engineering of Mesoporous Silica Nanoparticles for Release of Ginsenoside CK and Rh2 to Enhance Their Anticancer and Anti-inflammatory Efficacy: in vitro Studies [J]. Journal of Nanoparticle Research, 2017, 19: 257-1-257-14.
[52] HOU J G, XUE J J, LEE M, et al. Long-Term Administration of Ginsenoside Rh1 Enhances Learning and Memory by Promoting Cell Survival in the Mouse Hippocampus [J]. International Journal of Molecular Medicine, 2014, 33(1): 234-240.
[53] WANG C Z, AUNG H H, NI M, et al. Red American Ginseng: Ginsenoside Constituents and Antiproliferative Activities of Heat-Processed Panax quinquefolius Roots [J]. Planta Medica, 2007, 73(7): 669-674.
[54] 屈春园. 西洋参中丙二酰基人参皂苷对2型糖尿病IR的改善作用及机制研究 [D]. 长春: 吉林农业大学, 2022. (QU C Y. Study on the Regulation Mechanism of Malonyl Ginsenosides from American Ginseng Improving IR of Type 2 Diabetes [D]. Changchun: Jilin Agricultural University, 2022.)
[55] 孟岩, 王洪新, 杨育红. 人参皂苷Rg1对小鼠慢性间歇性缺氧诱导脑损伤的减轻作用及其机制 [J]. 吉林大学学报(医学版), 2024, 50(5): 1196-1204. (MENG Y, WANG H X, YANG Y H. Alleviative Effect of Ginsenoside Rg1 on Brain Injury Induced by Chronic Intermittent Hypoxia in Mice and Its Mechanism [J]. Journal of Jilin University (Medicine Edition), 2024, 50(5): 1196-1204.)
[56] 林丽, 陆滢, 李空飞, 等. 人参皂苷Rg1治疗多发性骨髓瘤的网络药理学预测与验证 [J]. 温州医科大学学报, 2024, 54(8): 650-656. (LIN L, LU Y, LI K F, et al. Network Target Prediction and Mechanism Confirmation of Ginsenoside Rg1 in Treating Multiple Myeloma [J]. Journal of Wenzhou Medical University, 2024, 54(8): 650-656.)
[57] 姜明春, 孙丽霞, 李大伟, 等. 基于RIP1/RIP3/MLKL介导程序性坏死通路探讨人参皂苷Rb1拮抗LPS诱导的黑质多巴胺神经元损伤机制 [J]. 现代中西医结合杂志, 2024," 33(16): 2191-2200. (JIANG M C, SUN L X, LI D W, et al. Ginsenoside Rb1 Antagonizes Lps-Induced Nigrostriatal Dopamine Neuron Damage via RIP1/RIP3/MLKL-Mediated Necroptosis Pathway [J]. Modern Journal of Integrated Traditional Chinese and Western Medicine, 2024, 33(16): 2191-2200.)
[58] OH G S, PAE H O, CHOI B M, et al. 20(S)-Protopanaxatriol, One of Ginsenoside Metabolites, Inhibits Inducible Nitric Oxide Synthase and Cyclooxygenase-2 Expressions through Inactivation of Nuclear Factor-κB in RAW 264.7 Macrophages Stimulated with Lipopolysaccharide [J]. Cancer Letters, 2004, 205(1): 23-29.
[59] 杨倩, 王灿. 人参皂苷Rg3减轻帕金森病小鼠神经系统氧化应激损伤的作用机制 [J]. 西部中医药, 2024,37(9): 25-29. (YANG Q, WANG C. The Mechanism of Action of Ginsenoside Rg3 for the Relief from Oxidative Stress Injury in the Nervous System of Mice with Parkinson’s Disease [J]. Western Journal of Traditional Chinese Medicine, 2024, 37(9): 25-29.)
[60] 张希贤, 孙俊杰, 刘清雅. 人参皂苷Rg2调控PI3K/Akt/mTOR信号通路对急性心肌梗死后心脏保护作用 [J/OL]. 中国实验方剂学杂志, (2024-07-19)[2024-12-03]. http://lihk.cnki.net/urlid/11.3495.R.20240718.1115.004. (ZHANG X X, SUN J J, LIU Q Y. Ginsenoside Rg2 Regulates PI3K/Akt/mTOR Signaling Pathway to Protect Heart after Acute Myocardial Infarction [J/OL]. Chinese Journal of Experimental Traditional Medical Formulae, (2024-07-19)[2024-12-03]. http://lihk.cnki.net/urlid/11.3495.R.20240718.1115.004.)
[61] 蒋岩, 许洁, 董扬扬, 等. 人参皂苷CK对神经退行性疾病的神经保护作用 [J]. 神经药理学报, 2021, 11(4): 49-57. (JIANG Y, XU J, DONG Y Y, et al. The Neuroprotective Effect of Ginsenoside Compound K on Neurodegenerative Diseases [J]. Acta Neuropharmacologica, 2021, 11(4): 49-57.)
[62] 叶萍, 张慧娥, 初孟瑶, 等. 人参皂苷CK美容护肤作用及机制研究进展 [J]. 特产研究, 2024, 46(3): 161-167. (YE P, ZHANG H E, CHU M Y, et al. Research Advances on Beauty and Skin Care Effect and Mechanism of Ginsenoside CK [J]. Special Wild Economic Animal and Plant Research, 2024, 46(3): 161-167.)
[63] 杨森, 张晓娟, 张辰露. 人参皂苷CK活性及生物转化合成研究进展 [J]. 广东化工, 2024, 51(15): 95-97. (YANG S, ZHANG X J, ZHANG C L. Research Progress of Ginsenoside CK Activity and Biotransformation Synthesis [J]. Guangdong Chemical Industry, 2024, 51(15): 95-97.)
[64] 崔颖. 裂褶菌对西洋参的固体发酵及其转化产物人参皂苷F2抗心肌梗死活性的研究 [D]. 长春: 吉林农业大学, 2024. (CUI Y. Anti-myocardial Infarction Activity of Solid Fermentation of Panax quinquefolius L.by Schizophyllum commune and Its Transformation Product Ginsenoside F2 [D]. Changchun: Jilin Agricultural University, 2024.)
[65] 何姗美. 人参皂苷Rk1对膝骨关节炎大鼠的保护作用研究 [D]. 长春: 吉林大学, 2024. (HE S M. Study on the Protective Effect of Ginsenoside Rk1 on Knee Osteoarthritis in Rats [D]. Changchun: Jilin University, 2024.)
[66] 徐梦丹. 黑西洋参炮制工艺及抗疲劳、 抗氧化作用评价 [D]. 长春: 长春中医药大学, 2024. (XU M D. Evaluation of Processing Technology and Anti-fatigue and Anti-oxidation Effects of Black American Ginseng [D]. Changchun: Changchun University of Chinese Medicine, 2024.)
(责任编辑: 单 凝)
