生物扰动对沉积物-水界面附近污染物环境行为及生物地球化学过程的影响
2025-02-06花修艺赵宇付欣妍谭春阳张乐园梁大鹏董德明


摘要: 沉积物-水界面是水生生态系统中物质交换与能量传递的关键区域, 是包括污染物和营养物在内的物质在沉积物和上覆水之间交换的必由路径. 底栖扰动生物的行为改变界面附近原有沉积物的结构和物质交换平衡, 显著影响局部微环境特征以及微生物种类、 数量和群落组成, 使界面附近的环境变得更复杂和动态. 生物扰动可改变污染物的迁移、 转化和生物可利用性," 并重塑碳、 氮、 磷等重要元素的循环路径和通量. 分析和综述底栖生物扰动对沉积物-水界面附近的典型污染物环境行为和典型生物地球化学循环过程的影响, 有助于深入了解底栖扰动生物介导的环境和生物地球化学过程, 认识生物扰动的重要生态环境意义.
关键词:" 沉积物-水界面; 生物扰动; 重金属; 有机污染物; 生物地球化学循环
中图分类号: X174" 文献标志码: A" 文章编号: 1671-5489(2025)01-0271-15
Effects of Bioturbation on Environmental Behavior of Pollutants
and Biogeochemical Process near Sediment-Water Interface
HUA Xiuyi, ZHAO Yu, FU Xinyan, TAN Chunyang, ZHANG Leyuan,
LIANG Dapeng, DONG Deming
(Key Laboratory of Ground Water Resources and Environment of" Ministry of Education,
College of New Energy and Environment, Jilin University, Changchun 130012, China)
Abstract:""" Sediment-water interface is a key area for material exchange and energy transfer in an aquatic ecosystem, and is a necessary pathway for the exchange of substances, including pollutants and nutrients, between sediment and overlying water. The behaviors of benthic bioturbators alter the structure of the existing sediments and the balance of the material exchange near the interface, significantly affecting the local microenvironmental characteristics as well as the microbial species, numbers and community composition, and making the" environment near the interface more complex and dynamic. The bioturbation can alter the transfer, transformation and bioavailability of the pollutants, and" reconstruct the cycling pathways and fluxes of important elements such as carbon, nitrogen, and phosphorus. We analyze and summarize the effects of benthic bioturbation on the environmental behavior of typical pollutants and typical biogeochemical cycling processes near the sediment-water interface, which contributes to an in-depth understanding of the benthic bioturbator-mediated environmental and biogeochemical processes, and to the recognition of the ecological significance of bioturbation.
Keywords: sediment-water interface; bioturbation; heavy metal; organic pollutant; biogeochemical cycling
沉积物位于地表水体的底部, 处于水圈、 岩石圈、 土壤圈和生物圈的交汇区, 是有机物质和营养元素的重要储存库, 也是水体环境中各类污染物最重要的汇集和潜在释放源[1-2]. 沉积物-水界面(SWI)代表了由物理、 化学和生态过程共同控制的生态环境界面和过渡区域, 是物质在沉积物和上覆水之间迁移的必经处, 因此关于各类化学物质在SWI迁移的研究受到广泛关注[3-4]. 从生态系统的角度, 生物地球化学循环紧密关联着物质、 能量和信息在生态系统各圈层间的流转和维持, 而沉积物和SWI是生物地球化学循环中的重要参与者, SWI附近的底栖生物和微生物群落以及沉积物中复杂的地球化学过程驱动主要元素和物质的迁移和循环[5], 影响水生生态系统的服务功能.
在SWI附近栖息的生物进行挖洞、 摄食、 分泌、 排泄和输送等各种活动, 直接或间接影响沉积物基质的活动统称为生物扰动[6], 生物扰动会显著改变沉积物的物理化学特征, 也是影响水生生态系统中污染物迁移转化和养分循环的关键过程[1,6]. 扰动生物对水生生态系统中物质循环和能量流动等方面的作用十分重要[3,7]. 底栖生物在对沉积物灌溉、 通水和搬运等物理活动过程中, 改变了沉积物结构, 影响了物质迁移和交换, 加速了污染物在沉积物与上覆水之间的迁移[8]. 同时, 生物活动还会影响溶解氧(DO)、 CO2和有机物等成分的局部浓度和分布, 改变微环境特征[9-10]和微生物群落结构[11], 从而间接影响污染物和营养物质的迁移转化和生物可利用性, 加速SWI附近的生物地球化学循环过程.
1 生物扰动及其对SWI附近环境的影响
生物扰动对沉积物的直接作用可分为颗粒重构和通水灌溉两类: 颗粒重构是指扰动生物的各种活动导致沉积物颗粒移动和沉积物结构改变; 通水灌溉是指扰动生物通过钻孔或挖穴等方式在沉积物中形成通道(gallery)或洞穴(burrow), 再通过呼吸、 滤食和运动等行为推动水的流动, 实现沉积物孔隙水(特别是通道/洞穴水)和上覆水间的交换[4,12]. 根据扰动方式及其对沉积物产生的效应, 可将生物扰动分为5种典型作用类型[6,13-14]. 1) 生物扩散作用: 扰动生物以随机方式移动短距离内的沉积物颗粒, 促进颗粒的扩散传输. 2) 向下输送作用: 生物在沉积物表层摄食颗粒, 通过向下输送最终排泄至深层沉积物中. 3) 向上输送作用:" 生物在沉积物深处摄食, 并向上输送至SWI附近将其排出. 4) 生物引灌作用: 生物通过挖掘通道/洞穴, 将大量沉积物从深处向上搬运至表面, 并被水带走; 在洞穴废弃后, 表层的沉积物填入洞穴底部. 5) 通道扩散作用: 扰动生物通过在沉积物中密集钻孔, 构建通道或洞穴使物质从沉积物表面传输到深处. 上述作用互不排斥, 很多生物同时具备多种扰动作用, 对沉积物产生复杂的扰动效果. 扰动生物的上述作用, 一方面会通过促进沉积物颗粒的迁移和再分布, 使颗粒物包含或吸附的化学物质随其迁移, 并会改变沉积物颗粒的粒度分布特征和沉积物孔隙度, 使沉积物疏松和均质化; 另一方面会通过促进水的迁移和再分布, 使水中溶解的营养元素、 气体和污染物等溶质随其迁移, 并提高沉积物含水率[15]. 这些作用提高了SWI附近物质的迁移速率和迁移通量, 显著促进物质在界面附近和沉积物内部的迁移. 如存在淡水环境中的寡毛纲颤蚓科(Tubificidae)小型群居扰动生物改变了沉积物结构, 促进了沉积物内部颗粒向SWI迁移, 在沉积物内形成洞穴, 而且洞穴数量和深度会随着生物密度和扰动时间的增加而增加; 颤蚓扰动还增加了沉积物中的DO含量, 进而导致氧化区厚度的增加也有类似趋势[16]. 近岸浅海中的滤食性贝类毛蚶(Scapharca subcrenata)的生物扰动可增加沉积物中营养物质的扩散深度和交换速率, 促使氮和磷等营养物质渗透到6~10 cm深的表层沉积物内部, 并将氮和磷向水中释放的通量约提高3倍[17].
上述以物理扰动为主的作用除搬运、 混合和输送等直接作用外, 还会导致DO和其他各种化学成分的再分布, 进而改变微环境特征. 同时, 扰动生物还会通过自身的新陈代谢和各种生理活动进一步影响微环境特征[9,18], 进而产生一系列间接影响. 如扰动生物的取食、 消化和排泄过程会改变其摄入的沉积物颗粒中有机质、 氮和其他化学成分的含量和构成; 生物的呼吸作用改变DO和CO2含量, 影响CO2/碳酸盐平衡; 生物的分泌作用和死亡后尸体分解会增加沉积物中包括溶解性有机质(DOM)在内的有机质含量; 有机质和DO等成分的改变会影响沉积物中微生物的分布、 构成和活性, 微生物的改变又会进一步改变沉积物微环境中DO、 有机质、 氮、 磷和硫等成分的分布、 含量和构成[7-8]. 上述影响也会体现在微环境氧化还原电位(ORP)、 pH值和DO等环境参数的改变上, 进而影响体系中的微生物过程和化学过程, 形成相互影响的复杂作用体系[9]. 这些微环境特征对SWI附近污染物的环境化学行为和生物地球化学过程有重要影响. 如扰动生物颤蚓除在沉积物内形成洞穴外, 还可促进沉积物中孔结构的形成, 从而改变了沉积物中微生物群落结构[16]; 颤蚓和其他一些扰动生物的存在也可能改变其洞穴或更大范围内的pH值、 DO和ORP[9,19]; 颤蚓还会分泌DOM, 并能与金属离子配合, 影响重金属的吸附行为[18]. 日本沼虾(Macrobrachium nipponense)的生物扰动有效提高了淡水表层沉积物的ORP, 促进了沉积物中有机质降解[20]. 十足目扰动生物Upogebia deltaura和Callianassa subterranean的存在会增加海岸带表层沉积物中细菌的多样性, 并可能在其洞穴深处形成独特的细菌群落[11]. 在海洋多毛纲环节动物Capitella teleta的粪便颗粒中, 与硫和碳循环相关的微生物群落明显富集, 从而使其在影响SWI附近的营养物质循环方面发挥重要作用[21].
此外, 底栖扰动生物本身也是水生生态系统的食物链/食物网中的一环, 是生态系统物质循环和能量流动的重要节点, 是维持生态系统稳定的重要组成之一[7]. 一方面使扰动生物自身吸收和富集的污染物随其进入食物网, 另一方面也使扰动生物自身生长、 繁殖、 死亡和分解也成为生物地球化学循环的一部分. 生物扰动对SWI附近局部环境的主要影响如图 1所示.
2 生物扰动对污染物环境行为的影响
生物扰动对SWI附近污染物环境行为的影响主要包括污染物的迁移、 转化和生物可利用性.
2.1 影响SWI附近污染物的迁移
根据上述生物扰动作用, 扰动生物会促进沉积物颗粒和水的迁移, 进而促进污染物随其迁移. 首先, 生物扰动通过向上输送和生物扩散等作用使包含或吸附污染物的沉积物颗粒再悬浮, 向上覆水中释放颗粒态污染物, 污染物的溶解和解吸又会形成溶解态污染物; 其次, 溶解态污染物也会直接随扰动生物的通水和灌溉等作用从沉积物向上覆水迁移. 如淡水环境中蜉蝣属生物Hexagenia rigida的若虫可通过促进颗粒物再悬浮的方式将Cd和Zn大量释放到上覆水中[22], 近岸海洋环境中端足目生物Monoporeia affinis、 多毛纲生物Marenzelleriaspp.和多毛纲生物双齿围沙蚕(Perinereis aibuhitensis)的扰动使沉积物颗粒再悬浮, 促进了沉积物中多氯联苯(PCBs)、 多溴二苯醚(PBDEs)和烃类向上覆水释放[23-24]. 滩涂多毛纲生物沙蚕(Nereis diversicolor)加速了沉积物颗粒向SWI迁移, 颗粒吸附的多环芳烃(PAHs)解吸到水中, 增加了上覆水中溶解态PAHs, 特别是低分子量PAHs的含量[25]. 多毛纲生物Marenzelleria neglecta对沉积物中PCBs等污染物向SWI和上覆水释放的促进作用被归因于生物扰动对溶解态污染物随水迁移的促进作用[26]. 生物扰动对沉积物中污染物释放的影响与扰动生物的种类和数量、 沉积物深度、 污染物的种类和性质等均有关[27-28]. 摇蚊属(Chironomus)生物幼虫和颤蚓科生物霍甫水丝蚓(Limnodrilus hoffmeisteri)对沉积物中Cr向SWI和上覆水迁移影响的研究结果表明, 虽然两种生物均显著增加了上覆水和孔隙水中Cr的浓度, 但颤蚓通过强烈的向上输送对上覆水中 Cr 浓度的影响更大, 而摇蚊幼虫则通过生物灌溉作用对孔隙水中Cr浓度和界面上Cr通量的影响更大[29]. 对Marenzelleria" spp.和M.affinis作用的对比研究表明, 前者对沉积物中PCBs和PBDEs释放的促进作用明显高于后者, 且最大促进作用发生在2.0~2.5 cm的沉积物中[23]. 在Marenzelleria spp.,M.affinis和双壳类生物白樱蛤(Macoma balthica)对沉积物中PAHs释放影响的研究中发现, 生物扰动在生物密度较高(约860~1 200只/m2)时可使PAHs从沉积物到水的通量提高3~55倍, 在生物密度较低(lt; 200只/m2)时没有该现象[30]. 在不同类型扰动生物复合作用的研究中发现, 当存在霍甫水丝蚓时, 污染沉积物中所有重金属均有明显向上覆水释放的趋势; 在体系中添加双壳类生物河蚬(Corbicula fluminea)后, 强烈促进了Mn,Co,Ni和Zn向上覆水的进一步释放, 但对Cu和Cr释放的促进作用很小[31]. 这是因为与颤蚓科生物主要促进沉积物颗粒从下到上的搬运过程不同, 双壳类生物主要促进生物灌溉和水的交换, 而Cu和Cr具有远大于其他金属与颗粒的结合能力, 因此河蚬对其进一步释放的影响很小. 类似地, 摇蚊属生物羽摇蚊(C.plumosus)幼虫的生物扰动和生物灌溉对沉积物中不同成分向上覆水释放的影响也与其化学特性密切相关: 溶解有机碳(DOC),N,Mg,Ca,Sr,Mo和U一直受生物强烈影响; Mn,Ni,As,Cd和Cs在幼虫开始挖掘沉积物时受生物强烈影响, 之后影响显著降低, 但仍高于无生物对照组; 而Al,Fe,Co,Cu,Zn和Ce只在开始阶段受生物强烈影响, 之后影响显著降低至对照水平[32].
生物扰动同样会促进污染物从上覆水向沉积物迁移, 包括促进SWI附近沉积物对污染物的吸附、 污染物随水流进入孔隙水并被更深层的颗粒物吸附等. 在对Cd和疏水性溴代阻燃剂BDE-99从上覆水向近海沉积物迁移的研究中发现, 3种具有不同摄食习性和扰动策略的扰动生物, 端足目生物M.affinis, 双壳类生物M.balthica和多毛纲生物Marenzelleria spp.均会促进这两种污染物向沉积物迁移, 其中M.affinis和M.balthica的作用更显著. Marenzelleria spp.对Cd和BDE-99迁移明显不同: 与其他两种生物相比, Marenzelleria spp.可使更多的Cd进入沉积物, 但同时也会使更多的Cd再移动并重新进入上覆水, 表明生物灌溉等作用使可溶性Cd在SWI附近高效迁移; 对高度疏水且主要与颗粒结合的BDE-99, 其主要存在于沉积物表层, 在表层以下的沉积物中浓度很低, 说明Marenzelleria spp.并未导致明显的颗粒混合[33]. 颤蚓对上覆水中Cd和Cu向沉积物迁移促进作用的影响因素研究表明: 迁移速率随颤蚓密度的增加而增大, 且对Cu的促进作用更显著; DO升高可促进迁移, 且在中等DO含量时其浓度进一步升高的促进作用更大; 酸和碱的存在均能促进生物扰动, 金属的迁移速率同时受pH值和扰动强度影响, 总体呈随上覆水pH值的增加而增加; 25 ℃时颤蚓扰动最显著, 且重金属迁移速率最快[34].
生物扰动也能促进沉积物内部污染物随沉积物颗粒或孔隙水迁移, 特别是垂直方向上的迁移. 颤蚓可将约20~50 mm深度内的沉积物颗粒迁移到沉积物表面, 吸附在颗粒表面的Pb和Cd会随其迁移到表面, 而后期搬运上来的新颗粒会覆盖之前的颗粒, 使金属随之再逐渐缓慢下移[16]. 类似地, Cd和BDE-99迁移到沉积物表面后, M.affinis,M.balthica和Marenzelleria spp.也会促进Cd和BDE-99在沉积物中进一步向下迁移[33]. 双齿围沙蚕也会影响沉积物中烃类物质的垂直分布[24]. 在河蚬和霍甫水丝蚓对重金属迁移复合影响的研究中发现, 河蚬对沉积物内不同重金属垂向迁移的促进作用也与其在上覆水中的规律一致, 即对Mn,Co,Ni和Zn进一步迁移的促进作用较大, 对Cu和Cr进一步迁移的促进作用较小[31].
由扰动生物导致的沉积物微环境变化和污染物存在形态的改变也可能促进或抑制污染物迁移, 特别是在沉积物内的垂向迁移和向上覆水释放. 如摇蚊幼虫的生物灌溉作用可将含氧水引入沉积物, 提高洞穴/孔隙水中的氧含量, 进而提高沉积物中Cr的移动性, 进一步促进了Cr迁移[29]. 泥鳅、 摇蚊幼虫和颤蚓等生物的扰动在前期会显著促进沉积物中Tl向上覆水释放, 但14 d后开始抑制Tl从沉积物颗粒中释放, 其中泥鳅的作用更显著, 这可能是生物扰动使体系pH值升高, 促进了Tl的吸附或共沉淀, 同时形成铁和锰的水合氧化物也进一步促进了Tl的吸附和沉淀[35]. 多毛纲生物M.neglecta对更深层沉积物的复氧作用促进PCBs包括高氯代PCBs的解吸及其向SWI和上覆水的释放[26].
生物扰动对沉积物-水体系中以颗粒形式存在的污染物(包括微纳塑料和人工纳米粒子等)迁移也有类似促进作用[36-37]. 生物扰动对微纳塑料颗粒迁移的影响主要包括促进沉积物中微塑料(MPs)的再悬浮[38]和促进MPs在沉积物中的深埋[39]. 沉积物中2 cm深的MPs在波罗的海蛤蜊(Limecola balthica),Marenzelleria spp.和M.affinis的生物扰动下迁移到表层, 但沉积物中深度超过 5 cm的MPs几乎不会返回沉积物表面[40]. Pakarinen等[41]发现生物扰动等作用可使沉积在湖泊表层沉积物中高达9%的富勒烯在几天内重新移动和释放; 颤蚓可促进含有毒重金属的CuO纳米粒子和CdTe量子点从上覆水向沉积物内部迁移, 且促进作用大于对相应金属离子的促进作用, 经过一段时间后, 沉积物内部的纳米粒子会被再次输送至1~3 cm的表层沉积物中[42].
2.2 影响污染物的转化和生物可利用性
生物扰动可通过改变污染物所处微环境的理化特征与微生物构成影响污染物转化. 这种改变既包括上述扰动生物对微环境特征的直接改变, 也包括通过输送作用把污染物迁移到新环境; 污染物转化对重金属更多是存在形态包括化学形态(speciation)和结合态(fractionation)的改变, 对有机污染物还包括各种降解作用.
扰动生物将DO输送到沉积物内部, 改变沉积物的ORP是其对微环境理化特征最重要的影响之一. 生物扰动对沉积物中重金属形态的影响如图 2所示.
DO增加会提高沉积物内的ORP, 并氧化以酸可挥发性硫化物(AVS)形式存在的重金属, 从而提高重金属的移动性, 有利于重金属向孔隙水和上覆水的迁移释放; 但也可能因ORP提高的同时提高了铁/锰(水合)氧化物的浓度, 使重金属转换为铁锰氧化物(吸附)结合态, 导致溶解态重金属浓度未显著提高, 但整体上仍有助于提升重金属的生物可利用性[27]. 此外, 生物扰动也可能降低ORP, 主要是因为ORP除受DO影响外还受有机物等还原性物质含量的影响, 而扰动生物在增加DO浓度的同时也增加了有机物含量[18], 如颤蚓扰动显著降低了一些水体0~5 cm深度内沉积物的ORP. 在该体系中研究颤蚓对沉积物中重金属结合态的影响发现:" 与沉积物结合较弱的Cd和Zn受影响较大, 与沉积物结合能力较强的Pb和Cu受影响较小;" 移动性较强的可交换态、 碳酸盐结合态和铁锰氧化物结合态受影响较大, 有机硫化物结合态和残渣态受影响较小. 以Cd的结合态为例, 0~2 cm深度的沉积物受影响最显著, 扰动时间越长受影响越显著, 颤蚓主要起促进铁锰氧化物的结合态向可交换态转化, 并增加沉积物表层碳酸盐结合态和可交换态的比例, 总体上起提高Cd生物可利用性的作用[43]. 对于双齿围沙蚕, 其存在会使沉积物中可交换态Cu及碳酸盐结合态Cu,Cd和Pb的比例显著降低, 而铁锰氧化物结合态和有机物结合态的Cd和Pb的比例显著提高, 总体上起降低重金属生物有效性的作用[44]. 颤蚓和双齿围沙蚕作用的这种差异主要由它们不同的生活习性所致.
由图2可见, 生物扰动导致微环境中微生物构成和特征改变、 ORP改变以及经常同时发生的pH值改变等会共同影响有机(污染)物降解以及重金属形态改变." 这种影响与具体的环境和生物有关, 具有一定的复杂性. 沉积物中有机氯污染物的还原脱氯降解会受到生物扰动的强烈影响[7], 如对日本沼虾扰动研究表明, 虾的存在会显著提高ORP并促进有机物降解, 并使沉积物富集11种不同细菌类群, 其中8种均与有机物降解显著相关[20]. 颤蚓显著促进了湿地沉积物中有机物的矿化, 导致细菌可用的营养生态位多样性减少, 进而使细菌多样性减少, 但对细菌群落结构的影响很小[45]. 而当沉积物中的有机物降解以厌氧代谢为主时, 扰动生物带来的DO可能会降低沉积物对有机物的代谢能力, 如海洋底栖多毛纲扰动生物Lumbrineris latreilli可通过增加沉积物氧含量以防止厌氧代谢产生有毒副产物的积累和毒害, 但也降低了沉积物中有机物的代谢能力[46].
底栖生物通过扰动和生命活动还会影响微环境中DOM的含量和构成, 进而影响污染物转化, 包括DOM与重金属配合、 对重金属吸附行为和存在形态以及对吸附态有机污染物的解吸等, 扰动和生命活动会促进颗粒态和吸附/结合态污染物转化为溶解态, 具有提高污染物生物可利用性的作用. 如颤蚓、 摇蚊幼虫和泥鳅的生物扰动/生物灌溉促进了DOM释放, 改变了沉积物释放的DOM组成, 显著增加了其中类富里酸物质和类胡敏酸物质的比例; 生物扰动/生物灌溉还加速了细菌的生长和繁殖, 提高了DOM中可溶性微生物副产物的比例. 溶解态Cu和各类DOM组成成分间的相关性最好, 表明沉积物中Cu以有机结合态的形式存在; DOM和沉积物中Cu的结合又促进了Cu的溶解和释放[47]. 一些扰动生物本身也会产生DOM(生物DOM, B-DOM), 如颤蚓产生的DOM有较宽的相对分子质量范围, 包含芳香结构和类富里酸、 类胡敏酸和类蛋白成分, 能与重金属形成配合物, 并促进沉积物对Cu的吸附而抑制对Pb和Cd的吸附[18,48]. 在模拟稻鱼共养稻田中, 中华绒螯蟹(Eriocheir sinensis)和泥鳅(Misgurnus anguillicaudatus)的生物扰动显著促进了溶解态菲(Phe)的释放, 且溶解态Phe含量与DOM间存在显著相关性; 生物产生的B-DOM是促进溶解态Phe释放的重要因素, 一方面大分子B-DOM会优先与水稻土的吸附位点结合而抑制Phe吸附, 另一方面小分子B-DOM与Phe形成DOM-Phe配合物抑制Phe再吸附, 从而提高了上覆水溶解态Phe的含量[49].
污染物转化通常伴随其生物可利用性的改变, 生物扰动对污染物生物可利用性的影响除通过影响污染物转化实现外, 还可通过影响污染物从沉积物向孔隙水和上覆水的迁移实现. 这种迁移也可理解为特定的形态转化, 即颗粒态/吸附结合态向溶解态的转化. 如双齿围沙蚕的生物扰动会提高上覆水中溶解态Cu,Zn,Cd和Pb的含量[44]; 摇蚊幼虫会增加沉积物孔隙水中生物可利用Cu(以薄膜扩散梯度技术(DGT)所测得的Cu为代表)的通量[27]; 多毛纲生物M.neglecta会显著促进具有高生物可利用的溶解性态PCBs和其他持久性有机污染物的大量释放[26]; 美洲钩虾(Hyalella azteca)和霍甫水丝蚓通过促进沉积物的悬浮, 增加悬浮颗粒浓度, 从而降低上覆水中溶解态全氟辛烷磺酰基化合物(PFOS)的浓度[50]. 利用被动采样法对沉积物中沙蚕扰动释放到上覆水中PAHs生物可利用性的研究发现, 生物扰动显著提高了低相对分子质量PAHs的生物可利用性, 但对高相对分子质量PAHs的影响较小[25]. 在上述河蚬和霍甫水丝蚓生物扰动的复合影响研究中, 以生物灌溉和促进水流动为主要作用的河蚬能进一步促进迁移的重金属主要以风险更高的小粒径形态(相对分子质量lt;10 000)存在[31]. 在双壳类动物Tellina deltoidalis和端足目生物Victoriopisa australiensis共同扰动下, DGT检测到沉积物孔隙水和上覆水中存在大量活性Cd,Ni,Pb和Zn, 但活性Cu和Fe含量较低, 同时T.deltoidalis体内存在Zn的高生物累积, 且Pb和Zn的生物累积量与DGT所测金属通量间有显著相关[51].
研究生物扰动对污染物生物可利用性影响更直接的方式是将扰动生物、 污染物和指示生物置于同一体系中, 利用有无扰动生物或不同扰动生物存在下指示生物对污染物吸收富集或存活情况的差异研究生物扰动的影响. 如在颤蚓、 浮萍、 皇冠草和斑马鱼共存的体系中, 颤蚓在促进沉积物中Cu和Zn释放的同时促进了上覆水中浮萍、 皇冠草和斑马鱼对重金属的吸收和富集, 颤蚓密度高时还会导致斑马鱼生长停滞和畸形发育[2]. 上述蜉蝣若虫扰动促进沉积物中Cd和Zn向上覆水释放的研究还表明, 由于释放的重金属主要是颗粒态, 而溶解态浓度很低, 因此这些重金属对河蚬的生物可利用性很低[22]. 带丝蚓科生物夹杂带丝蚓(Lumbriculus variegatus)的生物扰动显著促进了美洲钩虾对沉积物中PAHs积累, 提高了钩虾的死亡率[52]. 美洲钩虾和霍甫水丝蚓均会通过促进沉积物悬浮以促进沉积物中PFOS释放, 提高PFOS的生物有效性和环境风险, 使共存花翅摇蚊(C.kiiensis)幼虫的死亡率从2.8%分别上升到100%和41.7%[50].
此外, 水环境中的污染物也会在扰动生物体内积累, 并可产生一定的毒害甚至致死作用. 如颤蚓、 摇蚊幼虫和泥鳅可促进沉积物中Cd,Cu,Zn和Pb释放, 同时这些金属也会在它们体内积累[27]. 沉积物和海水中的重金属会在双齿围沙蚕体内积累并产生毒性效应, 且不同重金属间有协同毒性效应[44]. 沉积物中MPs会在摇蚊属扰动生物C.tepperi幼虫的肠道内积累, 影响其存活和生长[53]. 招潮蟹扰动可影响沉积物中MPs含量, 同时MPs在其软组织中也有较强的生物积累作用[54]. 虽然暴露于中等环境浓度MPs中的正颤蚓(Tubifex tubifex)不会死亡, 但呈现显著的氧化应激反应和扰动活动减少的现象, 它们促进SWI水交换通量和有机物矿化等能力被抑制[55]. 由于扰动生物对生态系统的重要作用, 污染物对扰动生物存活和健康状况的影响会进一步间接影响污染物环境行为、 水环境生物地球化学过程以及水生态系统的功能和健康, 从而产生一系列更复杂和深远的影响, 因此仍需进一步深入研究.
3 生物扰动对生物地球化学过程的影响
下面以碳、 氮和磷的循环为代表, 介绍生物扰动对SWI附近生物地球化学循环过程的影响. 这些影响同样是生物扰动通过促进相关物质迁移、 影响相关物质转化与生物可利用性实现的.
3.1 对碳循环的影响
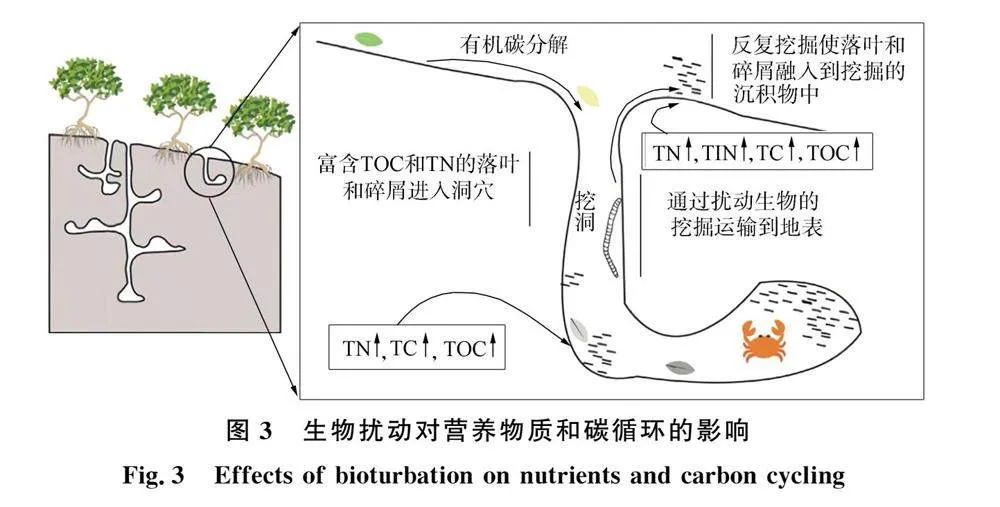
在近岸和滩涂水环境中, 底栖生物对生物质的搬运作用、 碎屑滤食性生物的摄食和排泄等活动, 以及底栖生物死亡后的尸体, 都会使更新的有机碳在沉积物内富集(即固碳过程)[56]. 如沿海红树林区蟹类的生物扰动会将落叶和有机碎屑等搬运到其洞穴深处, 再经过沉积物埋藏和微生物分解等过程转化为有机碳, 从而在沉积物深处形成大量有机碳源(图 3)[57], 其中TOC为总有机碳, TN为总氮, TC为总碳, TIN为总无机氮. 与对照区相比, 底栖双壳类生物绿唇贻贝(Perna canaliculus)的摄食和排泄等活动将更多有机碳和无机碳储存在沉积物中, 实现了更高的固碳率, 增加了碳的埋藏量[58]. 同时, 生物扰动同样也会把较深层沉积物中储存的有机碳以颗粒态或溶解态形式搬运输送到SWI, 该过程常伴随微生物活动和氧化还原条件改变而带来的有机碳转化. 如在红树林生态系统中, 螃蟹等生物扰动会将有机质以溶解无机碳(DIC)、 颗粒有机碳(POC)和溶解有机碳(DOC)等形式输送和释放到SWI(图 3)[57,59]. 蟹类的筑穴活动增加了氧化层深度, 从而影响了碳氧化的速率和数量, 促进了沉积物中有机碳向DIC和DOC转化, 进而影响海岸生态系统的碳平衡[60].
在生物扰动影响碳转化的作用中, 生物扰动和微生物活动共同影响(特别是促进)CO2和CH4等温室气体的产生和排放具有重要生态环境意义[61]. 如招潮蟹的生物扰动可增加扰动区有机质含量和产甲烷菌群落的丰度, 使沉积物中CH4的排放速率显著增加86%~430%[62]. 类似地, 对3种招潮蟹(Tubuca arcuata, Gelasimus borealis和Austruca lactea)的研究发现, 蟹类的洞穴促进了沉积物中DO向下渗透, 进而促进了沉积物中有机碳的氧化, 使沉积物中CO2和CH4的排放率分别增加了17%~30%和49%~141%[63]. 但也有研究表明, DO含量与CH4通量之间存在明显的负相关, 即缺氧沉积物可为产甲烷菌提供更多有机底物, 从而提高CH4的产生和排放. 如海水养殖区的扰动生物缢蛏(Sinonovacula constricta)、 斑节对虾(Penaeus monodon)和锯缘青蟹(Scylla serrata)的呼吸作用使水中DO的质量浓度与对照体系相比降低了5.19%~44.8%, 同时分别使系统的CH4通量增加了35.3%,80.6%和138%[64]. 然而, 生物扰动并不总是增加SWI的CH4排放通量, 如存在淡水环境中的寡毛纲动物Sparganophilus tamesis可使沉积物中CH4的释放量降低88%[65]; 底栖鲤鱼(Cyprinus carpio)扰动使CH4的扩散通量减少了33%, 但同时由于鲤鱼可增强有氧分解作用, 因此使CO2排放量增加, 最终导致温室气体的排放总量增加[66]. 此外, 温度是影响扰动生物对沉积物中碳转化影响的重要因素. 如5 ℃时羽摇蚊幼虫的存在对湖泊沉积物的有氧呼吸没有影响, 而30 ℃时摇蚊幼虫的存在(2 000只/m2)使沉积物的有氧呼吸作用比对照组沉积物高4.9倍[67]. 这也反映了扰动生物对沉积物碳代谢的季节变化及全球变暖的潜在影响.
3.2 对氮循环的影响
由于氮的主要存在形态均具有较强的溶解和迁移能力, 因此SWI附近氮主要是随水迁移, 迁移行为相对简单; 沉积物-水体系中氮循环更重要和更复杂的过程是氮的转化. 水环境中氮的常见价态包括氨态氮(-Ⅲ)、 单质氮(N2)、 N2O(Ⅰ)、 亚硝态氮(Ⅲ)和硝态氮(Ⅴ), 涉及的主要转化作用包括固氮、 硝化、 反硝化、 厌氧氨氧化和氨化等, 其中硝化和反硝化作用占主导地位[68]. 底栖生物扰动有助于在沉积物中形成好氧/缺氧的交替微生境, 影响沉积物内部和SWI附近的微生物过程和非生物过程, 进而影响氮的转化[69]. 生物扰动会增加沉积物中DO含量, 提高其洞穴中硝酸盐的浓度, 扩大硝化区, 增强硝化-反硝化作用的耦合, 促进沉积物中TN损失(即脱氮作用), 但不同生物有不同的脱氮效果[57]. 如寡毛纲动物S.tamesis的存在可使系统中N2产量增加4.2倍, 硝酸盐消耗量增加4倍[65]; 田螺科生物铜锈环棱螺(Bellamya aeruginosa)的生物扰动能显著促进沉积物的脱氮作用, 该作用主要通过增强硝化和反硝化细菌的协同作用实现[70]; 对3种扰动生物脱氮效果的对比研究发现, 红裸须摇蚊(Propsilocerus akamusi)幼虫的通道扩散作用对去除TN的贡献最大, 椭圆萝卜螺(Radix swinhoei)的生物扩散作用主要是增强表层沉积物的TN去除率, 颤蚓科生物苏氏尾鳃蚓(Branchiura sowerbyi)的向上输送作用对提高SWI的TN通量有较大贡献[71]. 与脱氮相反, 底栖动物的摄食和排泄将有机氮转化为无机氮(特别是氨态氮)并排入沉积物和水中, 增加了水体的无机氮含量, 因此在一些较浅的富营养化湖泊中, 底栖生物被认为是湖中养分的重要贡献者[72].
除脱氮外, 生物扰动对氮的转化特别是与氧化还原和微生物相关的转化有很多影响, 而且对不同生物影响也不同. 如颤蚓的存在增加了SWI的DO,NO-3,NH+4与温室气体N2O和CO2的通量, 且反硝化的相对重要性随颤蚓活动的增强而增加[73]. 羽摇蚊幼虫会促进硝化细菌将孔隙水中的NH+4氧化为NO-2和NO-3\3.3 对磷循环的影响
与氮不同, 水环境中的磷大部分与沉积物和悬浮颗粒物等固相物质结合, 以相对惰性的沉淀或吸附态存在. 一方面使生物扰动对磷迁移的影响更多是随沉积物颗粒的迁移, 另一方面也使对水环境中生物可利用的可溶性活性磷(SRP)的生成和迁移, 以及固相中磷的结合态及其转化的研究更有意义. 因此下面重点介绍生物扰动对SRP生成和迁移的影响, 以及对沉积物中磷结合态的影响. 生物扰动可能会促进沉积物中的磷向SRP转化和向上覆水释放. 如河蚬显著增加了太湖沉积物对O2的吸收以及沉积物中SRP和铵向上覆水的释放[78]; 颤蚓促进了孔隙水中SRP和沉积物中松散吸附磷含量的增加[79]; 铜锈环棱螺可显著提高0~30 mm深度内沉积物中SRP和0~20 mm深度内DGT活性磷的浓度, 与对照沉积物相比, 最大增幅分别为306%和1 133%, 同时也提高了SWI的磷通量(最大增幅为对照的218%)[80]. 相反, 也有一些扰动生物会减少沉积物中磷的释放, 如羽摇蚊的存在会显著减少沉积物中磷的释放[15]. 在上覆水比沉积物孔隙水含有更高浓度磷的条件下, 颤蚓科生物坦氏泥蚓(Ilyodrilus templetoni)和霍甫水丝蚓、 端足目生物Crangonyx sp.及摇蚊属生物Chironomus decorus S.G.4种底栖生物的存在均降低了上覆水中SRP的浓度, 被认为与沉积物ORP和水pH值的变化有关[81]. 太湖沉积物中的扰动生物霍甫水丝蚓[82]、 中国长足摇蚊(Tanypus chinensis)幼虫[83]和端足目的太湖大螯蜚(Grandidierella taihuensis)[84]会通过促进沉积物对磷的固定而降低上覆水中SRP的浓度; 河蚬通过减少沉积物对磷的固定而促进沉积物向上覆水释放SRP[85]. 可见, 生物扰动既可增加、 也可减少上覆水中磷和SRP的浓度, 主要由扰动生物及其作用的类型和水环境理化特征决定[81]. 底栖生物对沉积物中磷释放的影响还与生物密度密切相关: 日本海参(Apostichopus japonicus)密度的增加促进了沉积物中磷的解吸[86]; 随着河蚬密度的增加, 释放到上覆水中的SRP也明显增加[78].
沉积物中磷的形态受多种因素影响, 其中铁的形态被认为是影响磷形态的重要因素, 而生物扰动可通过改变SWI附近微环境特征影响铁的氧化还原, 进而影响磷的化学形态[84]. 一些底栖生物扰动会增加O2的渗透深度和氧化层厚度, 促进Fe(Ⅱ)的氧化, 并通过形成不溶性Fe(Ⅲ)水合氧化物对磷的沉淀和吸附作用实现磷的固定, 促进沉积物对磷的保留, 抑制活性磷释放, 形成铁和磷的耦合失活机制[80]. 如上述太湖大螯蜚的生物灌溉和通水作用可使DO的渗透深度增加20 mm以上, 使洞穴和周围沉积物的氧化还原条件在几分钟内发生显著变化, 使可溶性Fe(Ⅱ)被氧化并在表层沉积物中形成较稳定的铁氧化物结合态磷(Fe-P), 抑制沉积物中磷的释放[84]. 霍甫水丝蚓[82]和中国长足摇蚊[83]在促进沉积物中铁的氧化和增加沉积物磷保留方面也有类似作用." 另一些扰动生物可通过对DO直接或间接消耗降低沉积物的DO含量和ORP, 使沉积物中Fe(Ⅲ)还原为可溶性的Fe(Ⅱ), 促进与铁结合的磷释放. 如上述河蚬和铜锈环棱螺对沉积物中磷释放的促进主要是通过促进呼吸作用消耗DO, 使沉积物中的Fe(Ⅲ)羟基氧化物发生还原和溶解, 从而释放SRP并进入上覆水中[80,85]. 此外, 某些扰动生物和微生物的耦合作用也能在提高Fe-P含量的同时增加SRP浓度. 如近江牡蛎(Crassostrea ariakensis)一方面会在其养殖区形成氧化的沉积环境, 并显著提高Fe-P含量; 另一方面又会在沉积物中富集磷循环微生物(典型的磷溶解和磷积累相关微生物丰度分别增加17.76%和10.60%, 与磷循环相关的主要功能基因丰度也显著增加), 改变沉积物中微生物磷循环途径, 显著降低游离有机磷含量而增加以游离无机磷为主的SRP含量, 进而提高沉积物中磷的生物利用性[87]. 综上可见, 底栖扰动生物的种类、 扰动方式和数量是影响SWI附近磷形态和内源磷释放的重要因素. 近年来, 太湖中霍甫水丝蚓、 中国长足摇蚊幼虫和太湖大螯蜚等可抑制沉积物中SRP生成和释放的底栖动物数量大幅度减少被认为是湖水一直保持较高磷浓度的重要原因之一[84].
此外, 一些污染物会对扰动生物产生毒害作用, 影响扰动生物的行为, 进而产生一系列间接影响, 包括对生物扰动介导的生物地球化学过程的影响. 研究表明, 沉积物中MPs会通过影响扰动生物的活动改变磷的生物地球化学过程, 如MPs被中国长足摇蚊幼虫取食后会通过引起其肠道堵塞和氧化应激破坏生物的能量合成, 导致其生物扰动活性受损, 进而使沉积物磷的保留作用增强[88]. 碳和氮的过程也会受类似影响, 如上述MPs的存在可通过影响正颤蚓的活动完全抑制了颤蚓对SWI上CO2通量的促进作用, 并降低了颤蚓对NOx-N通量的促进作用[55].
4 结论与展望
底栖生物的挖掘、 摄食和排泄等活动改变了沉积物结构, 促进了SWI附近物质和能量的流动, 改变了水体环境的物理化学和微生物特征, 从而影响了SWI附近污染物的迁移转化和生物地球化学过程. 生物扰动会促进污染物和营养元素在SWI的双向迁移和在沉积物内的重新分布, 从而改变沉积物内部和SWI附近污染物和营养元素的赋存形态, 并影响它们的生物可利用性和环境风险; 生物扰动对水环境中关键营养元素生物地球化学行为的影响又会进一步影响全球更大范围内的物质循环. 此外, 由于不同生物之间、 污染物与生物之间、 微生物与生物之间以及环境与生物之间存在复杂的相互作用和影响, 进一步增加了相关研究的复杂性. 因此, 对底栖扰动生物不同环境功能的研究, 有助于深入了解污染物的水环境行为和风险, 以及水生态系统中的生物地球化学过程, 并有助于深刻认识生物扰动的生态环境意义.
未来研究可重点考虑以下几方面: 1) 在多种污染物共存时不同生物扰动对污染物迁移转化和生物可利用性的影响; 2) 利用现代生物技术和分析手段, 综合考虑生物因素和环境因素的协同作用, 以便更准确理解生物扰动对污染物和营养元素转化影响的机制; 3) 生物扰动对微生物群落的影响, 以及微生物群落与底栖动物之间的相互作用, 揭示微生物介导的生物扰动对污染物行为和生物地球化学过程影响的微观机制; 4) 全球变化背景下污染物长时间低浓度持续暴露对扰动生物及其对污染物环境行为与物质循环影响的间接效应和长期风险.
参考文献
[1] MERMILLOD-BLONDIN F. The Functional Significance of Bioturbation and Biodeposition on Biogeochemical Processes at the Water-Sediment Interface in Freshwater and Marine Ecosystems[J]. Journal of the North American Benthological Society, 2011, 30(3): 770-778.
[2] TIAN J Q, HUA X Y, JIANG X, et al. Effects of Tubificid Bioturbation on Bioaccumulation of Cu and Zn Released from Sediment by Aquatic Organisms [J]. Science of the Total Environment, 2020, 742: 140471-1-140471-11.
[3] LAING B A, BUATOIS L A, MANGANO M G, et al. Bioturbators as Ecosystem Engineers: Assessing Current Models [J]." PALAIOS, 2022, 37(12): 718-730.
[4] 覃雪波, 孙红文, 彭士涛, 等. 生物扰动对沉积物中污染物环境行为的影响研究进展 [J]." 生态学报, 2014, 34(1): 59-69. (QIN X B, SUN H W, PENG S T, et al. Review of the Impacts of Bioturbation on the Environmental Behavior of Contaminant in Sediment [J]." Acta Ecologica Sinica, 2014, 34(1): 59-69.)
[5] KAUPPI L, GÖBELER N, NORKKO J, et al. Changes in Macrofauna Bioturbation during Repeated Heatwaves Mediate Changes in Biogeochemical Cycling of Nutrients [J]." Frontiers in Marine Science, 2023, 9: 1070377-1-1070377-13.
[6] KRISTENSEN E, PENHA-LOPES G, DELEFOSSE M, et al. What Is Bioturbation? The Need for a Precise Definition for Fauna in Aquatic Sciences [J]." Marine Ecology Progress Series, 2012, 446: 285-302.
[7] CHAKRABORTY A, SAHA G K, ADITYA G. Macroinvertebrates as Engineers for Bioturbation in Freshwater Ecosystem" [J]." Environmental Science and Pollution Research, 2022, 29(43): 64447-64468.
[8] MERMILLOD-BLONDIN F, GAUDET J P, GÉRINO M, et al. Influence of Macroinvertebrates on Physico-Chemical and Microbial Processes in Hyporheic Sediments [J]." Hydrological Processes, 2003, 17(4): 779-794.
[9] 政芳, 李一楠, 陈渊, 等. 生物扰动下水/沉积物体系中pH,DO和pCO2的变化规律 [J]." 吉林大学学报(理学版), 2017, 55(3): 751-757. (ZHENG F, LI Y N, CHEN Y, et al. Variation of pH, DO and pCO2" in Water/Sediment System under Bioturbation [J]." Journal of Jilin University (Science Edition), 2017, 55(3): 751-757.)
[10] 李耀睿, 花修艺, 毛丹, 等. 颤蚓及其生物扰动对表层沉积物微环境pH和溶解氧的影响 [J]." 吉林大学学报(理学版), 2015, 53(6): 1334-1340." (LI Y R, HUA X Y, MAO D, et al. Effects of Tubificids and Their Bioturbation on pH and Dissolved Oxygen in the Microenvironment of Surface Sediment [J]." Journal of Jilin University (Science Edition), 2015, 53(6): 1334-1340.)
[11] LAVEROCK B, SMITH C J, TAIT K, et al. Bioturbating Shrimp Alter the Structure and Diversity of Bacterial Communities in Coastal Marine Sediments [J]." The ISME Journal, 2010, 4(12): 1531-1544.
[12] KRISTENSEN E, HOLMER M. Decomposition of Plant Materials in Marine Sediment Exposed to Different Electron Accepters (O2,NO-3and SO2-4), with Emphasis on Substrate Origin, Degradation Kinetics, and the Role of Bioturbation [J]." Geochimica et Cosmochimica Acta, 2001, 65(3): 419-433.
[13] GERINO M, STORA G, FRANÇOIS-CARCAILLET F, et al. Macro-invertebrate Functional Groups in Freshwater and Marine Sediments: A Common Mechanistic Classification [J]." Vie et Milieu-Life and Environment, 2003, 53(4): 221-232.
[14] 何怡, 门彬, 杨晓芳, 等. 生物扰动对沉积物中重金属迁移转化影响的研究进展 [J]." 生态毒理学报, 2016, 11(6): 25-36. (HE Y, MEN B, YANG X F, et al. Bioturbation Effect on the Migration and Transformation of Heavy Metals in Sediment: A Review [J]." Asian Journal of Ecotoxicology, 2016, 11(6): 25-36.)
[15] LEWANDOWSKI J, LASKOV C, HUPFER M. The Relationship between Chironomus plumosus Burrows and the Spatial Distribution of Pore-Water Phosphate, Iron and Ammonium in Lake Sediments [J]." Freshwater Biology, 2007, 52(2): 331-343.
[16] LI Y R, HUA X Y, ZHENG F, et al. Effects of Tubificid Bioturbation on Pore Structures in Sediment and the Migration of Sediment Particles [J]." Environmental Science and Pollution Research, 2016, 23(8): 8064-8075.
[17] ZHANG S, FANG X, ZHANG J B, et al. The Effect of Bioturbation Activity of the Ark Clam Scapharca subcrenata on the Fluxes of Nutrient Exchange at the Sediment-Water Interface [J]." Journal of Ocean University of China, 2020, 19(1): 232-240.
[18] 李耀睿. 颤蚓生物扰动对水-沉积物界面附近理化特征的影响 [D]. 长春: 吉林大学, 2016. (LI Y R. Effects of Tubificid Bioturbation on the Physical and Chemical Characteristics of Water-Sediment Interface [D]. Changchun: Jilin University, 2016.)
[19] ZHU Q Z, ALLER R C, FAN Y Z. High-Performance Planar pH Fluorosensor for Two-Dimensional pH Measurements in Marine Sediment and Water [J]." Environmental Science amp; Technology, 2005, 39(22): 8906-8911.
[20] HOU Y R, LI B, FENG G C, et al. Responses of Bacterial Communities and Organic Matter Degradation in Surface Sediment to Macrobrachium nipponense Bioturbation [J]." Science of the Total Environment, 2021, 759: 143534-1-143534-16.
[21] JANG J, HOCHSTEIN R, FORBES V E, et al. Bioturbation by Themarine Polychaete Capitella teleta Alters the Sediment Microbial Community by Ingestion and Defecation of Sediment Particles [J]." Science of the Total Environment, 2021, 752: 142239-1-142239-9.
[22] CIUTAT A, BOUDOU A. Bioturbation Effects on Cadmium and Zinc Transfers from a Contaminated Sediment and on Metal Bioavailability to Benthic Bivalves [J]." Environmental Toxicology and Chemistry, 2003, 22(7): 1574-1581.
[23] JOSEFSSON S, LEONARDSSON K, GUNNARSSON J S, et al. Bioturbation-Driven Release of Buried PCBs and PBDEs from Different Depths in Contaminated Sediments [J]." Environmental Science amp; Technology, 2010, 44(19): 7456-7464.
[24] TIAN S Y, TONG Y F, HOU Y. The Effect of Bioturbation by Polychaete Perinereis aibuhitensis on Release and Distribution of Buried Hydrocarbon Pollutants in Coastal Muddy Sediment [J]." Marine Pollution Bulletin, 2019, 149: 110487-1-110487-7.
[25] SUN N, CHEN Y L, XU S Q, et al. Remobilization and Bioavailability of Polycyclic Aromatic Hydrocarbons from Estuarine Sediments under the Effects of Nereis diversicolor Bioturbation [J]." Environmental Pollution, 2018, 242: 931-937.
[26] GRANBERG M E, GUNNARSSON J S, HEDMAN J E, et al. Bioturbation-Driven Release of Organic Contaminants from Baltic Sea Sediments Mediated by the Invading Polychaete Marenzelleria neglecta [J]." Environmental Science amp; Technology, 2008, 42(4): 1058-1065.
[27] HE Y, MEN B, YANG X F, et al. Investigation of Heavy Metals Release from Sediment with Bioturbation/Bioirrigation [J]." Chemosphere, 2017, 184: 235-243.
[28] ZHANG S R, XU D P, TIAN W J, et al. The Effect of Bioturbation on the Release Behavior of Polycyclic Aromatic Hydrocarbons from Sediments: A Sediment-Seawater Microcosm Experiment Combined with a Fugacity Model [J]." Environmental Pollution, 2024, 349: 123933-1-123933-10.
[29] CHENG D D, SONG J X, ZHAO X T, et al. Effects of Chironomid Larvae and Limnodrilus hoffmeisteri Bioturbation on the Distribution and Flux of Chromium at the Sediment-Water Interface [J]." Journal of Environmental Management, 2019, 245: 151-159.
[30] MUSTAJÄRVI L, NYBOM I, ERIKSSON-WIKLUND A K, et al. How Important Is Bioturbation for Sediment-to-Water Flux of Polycyclic Aromatic Hydrocarbons in the Baltic Sea? [J]." Environmental Toxicology and Chemistry, 2019, 38(8): 1803-1810.
[31] XIE M W, SIMPSON S L, WANG W X. Bioturbation Effects on Metal Release from Contaminated Sediments Are Metal-Dependent [J]." Environmental Pollution, 2019, 250: 87-96.
[32] SCHALLER J. Bioturbation/Bioirrigation by Chironomus plumosus as Main Factor Controlling Elemental Remobilization from Aquatic Sediments? [J]." Chemosphere, 2014, 107: 336-343.
[33] HEDMAN J E, BRADSHAW C, THORSSON M H, et al. Fate of Contaminants in Baltic Sea Sediments: Role of Bioturbation and Settling Organic Matter [J]." Marine Ecology Progress Series, 2008, 356: 25-38.
[34] 邓芊, 李耀睿, 花修艺, 等. 颤蚓生物扰动对Cu和Cd从上覆水向沉积物迁移的影响 [J]." 吉林大学学报(理学版), 2016, 54(5): 1186-1192. (DENG Q, LI Y R, HUA X Y, et al. Effect of Tubificid Bioturbation on Migration of Cu and Cd from Overlying Water to Sediment" [J]." Journal of Jilin University (Science Edition), 2016, 54(5): 1186-1192.)
[35] HE Y, MEN B, YANG X F, et al. Bioturbation/Bioirrigation Effect on Thallium Released from Reservoir Sediment by Different Organism Types [J]." Science of the Total Environment, 2015, 532: 617-624.
[36] LEAD J R, BATLEY G E, ALVAREZ P J J, et al. Nanomaterials in the Environment: Behavior, Fate, Bioavailability, and Effects: An Updated Review [J]." Environmental Toxicology and Chemistry, 2018, 37(8): 2029-2063.
[37] FAN S Y, YAN Z Z, QIAO L, et al. Biological Effects on the Migration and Transformation of Microplastics in the Marine Environment [J]." Marine Environmental Research, 2023, 185: 105875-1-105875-10.
[38] COPPOCK R L, LINDEQUE P K, COLE M, et al. Benthic Fauna Contribute to Microplastic Sequestration in Coastal Sediments [J]." Journal of Hazardous Materials, 2021, 415: 125583-1-125583-12.
[39] RENZ J R, POWILLEIT M, GOGINA M, et al. Community Bioirrigation Potential (BIPc), an Index to Quantify the Potential for Solute Exchange at the Sediment-Water Interface [J]." Marine Environmental Research, 2018, 141: 214-224.
[40] NÄKKI P, SETÄLÄ O, LEHTINIEMI M. Seafloor Sediments as Microplastic Sinks in the Northern Baltic Sea-Negligible Upward Transport of Buried Microplastics by Bioturbation [J]." Environmental Pollution, 2019, 249: 74-81.
[41] PAKARINEN K, AKKANEN J, LEPPÄNEN M T, et al. Distribution of Fullerenes (nC60) between Sediment and Water in Freshwaters [J]." Chemosphere, 2014, 108: 320-325.
[42] 李志轩. 颤蚓扰动对含重金属纳米粒子从上覆水向沉积物迁移的影响 [D]. 长春: 吉林大学, 2024. (LI Z X. Effects of Tubificid Bioturbation on Migration of Heavy Metal Containing Nanoparticles from Overlying Water to Sediment [D]. Changchun: Jilin University, 2024.)
[43] 吕继涛. 颤蚓生物扰动对沉积物中重金属释放及形态分布的影响 [D]. 长春: 吉林大学, 2009. (LÜ J T. Effects of Tubificid Bioturbation on the Physical and Chemical Characteristics of Water-Sediment Interface [D]. Changchun: Jilin University, 2009.)
[44] 童一帆. 双齿围沙蚕对河口沉积物中重金属生物有效性的影响 [D]. 天津: 天津科技大学, 2020. (TONG Y F. Effect of Perinereis aibuhitensis on Bioavailablility of Heavy Metals in Estuarine Sediments [D]. Tianjin: Tianjin University of Science and Technology, 2020.)
[45] CARIOU M, FRANCOIS C M, VOISIN J, et al. Effects of Bioturbation by Tubificid Worms on Biogeochemical Processes, Bacterial Community Structure and Diversity in Heterotrophic Wetland Sediments [J]." Science of the Total Environment, 2021, 795: 148842-1-148842-13.
[46] CASADO-COY N, SÁNCHEZ-JEREZ P, HOLMER M, et al. Bioturbation May Not Always Enhance the Metabolic Capacity of Organic Polluted Sediments [J]." Marine Environmental Research, 2020, 155: 104882-1-104882-7.
[47] HE Y, MEN B, YANG X F, et al. Relationship between Heavy Metals and Dissolved Organic Matter Released from Sediment by Bioturbation/Bioirrigation [J]." Journal of Environmental Sciences, 2019, 75: 216-223.
[48] 陈渊. 颤蚓 DOM 的理化性质及其对沉积物吸附Cu、 Cd的影响 [D]. 长春: 吉林大学, 2018. (CHEN Y. The Physical and Chemical Properties of DOM Solution Produced by Tubificids and Its Effects on Adsorption of Cu and Cd by Sediments [D]. Changchun: Jilin University, 2018.)
[49] SUN N, LIU J, WANG Z J, et al. Phenanthrene Release-Migration Characteristics and Potential Influencing Mechanisms from Paddy Soil to Overlying Water under Bioturbation in a Rice-Fish Coculture Agroecosystem [J]." Journal of Cleaner Production, 2023, 430: 139719-1-139719-10.
[50] WU Z H, LI R X, ZHANG Y F, et al. Insights into the Impacts of Bioturbation by Multiple Benthic Organisms on the Bioavailability and Toxic Effects of Perfluorooctane Sulfonate in Sediment [J]." Journal of Hazardous Materials, 2021, 420: 126675-1-126675-7.
[51] AMATO E D, SIMPSON S L, REMAILI T M, et al. Assessing the Effects of Bioturbation on Metal Bioavailability in Contaminated Sediments by Diffusive Gradients in Thin Films (DGT) [J]." Environmental Science amp; Technology, 2016, 50(6): 3055-3064.
[52] PANG J X, SUN B Q, LI H Z, et al. Influence of Bioturbation on Bioavailability and Toxicity of PAHs in Sediment from an Electronic Waste Recycling Site in South China [J]." Ecotoxicology and Environmental Safety, 2012, 84: 227-233.
[53] ZIAJAHROMI S, KUMAR A, NEALE P A, et al. Environmentally Relevant Concentrations of Polyethylene Microplastics Negatively Impact the Survival, Growth and Emergence of Sediment-Dwelling Invertebrates [J]." Environmental Pollution, 2018, 236: 425-431.
[54] CAPPARELLI M V, MARTÍNEZ-COLN M, LUCAS-SOLIS O, et al. Can the Bioturbation Activity of the Fiddler Crab Minuca rapax Modify the Distribution of Microplastics in Sediments? [J]." Marine Pollution Bulletin, 2022, 180: 113798-1-113798-9.
[55] WAZNE M, MERMILLOD-BLONDIN F, VALLIER M, et al. Microplastics in Freshwater Sediments Impact the Role of a Main Bioturbator in Ecosystem Functioning [J]." Environmental Science amp; Technology, 2023, 57(8): 3042-3052.
[56] DEMINA L L, GALKIN S V, SOLOMATINA A S. Bioaccumulation of Chemical Elements and Organic Carbon in Macrozoobenthic Organisms of the Laptev Sea [J]." Oceanology, 2024, 64(1): 9-26.
[57] SARKER S, MASUD-UL-ALAM M, HOSSAIN M S, et al. A Review of Bioturbation and Sediment Organic Geochemistry in Mangroves [J]." Geological Journal, 2021, 56(5): 2439-2450.
[58] SEA M A, HILLMAN J R, THRUSH S F. The Influence of Mussel Restoration on Coastal Carbon Cycling [J]." Global Change Biology, 2022, 28(17): 5269-5282.
[59] XIAO K, WILSON A M, LI H L, et al. Large CO2 Release and Tidal Flushing in Salt Marsh Crab Burrows Reduce the Potential for Blue Carbon Sequestration [J]." Limnology and Oceanography, 2021, 66(1): 14-29.
[60] GUIMOND J A, SEYFFERTH A L, MOFFETT K B, et al. A Physical-Biogeochemical Mechanism for Negative Feedback between Marsh Crabs and Carbon Storage [J]." Environmental Research Letters, 2020, 15(3): 034024-1-034024-10.
[61] 陈大屡, 赵璐峰, 唐建军, 等. 沉积物-水界面生物扰动对湿地甲烷排放影响研究进展 [J/OL]. 生态学杂志, (2024-10-09)[2024-11-20]. https://link.cnki.net/urlid/21.1148.Q.20241009.1057.004. (CHEN D L, ZHAO L F, TANG J J, et al. Advances in the Effects of Bioturbation at Sediment-Water Interface on Methane Emissions from Wetlands [J/OL]. Chinese Journal of Ecology, (2024-10-09)[2024-11-20]. https://link.cnki.net/urlid/21.1148.Q.20241009.1057.004.)
[62] QIN G M, LU Z, GAN S C, et al. Fiddler Crab Bioturbation Stimulates Methane Emissions in Mangroves: Insights into Microbial Mechanisms [J]." Soil Biology amp; Biochemistry, 2024, 194: 109445-1-109445-14.
[63] XIAO K, WU Y C, PAN F, et al. Widespread Crab Burrows Enhance Greenhouse Gas Emissions from Coastal Blue Carbon Ecosystems [J]." Communications Earth amp; Environment, 2024, 5(1): 437-1-437-9.
[64] DONG Y H, YUAN J J, LI J J, et al. Divergent Impacts of Animal Bioturbation on Methane and Nitrous Oxide Emissions from Mariculture Ponds [J]." Water Research, 2024, 270: 122822-1-122822-12.
[65] BENELLI S, BARTOLI M. Worms and Submersed Macrophytes Reduce Methane Release and Increase Nutrient Removal in Organic Sediments [J]." Limnology and Oceanography Letters, 2021, 6(6): 329-338.
[66] OLIVEIRA JUNIOR E S, TEMMINK R J M, BUHLER B F, et al. Benthivorous Fish Bioturbation Reduces Methane Emissions, but Increases Total Greenhouse Gas Emissions [J]." Freshwater Biology, 2019, 64(1): 197-207.
[67] BARANOV V, LEWANDOWSKI J, KRAUSE S. Bioturbation Enhances the Aerobic Respiration of Lake Sediments in Warming Lakes [J]." Biology Letters, 2016, 12(8): 20160448-1-20160448-4.
[68] KUYPERS M M M, MARCHANT H K, KARTAL B. The Microbial Nitrogen-Cycling Network [J]." Nature Reviews Microbiology, 2018, 16(5): 263-276.
[69] LAVEROCK B, TAIT K, GILBERT J A, et al. Impacts of Bioturbation on Temporal Variation in Bacterial and Archaeal Nitrogen-Cycling Gene Abundance in Coastal Sediments [J]." Environmental Microbiology Reports, 2014, 6(1): 113-121.
[70] LI X, XIE C, XU Y H, et al. Freshwater Snails (Bellamya aeruginosa) Bioturbation to Enhance Nitrogen Removal and Associated Mechanism in Constructed Wetlands [J]." Bioresource Technology, 2024, 417: 131849-1-131849-11.
[71] GAO J, ZHI" Y, HUANG Y Y, et al. Effects of Benthic Bioturbation on Anammox in Nitrogen Removal at the Sediment-Water Interface in Eutrophic Surface Waters [J]." Water Research, 2023, 243: 120287-1-120287-8.
[72] PENG K, QIN B Q, CAI Y J, et al. Water Column Nutrient Concentrations Are Related to Excretion by Benthic Invertebrates in Lake Taihu, China [J]." Environmental Pollution, 2020, 261: 114161-1-114161-9.
[73] NOGARO G, BURGIN A J. Influence of Bioturbation on Denitrification and Dissimilatory Nitrate Reduction to Ammonium (DNRA) in Freshwater Sediments [J]." Biogeochemistry, 2014, 120(1/2/3): 279-294.
[74] SAMUILOVIENE A, BARTOLI M, BONAGLIA S, et al. The Effect of Chironomid Larvae on Nitrogen Cycling and Microbial Communities in Soft Sediments [J]." Water, 2019, 11(9): 1931-1-1931-16.
[75] MORAES P C, ZILIUS M, BENELLI S, et al. Nitrification and Denitrification in Estuarine Sediments with Tube-Dwelling Benthic Animals [J]." Hydrobiologia, 2018, 819(1): 217-230.
[76] AN Z R, GAO D Z, CHEN F Y, et al. Crab Bioturbation Alters Nitrogen Cycling and Promotes Nitrous Oxide Emission in Intertidal Wetlands: Influence and Microbial Mechanism [J]." Science of the Total Environment, 2021, 797: 149176-1-149176-12.
[77] LIU C, XIA J B, CUI Q, et al. Crab Bioturbation Affects Competition between Microbial Nitrogen Removal and Retention in Estuarine and Coastal Wetlands [J]." Environmental Research, 2022, 215(P2): 114280-1-114280-10.
[78] ZHANG L, SHEN Q S, HU H Y, et al. Impacts of Corbicula fluminea on Oxygen Uptake and Nutrient Fluxes across the Sediment-Water Interface [J]." Water, Air amp; Soil Pollution, 2011, 220(1/2/3/4): 399-411.
[79] ZHANG L, LIAO Q J H, GU X Z, et al. Oxygen and Phosphorus Dynamics in Freshwater Sediment after the Deposition of Flocculated Cyanobacteria and the Role of Tubificid Worms [J]." Journal of Hazardous Materials, 2014, 266: 1-9.
[80] YANG Y Q, ZHANG J Y, LIU L, et al. Experimental Study on Phosphorus Release from Sediment with Fresh-Water Snail (Bellamya aeruginosa) Bioturbation in Eutrophic Lakes [J]." Journal of Soils and Sediments, 2020, 20(5): 2526-2536.
[81] LESLIE A W, LAMP W O. Burrowing Macroinvertebrates Alter Phosphorus Dynamics in Drainage Ditch Sediments [J]." Aquatic Sciences, 2019, 81(2): 23-1-23-12.
[82] CHEN M S, DING S M, LIU L, et al. Fine-Scale Bioturbation Effects of Tubificid Worm (Limnodrilus hoffrneisteri) on the Lability of Phosphorus in Sediments [J]." Environmental Pollution, 2016, 219: 604-611.
[83] CHEN M S, DING S M, LIU L, et al. Iron-Coupled Inactivation of Phosphorus in Sediments by Macrozoobenthos (Chironomid larvae) Bioturbation: Evidences from High-Resolution Dynamic Measurements [J]." Environmental Pollution, 2015, 204: 241-247.
[84] LI C, DING S M, CAI Y J, et al. Decrease in Macrofauna Density Increases the Sediment Phosphorus Release and Maintains the High Phosphorus Level of Water Column in Lake Taihu: A Case Study on Grandidierella taihuensis [J]." Water Research, 2022, 225: 119193-1-119193-10.
[85] CHEN M S, DING S M, LIU L, et al. Kinetics of Phosphorus Release from Sediments and Its Relationship with Iron Speciation Influenced by the Mussel (Corbicula fluminea) Bioturbation [J]." Science of the Total Environment, 2016, 542: 833-840.
[86] HOU Y R, SUN Y J, GAO Q F, et al. Bioturbation by Sea Cucumbers Apostichopus japonicus Affects Sediment Phosphorus Forms and Sorption Characteristics [J]." Aquaculture Environment Interactions, 2018, 10: 201-211.
[87] YAN Q, JIA Z P, SONG J T, et al. Oyster Culture Changed the Phosphorus Speciation in Sediments through Biodeposition [J]." Environmental Research, 2023, 216: 114586-1-114586-11.
[88] SONG X J, DING J N, ZHANG Y B, et al. New Insights into Changes in Phosphorus Profile at Sediment-Water Interface by Microplastics: Role of Benthic Bioturbation [J]." Journal of Hazardous Materials, 2024, 469: 134047-1-134047-12.
(责任编辑: 单 凝)
