工程化的PMN-MDSCs来源外泌体在胶原诱导性关节炎小鼠中的应用
2025-01-25陈玉梅戴锦东张一珂李泽兰朱栋炜朱成栋




[摘要] 目的: 使用电穿孔方法对多形核髓源性抑制细胞(polymorphonuclear myeloid-derived suppressor cells,PMN-MDSCs)来源的外泌体(exosomes,Ex)进行工程化改造,观察其对胶原诱导性关节炎(collagen-induced arthritis,CIA)模型小鼠疾病进程的干预作用。方法: 构建CIA模型小鼠,磁珠分选PMN-MDSCs,运用超滤技术联合试剂沉淀法制备培养上清液中的PMN-Ex,免疫印迹法检测Ex标志性蛋白。使用电穿孔技术对PMN-Ex进行改造并设置分组,包括未处理的PMN-Ex组,电转miR-93-5p mimics NC组(miR-93-5p mimics NC组)以及电转miR-93-5p mimics组(miR-93-5p mimics组)。利用实时荧光定量PCR检测miR-93-5p的装载效率。流式细胞术检测改造后的Ex对Th17细胞分化的影响。将不同组别的PMN-Ex尾静脉注射到CIA小鼠体内,分别观察足趾外观情况、足趾HE染色切片情况,测定小鼠的平均关节炎指数(mean arthritic index,MAI)、腘窝淋巴结Th17的比例、血清IL-17A水平,以此判断不同组别PMN-Ex对CIA小鼠的干预作用。结果: PMN-MDSCs被成功分选并制备了PMN-Ex。荧光定量PCR结果显示,miR-93-5p mimics组中miR-93-5p的表达水平明显高于miR-93-5p mimics NC组。相比miR-93-5p mimics NC组,miR-93-5p mimics组处理的小鼠足趾红肿轻微,关节结构较完整;MAI、腘窝淋巴结Th17细胞比例以及血清IL-17A水平明显降低。结论: 使用miR-93-5p mimics工程化改造后的PMN-Ex可以更有效地延缓CIA小鼠的疾病进程。
[关键词] 胶原诱导性关节炎;髓源性抑制细胞;外泌体;miR-93-5p
[中图分类号] R392.9" [文献标志码] A" [文章编号] 1671-7783(2025)01-0001-07
DOI: 10.13312/j.issn.1671-7783.y240130
[引用格式]陈玉梅, 戴锦东, 张一珂, 等. 工程化的PMN-MDSCs来源外泌体在胶原诱导性关节炎小鼠中的应用[J]. 江苏大学学报(医学版), 2025, 35(1): 1-7.
[基金项目]国家自然科学基金青年基金资助项目(82202001);仪征市卫生健康委2024年度医学科研项目(Yxh2024-2-19)
[作者简介]陈玉梅(1972—),女,主任技师,主要从事自身免疫性疾病的检验指标研究;朱栋炜(通讯作者),副教授,硕士生导师,E-mail: 1000005601@ujs.edu.cn;朱成栋(通讯作者),副主任医师,E-mail: dongdong801208@163.com
Engineered PMN-MDSCs-derived exosomes delay the progression of collagen-induced arthritis in mice
CHEN Yumei1 , DAI Jindong2 , ZHANG Yike2 , LI Zelan2 , ZHU Dongwei2 , ZHU Chengdong3
(1. Department of Laboratory Medicine, Yizheng People′s "Hospital, Yizheng Jiangsu 211400; 2. School of Medicine, Jiangsu University, Jiangsu Key Laboratory of Laboratory Medicine, Zhenjiang Jiangsu 212013; 3. Department of Orthopedics, Yizheng People′s "Hospital, Yizheng Jiangsu 211400, China)
[Abstract] Objective: To make engineered exosomes (Ex) derived from polymorphonuclear myeloid-derived suppressor cells (PMN-MDSCs) by electroporation, and evaluate the intervention effect on the progression of collagen-induced arthritis (CIA) mice model. Methods: Firstly, PMN-MDSCs were selected using magnetic beads from CIA mice, and PMN-Ex were prepared in the culture supernatant using ultrafiltration technology combined with reagent precipitation method. The surface marker proteins were detected by Western blotting. The PMN-Ex were modified by electroporation technology. The loading efficiency of miR-93-5p in PMN-Ex was detected by fluorescence quantitative PCR. The modified PMN-Ex were added to regulate the differentiation of Th17 cells. After injecting different PMN-Ex into the CIA mice, the appearance of the toes, the HE staining section of the toes, the mean arthritis index (MAI), the proportion of Th17, and serum IL-17A level in mice were observed. Results: PMN-Ex were prepared successfully. The fluorescence quantitative PCR results showed that the expression level of miR-93-5p in PMN-Ex in the experimental group was significantly higher than that in the negative control group. Compared to the negative control group, the mice treated in the experimental group had mild toe redness and swelling and more complete joint structure. In addition, the proportion of Th17 cells in popliteal lymph node, and serum IL-17A level were significantly reduced. Conclusion: The miR-93-5p mimics-engineered PMN-Ex can alleviate the development of CIA mice more effectively.
[Key words] collagen-induced arthritis; myeloid-derived suppressor cell; exosomes; miR-93-5p
类风湿关节炎(rheumatoid arthritis,RA)是一种慢性炎症性自身免疫性疾病[1] ,全球患病率约1%,我国患病率约0.5%,总患病人群大约500万人,通常40~60岁开始发病[2-3] ,女性患RA的风险是男性的2~3倍[4] 。研究表明,RA患者的血清和关节滑液中均表达高水平的IL-17,并且患者外周血中Th17细胞数量增多[5] 。胶原诱导性关节炎(collagen-induced arthritis,CIA)小鼠是研究RA的重要模型,1977年Trentham等[6] 通过皮内免疫诱导构建CIA模型,该模型的表型在临床特征、病理变化和免疫学方面与RA十分相似。小鼠品系DBA/1(H-2q)有较高的CIA发病率,在关节病理变化方面与人类RA更为相似[7] 。
本课题组针对RA的治疗进行了相关研究,结果发现多形核髓源性抑制细胞(polymorphonuclear myeloid-derived suppressor cells,PMN-MDSCs)来源的外泌体(exosomes,Ex)可以通过miR-29a-3p和miR-93-5p分别靶向T盒子转录因子TBX21(T-bet)和信号转导及转录激活因子3(STAT3),从而抑制Th1和Th17细胞分化,减弱CIA小鼠的关节炎症状[8] ;另一项研究表明,PMN-Ex能够通过其内容物前列腺素E2增强IL-10+ "B细胞数量,从而改善CIA小鼠的关节炎症状[9] 。本研究试图通过工程化改造PMN-Ex,以此增强PMN-Ex延缓CIA小鼠疾病进程的作用。据资料显示,工程化改造Ex包括表面改造和内容物负载[10] 。目前关于MDSC-Ex的内容物负载方式主要采取转染母细胞的方式进行,本课题组利用miR-29a-3p mimics转染PMN-MDSCs[8] ,分离发现PMN-Ex内的miR-29a-3p表达也增加,进而研究PMN-Ex对初始CD4+ "T细胞分化的影响。电穿法是利用电场作用于悬浮在液体中的Ex,瞬间高强度电场产生的电脉冲能穿透Ex的薄膜,在薄膜上形成暂时的小孔,使药物或类似物质能够从小孔中向Ex内扩散[11-12] 。电穿孔技术的优点是没有添加任何化学药剂,在加载DNA和RNA等亲水药物时非常有效[13] 。Bai等[14] 将人工合成的siRNA通过电穿孔技术装载进靶向肿瘤归巢穿膜肽(tLyp-1)的Ex内,结果发现此Ex转染肺癌和肿瘤干细胞的效率较高。本研究拟对PMN-Ex进行电穿法改造,并探究其对CIA小鼠疾病进程的影响,从而为RA的治疗提供新的方法。
1 材料与方法
1.1 主要试剂与仪器
MDSCs磁珠分选试剂盒(德国美天旎公司);新生小牛血清、DMEM、RPMI-1640、胰蛋白酶(美国Gibco公司);Ex分选试剂盒(美国SBI公司);miR-93-5p mimics、mimics-NC(广州锐博生物科技有限公司);兔抗小鼠钙黏蛋白(Calnexin)、CD63、CD9单克隆抗体(英国Abcam公司);牛二型胶原、弗氏完全佐剂和弗氏不完全佐剂(美国Sigma公司);流式细胞仪(美国Beckman公司);培养箱(上海力康公司);凝胶成像系统(美国GE公司)。
1.2 建立CIA小鼠模型
DBA/1J小鼠购自常州卡文斯实验动物有限公司,6~8周龄,体重18~22 g。第1天,小鼠尾静脉注射0.1 mL浓度为2 mg/mL的牛二型胶原和同体积的弗氏完全佐剂的混合液;第21天,小鼠尾静脉注射0.1 mL浓度为2 mg/mL的牛二型胶原和同样体积的弗氏不完全佐剂的混合液,实验期间定期观察小鼠的足趾,并拍照记录。
1.3 磁珠分选PMN-MDSCs并测定其纯度
摘取CIA小鼠的脾脏,将其研磨成细胞悬液,然后从MDSCs磁珠分选试剂盒中选择FcR阻断试剂、抗Ly-6G生物素和抗生物素磁珠加入细胞悬液,在冰盒中孵育后,将磁珠分选柱装在分选器上,用PBS洗柱,重复3次,最后获得的细胞悬液即为PMN-MDSCs,采用流式细胞仪对分选出的细胞进行纯度检测。
1.4 PMN-Ex的提取和蛋白浓度测定
将PMN-MDSCs用RPMI-1640培养液于细胞培养箱中培养,20 h后收集上清液,在超滤管中进行超滤,获得浓缩液,然后用快速提取试剂盒提取Ex,PBS重悬Ex,于-80 ℃保存;再用等体积的裂解液(RIPA∶ PMSF=250∶1)裂解Ex,采用BCA法测定Ex裂解上清液中的蛋白浓度。
1.5 免疫印迹法检测PMN-Ex的特异性蛋白
使用等体积的裂解液(RIPA∶PMSF=250∶1)裂 解Ex,冰上放置10 min并振荡。4 ℃、12 000× "g ,离心15 min,吸取上清液,按体积比3∶1加 入4×SDS-PAGE混匀后,沸水煮10 min。常温14 000× g 离心10 min,吸取上清液分装于EP管内,备用;将制备的样本进行SDS-PAGE电泳,然后转膜,BSA封闭1 h,将兔抗小鼠Calnexin、CD63单克隆抗体、CD9单克隆抗体,完全覆盖PVDF膜,4 ℃孵育12 h。第2天,用辣根过氧化物酶标记的羊抗兔IgG抗体覆盖PVDF膜,室温孵育2 h后 ,用ECL显色曝光,在凝胶成像系统下分析条带。
1.6 工程化改造Ex
用电穿仪制备工程化的Ex,利用瞬时电场在Ex膜上穿孔,使外源性的miR-93-5p mimics进入PMN-Ex中,达到过表达miR-93-5p的目的。实验分为未处理的PMN-Ex组、miR-93-5p mimics NC组 和miR-93-5p mimics组。miR-93-5p mimics、mimics NC粉末用 ddH2O溶解(终浓度1 μg/μL),将电极杯及专用长头吸管置于超净台中紫外灭菌30 min以上;每个组别均含有20 μg/μL的PMN-Ex,其中miR-93-5p mimics组和miR-93-5p mimics NC组分别加入5 μL的miR-93-5p mimics和mimics NC,混匀后加入电极杯内;电穿参数设置:111 V电转3.0 ms,间歇10.0 ms,25 V电转10.0 ms,间歇50.0 ms,循环10次;最后将电穿好的PMN-Ex 37 ℃水浴1 h,使膜孔完全闭合。加入200 μL PBS后用100 kD超滤离心管洗涤,去除游离在Ex外部的miRNA;滤菌器除菌后,于-80 ℃保存备用。
1.7 检测改造后的Ex装载效率
用Trizol法提取各组Ex的总RNA,逆转录试剂盒(日本Toyobo公司)对相关miRNA进行逆转录,逆转录定量PCR检测miR-93-5p的表达,PCR采用2720热循环仪(美国ThermoFisher公司)进行,使用Bio-Rad SYBR green mix进行实时PCR,最后用ΔΔCt法对结果进行分析。
1.8 改造后的Ex体外对Th17细胞分化的影响
建立初始T细胞到Th17细胞的分化体系,使用CD4+ "T细胞分离试剂盒(德国美天旎公司)分离小鼠CD4+ "T细胞。在24孔板中预涂抗CD3单抗(2 μg/mL),每孔接种1×106 个细胞,每个孔内加入相应浓度的细胞因子:抗CD28单抗(2 μg/mL),TGF-β(5 ng/mL),IL-6(30 μg/mL),抗IL-4单抗(5 μg/mL) ,抗IFN-γ单抗(5 μg/mL)和IL-23(30 ng/mL) 。用含15%胎牛血清(经过100 000× g 离心16 h处理)、pH 7.2~7.4的RPMI-1640细胞培养液,37 ℃、5% CO2 "条件下培养72 h。在Th17细胞分化体系中加入各组Ex,检测Th17细胞比例和IL-17A水平。
1.9 动物实验分组
分别在免疫的第18和24天进行小鼠尾静脉注射,每组6只。① PBS组:注射100 μL的PBS;② 未 处理的PMN-Ex组:注射100 μL用PBS溶解的未作处理的PMN-Ex;③ miR-93-5p mimics NC组:注射100 μL用PBS溶解的miR-93-5p mimics NC组的PMN-Ex;④ miR-93-5p mimics组:注射100 μL用PBS溶解的miR-93-5p mimics组的PMN-Ex。
1.10 小鼠疾病进程评价和足趾切片病理学观察
在免疫21 d后,每3 d观察小鼠关节状况(4只爪子关节炎得分之和):0分,无红肿;1分,关节发红但无肿胀;2分,局限于足趾或踝关节的轻度红肿;3分 ,足趾至踝关节的轻度红肿;4分,严重的关节肿胀和运动障碍。平均关节炎指数(mean arthritic index,MAI)=每组关节炎得分之和/小鼠总数。于免疫后第42天,取每只小鼠具有代表性的前爪和后爪,将其分别置于10%福尔马林中;用石蜡包埋,切片4 μm,HE染色,显微镜下观察,拍照记录。评估关节间隙大小、骨质破坏程度和浸润性淋巴细胞数量。
1.11 各组模型小鼠腘窝淋巴结中Th17细胞和血清IL-17A水平检测
在免疫小鼠第42天,摘取小鼠两侧腘窝淋巴结,研磨制备单细胞悬液,加入FITC标记的抗小鼠CD4单克隆抗体,在24孔培养板上培养5 h后用流体细胞仪检测并分析数据。收集各组小鼠的眼球血,至1.5 mL的EP管中,37 ℃金属浴30 min,离心后吸取上层血清,用IL-17A检测试剂盒(上海碧云天公司)进行检测,测量光密度值,建立标准曲线,分析样本IL-17A的含量。
1.12 统计学分析
应用GraphPad Prism 8.0软件绘制统计图。符合正态分布计量资料用均值±标准差表示,两组均数比较采用两样本 t 检验,多组均数比较采用单因素方差分析,进一步组间比较采用Turkey检验。 P lt;0.05为差异有统计学意义。
2 结果
2.1 PMN-Ex的提取与鉴定
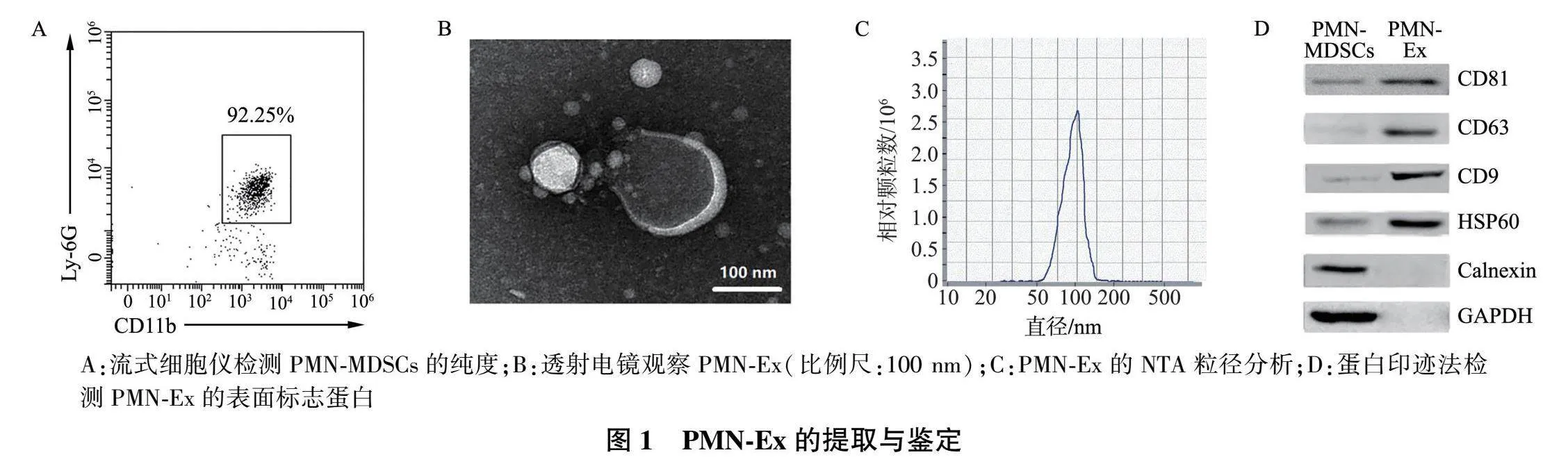
PMN-MDSCs为CD11b和Ly-6G双阳性细胞,通过流式细胞仪测定磁珠分选的PMN-MDSCs,结果显示PMN-MDSCs的纯度达到90%以上(图1A)。通过超滤法制备PMN-MDSCs培养上清液中的Ex,透射电镜观察结果显示(图1B),具有典型的茶托样结构。NTA粒径分析结果显示(图1C),PMN-Ex的直径为50~120 nm。免疫印迹法检测结果显示(图1D),PMN-Ex高表达CD9、CD63、CD81和HSP60分子,不表达Calnexin蛋白和GAPDH蛋白。
2.2 工程化改造PMN-Ex的装载效率
利用电穿孔技术制备工程化的Ex,结果显示,miR-93-5p mimics组PMN-Ex中miR-93-5p的表达水平明显高于miR-93-5p mimics NC组,并且相比于miR-93-5p mimics细胞转染组,miR-93-5p mimics组的miR-93-5p水平显著升高(图2),表明相比干细胞转染的方法,电穿孔技术能有效地将miR-93-5p mimics装载进Ex内。
2.3 改造后的Ex对Th17细胞分化的影响
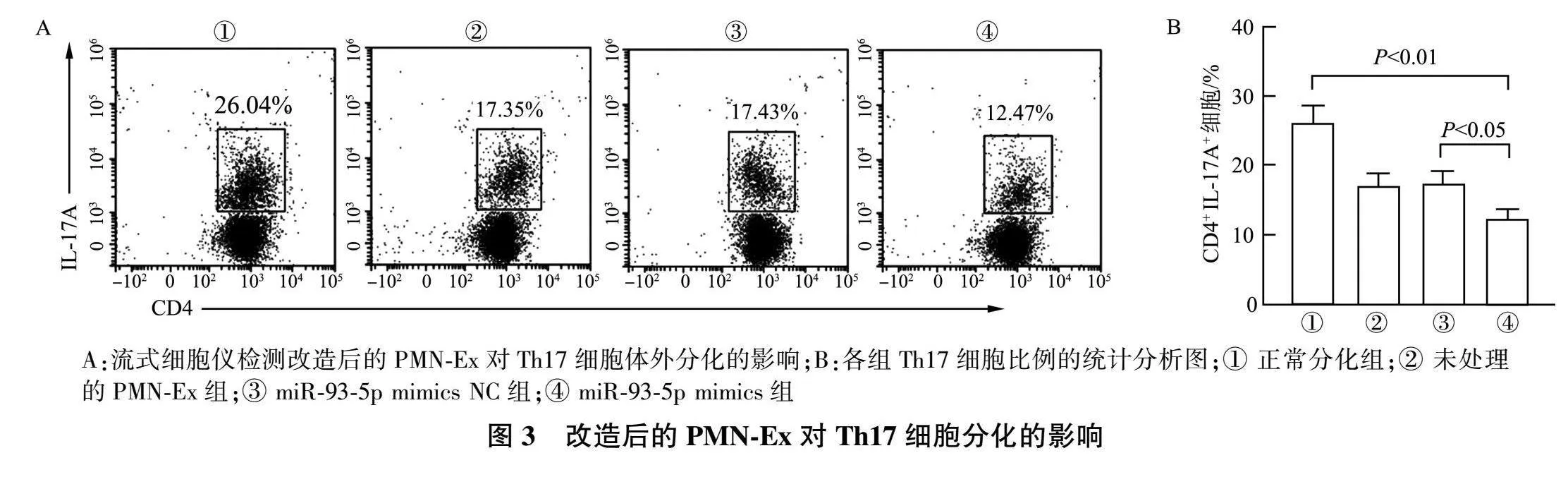
在Th17细胞诱导分化体系中,加入不同组别的PMN-Ex,流式细胞仪检测Th17细胞的比例(图3A)。未处理的PMN-Ex组和miR-93-5p mimics NC组没有明显差异,相较于miR-93-5p mimics NC组,miR-93-5p mimics组Th17细胞的比例明显降低(图3B)。
2.4 各组小鼠关节炎疾病进程
使用不同组别的PMN-Ex处理CIA小鼠,结果发现PBS组小鼠的MAI水平最高,未处理的PMN-Ex组与miR-93-5p mimics NC组相比,MAI无明显差异;而与miR-93-5p mimics NC组相比,miR-93-5p mimics组小鼠MAI水平则明显下降( P lt;0.05),见图4。
2.5 各组小鼠足趾外观及关节活动情况
在免疫第42天对CIA模型小鼠进行拍照,发现PBS组的小鼠足趾严重红肿,miR-93-5p mimics NC组和未处理的PMN-Ex组内小鼠足趾轻微红肿,miR-93-5p mimics组小鼠的足趾外观几乎没有红肿(图5) 。
2.6 各组小鼠足趾切片HE染色情况
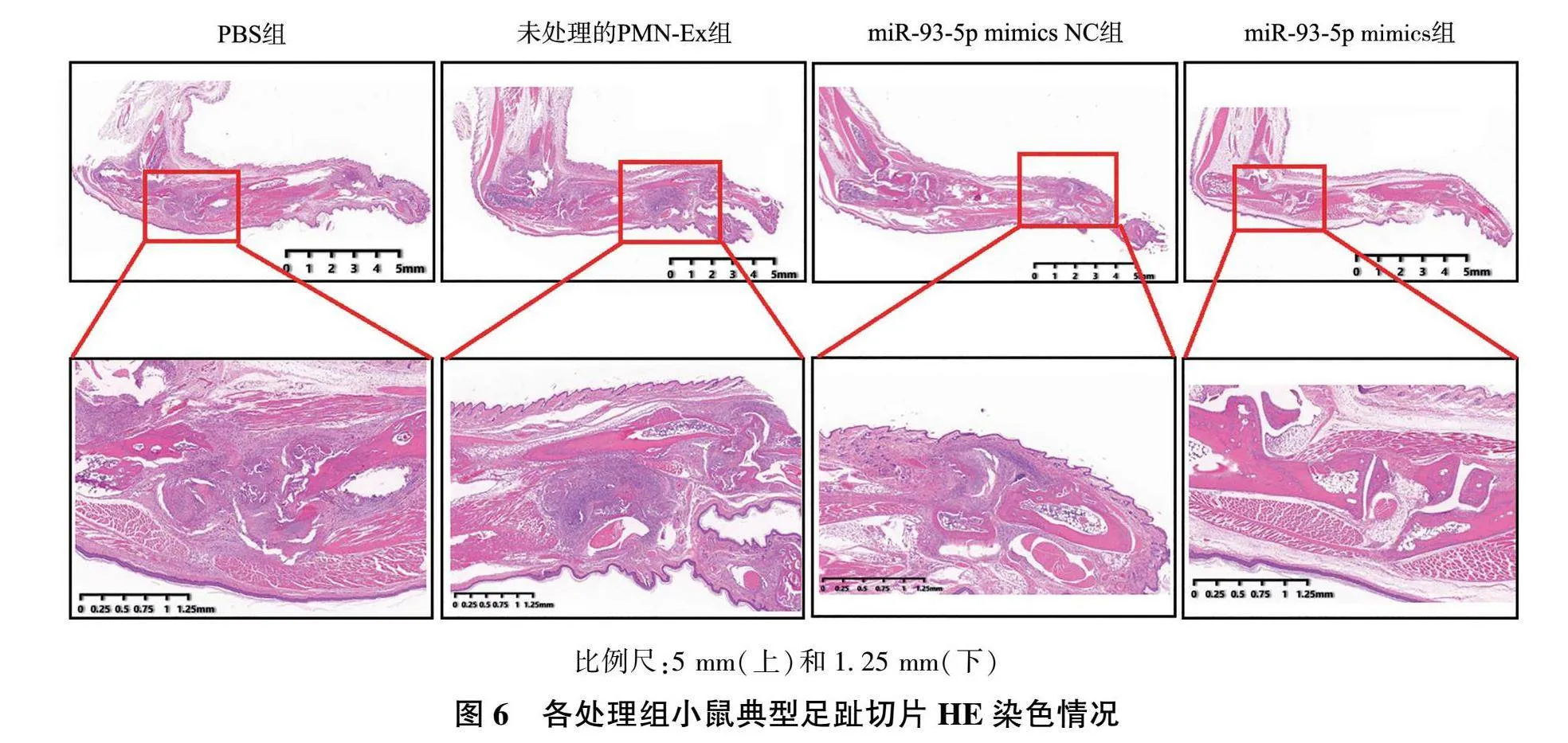
对各组别PMN-Ex处理后的CIA小鼠足趾进行切片及HE染色,结果显示,PBS组小鼠关节结构遭到破坏,关节腔缩小,并可见大量炎性细胞浸润。未处理的PMN-Ex组和miR-93-5p mimics NC组小鼠足趾关节显示淋巴细胞浸润较少,关节结构相对完整。相较于miR-93-5p mimics NC组,miR-93-5p mimics组小鼠的足趾关节结构更为完整,保护作用更强(图6)。
2.7 各处理组小鼠腘窝淋巴结中的Th17细胞比例
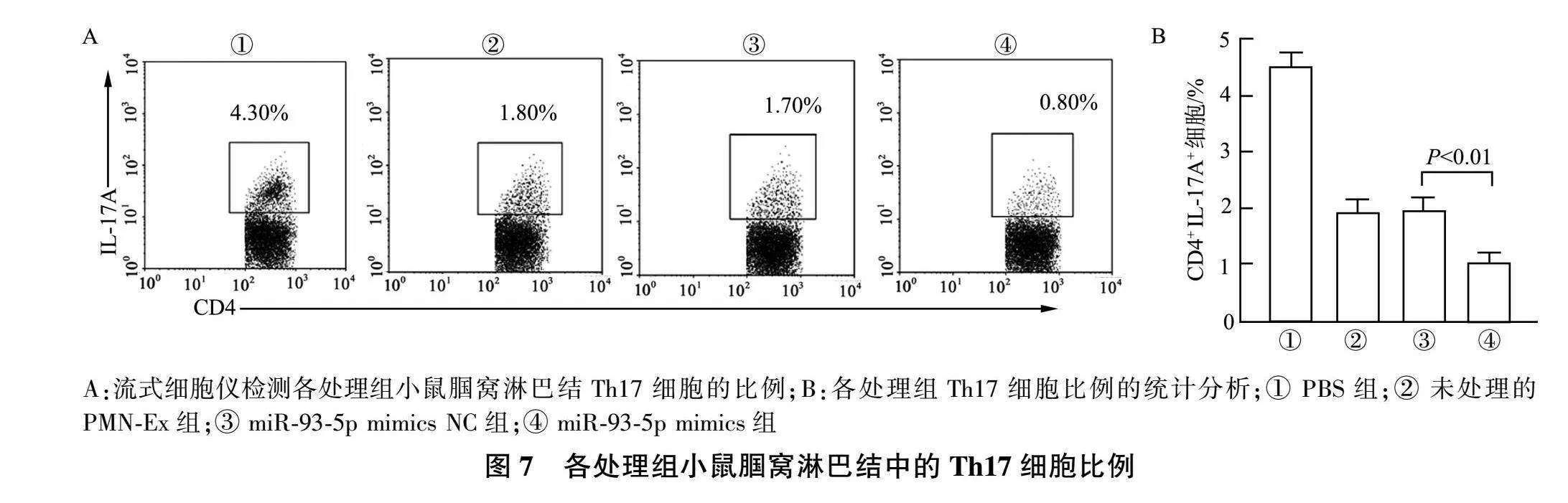
流式细胞仪检测各处理组小鼠腘窝淋巴结内Th17细胞的比例(图7A),未处理的PMN-Ex组与miR-93-5p mimics NC组比较,小鼠腘窝淋巴结内Th17细胞的比例无明显差异;而相较于miR-93-5p mimics NC组,miR-93-5p mimics组小鼠腘窝淋巴结内Th17细胞的比例明显下降( P lt;0.01),见图7B。
2.8 各处理组小鼠血清IL-17A的水平
ELISA测定各处理组小鼠血清中IL-17A水平,结果显示,未处理的PMN-Ex组与miR-93-5p mimics NC组比较,小鼠血清IL-17A水平无明显差异;而相较于miR-93-5p mimics NC组,miR-93-5p mimics处理组小鼠血清IL-17A水平明显下降( P lt;0.01),见图8。
3 讨论
RA是一种慢性自身免疫性疾病,其主要特点是免疫功能紊乱[15] 。目前对RA的治疗主要是对症治疗,即控制疾病的发展,缓解关节疼痛感,维持受累关节的功能,尽可能减少对骨的破坏,然而非靶向性疗法不可避免地会对RA患者产生显著的不良反应,也会诱发系统性并发症,并且非靶向性疗法的价格昂贵[5,16] 。因此,找到一种更安全有效的治疗方式显得格外重要。
Ex属于内源性囊泡,包裹各种脂质、蛋白质、核酸,并能将其装载的物质运输至受体细胞而发挥生物学作用,它可以通过生物屏障,具有低免疫原性和低毒性的特点,在机体内难以被降解或清除[17] 。相对其来源细胞,利用Ex调节受体细胞生物学功能来治疗疾病具有很大优势[18-19] 。研究发现,在自身免疫性斑秃(alopecia areata,AA)小鼠模型中,使用MDSC-Ex治疗AA小鼠后,MDSC-Ex主要被Treg细胞摄取,随后Treg细胞比例大幅增加,辅助性T细胞则减少,淋巴细胞凋亡增加,小鼠斑秃症状得到明显改善[20] 。但是,天然Ex在体内没有足够的靶向性,很容易被机体清除,或者被其他非目的细胞吸收,并且Ex与细胞膜的相互作用使得Ex的半衰期缩短,这也会使Ex的治疗效果大打折扣[21] 。为了增强Ex在靶向治疗疾病方面的效果,越来越多的研究开始着手改造Ex,一般将改造后的Ex称为工程化Ex。目前,对于工程化改造Ex的研究主要集中在来源于间充质干细胞和免疫细胞的Ex,对于MDSCs来源Ex的改造研究较少。因此本实验试图对MDSCs-Ex进行内容物的装载,即主要聚焦于筛选Ex内有效“货物”,进而采取不同的方法将有效的“货物”装载入Ex内。miR-93-5p作为一种微小RNA,在多种疾病中通过不同的机制发挥作用,例如直接靶向基因、调节信号通路、影响细胞行为等。本课题组在前期的研究中发现,装载外源性miR-93-5p可以靶向初始T细胞内的STAT3,从而抑制Th17细胞的分化,因此本研究通过工程化改造PMN-Ex,将miR-93-5p装载到PMN-Ex中,观察其对CIA模型小鼠疾病进程的干预作用。结果发现工程化改造的PMN-Ex在CIA小鼠体内展现了强大的免疫抑制作用,实验结果表明工程化的PMN-Ex可以显著降低小鼠腘窝淋巴结中Th17的比例以及降低血清IL-17A的水平,并且延缓小鼠的疾病进程。
下一步的研究可以从三方面进行,第一,增加更多有效内容物的装载,如课题组前期发现的miR-29a-3p,并且可以拓宽对有效内容物的寻找,比如有效的蛋白质和其他非编码RNA成分。第二,可以着手对PMN-Ex进行表面改造,使其可以靶向重要的目的细胞,进而增加目的细胞对Ex的摄取,进一步提高Ex的干预作用。第三,从Ex的来源考虑,目前通过细胞分泌Ex这种方法来获取Ex的量还太有限,可以考虑用纳米材料取代囊泡结构,包裹已知的有效成分,从而达到批量、大量生产的条件,为Ex的临床生物治疗提供可行性方案。此外,PMN-Ex也被证实对CIA等其他自身免疫性疾病模型小鼠具有重要的免疫抑制作用[22] ,所以对PMN-Ex进行工程化改造将大有可为,有望为治疗自身免疫性疾病提供新的方法。
[参考文献]
[1] 贾 筠, 杜望磊, 肖广智, 等. 血清外泌体源性microRNA对类风湿性关节炎的诊断意义[J]. 局解手术学杂志, 2023, 32(2): 160-164.
[2] Yang "W, Xu Y, Lin J, et al. Regional and national burden of rheumatoid arthritis, and attributable risk factors from 1990 to 2019: update from the global burden of disease 2019 study[J]. Clin Exp Rheumatol, 2023, 41(7): 1516-1527.
[3] Zou "W, Fang Y, Xu D. Increasing global burden of rheumatoid arthritis: an epidemiological analysis from 1990 to 2019[J]. Arch Med Sci, 2023, 19(4): 1037-1048.
[4] Smolen "JS, Aletaha D, McInnes IB. Rheumatoidarthritis[J]. Lancet, 2016, 388(10055): 2023-2038.
[5] Zhao "R, Zhang YW, Yao JY, et al. Genetic association between interleukin-17 and susceptibility to rheumatoid arthritis[J]. BMC Med Genomics, 2023, 16(1): 277-290.
[6] Trentham "DE, Townes AS, Kang AH. Autoimmunity to type Ⅱ collagen an experimental model of arthritis[J]. J Exp Med, 1977, 146(3): 857-868.
[7] Miyoshi "M, Liu S. Collagen-induced arthritis models[J]. Methods Mol Biol, 2018, 1868: 3-7.
[8] Zhu "D, Tian J, Wu X, et al. G-MDSC-derived exosomes attenuate collagen-induced arthritis by impairing Th1 and Th17 cell responses[J]. Biochim Biophys Acta Mol Basis Dis, 2019, 1865(12): 165540-165551.
[9] Wu "X, Zhu D, Tian J, et al. Granulocytic myeloid-derived suppressor cell exosomal prostaglandin E2 ameliorates collagen-induced arthritis by enhancing IL-10+ "B Cells[J]. Front Immunol, 2020, 11: 588500.
[10] Nawaz "M. Extracelluar vesicle-mediated transport of non-coding RNAs between stem cells and cancer cells: implications in tumor progression and therapeutic resistance[J]. Stem Cell Investig, 2017, 4: 83-102.
[11] Kooijmans "S, Stremersch S, Braeckmans K, et al. Electroporation-induced siRNA precipitation obscures the efficiency of siRNA loading into extracelluar vesicles[J]. J Control Release, 2013, 172(1): 229-238.
[12] Wang "C, Xu M, Fan Q, et al. Therapeutic potential of exosome-based personalized delivery platform in chronic inflammatory diseases[J]. Asian J Pharm Sci, 2023, 18(1): "100772-100784.
[13] Wang "J, Zheng Y, Zhao M. Exosome-based cancer therapy: implication for targeting cancer stem cells[J]. Front Pharmacol, 2016, 7: 533-545.
[14] Bai "J, Duan J, Liu R, et al. Engineered targeting tLyp-1 exosomes as gene therapy vectors for efficient delivery of siRNA into lung cancer cells[J]. Asian J Pharm Sci, 2020, 15(4): 461-471.
[15] Wang "Q, Sun X. Recent advances in nanomedicines for the treatment of rheumatoid arthritis[J]. Biomater Sci, 2017, 5(8): 1407-1420.
[16] Elron-Gross "I, Glucksam Y, Margalit R. Liposomal dexame- thasone-diclofenac combinations for local osteoarthritis treatment[J]. Int J Pharm, 2009, 376(1/2): 84-91.
[17] Fang "Y, Ni J, Wang YS, et al. Exosomes as biomarkers and therapeutic delivery for autoimmune diseases: opportunities and challenges[J]. Autoimmun Rev, 2023, 22(3): 103260.
[18] Hejrati "A, Hasani B, Esmaili M, et al. Role of exosome in autoimmunity, with a particular emphasis on rheumatoid arthritis[J]. Int J Rheum Dis, 2021, 24(2): 159-169.
[19] Lai "JJ, Chau ZL, Chen SY, et al. Exosome processing and characterization approaches for research and technology development[J]. Adv Sci (Weinh), 2022, 9(15): "e2103222.
[20] Zller "M, Zhao K, Kutlu N, et al. Immunoregulatory effects of myeloid-derived suppressor cell exosomes in mouse model of autoimmune alopecia areata[J]. Front Immunol, 2018, 9: 1279-1293.
[21] Nakase "I, Noguchi K, Fujii I, et al. Vectorization of biomacromolecules into cells using extracellular vesicles with enhanced internalization induced by macropinocytosis[J]. Sci Rep, 2016, 6: 34937-34949.
[22] Wang "Y, Tian J, Tang X, et al. Exosomes released by granulocytic myeloid-derived suppressor cells attenuate DSS-induced colitis in mice[J]. Oncotarget, 2016, 7(13): "15356-15368.
[收稿日期] 2024-08-06" [编辑] 郭 欣
