多西他赛联合顺铂治疗中晚期非小细胞肺癌的效果及对患者肿瘤标志物水平的影响
2025-01-24张金萍薛得王玉珮
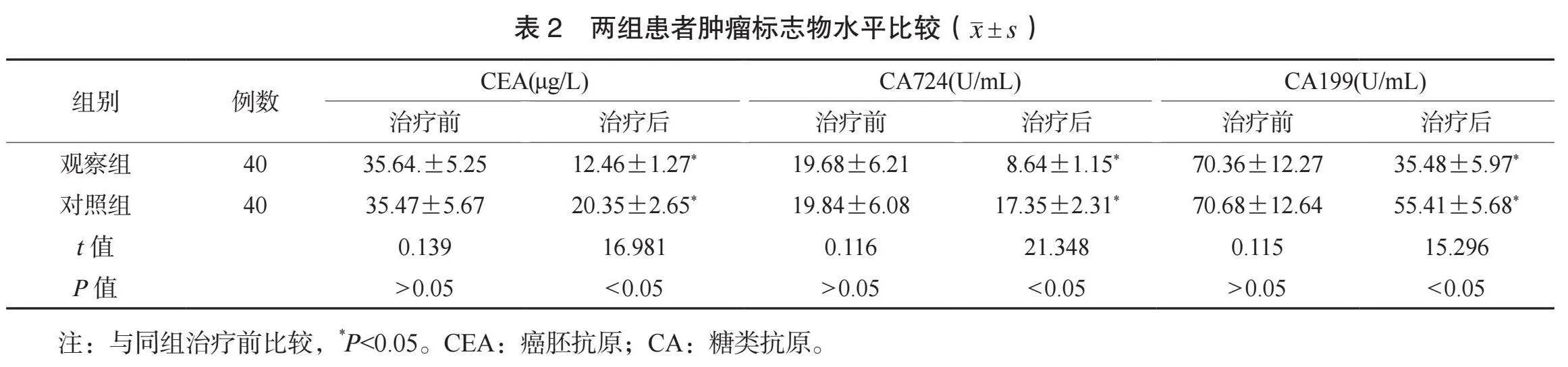
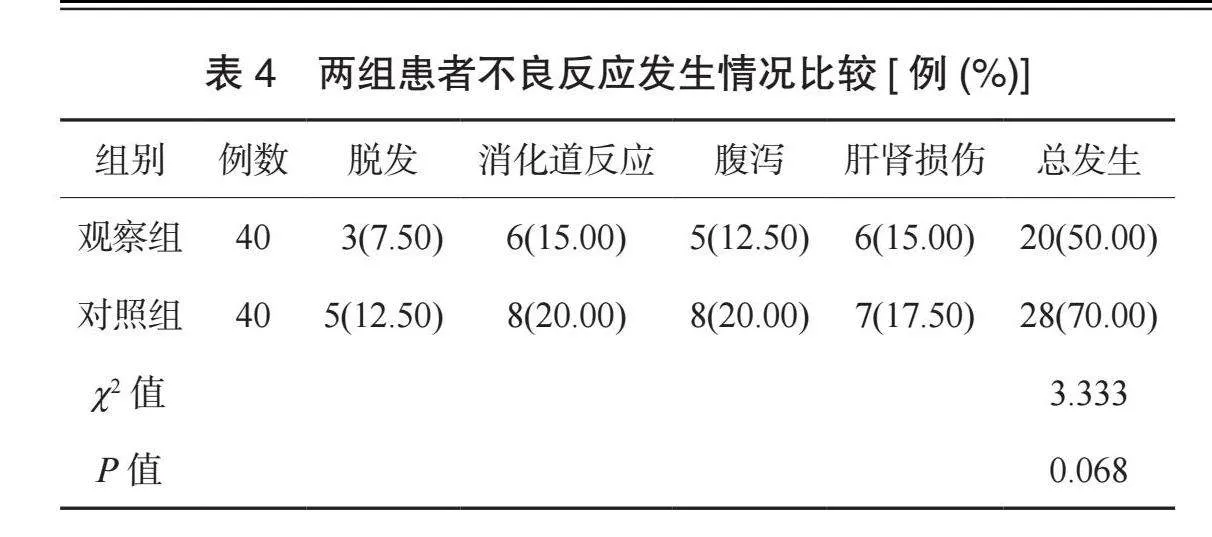
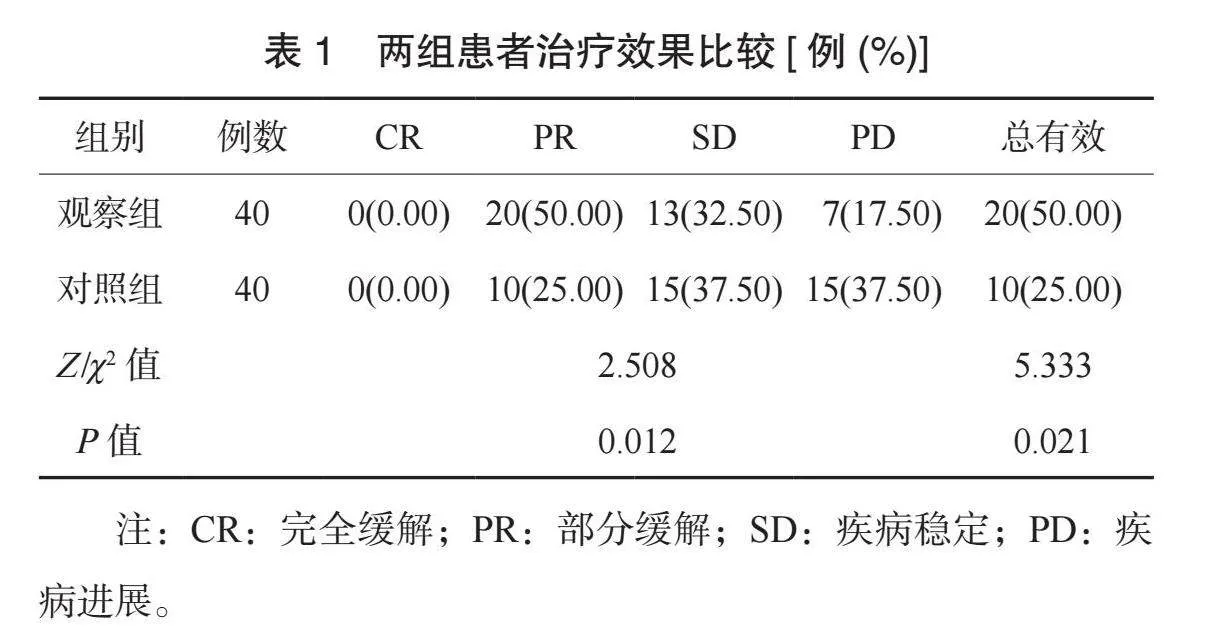
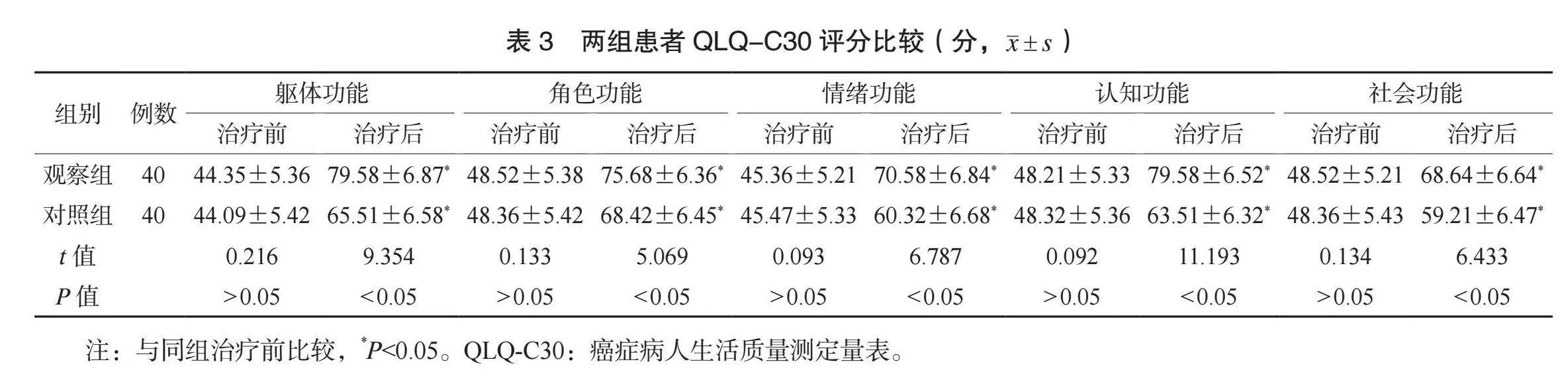
【摘要】目的 观察多西他赛(DOC)联合顺铂(DDP)治疗中晚期非小细胞肺癌(NSCLC)的效果及对患者肿瘤标志物水平的影响。方法 选取2020年1月至2024年1月于武威市人民医院治疗的80例NSCLC患者,按照随机数字表法分为对照组和观察组,各40例。对照组患者静脉滴注培美曲塞(PEM)联合DDP,观察组患者静脉滴注DOC联合DDP。比较两组患者疗效、肿瘤标志物水平、癌症病人生活质量测定量表(QLQ-C30)评分及不良反应发生情况。结果 观察组患者整体疗效更优,总有效率更高(均Plt;0.05)。治疗后,两组患者肿瘤标志物水平均降低,且观察组均更低(均Plt;0.05)。治疗后,两组患者QLQ-C30各维度评分均升高,且观察组均更高(均Plt;0.05)。两组患者不良反应总发生率比较,差异无统计学意义(Pgt;0.05)。结论 DOC联合DDP治疗NSCLC的效果较好,能改善患者肿瘤标志物水平,提高生活质量,且安全性良好。
【关键词】多西他赛;顺铂;中晚期非小细胞肺癌;肿瘤标志物;安全性
【中图分类号】R734.2 【文献标识码】A 【文章编号】2096-2665.2025.03.0007.03
DOI:10.3969/j.issn.2096-2665.2025.03.003
非小细胞肺癌(non-small cell lung cancer,NSCLC)是一类肺恶性肿瘤性疾病,主要包括鳞状细胞癌、腺癌等,其症状与病灶位置及其转移情况有关。在显微镜下,其特征表现为核异形性、细胞体积较大及胞浆丰富[1]。在肺癌的分类中,NSCLC约占所有肺癌的85%,其中,70%~80%患者在确诊时已处于疾病的中晚期阶段[2]。化疗是临床治疗中晚期NSCLC的主要手段之一,临床化疗方案由多种药物组成,目的是增强治疗效果并降低耐药性的发生风险[3]。培美曲塞(PEM)通过破坏细胞内叶酸依赖性的正常代谢过程,抑制细胞复制,进而有效抑制肿瘤细胞的生长和分裂。然而,其治疗效果可能受限于肿瘤特定基因表达的影响,且长期使用可能导致耐药性等问题。多西他赛(DOC)能够通过干扰微管蛋白聚合与解聚的动态平衡,抑制细胞分裂过程,进而导致肿瘤细胞凋亡[4]。顺铂(DDP)则通过与DNA分子产生交联作用,抑制其复制与转录过程,发挥抗肿瘤效应[5]。基于此,本研究旨在观察DOC联合DDP治疗中晚期NSCLC患者的效果。
1 资料与方法
1.1 一般资料 选取2020年1月至2024年1月于武威市人民医院治疗的80例NSCLC患者,按照随机数字表法分为对照组和观察组,各40例。对照组患者年龄31~70岁,平均年龄(50.33±10.21)岁;男性24例,女性16例;临床分期[6]:Ⅲ期23例,Ⅳ期17例;肿瘤类型:鳞癌27例,腺癌13例。观察组患者年龄30~70岁,平均年龄(50.21±10.52)岁;男性23例,女性17例;临床分期:Ⅲ期24例,Ⅳ期16例;肿瘤类型:鳞癌28例,腺癌12例。两组患者一般资料比较,差异均无统计学意义(均Pgt;0.05),可比。本研究经武威市人民医院医学伦理委员会批准,患者及其家属均知情并签署知情同意书。纳入标准:⑴符合NSCLC的临床诊断[7];⑵临床分期为Ⅲ~Ⅳ期;⑶预计生存期≥3个月。排除标准:⑴合并其他恶性肿瘤者;⑵存在认知功能障碍,无法配合研究者;⑶合并心、肾等严重脏器疾病者;⑷妊娠期或哺乳期妇女。
1.2 治疗方法 对照组患者行培美曲塞(PEM)[山东新时代药业有限公司,国药准字H20203051,规格:100 mg(按C20H21N5O6计)]联合注射用顺铂(冻干型)(DDP)(齐鲁制药有限公司,国药准字H20023461,规格:20 mg/支)治疗,取PEM 500 mg/m2(最大剂量为800 mg/m2)与生理盐水100 mL混匀后静脉滴注10~30 min,于每个化疗周期的第1天用药;DDP 25 mg/m2(最大剂量为120 mg/m2)静脉注射,于每个化疗周期的第1~3天用药。观察组患者接受多西他赛注射液(DOC)(江苏恒瑞医药股份有限公司,国药准字H20020543,规格:0.5 mL∶20 mg)联合DDP治疗,取DOC 75 mg/m2(最大剂量为120 mg/m2)与生理盐水250 mL混匀后静脉滴注1 h,于每个化疗周期的第1~3天用药;DDP用法用量同对照组。21 d为1个化疗周期,两组患者均持续治疗3个化疗周期。
1.3 观察指标 ⑴比较两组患者治疗效果。病灶完全消失,目标结节缩小至正常大小为完全缓解(CR);病灶直径总和缩小gt;30%为部分缓解(PR);病灶直径总和缩小20%~30%或增大20%以上为疾病进展(PD);靶病灶直径总和减少程度未达到PR,增加程度未达到PD为疾病稳定(SD)[8]。总有效率=[(CR+PR)例数/总例数]×100%。⑵比较两组患者肿瘤标志物水平。分别于治疗前后采集患者静脉血5 mL,采用离心机离心5 min(转速为3 000 r/min,离心半径为15 cm),使用全自动化学发光免疫分析仪(深圳迈瑞生物医疗电子股份有限公司,粤械注准20242220337,型号:CL-2600i)检测癌胚抗原(CEA)、糖类抗原(CA)724、CA199水平。⑶比较两组患者生活质量。采用癌症病人生活质量测定量表(QLQ-C30)[9]评估,共5个维度,总分各为100分,评分与生活质量成正比。⑷比较两组患者不良反应发生情况。不良反应包括脱发、消化道反应、腹泻和肝肾损伤。不良反应总发生率=各项不良反应发生例数之和/总例数×100%。
1.4 统计学分析 采用SPSS 22.0统计学软件处理数据。计数资料以[例(%)]表示,采用χ2检验或秩和检验;计量资料以(x)表示,采用t检验。以Plt;0.05为差异有统计学意义。
2 结果
2.1 两组患者治疗效果比较 观察组患者整体疗效更优,总有效率更高,差异均有统计学意义(均Plt;0.05),见表1。
2.2 两组患者肿瘤标志物水平比较 治疗前,两组患者肿瘤标志物水平比较,差异均无统计学意义(均Pgt;0.05);治疗后,两组患者肿瘤标志物水平均降低,且观察组均更低,差异均有统计学意义(均Plt;0.05),见表2。
2.3 两组患者QLQ-C30评分比较 治疗前,两组患者QLQ-C30评分比较,差异均无统计学意义(均Pgt;0.05);治疗后,两组患者QLQ-C30各维度评分均升高,且观察组均更高,差异均有统计学意义(均Plt;0.05),见表3。
2.4 两组患者不良反应发生情况比较 两组患者不良反应总发生率比较,差异无统计学意义(Pgt;0.05),见表4。
3 讨论
NSCLC的发生因素较多,包括个体的特征、年龄、遗传背景、免疫状态、营养状况、吸烟、职业暴露和环境污染等因素[10]。化疗是目前治疗NSCLC的主要手段之一,通过使用药物杀灭肿瘤细胞或减缓肿瘤细胞的生长[11]。然而,化疗通常具有明显的不良反应,因此,临床实践中通常采取联合用药等策略。DOC是一种半合成的化合物,其抗肿瘤作用机理在于抑制微管的解聚作用,并促进微管聚合,进而阻断肿瘤细胞的分裂过程。在临床治疗NSCLC中,DOC与其他抗微管解聚药物(如DDP等)的联合疗法逐渐普遍。
本研究结果显示,观察组患者整体疗效更优,总有效率更高,提示DOC联合DDP的疗效较好。分析原因为,DOC属于紫杉类药物,其作用机制主要是促进微管蛋白聚合和阻止微管解聚,进而抑制肿瘤细胞的有丝分裂和增殖,减缓其生长速度[12]。而DDP是一种细胞周期非特异性药物,能够通过形成DNA链间和链内交联,破坏肿瘤细胞的DNA复制和转录,导致细胞凋亡。两者联合使用,可以作用于肿瘤细胞的不同生长周期和信号通路,增强抗肿瘤效果,提高治疗效率[13]。本研究结果显示,治疗后,两组患者肿瘤标志物水平均降低,且观察组均更低,提示DOC联合DDP能够改善中晚期NSCLC患者肿瘤标志物水平。这可能与DOC对肿瘤细胞周期的阻滞作用及DDP对肿瘤细胞DNA的损伤作用有关。有研究显示,DOC能够抑制微管蛋白的聚合,导致细胞凋亡[14]。而DDP作为一种细胞毒性药物,能够与DNA形成交联,干扰其复制和转录,最终引起细胞凋亡。当这两种药物联合使用时,可增强对肿瘤细胞的杀伤效果。此外,DOC联合DDP还能够调节肿瘤微环境,抑制肿瘤血管生成,减少肿瘤的营养供应,进而抑制肿瘤的生长和转移。本研究结果显示,治疗后,两组患者QLQ-C30各维度评分均升高,且观察组均更高,提示观察组方案更有利于提高患者生活质量。分析原因为,观察组治疗方案通过有效控制肿瘤生长,减轻患者的症状,如咳嗽、呼吸困难和胸痛等,从而提高患者生活质量。本研究结果显示,两组患者不良反应总发生率比较无差异,提示联合使用患者耐受性良好,安全性良好。分析原因为,DOC及DDP能够产生协同作用,通过不同机制发挥治疗作用,未增加不良反应发生率。
综上所述,DOC联合DDP治疗NSCLC的效果较好,能改善患者肿瘤标志物水平,提高生活质量,且安全性良好。
参考文献
万畅,庞静丹,吴正升,等.非小细胞肺癌脑转移免疫微环境、临床病理特征分析[J].临床与实验病理学杂志, 2023, 39(11): 1316-1321.
段建春,胡洁,李国辉,等.非小细胞肺癌免疫治疗持续用药规范化白皮书[J].临床肿瘤学杂志, 2024, 29(4): 280-287.
梁彦,李玥,郑贵雄,等.非小细胞肺癌患者化疗疗效与可溶性细胞间黏附分子-1、P-糖蛋白、p53及CT灌注成像参数的相关性[J].中华实验外科杂志, 2024, 41(5): 1068-1073.
季秋蓉,杨晓琴,汤金燕.多西他赛或培美曲塞联合铂类对EGFR-TKI耐药的非小细胞肺癌晚期患者外周血PD-1表达水平及淋巴细胞亚群影响分析[J].中华保健医学杂志, 2024, 26(2): 176-179.
苏文. 培美曲塞联合顺铂治疗晚期非鳞状细胞NSCLC的效果观察[J]. 药品评价, 2019, 16(24): 15-16.
中国抗癌协会肺癌专业委员会,中华医学会肿瘤学分会肺癌学组. Ⅲ期非小细胞肺癌多学科诊疗专家共识(2019版)[J].中华肿瘤杂志, 2019, 41(12): 881-890.
中华医学会,中华医学会肿瘤学分会,中华医学会杂志社.中华医学会肺癌临床诊疗指南(2018版)[J].中华肿瘤杂志, 2018, 40(12): 935-964.
王书航,王洁. 2018年V3版NCCN非小细胞肺癌指南更新要点解读[J].华西医学, 2018, 33(4): 388-392.
胡彩平,林毅,李秋萍. SF-36量表与QLQ-C30量表在老年癌症病人生活质量评估中的应用及其相关性研究[J].护理研究, 2015, 29(24): 2968-2972.
张艰,刘苗艳,李京耕.非小细胞肺癌罕见靶点与药物治疗[J].国际呼吸杂志, 2024, 44(7): 764-772.
杨俊,唐培,张富宏.顺铂联合吉西他滨或多西他赛治疗中老年晚期非小细胞肺癌的疗效观察[J].中国肿瘤临床与康复, 2020, 27(11): 1329-1331.
钟家将,张东伟,蓝冰,等.多西他赛联合顺铂治疗对中晚期非小细胞肺癌的疗效及对低剂量CT灌注成像参数的影响[J].中国CT和MRI杂志, 2023, 21(1): 72-73, 179.
杨晓樽,李强.度伐利尤单抗联合顺铂和多西他赛新辅助治疗局部晚期非小细胞肺癌的疗效评估[J].世界临床药物, 2024, 45(5): 514-520.
张光照,杜佳辉,袁五营.培美曲塞与多西他赛联合顺铂治疗晚期非小细胞肺癌患者的临床对比研究[J].实用医院临床杂志, 2021, 18(3): 56-59
