红大戟根腐病病原鉴定及其生物学特性
2025-01-24刘春菊张磊李恒董家红何霞红邱斌







摘要[目的]分离、鉴定红大戟根腐病的病原菌及掌握该病原菌的生物学特性。[方法]根据病原菌形态特征,结合ITS-5.8SrDNA、tub2和ACT序列分析,依据柯赫氏法则进行致病性试验。[结果]从接种植株中重新分离出形态一致的病原菌,并将其鉴定为大豆茎点霉(Boeremiaexigua)。生物学特性研究表明,病原菌最适生长培养基为PDA培养基,最适生长温度为20℃或25℃,最适培养的pH为5;最适碳源是乳糖,最适氮源是硝酸钾。[结论]这是B.exigua在中国引起红大戟根腐病的首次报道;掌握其生物学特性,为红大戟根腐病的防治奠定理论基础。
关键词红大戟;根腐病;大豆茎点霉;鉴定;生物学特性
中图分类号S435.672"文献标识码A"文章编号0517-6611(2025)02-0178-05
doi:10.3969/j.issn.0517-6611.2025.02.035
开放科学(资源服务)标识码(OSID):
IdentificationandBiologicalCharacteristicsoftheRootRotPathogenofKnoxiaroxburghii
LIUChun-juZHANGLei"LIHeng3etal
(1.CollegeofTraditionalChineseMedicine,YunnanUniversityofChineseMedicine,Kunming,Yunnan650500;2.CollegeofPlantProtection,YunnanAgriculturalUniversity,Kunming,Yunnan650201;3R&DCenterofYunnanYuntianhuaCo.,Ltd.,Kunming,Yunnan650228)
Abstract[Objective]InordertoisolateandidentifythepathogenofrootrotofKnoxiaroxburghiiandmasterthebiologicalcharacteristicsofthepathogen.[Method]Accordingtothemorphologicalcharacteristicsofthepathogen,combinedwithITS-5.8SrDNA,tub2andACTsequenceanalysis,thepathogenicitytestwascarriedoutaccordingtoKoch’sRule.[Result]Themorphologicallyconsistentpathogenwasre-isolatedfromtheinoculatedplantsandfinallyidentifiedasBoeremiaexigua.ThestudiesofbiologicalcharacteristicsshowedthattheoptimumgrowthmediumofpathogenwasPDA,theoptimumgrowthtemperaturewas20℃or25℃,andtheoptimumpHwas5.Theoptimumcarbonsourcewaslactose,andtheoptimumnitrogensourcewaspotassiumnitrate.[Conclusion]ThisisthefirstreportofB.exiguacausingrootrotofK.roxburghiiinChina.MasteringitsbiologicalcharacteristicswilllayatheoreticalfoundationforthepreventionofrootrotofK.roxburghii.
KeywordsKnoxiaroxburghii;Rootrot;Boeremiaexigua;Identification;Biologicalcharacteristics
红大戟[Knoxia roxburghii(Sprengel)M.A.Rau]为茜草科(Rubiaceae)红芽大戟属(Knoxia)植物,为多年生草本[1-2],其主要化学成分有蒽醌及三萜类,蒽醌类也是抗肿瘤药物的重要来源,可用于治疗癌症,具有泻水逐饮、消肿散结等功效[3],因其疗效显著,在临床上得到大量广泛应用,是紫金锭(散)、骨通贴膏等上百种上市中成药的原料[4-5]。随着红大戟块根需求量的增长,供不应求的市场业绩激发了农民的种植热情,红大戟在野生引种驯化过程中病害问题也频繁发生,以根部病害尤为突出,这严重阻碍了红大戟产业的健康发展。2021年云南省大理白族自治州祥云县红大戟种植示范基地红大戟根腐病发病情况严重,该病田间发病率为15%~30%,对红大戟的产量和品质影响较为严重。目前,红大戟的根腐病病原菌及发病原因尚不清楚。为此,该研究拟采用形态学和分子生物学的方法,对所分离的病原菌进行鉴定,并对其致病性进行验证,开展病原菌的生物学特性研究,为该类病害的防治奠定一定的基础。
1材料与方法
1.1试验材料
2022年8月,以云南省祥云县红大戟种植示范基地的红大戟根腐样品为研究对象,对其进行病原菌的分离和鉴定。一年生长势良好的红大戟(云戟1号)进行后续的接种试验[6]。
1.2菌株分离与纯化
将腐烂的红大戟病根用流动的自来水冲洗干净,用解剖刀将病健交界部位切成0.5 cm×0.5 cm的薄片,75%乙醇和1% NaClO灭菌后用无菌水漂洗3~5次。采用无菌滤纸吸干水分后转移至马铃薯葡萄糖琼脂(PDA)培养基上,在25~28 ℃下进行3 d的培养得到纯化菌株[7]。
1.3形态学鉴定
将纯化后的菌株接种于PDA培养基、燕麦琼脂(OA)培养基上,25~28 ℃暗培养10 d后观察菌落形态。载玻片上滴入无菌水后挑取小黑点及菌丝放入,利用显微镜观察孢子及菌丝形态,显微镜拍照后孢子大小用ImageJ软件测量[7]。
1.4DNA提取与分子鉴定
简化的CTAB法用于提取病原菌菌丝DNA,用引物ITS1/ITS4[8]、Bt2a/Bt2b[9]和ACT-512F/ACT-783R[10]分别扩增核糖体内源ITS-5.8S rDNA、tub2和ACT区域。组装后的核苷酸序列,经NCBI中的Blastn比对后,利用软件MEGA-X中的邻接法构建近缘菌株的系统发育树[7]。
1.5致病性验证
采用菌丝块接种方法进行致病性检测,无菌土种植的一年生红大戟幼苗,将在PDA培养基上培养10d的病原菌,用无菌手术刀切成5mm×5mm,每株根边接种10块,以无菌未接种病原菌菌丝的PDA培养基为对照。每个处理10株,重复3次。置于25℃、相对湿度70%条件下培养40d,统计植株的发病情况。从感病的红大戟根上再次进行病原菌的分离与鉴定,以验证柯赫氏法则。
1.6病原菌的生物学特性
1.6.1
病原菌最适培养基的筛选。选取实验室常用的5种培养基(PDA、PSA、MEA、CMD、WA)。病原菌在PDA培养基上培养10 d后,打取直径为5 mm的边缘菌饼接种到以上5种培养基上,用封口薄膜密封。每个处理重复3次。在25 ℃黑暗条件下,以十字形交叉法测定各病原菌在不同培养基上的生长情况,直至有处理长满培养皿(90 mm)后停止记录[11]。
1.6.2温度对病原菌生长的影响。选取PDA培养基作为基础培养基,5mm的病原菌接种到PDA培养基中心,封口膜密封后做好标记,放置于15、20、25、30℃的恒温培养箱中培养,每个处理重复3次,菌落测量方法同“1.6.1”。
1.6.3初始pH对病原菌生长的影响。选取PDA培养基作为基础培养基,用0.1mol/L的盐酸和氢氧化钠溶液配制相应浓度的培养基(pH4~pH14),共计11个浓度。平板制好后接入5mm的病原菌边缘菌饼,置于25℃培养箱中暗培养,处理重复和菌落测量方法同“1.6.1”。
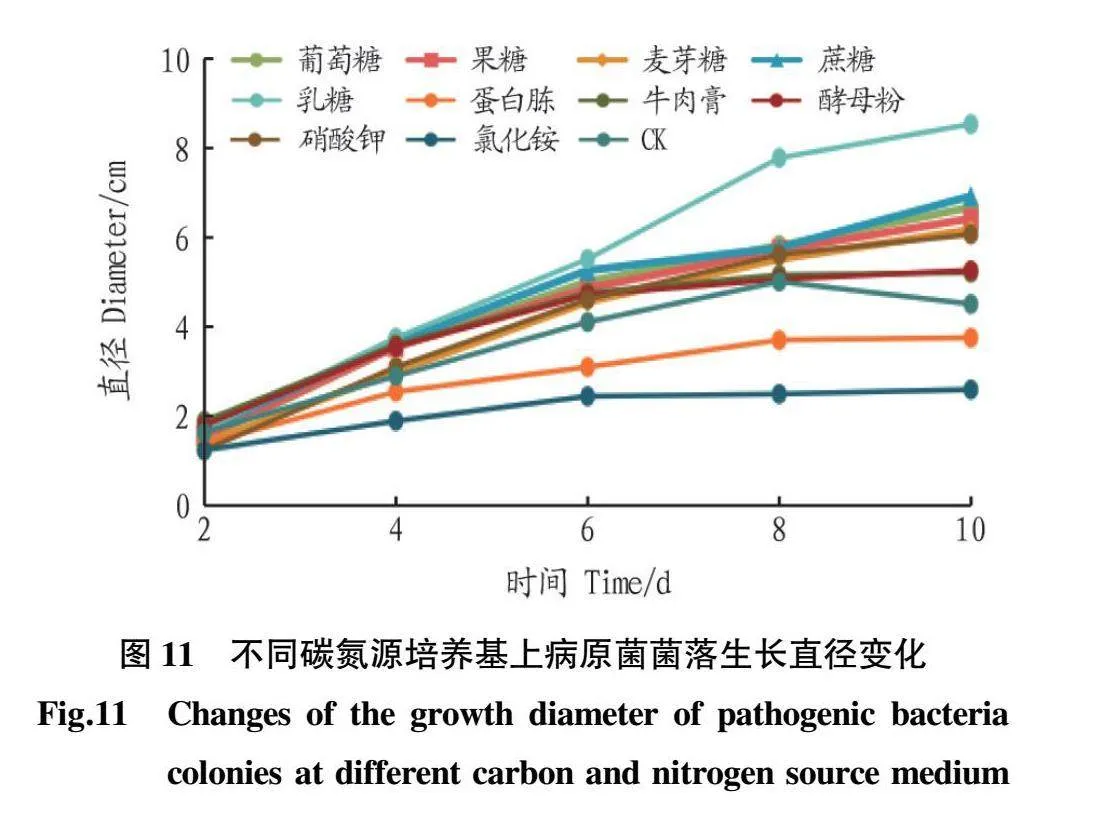
1.6.4不同碳氮源对病原菌生长的影响。选取PDA培养基作为基础培养基,分别用葡萄糖、果糖、蔗糖、麦芽糖、乳糖作为碳源,蛋白胨、牛肉膏、酵母粉、硝酸钾、氯化铵作为氮源,以未加碳源和氮源的培养基作为对照(CK)。选取等摩尔的碳原子和氮原子代替基础培养基中的碳源和氮源,培养皿平板制好后,接种及测量方法同“1.6.1”。
2结果与分析
2.1红大戟根腐病田间症状
患病的红大戟根部为褐色至深褐色,叶片伴有枯萎症状,茎基为褐色,根部内部病斑切面呈红棕色(图1)。综合发病特点及症状,将该病称为红大戟根腐病。
2.2病原菌的形态特征
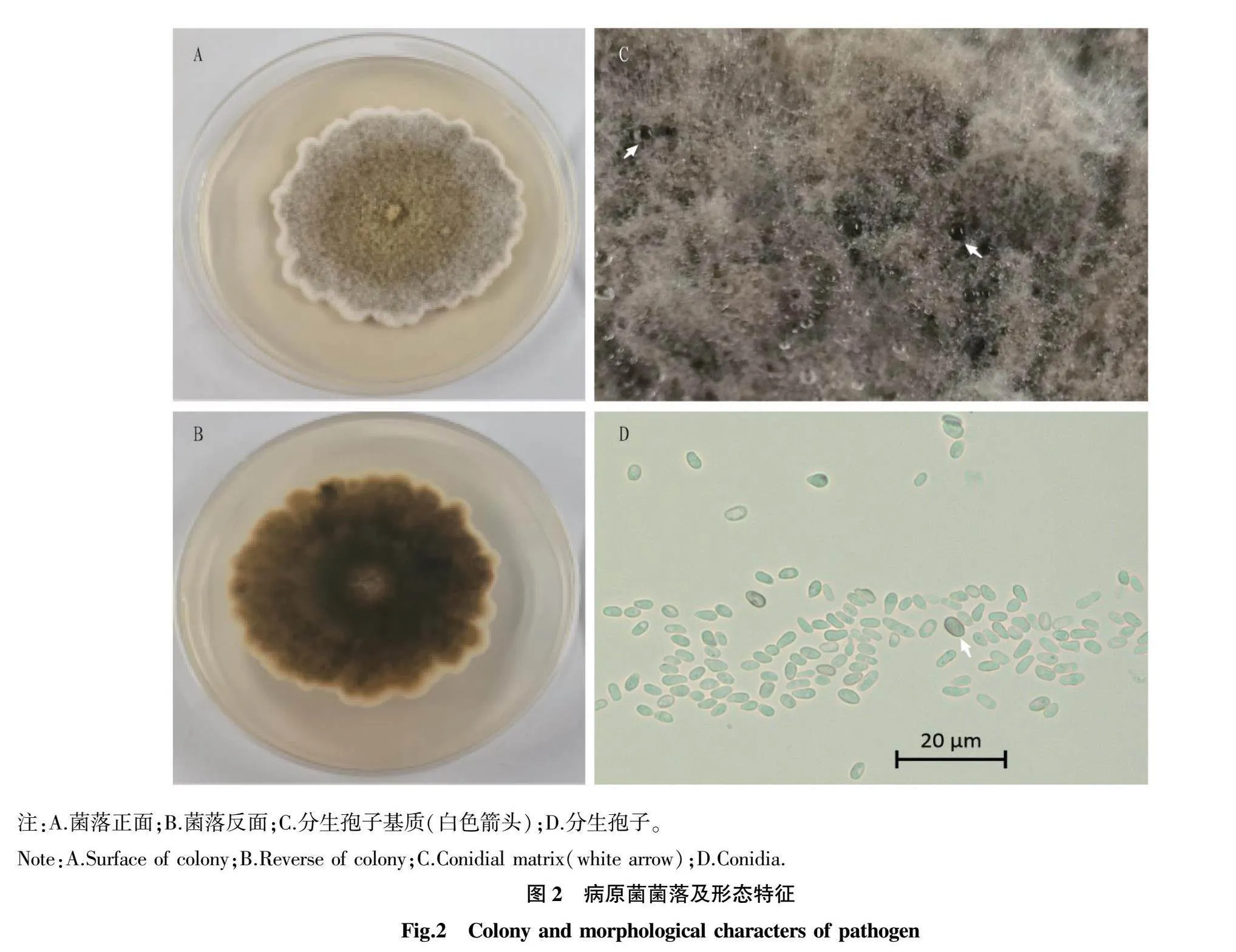
从典型的根腐病症状的发病红大戟上分离获得与Boeremia spp.菌落形态结构相似的菌株有10株。菌落在PDA培养基上培养初期为灰白色,之后变成淡橄榄绿色,气生菌丝发达,菌丝表面有无色透明小水珠,边缘呈白色的耦节状,背面黑褐色(图2A、B)。在OA培养基培养 30 d 后有分生孢子基质产生(黑色小点)(图2C)。分生孢子椭圆到长圆,单孢无隔膜,大小(2.6~6.9)μm×(1.5~3.1)μm(图2D);无厚垣孢子[12]。
2.3病原菌的分子生物学鉴定
随机挑选3株病原菌,单孢分离纯化后,提取菌丝DNA后用ITS、tub2和ACT 3对引物进行扩增测序。结果显示,组装后的3株病原菌的核苷酸序列是一致的。选择一株具有代表性的序列上传至NCBI。ITS序列(OR142417)与Boeremia exigua(MT154624)相似性为100%(518/533 bp);tub2序列(OR146750)与B.exigua(OP611567)相似性为100%(316/335 bp);ACT序列(OR146751)与B.exigua(OP611566)相似性为100%(231/247 bp)。以ITS、tub2和ACT 3对引物序列构建系统发育树结果显示(图3),该菌株与B.exigua聚在同一分支上,其分支的自举值为99%。根据该菌的形态学和分子生物学鉴定结果,将该病原菌鉴定为大豆茎点霉(B.exigua)[13],命名为ByF12。
2.4病原菌的致病性
将一年生红大戟幼苗(云戟1号)根部接种病原菌ByF12(5mm2)菌丝块10块于25℃光照培养箱(70%相对湿度,12h光照/黑暗)中培养,每个处理10株,3次重复,以接种无病原菌的PDA培养基为对照,接种40d后,所有接种植株根部均出现了黑褐色的腐烂症状,而对照无病状(图4)。从再次感病的红大戟根中能重新分离得到形态学和测序结果与前面保持一致的病原菌,以验证柯赫氏法则,由此证明B.exigua是引起红大戟根腐病的病原菌。
2.5病原菌的生物学特性
2.5.1最适培养基的筛选。由图5可知,病原菌在5种培养基上均可生长,其中在CMD培养基上生长较快,前4d生长缓慢,之后呈直线生长;PDA培养基次之;在CMD培养基上菌丝蓬松且稀释,PDA培养基上菌丝致密且发达。从日生长变化及菌丝总生长变化来看,病原菌在WA培养基上生长均较为缓慢,原因可能与WA培养基没有营养有关。由图6可见,ByF12在CMD培养基上菌落日均生长量显著高于PDA、PSA、MEA、WA培养基(Plt;0.05),PDA、PSA、MEA这3种培养基之间差异不显著(Pgt;0.05)。鉴于ByF12在PDA培养基上菌丝致密,形态较好,ByF12最适培养基为PDA培养基。
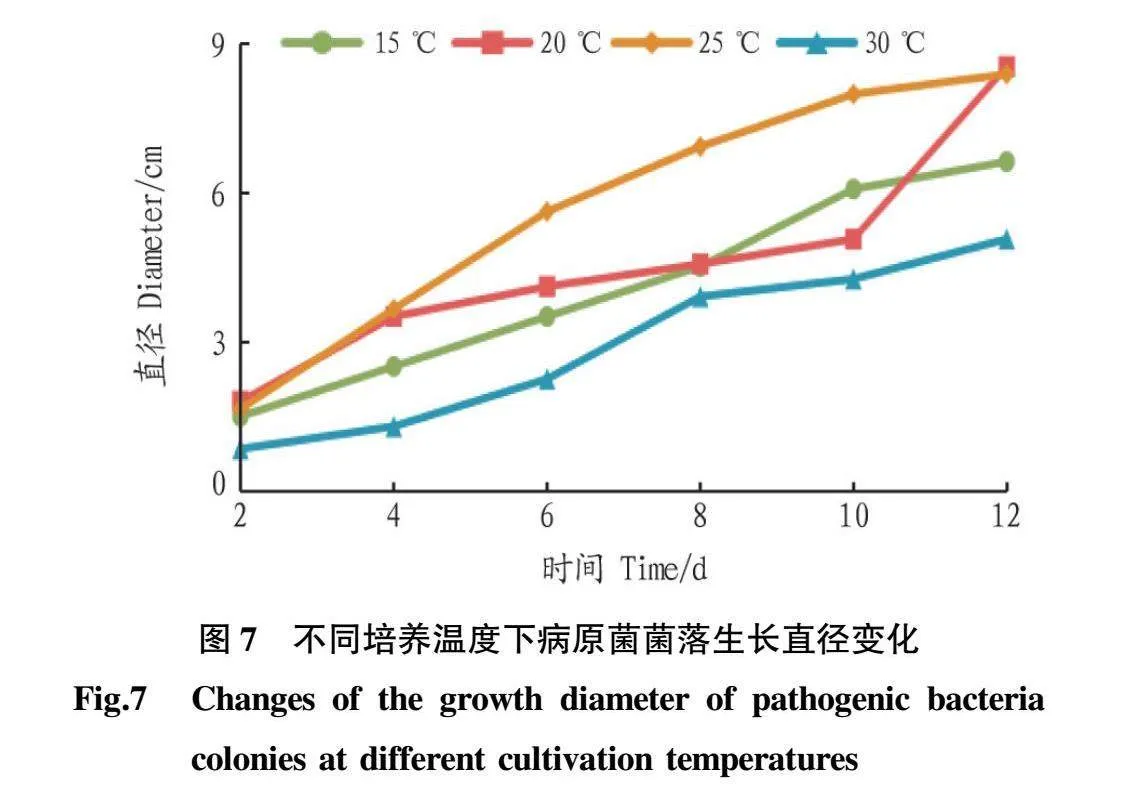
2.5.2不同温度对病原菌菌丝生长的影响。由图7可知,病原菌在15、20、25、30℃温度下均可生长,其中在20、25℃生长较快,两者相比差别不大,30℃时生长最慢;在不同温度下的前2d生长速度几乎重叠,6d之后逐渐分开。由图8可知,ByF12菌丝日均生长在30℃时最低,随着温度的升高,菌丝日均生长量先增加后降低,20℃与25℃之间差异不显著(Pgt;0.05),但两者与15℃和30℃之间差异显著(Plt;0.05)。综上所述,ByF12的最适培养温度是20℃或25℃。
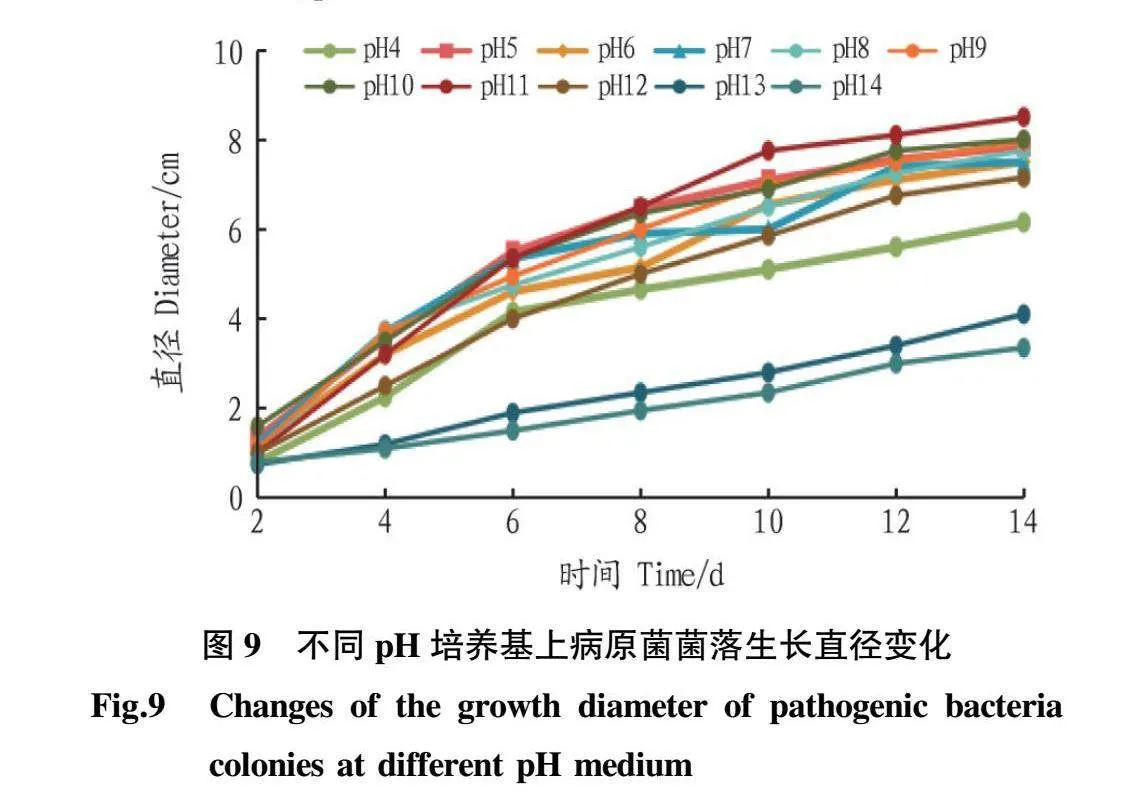
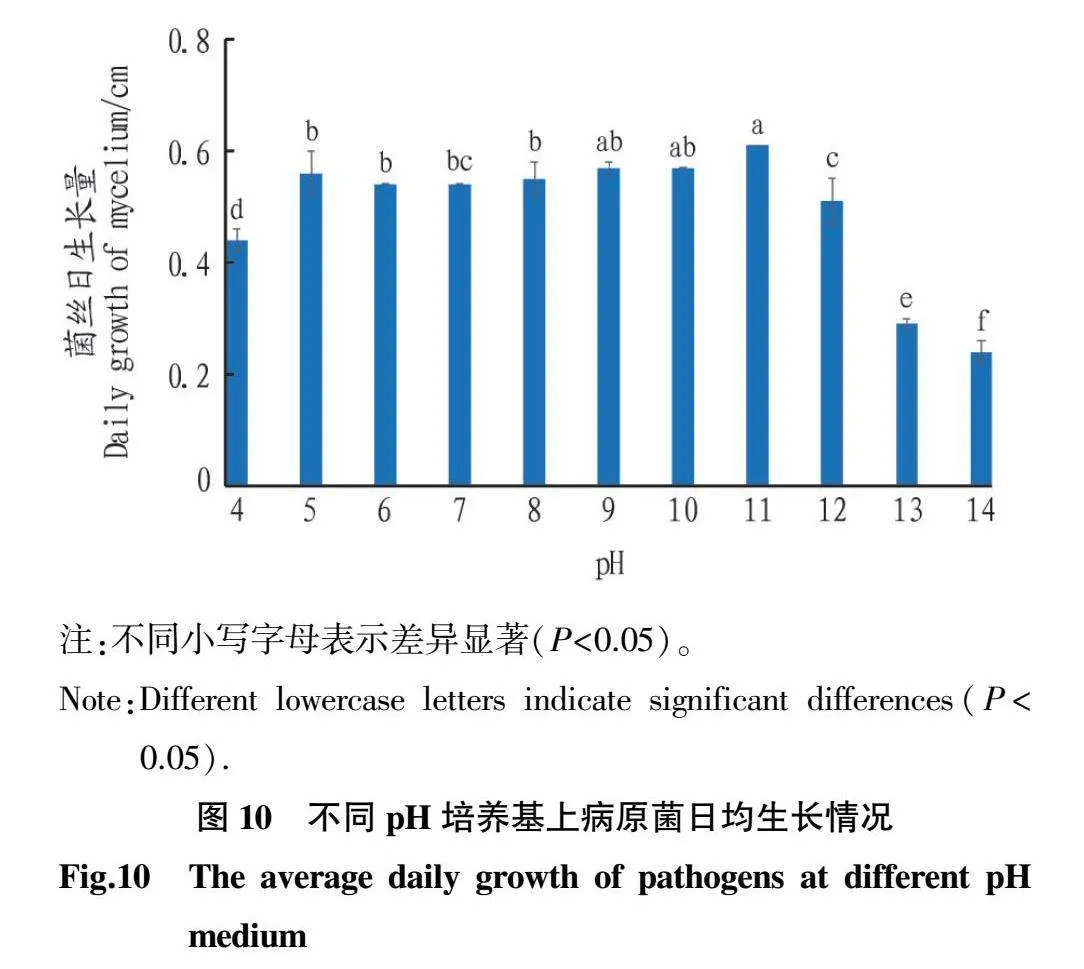
2.5.3初始pH对病原菌菌丝生长的影响。由图9可知,ByF12在pH4~pH14(11个浓度)上均可生长。在接种2d后,病原菌生长速度均明显提高。ByF12在pH5和pH11时出现高峰,菌落颜色从pH9时开始变为白色且疏松。由图10可知,ByF12在pH5时生长量较高,后逐步下降,pH9时再次升高为菌落生长的第2次转折点。综上所述,ByF12喜欢偏酸的环境,pH5时长势较好。
2.5.4不同碳氮源对病原菌菌丝生长的影响。由图11可知,病原菌ByF12在所有供试的培养基上均可生长,但碳源和氮源在利用方面有一定的差异。ByF12对碳源乳糖利用较好,10d时长满平板;对氮源氯化铵和蛋白胨利用较差,远低于CK。由图12可知,ByF12在碳源乳糖上菌丝日均生长最快,显著高于其他碳源培养基(Plt;0.05),其余4组处理间差异不显著(Pgt;0.05)。ByF12对碳源的利用优于氮源,其最适碳源是乳糖,最适氮源是硝酸钾。由此可见,病原菌对硝酸钾的利用有一定的偏好。
3结论与讨论
根腐病是红大戟的主要病害,发病时根部表皮先变黑最后全根腐烂[14],其病因复杂多变,严重影响了红大戟的产量和品质;已有报道指出引起红大戟根腐病的病原菌有尖孢镰刀菌(Fusarium oxysporum)和亚红青霉(Penicillium subrubescens)[15-16]。该研究表明红大戟根腐病的致病菌为大豆茎点霉(B.exigua)。
B.exigua为多主寄生真菌,无寄主专化现象[17]。B.exigua一般引起植物叶斑病[18-19],但也可导致植物根腐病[20-21]。菌株ByF12可造成红大戟根部的维管束坏死,进而引发根腐病的发生,这与B.exigua引起的根部危害症状尤为相似。茎点霉属(Boeremia)侵染红芽大戟属植物目前还鲜见报道,该研究为B.exigua引起红大戟根腐病的首次报道。
除此之外,该研究对该菌株进行了系统的生物学特性研究。病原菌在5种常用的培养基中均可生长,生长的培养基范围较广,即使在没有任何营养物质的WA培养基上均可生长,具有较强的适应能力。茎点霉属(Boeremia)的寄主范围较广,王梦奇[22]采集了东北地区的茎点霉真菌,发现25 ℃、pH为7的PDA培养基上菌落生长直径最大,这一研究结果与该研究类似。由此看来,红大戟根腐病原菌喜欢偏中性的环境,因此在进行人工种植的过程中,也应持续关注田地土壤的酸碱平衡,并通过调整土壤pH来实现预防和控制根腐病的目标。云南祥云在历史上的全年平均温度是11~23 ℃,从2020年记录以来,其最低气温为0 ℃,最高气温达到了34 ℃,该温区内,病原菌ByF12均能存活,特别是6—8月份,随着气温的升高和降雨量的增多,为这些病原菌提供了一个适宜的生长环境。
参考文献
[1]赵峰,马丽,孙居锋,等.红大戟中的1个新降碳三萜[J].中草药,2014,45(1):28-30.
[2]陈曦,高燕,王杨海,等.醋红大戟的质量标准研究[J].山东科学,20236(4):18-28.
[3]CHENXJ,PUXY,PUXM,etal.ExtractsofKnoxiaroxburghii(Spreng.)M.A.RauinduceapoptosisinhumanMCF-7breastcancercellsviamitochondrialpathways[J].Molecules,2022,27(19):1-14.
[4]蒲昕颖,陈晓娇,王欣格,等.基于流式细胞术和基因组Survey的红大戟基因组大小测定和分析[J/OL].分子植物育种,2022-10-28[2023-07-22].https://kns.cnki.net/kcms/detail/46.1068.S.20221028.1008.002.html.
[5]蒲昕颖,陈晓娇,徐雅静,等.基于“辨色论质”的红大戟色泽与蒽醌类成分的相关性研究[J].时珍国医国药,20234(9):2288-2290.
[6]邱斌,蒲昕颖,杨成金,等.红大戟新品种‘云戟1号’和‘云戟2号’[J].园艺学报,20250(S2):203-204.
[7]张磊,李辉山,杨枝中,等.云南滇黄精根茎腐病病原鉴定[J].植物病理学报,20251(6):1000-1004.
[8]WHITETJ,BRUNST,LEES,etal.AmplificationanddirectsequencingoffungalribosomalRNAgenesforphylogenetics[M]//PCRprotocols:Aguidetomethodsandapplications.SanDiego:AcademicPress,Inc.,1990:315-322.
[9]GLASSNL,DONALDSONGC.DevelopmentofprimersetsdesignedforusewiththePCRtoamplifyconservedgenesfromfilamentousascomycetes[J].Appliedandenvironmentalmicrobiology,1995,61(4):1323-1330.
[10]CARBONEI,KOHNLM.Amethodfordesigningprimersetsforspeciationstudiesinfilamentousascomycetes[J].Mycologia,1999,91(3):553-556.
[11]张海啸.蒙古栎枯枝病病原鉴定及其致病机理[D].哈尔滨:东北林业大学,2021:22-23.
[12]BOEREMAGH,DEGRUYTERJ,NOORDELOOSME,etal.Phomaidentificationmanual[M].Wallingford,UK:CABIPublishing,2004:3.
[13]WANGJH,TANGMM,ZHOUW,etal.FirstreportofleafspotassociatedwithBoeremiaexiguaonwhitecloverinChina[J].Plantdisease,202105(2):504.
[14]卫锡锦.红大戟的栽培技术[J].中药材,1997,20(12):598-599.
[15]LIUCJ,QIUB,ZHANGL,etal.FirstreportofrootrotcausedbyFusariumoxysporumonKnoxiavalerianoidesinChina[J].Journalofplantpathology,202105(3):1205-1206.
[16]"LIUCJ,ZHANGL,LIH,etal.FirstreportofPenicilliumsubrubescenscausingrootrotofKnoxiaroxburghiiinChina[J].Plantdisease,202107(10):3304.
[17]"AVESKAMPMM,DEGRUYTERJ,WOUDENBERGJHC,etal.HighlightsoftheDidymellaceae:ApolyphasicapproachtocharacterisePhomaandrelatedpleosporaleangenera[J].Studiesinmycology,2010,65:1-60.
[18]"韦海玲.桑断枝烂叶病的病原菌种类鉴定[D].南宁:广西大学,2015:49.
[19]"王梦奇,白庆荣,王大川,等.吉林省大豆茎点霉叶斑病病原鉴定[J].大豆科学,2019,38(3):428-43454.
[20]"KOIKEST,GROENEWALDJZ,CROUSPW.FirstreportofblackrotcausedbyBoeremiaexiguavar.pseudolilacisonArtichokeinCalifornia[J].Plantdisease,2016,100(2):524.
[21]"GRINBERGSD,FRANCEA,VARRELMANNM.FirstreportofBoeremiaexiguavar.exigua(syn.Phomaexiguavar.exigua)causingblackrootrotonIndustrialChicory(Cichoriumintybusvar.sativum)inChile[J].Plantdisease,2016,100(11):2328-2329.
[22]王梦奇.东北地区茎点霉属真菌研究[D].长春:吉林农业大学,2019:3.
