基于全长转录组测序的金花茶NAC基因家族鉴定及分析
2025-01-24刘合霞徐飞凤杨卓玲吴晓敏徐赛颖李博






摘要利用生物信息学技术对金花茶(Camellianitidissima)的全长转录组数据进行筛选,获得了35个金花茶NAC转录因子,将其分别命名为CnNAC1~CnNAC35;随后分析了蛋白理化性质、保守结构域以及系统发育关系;利用RNA-seq数据,对金花茶NAC转录因子在根、茎、叶、花等组织中的表达谱进行了研究;并对金花茶不同开花时期的花瓣表达量与关键类黄酮化合物含量进行Pearson相关性分析。结果表明:金花茶NAC基因家族成员编码的蛋白主要为亲水性的不稳定蛋白,大多定位于细胞核或叶绿体中,多数蛋白都含有NAC基因家族所特有的5个亚保守结构域;系统进化分析中,35个金花茶NAC蛋白被分为16个亚家族,而NAC2亚家族所包含的蛋白数量最多;金花茶NAC转录因子在不同组织中的表达量存在差异,其中8个金花茶NAC转录因子在花瓣中的表达量相对较高,且与槲皮素、槲皮素-7-O-葡糖苷的变化量显著相关。
关键词金花茶;类黄酮合成调控;NAC基因家族;进化分析;表达分析
中图分类号S685.14"文献标识码A
文章编号0517-6611(2025)02-0097-07
doi:10.3969/j.issn.0517-6611.2025.02.022
开放科学(资源服务)标识码(OSID):
IdentificationandAnalysisofNACGeneFamilyinCamellianitidissimaBasedonFull-lengthTranscriptomeSequencing
LIUHe-xiaXUFei-feng2,YANGZhuo-ling2etal
(1.CollegeofSmartAgriculture,YulinNormalUniversity,Yulin,Guangxi537000;2.CollegeofBiologyandPharmacy,YulinNormalUniversity,Yulin,Guangxi537000)
AbstractInthisstudy,bioinformaticstechnologywasusedtoscreenthefull-lengthtranscriptomesequencingdataofCamellianitidissima,and35CnNACtranscriptionfactorswereobtained,whichwerenamedCnNAC1-CnNAC35respectively.Thephysicochemicalproperties,conserveddomainsandphylogeneticrelationshipsofCnNACproteinswereanalyzed.BasedonRNA-seqdata,theexpressionprofilesofCnNACtranscriptionfactorsinroot,stem,leafandflowerofCamellianitidissimawerestudied.Subsequently,PearsoncorrelationanalysiswasconductedbetweentheexpressiondataofCamellianitidissimapetalsandthecontentsofkeyflavonoidsindifferentfloweringperiods.TheresultsshowedthattheCnNACproteinsweremainlyhydrophilicandunstableproteinswhichweremainlylocatedinthenucleusorchloroplast,andmostoftheproteinscontained5subconserveddomainswhichwasspecialstructureintheNACgenefamily.Inphylogeneticanalysis,35CnNACproteinsweredividedinto16subfamilies,andNAC2subfamilycontainedthemostproteins.ThereweredifferencesintheexpressionlevelsofCnNACtranscriptionfactorsindifferenttissues,andtheexpressionlevelsof8CnNACtranscriptionfactorsinpetalswererelativelyhighwhichweresignificantlycorrelatedwiththechangesofquercetinandquercetin3-O-rhamnoside-7-O-glucoside.
KeywordsCamellianitidissima;Regulationofflavonoidsynthesis;NACgenefamily;Phylogeneticanalysis;Expressionanalysis
金花茶(Camellia nitidissima)是山茶科山茶属植物,其叶片及花朵中含有皂苷类、多糖、类黄酮等次生代谢物[1-2],可用于治疗高血压、痢疾、咽喉炎和便血等疾病[3]。金花茶中富含的类黄酮化合物不仅是花色形成的关键物质[4-5],还是其具有药用价值的活性成分。近年来,金花茶中与类黄酮合成相关的结构基因及少数MYB转录因子已被克隆[6-8],部分基因的功能已被验证[6,8],金花茶类黄酮合成机理正在逐步阐明,但是bHLH、NAC、WD40等其他类别的转录因子对金花茶中类黄酮合成的调控机制仍知之甚少。
NAC(NAM,ATAF1/ATAF2和CUC2)基因家族是植物中发现的最大转录因子家族之一[9-10],它们在N端具有高度保守的NAC结构域,该结构域由约150个氨基酸残基组成,主要包含5个保守区域(A~E)[11-12];C端区域富含简单的氨基酸重复序列及丝氨酸、苏氨酸、脯氨酸、谷氨酰胺、天冬氨酸、谷氨酸等氨基酸残基,是一个高度分化的转录调控区,具有转录激活或遏制蛋白活性的作用[13-15]。NAC蛋白可与自身或其他NAC蛋白相互作用,形成同源二聚体或异源二聚体,它们互作的区域主要定位于N端的保守NAC结构域[16-17];而通过蛋白互作形成的功能性NAC蛋白二聚体,其表面一侧富含正电荷,该区域可能与DNA结合有关[18-19]。NAC转录因子具有广泛的生物学功能,在植物生长发育、次生代谢物质合成、激素应答、逆境胁迫等方面发挥着重要作用[20-21]。例如,MdNAC029转录因子可激活MdMYB1转录,促进花青素在苹果(Malus pumila)愈伤组织中合成[22];MdNAC52转录因子转录水平在果实着色期间增加,过表达MdNAC52能够促进苹果愈伤组织花色苷的积累[23]。在金花茶不同开花时期的花瓣转录组测序研究中[24-25],发现部分金花茶NAC转录因子在金花茶开花过程中差异表达,它们可能具有调控金花茶中类黄酮合成的功能。目前,基于植物基因组学和生物信息学的手段,植物NAC转录因子基因家族的研究日益增多[26-27],但关于金花茶NAC基因家族以及NAC基因功能的研究尚鲜见报道,因此笔者基于全长转录组测序数据,利用生物信息技术鉴定金花茶NAC基因家族,对其蛋白结构特征进行预测,分析金花茶NAC基因家族成员在不同组织中的表达特征,并对它们的表达量与关键类黄酮化合物的含量进行相关性分析,以期筛选出在金花茶中具有调控类黄酮合成的NAC转录因子。该研究结果将为进一步分析金花茶NAC基因功能及其在类黄酮合成中的作用机制提供科学依据。
1材料与方法
1.1材料
在PlantTFDB数据库中(http://planttfdb.gao-lab.org/tf.php?sp=Athamp;did=AT5G62610.1)下载拟南芥NAC基因家族的蛋白编码序列,然后将其作为搜寻序列(Querysequence),以金花茶的茎、叶以及不同开花时期的花朵等组织的全长转录组测序数据(Accessionnumber:SRX18217210)作为目标序列,搜索金花茶全长转录组中所包含的NAC基因家族。
1.2方法
1.2.1金花茶NAC基因家族成员鉴定。
本地Blast搜索金花茶全长转录组中的NAC基因家族,阈值 Elt;10-5,用在线软件NCBI (http://www.ncbi.nlm.nih.gov/Structure/cdd/)确定候选基因编码的蛋白序列是否含有NAC蛋白保守结构域,排除不符合要求的基因。
1.2.2金花茶NAC蛋白质的理化性质、保守结构域以及保守结构元件分析。
通过在线网站ExPASy(http://web.expasy.org/prot-param/)完成对金花茶NAC基因家族成员蛋白质的性质的分析,如等电点、脂肪系数、不稳定系数、平均亲水系数、分子量等;同时利用在线网站WOLFPSORT(https://wolfpsort.hgc.jp/)对蛋白质进行亚细胞定位预测;利用在线工具MEME(http://meme-suite.org/)预测金花茶NAC基因家族成员的保守基序,其中Motifs数量设定为10个,保守位点宽度为6~50,其余参数不变;通过TBtools软件绘制展示结果。对于金花茶NAC蛋白保守结构域的分析,则利用DNAMAN9.0软件对金花茶NAC蛋白进行多序列比对,分析它们保守结构域的完整性。
1.2.3金花茶NAC基因家族系统进化树的构建。
采用Neighbor-joining方法,构建金花茶NAC基因家族与拟南芥NAC基因家族的系统进化树,该过程主要利用MEGA10软件完成,其中Boot-strap值设为1000,而其他参数设为默认值。
1.2.4金花茶NAC基因家族表达模式分析及相关性分析。
利用金花茶根、茎、叶、不同开花时期的花瓣、不同发育时期花芽的转录组测序数据,分析金花茶NAC基因家族在不同组织中的表达量,然后使用R语言软件中的Heatmap工具绘制表达量热图;并将金花茶不同开花时期的花瓣表达量与槲皮素(Quercetin)、山奈酚(Kaempferol)、槲皮素-7-O-葡糖苷(Quercetin-3-O-rhamnoside-7-O-glucoside,Qu7G)、槲皮素-3-O-葡糖苷(Quercetin-3-O-glucoside,Qu3G)等类黄酮化合物的含量进行Pearson相关性分析,研究NAC基因的表达量与关键类黄酮化合物之间的相关性。
2结果与分析
2.1金花茶NAC基因家族的筛选及蛋白特性预测
利用生物信息学技术手段,在金花茶全长转录组中筛选获得35个有完整ORF的NAC基因家族成员,分别将其命名为CnNAC1~CnNAC35(表1);其中CnNAC03的氨基酸序列最长,有638个氨基酸残基,CnNAC35的氨基酸序列最短,仅有292个氨基酸残基。对35个金花茶NAC蛋白的物理特性进行预测,发现它们的分子量分布范围为33.30~71.56kD,等电点(isoelectricpoint,pI)的分布范围在4.62~8.98,其中26个为酸性蛋白,9个为碱性蛋白;不稳定系数为33.31~54.42,其中17个属于稳定蛋白,18个属于不稳定蛋白;而金花茶NAC蛋白的平均亲水指数分布范围为-0.892~-0.295,结果表明所有金花茶CnNAC蛋白均为亲水性蛋白;它们的脂肪系数为55.65~75.50。对35个金花茶NAC蛋白进行亚细胞定位预测,显示这些蛋白主要分布在细胞核和叶绿体中,少数定位在液泡、质体和高尔基体中。
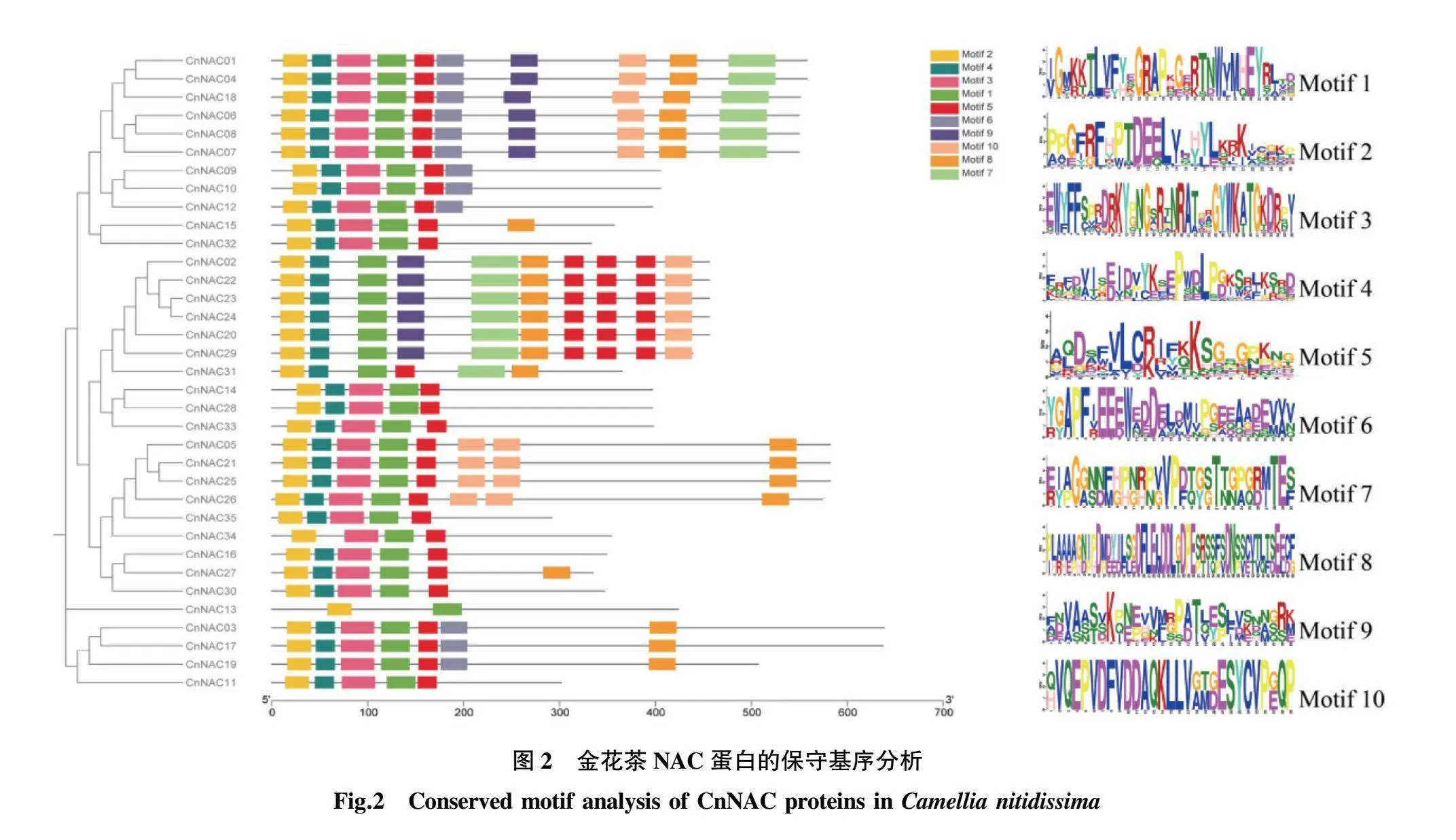
2.2金花茶NAC蛋白的保守结构域及保守基序分析
对金花茶CnNAC的蛋白序列进行多序列比对,结果表明,大部分金花茶CnNAC蛋白均含有完整的5个保守亚结构域,只有少数CnNAC蛋白所含的保守亚结构域不完整,它们缺失了其中的1~3个保守亚结构域(图1)。如CnNAC31缺失了1个保守亚结构域C,CnNAC34缺失了1个保守亚结构域B;CnNAC02、CnNAC20、CnNAC22、CnNAC23、CnNAC24、CnNAC29都缺少了2个保守亚结构域C和E;而CnNAC13蛋白缺少了3个保守亚结构域B、C和E。
利用MEME在线工具对金花茶CnNAC蛋白的保守基序进行分析,设定筛选的保守基序数量为10,将它们分别被命名为Motif1~Motif10,结果表明:35个金花茶CnNAC蛋白保守基序的长度分布范围为21~51个氨基酸,而CnNAC蛋白中包含的保守基序数目为2~10个(图2)。比对金花茶NAC蛋白的保守结构域与保守基序的分析结果,发现Motif2代表NAC蛋白的保守亚结构域A,Motif4为保守亚结构域B,Motif3为保守亚结构域C,Motif1为保守亚结构域D,Motif5为保守亚结构域E,大多数金花茶CnNAC蛋白都含有上述5个保守基序,只有少数CnNAC蛋白缺失了其中1~3个基序。另外,综合金花茶NAC基因家族的进化分析结果,发现属于同一亚组的NAC基因家族成员的Motif组成类型相似,推测它们可能具有相似的功能。
2.3金花茶NAC蛋白的系统进化分析
构建金花茶NAC蛋白与拟南芥NAC蛋白的系统进化树,研究结果表明,该系统进化树共划分为16个亚家族(图3),35个金花茶NAC蛋白分布在NAC2、TIP、OsNAC8、NAM、OSNAC7、NAP/ANAC3、ATAF、ANAC001、UN和ONAC00310个亚族中,而在ANAC011、ANAC063-a、NAC1、SEUN5、ONAC22及ANAC063-b6个亚家族中未发现金花茶NAC蛋白。NAC2亚家族所包含的金花茶NAC蛋白数量最多,共有12个,占总数的34.28%;其次为ANAC001亚家族、TIP亚家族、NAP/ANAC3亚家族、OsNAC8及NAM亚家族,它们含有的NAC蛋白数量分别为7、4、4、2、2个;而OSNAC7、ATAF、UN及ONAC003亚家族则各有1个。
2.4金花茶NAC基因的表达及相关分析
基于转录组数据,将35个金花茶NAC基因在花瓣、花芽、根、茎及叶等组织中的表达数据进行热图聚类分析,结果表明,35个金花茶NAC基因在不同组织中的表达量存在差异,它们的表达情况大致可分为4种类型(图4),第1种表达类型是部分金花茶NAC基因在花瓣、花芽、根、茎、叶中的表达量都很低,如,CnNAC34、CnNAC02、CnNAC22、CnNAC23、CnNAC24、CnNAC25、CnNAC07、CnNAC28、CnNAC17、CnNAC19等;第2种表达类型是CnNAC32、CnNAC35在花瓣、花芽、根、茎、叶等组织中都高度表达;第3种表达类型是CnNAC16、CnNAC30、CnNAC18、CnNAC06、CnNAC10、CnNAC01、CnNAC05、CnNAC03、CnNAC12等基因主要在花瓣中高表达,而在其他部位中表达量较低;第4种类型是CnNAC27、CnNAC15、CnNAC09、CnNAC20、CnNAC11、CnNAC14、CnNAC21、CnNAC29、CnNAC26、CnNAC13、CnNAC31、CnNAC33、CnNAC04、CnNAC08等基因主要在根、茎、叶等营养器官中高表达。此外,将金花茶NAC基因在花瓣中的表达量与槲皮素、山奈酚、Qu7G、Qu3G的含量进行相关性分析,发现CnNAC11、CnNAC13、CnNAC14、CnNAC15、CnNAC31、CnNAC32等基因的表达量与槲皮素含量为负相关,而CnNAC32、CnNAC33的表达量则与Qu7G含量为正相关,且它们的相关性均达到了显著水平(图5)。
3讨论
该研究从金花茶全长转录组测序数据中鉴定出35个NAC转录因子,金花茶NAC转录因子数量与矮牵牛的NAC转录因子数量相似[28],而与双子叶模式植物拟南芥、单子叶模式植物水稻以及近缘物种茶树的NAC转录因子数目相比[29],金花茶NAC基因家族数量则相对较少,推测其原因,可能是物种差异所造成。NAC蛋白的N端结构域被细分为A、B、C、D、E 5个亚保守结构域,其中A、C、D亚保守结构域高度保守,B、E亚保守结构域的保守性较低,推断B、E亚保守结构域的蛋白序列差异可能是导致植物NAC基因功能多样性的主要原因[30]。该研究通过对金花茶NAC蛋白进行序列比对及保守基序分析,发现所有金花茶NAC转录因子都含有NAC基因家族N端所特有的A、D亚结构域,2个金花茶NAC转录因子不含B亚结构域,8个金花茶NAC转录因子不含C亚结构域,7个金花茶NAC转录因子不含E亚结构域,表明金花茶NAC转录因子的A、D亚结构域序列高度保守,B亚结构域序列比较保守,而C、E亚结构域序列保守性相对较低,因此推断金花茶中C、E亚保守结构域的蛋白序列差异可能是导致金花茶NAC蛋白功能多样性的原因之一,这与Mohanta等[31]的研究结果存在差异。
通过构建系统发育树,Ooka等[32] 研究发现,拟南芥NAC基因家族和水稻NAC基因家族主要分成两大类,共18个亚族。而系统进化分析发现,35个金花茶NAC基因家族成员在10个亚家族中均有分布,且在NAC2亚族中的分布数量最多;卓茂根等[33]在对368个NAC转录因子的系统进化分析中也获得了类似结果。
对金花茶NAC基因在花瓣、花芽、根、茎及叶等组织中的表达量进行分析,发现CnNAC01、CnNAC03、CnNAC05、CnNAC06、CnNAC10、CnNAC12、CnNAC16、CnNAC18、CnNAC30等转录因子主要在花瓣中高表达;且部分在金花茶花瓣中中度表达的NAC转录因子,如CnNAC11、CnNAC13、CnNAC14、CnNAC15、CnNAC32、CnNAC33等,与花瓣中关键类黄酮化合物的含量具有显著相关性。金花茶花瓣中富含类黄酮物质[34],而NAC转录因子具有调控类黄酮物质合成的作用,如,该研究中金花茶CnNAC11转录因子被注释为AtNAC072,已有研究发现与其互为同源基因的越橘VcNAC072转录因子在拟南芥中过量表达,可显著促进拟南芥AtPAP1转录因子及花青素合成基因的表达,表明VcNAC072可能具有促进越橘花青素合成的作用[35];金花茶CnNAC16转录因子被注释为AtNAC056,与其互为同源基因的红薯IbNAC56转录因子可与IbMYB340、IbbHLH2转录因子形成MYB340-bHLH2-NAC56蛋白复合体来调控IbANS基因的表达,进而调控花色素苷的合成[36],因此推断上述中高度表达的金花茶NAC转录因子在花瓣中可能具有调控类黄酮物质合成的功能,但它们的具体功能仍有待进一步研究。
综上所述,该研究基于全长转录组测序数据,筛选获得了金花茶NAC基因家族,明确了该基因家族的分子特征、保守结构域类型和系统进化特征,揭示了NAC基因家族成员在金花茶不同组织中的表达模式,以及与关键类黄酮化合物的相关性,丰富了金花茶NAC转录因子研究,为后续金花茶NAC转录因子的研究功能及其在类黄酮合成调控中的作用机制提供支撑。
参考文献
[1]ZHOUXW,FANZQ,CHENY,etal.Functionalanalysesofaflavonolsynthase-likegenefromCamellianitidissimarevealitsrolesinflavonoidmetabolismduringfloralpigmentation[J].JBiosci,20138(3):593-604.
[2]HATTORIM,HUANGXL,CHEQM,etal.6-hydroxykaempferolanditsglycosidesfromCarthamustinctoriuspetals[J].Phytochemistry,1992,31(11):4001-4004.
[3]HEDY,LIXY,SAIX,etal.CamellianitidissimaC.W.Chi:Areviewofbotany,chemistry,andpharmacology[J].PhytochemRev,2018,17(2):327-349.
[4]LINJN,LINHY,YANGNS,etal.ChemicalconstituentsandanticanceractivityofyellowcamelliasagainstMDA-MB-231humanbreastcancercells[J].JAgricFoodChem,20161(40):9638-9644.
[5]姜丽娜.金花茶花色形成代谢机理及关键基因功能研究[D].北京:中国林业科学研究院,2020.
[6]姜丽娜,李纪元,范正琪,等.金花茶类黄酮糖基转移酶基因的克隆和功能初步研究[J].西北植物学报,2020,40(12):1989-1999.
[7]JIANGLN,FANZ,TONGR,etal.Functionaldiversificationofthedihydroflavonol4-reductasefromCamellianitidissimaChi.inthecontrolofpolyphenolbiosynthesis[J].Genes,2020,11(11):1-12.
[8]JIANGLN,FANZ,TONGR,etal.Flavonoid3'-hydroxylaseofCamellianitidissimaChi.promotesthesynthesisofpolyphenolsbetterthanflavonoids[J].MolBiolRep,20248(5):3903-3912.
[9]SOUERE,VANHOUWELINGENA,KLOOSD,etal.Thenoapicalmeristemgeneofpetuniaisrequiredforpatternformationinembryosandflowersandisexpressedatmeristemandprimordiaboundaries[J].Cell,1996,85(2):159-170.
[10]AIDAM,ISHIDAT,FUKAKIH,etal.GenesinvolvedinorganseparationinArabidopsis:Ananalysisofthecup-shapedcotyledonmutant[J].PlantCell,1997,9(6):841-857.
[11]PURANIKS,SAHUPP,SRIVASTAVAPS,etal.NACproteins:Regulationandroleinstresstolerance[J].TrendsPlantSci,2012,17(6):369-381.
[12]DUVALM,HSIEHTF,KIMSY,etal.MolecularcharacterizationofAtNAM:AmemberoftheArabidopsisNACdomainsuperfamily[J].PlantMolBiol,2002,50(2):237-248.
[13]陈倩,游双梅,邢乐华,等.果树NAC转录因子的研究进展[J].分子植物育种,20219(19):6396-6405.
[14]OLSENAN,ERNSTHA,LEGGIOLL,etal.NACtranscriptionfactors:Structurallydistinct,functionallydiverse[J].TrendsPlantSci,2005,10(2):79-87.
[15]HEGEDUSD,YUM,BALDWIND,etal.MolecularcharacterizationofBrassicanapusNACdomaintranscriptionalactivatorsinducedinresponsetobioticandabioticstress[J].PlantMolBiol,20053(3):383-397.
[16]李伟,韩蕾,钱永强,等.植物NAC转录因子的种类、特征及功能[J].应用与环境生物学报,20117(4):596-606.
[17]XIEQ,FRUGISG,COLGAND,etal.ArabidopsisNAC1transducesauxinsignaldownstreamofTIR1topromotelateralrootdevelopment[J].GenesDev,2000,14(23):3024-3036.
[18]ERNSTHA,OLSENAN,LARSENS,etal.StructureoftheconserveddomainofANAC,amemberoftheNACfamilyoftranscriptionfactors[J].EMBORep,2004,5(3):297-303.
[19]王春雨,张茜.植物NAC转录因子功能研究进展[J].生物技术通报,2018,34(11):8-14.
[20]LIUGS,LIHL,GRIERSOND,etal.NACtranscriptionfactorfamilyregulationoffruitripeningandquality:Areview[J].Cells,2022,11(3):1-29.
[21]WANGJF,WANGYP,ZHANGJ,etal.TheNACtranscriptionfactorClNAC68positivelyregulatessugarcontentandseeddevelopmentinwatermelonbyrepressingClINVandClGH3.6[J].HorticRes,2028(1):1-14.
[22]安建平,宋来庆,赵玲玲,等.苹果愈伤组织超表达MdNAC029促进花青苷积累[J].园艺学报,2018,45(5):845-854.
[23]SUNQG,JIANGSH,ZHANGTL,etal.AppleNACtranscriptionfactorMdNAC52regulatesbiosynthesisofanthocyaninandproanthocyanidinthroughMdMYB9andMdMYB11[J].PlantSci,2019,289:1-12.
[24]ZHOUXW,LIJR,ZHUYL,etal.DenovoassemblyoftheCamellianitidissimatranscriptomerevealskeygenesofflowerpigmentbiosynthesis[J].FrontPlantSci,2017,8:1-15.
[25]LIUHX,LIUQ,CHENYL,etal.Full-lengthtranscriptomesequencingprovidesinsightsintoflavonoidbiosynthesisinCamellianitidissimaPetals[J].Gene,202850:1-12.
[26]LIUHJ,CHENSS,WUXM,etal.IdentificationoftheNACtranscriptionfactorfamilyduringearlyseeddevelopmentinAkebiatrifoliata(Thunb.)Koidz[J].Plants,20212(7):1-22.
[27]SHENSY,ZHANGQR,SHIY,etal.Genome-wideanalysisoftheNACdomaintranscriptionfactorgenefamilyinTheobromacacao[J].Genes,2019,11(1):1-11.
[28]TRUPKINSA,ASTIGUETAFH,BAIGORRIAAH,etal.IdentificationandexpressionanalysisofNACtranscriptionfactorspotentiallyinvolvedinleafandpetalsenescenceinPetuniahybrida[J].PlantSci,2019,287:1-15.
[29]荣欢,任师杰,汪梓坪,等.植物NAC转录因子的结构及功能研究进展[J].江苏农业科学,2020,48(18):44-53.
[30]马雪祺,阴艳红,冯婧娴,等.植物NAC转录因子研究进展[J].植物生理学报,20257(12):2225-2234.
[31]MOHANTATK,YADAVD,KHANA,etal.Genomics,molecularandevolutionaryperspectiveofNACtranscriptionfactors[J].PLoSOne,2020,15(4):1-34.
[32]OOKAH,SATOHK,DOIK,etal.ComprehensiveanalysisofNACfamilygenesinOryzasativaandArabidopsisthaliana[J].DNARes,20010(6):239-247.
[33]卓茂根,王惠聪.NAC转录因子在果实成熟中的调控作用[J].果树学报,20240(7):1455-1470.
[34]PENGX,YUDY,FENGBM,etal.AnewacylatedflavonoidglycosidefromtheflowersofCamellianitidissimaanditseffectontheinductionofapoptosisinhumanlymphomaU937cells[J].JAsianNatProdRes,2012,14(8):799-804.
[35]宋杨,刘红弟,王海波,等.越橘VcNAC072克隆及其促进花青素积累的功能分析[J].中国农业科学,2019,52(3):503-511.
[36]WEIZZ,HUKD,ZHAODL,etal.MYB44competitivelyinhibitstheformationoftheMYB340-bHLH2-NAC56complextoregulateanthocyaninbiosynthesisinpurple-fleshedsweetpotato[J].BMCPlantBiol,2020,20(1):1-15.
