钙磷基生物陶瓷材料的计算模拟进展与挑战
2025-01-12张巧徐定国
钙磷基生物陶瓷材料在生物医学领域,特别是骨修复和替代方面,展现出广阔的应用前景.传统的实验方法受制于漫长的时间、高昂的成本以及极端的条件而引入的计算模拟技术,在理解和优化材料的性能方面发挥了至关重要的作用.结合国内外研究和本小组近年的相关工作,总结钙磷基生物陶瓷材料的计算模拟进展和面临的诸多挑战,展望该领域的未来发展,强调通过结合先进的计算方法与实验验证,有望进一步推动钙磷基生物陶瓷材料在生物医学中的应用和发展.
生物陶瓷材料; 计算模拟; 骨组织工程; 羟基磷灰石
O641A0166-1002.003
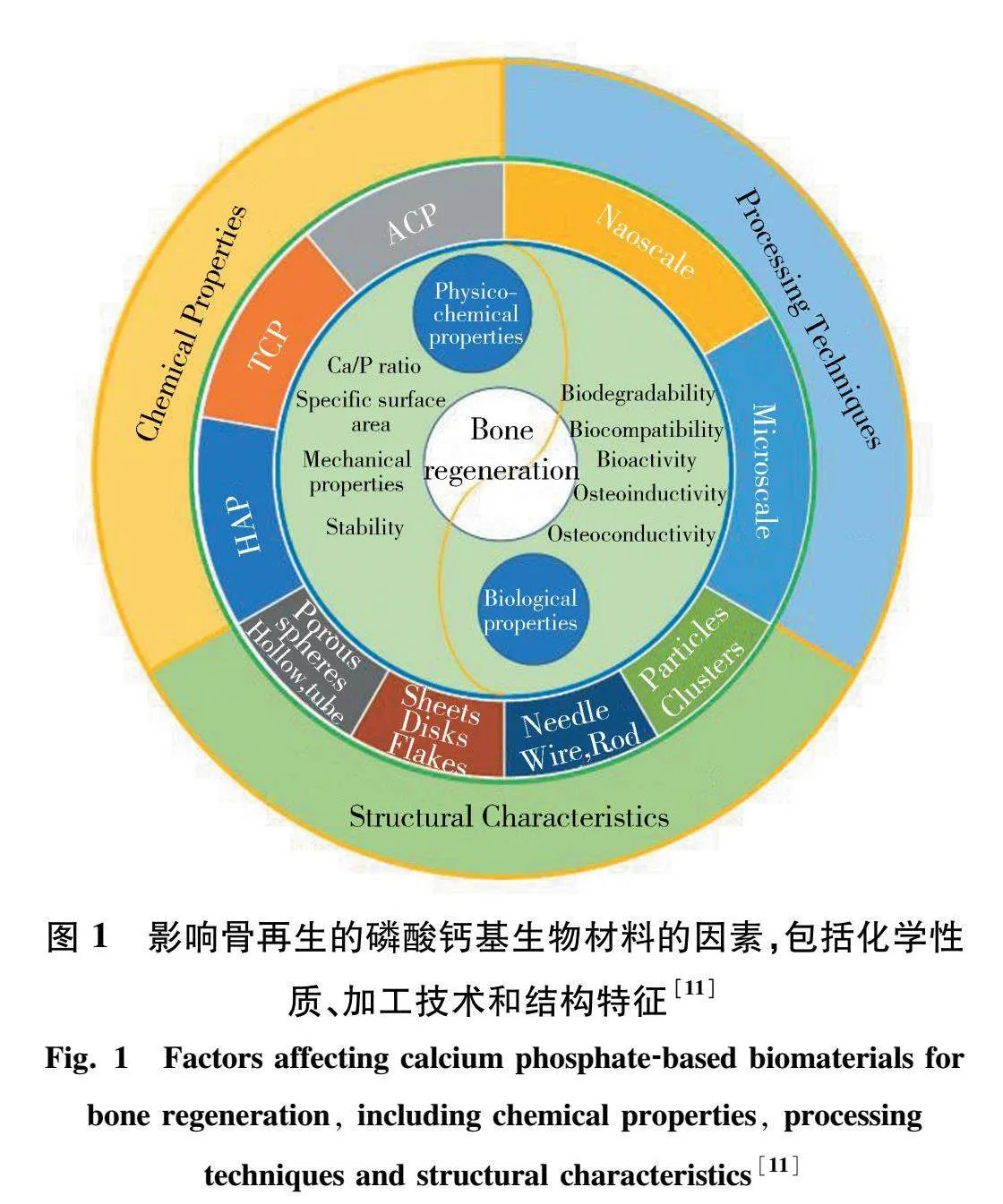
由于人口老龄化、慢性疾病和创伤治疗需求的增加,以及手术数量的上升、医疗技术的进步和医疗器械需求的增长等多重因素的影响,生物材料的市场需求正在迅速扩大[1-3].钙磷基生物陶瓷材料是生物医用陶瓷材料中的一类重要材料,因其与人体骨组织的成分相似,具有良好的生物相容性和生物活性,广泛应用于骨修复和替代等骨组织工程领域[4-7].主要的钙磷基生物陶瓷材料包括羟基磷灰石(Ca10(PO4)6(OH)2,简写为HAP)、磷酸三钙(Ca3(PO4)2,简写为TCP)、无定型磷酸钙(ACP)以及双相磷酸钙(BCP)等.大量研究表明,通过优化其组成和结构,能够使性能得以提升,更好地满足各种临床需求[8-9].图1总结了影响骨再生的磷酸钙基生物材料的因素,包括化学性质、加工技术和结构特征.这些操作包括调整材料的钙磷比例、引入其他生物活性元素、控制材料的晶体结构和孔隙度等方法[10-13].此外,通过与其他生物材料复合,也能更进一步提升其在复杂骨修复和再生中的应用效果[14-15].这些创新和改进使得钙磷基生物陶瓷材料在临床应用中表现出更加优异的性能,并不断推动骨科和牙科医学的进步.
然而,基于“试错法”的传统实验方法往往受到成本高昂、时间耗费长和极端试验条件等因素的限制[16].近年来,材料基因组计划的提出,强调了计算在新材料研究和开发中的贡献[17-18].科学计算在新材料的发现和开发方面取得了巨大的成功,材料计算已经成为材料科学与技术的一个重要分支,直接或间接地参与了一些新材料的开发,如拓扑绝缘体、锂离子电池材料和低维纳米材料等[16,19],计算模拟几乎服务于材料开发链的所有阶段.考虑到材料的多尺度本征特性,需要在材料计算领域引入多尺度计算技术.多尺度计算模拟有助于研究人员明智地计划和执行必要的实验,从而节省时间和资源.同时,材料的纳米尺度特性影响其宏观性能[20-21].在这种情况下,计算模拟方法的出现为材料的研究提供了一种全新的途径,有助于建立结构或组成与材料内在性能之间的关系.基于第一性原理计算的密度泛函理论已被证明可以揭示与电子结构相关的生物医学特性,分子动力学全原子模拟方法可用于研究生物材料和生物大分子的相互作用机制[22].因此,通过计算机模拟的方式,可以对钙磷基生物陶瓷材料的结构、性能和相互作用等进行深入理解,为其设计、优化和应用提供重要的参考和指导.
本综述探讨了钙磷基生物陶瓷材料理论模拟的最新研究进展和面临的挑战.首先,介绍了常见的钙磷基生物陶瓷材料,如羟基磷灰石、磷酸三钙和双相磷酸钙陶瓷材料.接着,详细介绍了常用的理论模拟方法,包括密度泛函理论和分子动力学模拟,以及它们在钙磷基生物陶瓷材料中的应用,涵盖了力学性能、生物相容性评估以及与机器学习结合等方面的研究进展.随后,总结了当前的研究成果和突破,并探讨了未来可能面临的挑战和发展方向.希望本综述能为钙磷基生物陶瓷材料的设计和开发提供有价值的参考和启示,促进该领域的进步和发展.
1 钙磷基生物陶瓷材料介绍
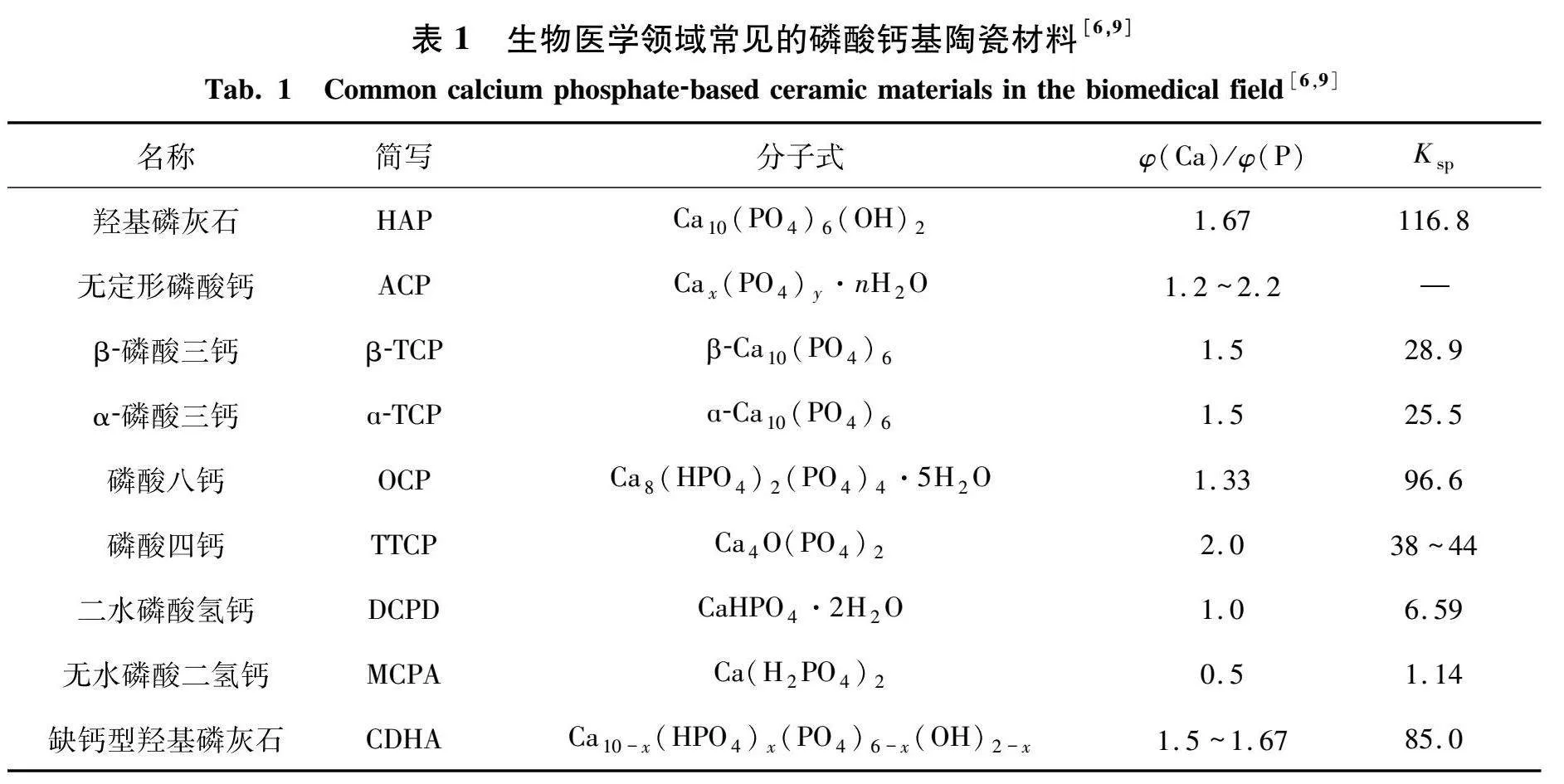
在生物体内,骨骼和牙齿中的无机矿物质是钙磷质量分数比小于1.67的碳酸化羟基磷灰石[23-24].钙磷基生物陶瓷材料由于其结构和化学组成与人体骨骼和牙齿相似,成为整形外科和牙科手术中理想的骨替代物.此外,这些材料具有高孔隙率,能够提高自身的降解速率,增大与体液的接触表面积,从而促进细胞黏附和血管生成[25].同时,材料的溶解会释放钙离子和磷酸根离子,导致离子浓度局部升高,从而影响成骨细胞的分化和骨诱导过程[8].表1列出了生物医学领域常见的磷酸钙基陶瓷材料的标准缩写及其活度积等.
羟基磷灰石(hydroxyapatite,HAP)是一种重要的生物活性陶瓷材料,同时也是骨骼和牙齿中主要的无机成分.HAP陶瓷材料具有无毒性,并且在植入体内后可以诱导骨组织再生.因此,在骨组织工程中被广泛用作骨填料和骨补充剂的组成部分[26].HAP在常温下以单斜晶相(P21/c)存在,晶胞参数a=b=0.942 nm,c=0.689 nm[27].HAP晶胞中的Ca2+有Ca(I)、Ca(II)2种位点,其中Ca(I)位点由4个Ca2+所占据,Ca(II)位点由6个Ca2+占据.2种不同位置的钙位点可以被大多数重金属离子所替代,例如Zn2+、Cd2+、Cu2+等.同时,HAP中的阴离子也可以被其他阴离子取代,如PO3-4被CO2-3或HCO-3等阴离子所取代,OH-也能够被F-或Cl-所取代.HAP发生离子取代后,其性能会根据具体取代的离子种类发生显著变化.这些变化可以用于定制HAP的特性,以满足特定的临床需求[26].在临床应用中,HAP一方面常被用作骨水泥或填充剂的主要成分[28],另一方面也可以以生物陶瓷和支架的形式直接用作植入物,进行骨诱导作用[29].此外,为了满足植入物的长期机械稳定性要求,通常通过等离子喷涂、电化学沉积等方法,在金属材料表面覆盖HAP涂层,以增强惰性金属材料与周围组织的结合度[30].
磷酸三钙(tricalcium phosphate,TCP)是一种生物可吸收陶瓷材料,钙磷质量分数比为1.5,溶解度大于HAP[31].TCP主要包括3种晶型:α相、α′相和β相.在低于1 125 ℃时主要以β-TCP形式存在,并随着温度升高,β-TCP会依次变成α-TCP和α′-TCP相[32].β-TCP晶体属于三方晶系,空间群为R3c.由于磷酸三钙具有较高的降解性能,所以具有更快的离子释放速度,使得局部溶液环境离子浓度更快升高;但也因此,其在体液中的稳定性较差,难以与新骨的生长速率相匹配,并且难以达到植入材料应有的机械强度[5-9].通常β-TCP以双相复合材料的形式应用于临床研究,以期通过组合不同材料的特性来优化其生物性能和降解速率,进而能够更好地支持新骨组织的生长和骨替代过程.
双相磷酸钙(biphasic calcium phosphate,BCP)由2种独立磷酸钙相组成的复合生物陶瓷材料,最常见的BCP主要由不同比例的HAP和β-TCP组成[10,33-35].结合HAP的高生物稳定性和β-TCP的可降解性,兼具两者的优点,通过调节HAP和β-TCP的比例,BCP的降解速率和生物活性可以得到优化,从而更好地匹配新骨的生长速度,促进骨组织的再生和修复[35-36].因此,BCP被认为是骨替代物的金标准[10,34].BCP支架被证明具有高度的生物相容性,可以支持成骨细胞的附着、增殖和分化.同时,BCP可以应用于较大的骨缺损,在一些承重区域,作为定制件可在很长一段时间内保持其形状,例如用于牙种植体放置的窦底抬高和填充牙根管等[34].BCP除了可以通过混合HAP和TCP来生产,也可以通过化学方法在高温下烧结CDHAs来得到2种不同相的混合物[37-38].虽然实验上对BCP的研究很多,但BCP的组成比例与细胞行为之间的关系是复杂的,对于临床应用BCP中HAP/β-TCP两相的理想比例还没有普遍的共识,需要进一步制定标准化的材料制备、表征和生物行为分析方案[10].
2 钙磷基生物陶瓷材料计算模拟的研究进展
钙磷基生物陶瓷材料在临床应用中需要具备一系列关键性能,以确保其有效性和安全性.首先,材料必须具有良好的生物相容性,以避免引起免疫排斥反应[8].这就需要对磷酸钙基陶瓷材料和生物小分子、蛋白等结合进行研究.其次,材料应具有足够的机械强度,以提供必要的支撑和稳定性,特别是在承受压力和负荷的骨修复部位[39].另外,高孔隙率和适宜的孔径结构也是关键特征,有助于血管生成和细胞内生,促进新骨组织的生长和整合[40-42].
虽然在实验上对磷酸钙基生物陶瓷材料的生物相容性、力学性能、成骨性能等进行了大量研究,但实验受限于高昂的成本、长时间周期以及苛刻的条件,并且难以解析材料在原子和分子水平上的行为和机制.计算模拟可以弥补这些不足,通过高精度的计算和模拟技术,如密度泛函理论(DFT)[43]、分子动力学(MD)[44]和机器学习(ML)[45]等,研究者能够深入了解材料的成核、生长、降解等微观过程.这些模拟不仅能提供对实验数据的支持和验证,还可以预测和优化材料性能,指导实验设计,缩短研发周期,提高效率[16,46].因此,计算模拟在推动磷酸钙基生物陶瓷材料的发展中发挥着不可或缺的作用.目前,大部分的计算研究尺度集中在全原子内.本节概述了使用DFT、MD和ML等计算模拟方法在磷酸钙基陶瓷材料研究中的进展.
2.1 密度泛函理论(density functional theory,DFT) 第一性原理计算是一种基于基本物理定律、不依赖经验参数的方法,通过物理理论和数学模型来预测和理解材料的性质和行为.它能够计算电子结构、能量状态、材料稳定性、化学反应路径和力学性能等,为材料设计、性能优化和新材料发现提供重要的理论支撑和精确的数据参考[47].目前,DFT是第一性原理计算方法中最主要的工具.DFT通过Kohn-Sham方程[48],将第一性原理计算问题转化为对系统中电子相互作用的交换关联项的精确描述和求解.为了适应不同的研究需求,科学家们已经开发了200多种精度不同的泛函.
DFT计算研究对钙磷基陶瓷材料主要涉及:电子结构与态密度分析、离子取代和掺杂效应、表界面能量计算[49]、缺陷分析、力学性能和热力学性质计算等方面.其中,由于离子在晶格结构中的掺杂取代对其性能影响很大,在过去的几年里,许多磷酸钙基陶瓷材料晶格离子掺杂的研究,特别是对HAP的离子掺杂,都是研究的热点[50-56].针对Ca2+位点的掺杂取代,主要是Sr2+,Mg2+和Zn2+等二价金属阳离子.Liu等[50]采用第一性原理的方法,研究讨论了锶掺杂HAP的性质,发现锶离子的加入能够降低HAP的刚度,增加材料的延展性.Bystrov等[51]证明了随着取代次数的增加,HAP的晶胞参数和体积逐渐减小,力学性能也与Mg2+插入的位置有关.同时,他们还发现间隙能级的位置对Mg掺杂非常敏感,这表现出了选择性控制材料光学性质的可能性,这在Klinkla等[53]的研究中也有报道,即HAP掺杂离子为改善其光催化性能提供了一条潜在的途径.除了Ca2+位点的掺杂、取代,PO3-4和OH-也能被F-,CO2-3,SiO4-4等取代[54-56].Astala等[54]研究发现,最稳定的取代方式是一个碳酸根进行磷酸根取代的同时引入一个钙离子空穴和一个氢原子,氢原子可以和邻近的磷酸根成键.Makshakova等[55]在DFT水平上的计算结果表明,CO2-3和Mg2+共掺杂HAP比单独掺杂碳酸盐或镁离子更有能量增益效果.
2.2 分子动力学模拟(molecular dynamics,MD) 分子动力学模拟是一种通过计算原子和分子的运动来研究物质行为的方法.基于经典力学原理,MD模拟通过求解牛顿运动方程来追踪每个粒子的运动轨迹,从而揭示系统在特定条件下的动态演化过程[44].该方法能够模拟和预测物质在不同温度、压力和时间尺度下的结构和动力学性质.MD模拟提供了连接材料微观结构和宏观性能的桥梁,由于其对微观结构和原子尺度过程的成功描述,广泛应用在材料科学、生物物理、化学等领域[57].
势函数的选择是MD模拟的关键因素之一,它直接决定了仿真结果的合理性和可靠性.因此,选择合适的力场和模拟参数对于获得可靠的结果至关重要.目前,适用于磷酸钙基陶瓷材料的力场主要有Buckingham力场[58]、BMH力场[59]和IFF力场[60-61].其中,HAP体相的性质适合用BMH力场描述,而界面性质更适合采用IFF力场描述[60-61].由IFF力场计算的HAP的晶格常数、结构和力学性能数据和变化趋势与实验测量相符;同时,HAP晶面与水界面的性质也与实验观察一致[60-61].目前,文献[62-63]报道已表明,采用IFF力场对β-TCP和BCP的物理化学性质、力学性能等计算也能很好地贴近宏观实验.此外,IFF力场具有很好的兼容性,可以与其他如CHARMM、AMBER、GROMACS、PCFF、CFF、CVFF、DREIDING和OPLS-AA等力场结合使用,因此适用于多种磷灰石材料的界面研究[60-61].
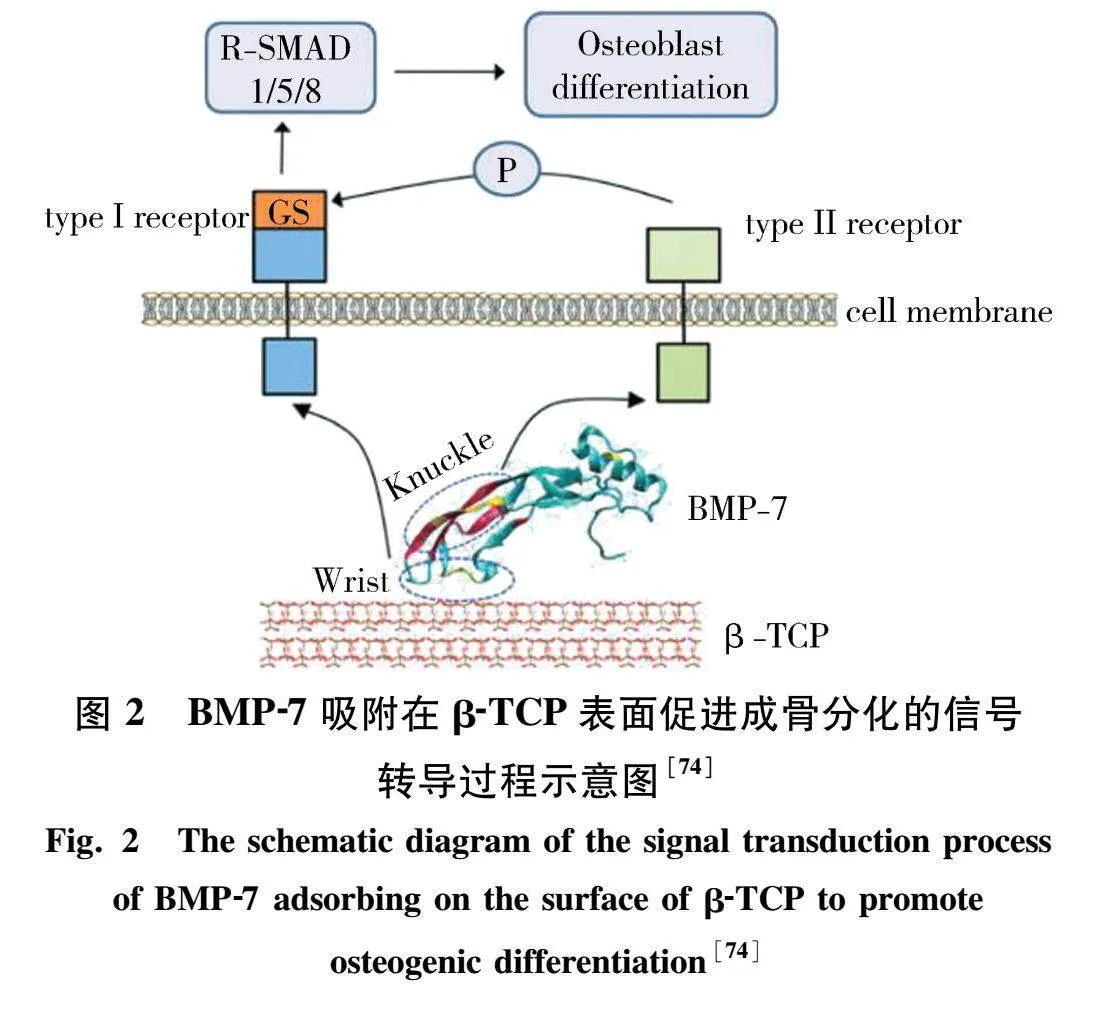
近年来,MD模拟在揭示磷酸钙基陶瓷材料的物理化学性质、成核行为、界面行为和与蛋白质、氨基酸相互作用机制等方面发挥了重要作用.Wu等[64]和Xie等[65]通过模拟退火方法研究了HAP块体的表面结构,利用结构分析方法比较了退火结构与晶体结构的差异.Hu等[62]通过MD模拟发现β-TCP的非晶态表面结构具有明显的纳米沟槽,这可能有利于生物分子的吸附和生物活性的增强.文献[63,66]通过voronoi tessellation(VT)方法结合模拟退火MD,建立了更贴近实际BCP结构的(含孔)纳米BCP模型,并对其物理化学性质、力学性能、晶界性质进行了详细研究,进一步展示了BCP在纳米尺度下的结构和性能.除了在模型构建方面的研究之外,磷酸钙基陶瓷材料表面相互作用的研究也取得了许多进展.Sahai课题组[67-72]针对HAP-水表面进行了大量研究,详细讨论了水在HAP表面以及介孔模型中的传输方式.Xu课题组[73-74]对HAP和β-TCP与BMP蛋白家族的相互作用进行了详细研究,为磷酸钙基陶瓷材料的骨诱导性提供了原子和分子水平的信息,图2为该小组提出的BMP-7吸附在β-TCP表面促进成骨分化的信号转导过程示意图.同时,该小组[75-80]也进行了HAP的成核与矿化过程研究,为生物材料的开发提供了新的思路和方法,有利于加速生物材料的开发和优化.
2.3 机器学习(machine learning,ML) 机器学习是一种利用数据和算法从大型数据集中学习数据中的隐藏模式和关系,旨在构造模型来将一些输入变量(描述符)与系统的输出(目标性质)相关联的人工智能方法[45].ML在材料科学中日益受到重视,因其可以处理大规模数据,发现传统方法难以察觉的潜在规律,从而加速材料设计和优化过程.目前ML已成功应用于药物分子[81]、高分子[82]和能源相关材料[83]等领域.在钙磷基陶瓷材料领域,通过实验数据进行机器学习分析预测材料性能的研究已有报道.Horikawa等[84]利用ML成功地构建了从材料的制造条件预测材料的性能和从材料的性能和体内实验条件预测骨形成速率的模型,提出了实现骨形成率目标值的候选材料制造条件,并成功用ML预测得出了和动物实验一致的结果.Yu等[85]进行了取代羟基磷灰石的力学合成和结构特征建模,该模型能够根据材料的化学成分准确地预测材料的结构特征,从而节省大量的时间和成本.
在磷酸钙基陶瓷材料的研究中,将机器学习方法与DFT、MD计算等技术结合,展示了材料设计的显著优势[16,86].Wang等[87]将第一性原理和机器学习算法相结合,研究了掺杂Zn2+的HAP机制,提供了一种有效的方法来定位HAP掺杂体系中可能的优化结构.Hartnett等[88]将ML和DFT方法相结合,并利用实验数据,以预测热力学稳定的含碘磷灰石结构.Wang等[89]采用ML辅助MD来分析具有缺陷的HAP在烧结过程中的结构变化,并采用第一性原理反应机制计算,探讨了甲烷在HAP不同烧结表面上的催化机制,其结果挑战了活性位点仅局限于HAP表面的流行观点,有利于设计和合成性能更高、效率更高的新型电催化剂.
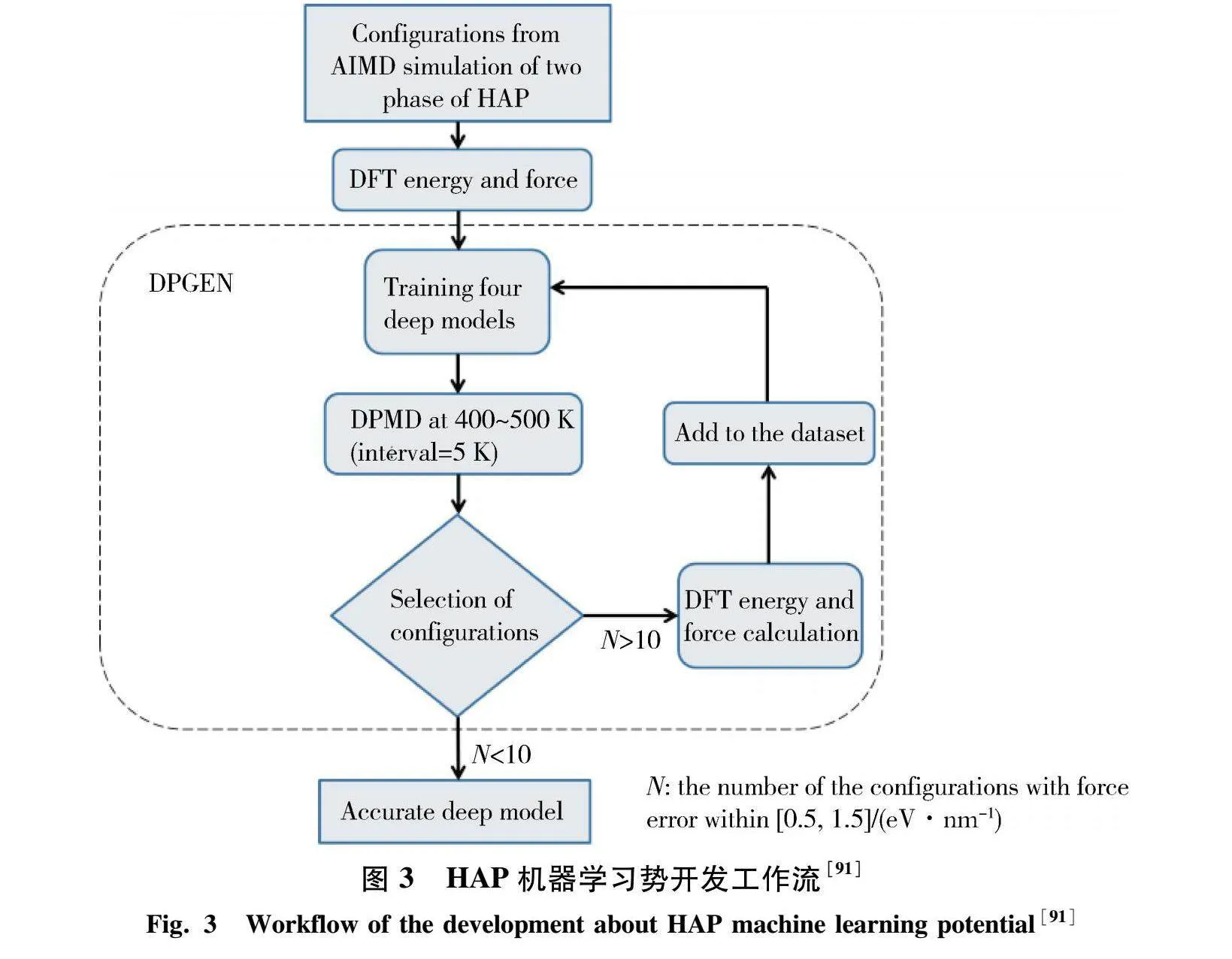
随着计算方法的发展,机器学习势能(machine learning potentials,MLPs)逐渐成为材料科学研究中的一个重要工具[90].传统的势能模型,如经典力场和密度泛函理论(DFT),在描述材料的微观行为和预测材料性能方面取得了显著成功.然而,这些方法通常需要大量的计算资源,并且在处理复杂的化学环境时,可能存在精度和适用范围的限制.机器学习势能通过利用大规模数据训练模型,可以在保证较高精度的同时,大幅提升计算效率,克服传统方法的一些局限性.Wang等[91]利用主动学习算法开发了HAP的机器学习原子势,该算法在描述HAP的OH-时达到了密度泛函理论级的精度,其工作流如图3所示.
3 总结与展望
钙磷基陶瓷材料的计算研究近年来取得了显著进展,主要得益于第一性原理、分子动力学和机器学习等方法的应用.DFT计算在揭示材料的电子结构和掺杂效应方面发挥了关键作用,为理解材料的基础性质提供了理论支持.MD模拟则在研究材料的动力学行为、界面相互作用及力学性能方面表现出色,通过原子级别的模拟揭示了材料的微观机制.机器学习方法的引入,为处理大规模数据、预测材料性能和加速材料设计带来了新的契机.但仍需注意的是,生物陶瓷材料的主要应用场景为人体,故不能忽略其宏观尺度的结构力学性质与生理学性质(如生物相容性和组织诱导性)之间的关联.在我们看来,针对生物陶瓷材料的计算模拟还有如下一些挑战值得关注.
1) 新的计算模型.必须明确的是,当生物陶瓷材料植入人体后,与植入环境的相互作用表面并非简单的单一晶面,可能是多晶面的组合体系,甚至是纳米多晶粒子.同时,考虑到组成成分的变化,相应的计算模型也应该随之改变,例如双相磷酸钙陶瓷或阴阳离子掺杂的磷酸钙体系等.此外,实验表明含孔结构的生物陶瓷材料具有更好的生物活性,故考虑孔结构特征的计算模型也是未来研究的方向.但这些模型的引入将需要更大的计算算力的支撑以及更加准确的力场参数.
2) 多尺度模拟磷酸钙晶体的生长过程.骨修复或生长的微观过程可视为磷酸钙晶体的生长过程,其本质为溶液相中钙离子和磷酸根离子在材料表面的聚集生长,对该过程的完整解析有助于新型生物陶瓷材料的设计.该过程涉及从电子、原子到介观尺度等多个尺度,如何在考虑复杂服役环境的同时兼顾计算精度和计算效率的条件下,实现从微观到宏观性能的全面理解,是极具挑战性的研究方向.
3) 机器学习算法的应用.机器学习方法在材料预测和设计中展示了巨大潜力,未来可以将机器学习模型应用于钙磷基生物陶瓷材料生物的相容性等生理学相关性质的预测,尤其是无法用第一性原理或分子动力学模拟计算直接获得的性质.同时,寻求实验验证以确保机器学习算法的可靠性和可行性.另外,有效地将计算模拟与实验研究相结合,形成一个相互验证、相互促进的闭环,是未来研究的重要方向.
展望未来,通过进一步优化计算方法、提升计算效率和精度,并结合实验验证,有望在钙磷基陶瓷材料的研究中取得突破性的进展,为骨组织工程等实际医疗需求,提供更加有效和可靠的新型材料.
参考文献
[1] HOLZAPFEL B M, REICHERT J C, SCHANTZ J-T, et al. How smart do biomaterials need to be? a translational science and clinical point of view[J]. Adv Drug Deliv Rev,2013,65(4):581-603.
[2] YADAV S, GANGWAR S. An overview on recent progresses and future perspective of biomaterials[J]. IOP Conference Series: Materials Science and Engineering,2018,404:012013.
[3] AL GEORGEANU V, GINGU O, ANTONIAC I V, et al. Current options and future perspectives on bone graft and biomaterials substitutes for bone repair, from clinical needs to advanced biomaterials research[J]. Appl Sci,2023,13(14):8471.
[4] TANG Z R, LI X F, TAN Y F, et al. The material and biological characteristics of osteoinductive calcium phosphate ceramics[J]. Regenerative Biomaterials,2018,5(1):43-59.
[5] ELIAZ N, METOKI N. Calcium phosphate bioceramics: a review of their history, structure, properties, coating technologies and biomedical applications[J]. Materials,2017,10(4):334.
[6] DOROZHKIN S V. Calcium orthophosphate bioceramics[J]. Ceramics International,2015,41(10):13913-13966.
[7] BLACK C R, GORIAINOV V, GIBBS D, et al. Bone tissue engineering[J]. Curr Mol Biol Rep,2015,1(3):132-140.
[8] SAMAVEDI S, WHITTINGTON A R, GOLDSTEIN A S. Calcium phosphate ceramics in bone tissue engineering: a review of properties and their influence on cell behavior[J]. Acta Biomaterialia,2013,9:8037-8045.
[9] DOROZHKIN S V. Calcium orthophosphate (CaPO4)-based bioceramics: preparation, properties, and applications[J]. Coatings,2022,12(10):1380.
[10] EBRAHIMI M, BOTELHO M G, DOROZHKIN S V. Biphasic calcium phosphates bioceramics (HA/TCP): concept, physicochemical properties and the impact of standardization of study protocols in biomaterials research[J]. Mater Sci Eng C,2017,71:1293-1312.
[11] HOU X D, ZHANG L, ZHOU Z F, et al. Calcium phosphate-based biomaterials for bone repair[J]. J Funct Biomater,2022,13(4):187.
[12] 吴家刚. 铌酸钾钠基无铅压电陶瓷的发展与展望[J]. 四川师范大学学报(自然科学版),2019,42(2):143-153.
[13] 何茗,张婷. TiO2B2O3对钛酸锂锌微波陶瓷的掺杂改性[J]. 四川师范大学学报(自然科学版),2021,44(1):99-102.
[14] KOSTAG M, EL SEOUD O A. Sustainable biomaterials based on cellulose, chitin and chitosan composites-a review[J]. Carbohydr Poly Tech,2021,2:100079.
[15] SHEKHAWAT D, SINGH A, BANERJEE M K, et al. Bioceramic composites for orthopaedic applications: a comprehensive review of mechanical, biological, and microstructural properties[J]. Ceram Int,2021,47(3):3013-3030.
[16] XU D, ZHANG Q, HUO X, et al. Advances in data-assisted high-throughput computations for material design[J]. MGE Advances,2023,1(1): e11.
[17] GREEN M L, CHOI C L, HATTRICK-SIMPERS J R, et al. Fulfilling the promise of the materials genome initiative with high-throughput experimental methodologies[J]. Appl Phys Rev,2017,4:011105.
[18] DE PABLO J J, JONES B, KOVACS C L, et al. The Materials Genome Initiative, the interplay of experiment, theory and computation[J]. Curr Opin Solid St M,2014,18(2):99-117.
[19] PENG Y H, HE C C, ZHAO Y J, et al. High-throughput computational materials screening of transition metal peroxides[J]. Phys Chem Chem Phys,2024,26(3):2093-2100.
[20] LAO J J, NAGHDI TAM M, PINISETTY D, et al. Molecular dynamics simulation of FCC metallic nanowires: a review[J]. JOM,2012,65(2):175-184.
[21] KEDHARNATH A, KAPOOR R, SARKAR A. Classical molecular dynamics simulations of the deformation of metals under uniaxial monotonic loading: a review[J]. Comput Struct,2021,254:106614.
[22] DAI X Y, CHEN Y. Computational biomaterials: computational simulations for biomedicine[J]. Adv Mater,2023,35(7):e2204798.
[23] CHAI Y C, CARLIER A, BOLANDER J, et al. Current views on calcium phosphate osteogenicity and the translation into effective bone regeneration strategies[J]. Acta Biomaterialia,2012,8(11):3876-3887.
[24] VON EUW S, WANG Y, LAURENT G, et al. Bone mineral: new insights into its chemical composition[J]. Sci Rep,2019,9(1):8456.
[25] ANSARI M. Bone tissue regeneration: biology, strategies and interface studies[J]. Prog Biomater,2019,8:223-237.
[26] KAREEM R O, BULUT N, KAYGILI O. Hydroxyapatite biomaterials: a comprehensive review of their properties, structures, medical applications, and fabrication methods[J]. J Chem Rev,2024,6(1):1-26.
[27] DOROZHKIN S V, EPPLE M. Biological and medical significance of calcium phosphates[J]. Angew Chem Int Ed,2002,41(17):3130-3146.
[28] OTSUKA M, MATSUDA Y, SUWA Y, et al. Effect of particle size of metastable calcium phosphates on mechanical strength of a novel self-setting bioactive calcium phosphate cement[J]. J Biomed Mater Res,1995,29(1):25-32.
[29] HABIBOVIC P, YUAN H P, VAN DER VALK C M, et al. 3D microenvironment as essential element for osteoinduction by biomaterials[J]. Biomaterials,2005,26(17):3565-3575.
[30] KOKUBO T, KIM H M, KAWASHITA M, et al. Bioactive metals: preparation and properties[J]. J Mater Sci-Mater M,2004,15(2):99-107.
[31] YUAN H P, DE BRUIJN J D, LI Y B, et al. Bone formation induced by calcium phosphate ceramics in soft tissue of dogs: a comparative study between porous α-TCP and β-TCP[J]. J Mater Sci-Mater M,2001,12(1):7-13.
[32] YIN X L, STOTT M J, RUBIO A. α-and β-tricalcium phosphate: a density functional study[J]. Phys Rev B,2003,68(20):205205.
[33] RAMAY H R R, ZHANG M. Biphasic calcium phosphate nanocomposite porous scaffolds for load-bearing bone tissue engineering[J]. Biomaterials,2004,25(21):5171-5180.
[34] DOROZHKIN S V. Biphasic, triphasic and multiphasic calcium orthophosphates[J]. Acta Biomater,2012,8(3):963-977.
[35] BOULER J M, PILET P, GAUTHIER O, et al. Biphasic calcium phosphate ceramics for bone reconstruction: a review of biological response[J]. Acta Biomater,2017,53:1-12.
[36] BARADARARAN S, HAMDI M, METSELAAR I H. Biphasic calcium phosphate (BCP) macroporous scaffold with different ratios of HA/β-TCP by combination of gel casting and polymer sponge methods[J]. Adv Appl Ceram,2013,111(7):367-373.
[37] LEGEROS R Z, LIN S, ROHANIZADEH R, et al. Biphasic calcium phosphate bioceramics: preparation, properties and applications[J]. J Mater Sci-Mater M,2003,14(3):201-209.
[38] LIN S J, LEGEROS R Z, ROHANIZADEH R, et al. Biphasic calcium phosphate (BCP) bioceramics: preparation and properties[J]. Key Eng Mater,2003,240/241/242:473-476.
[39] O'BRIEN F J. Biomaterials amp; scaffolds for tissue engineering[J]. Mater Today,2011,14:88-95.
[40] KARAGEORGIOU V, KAPLAN D. Porosity of 3D biomaterial scaffolds and osteogenesis[J]. Biomaterials,2005,26(27):5474-5491.
[41] EBRAHIMI M. Porosity parameters in biomaterial science: definition, impact, and challenges in tissue engineering[J]. Front Mater Sci,2021,15(3):352-373.
[42] MAKSOUD F J, VELZQUEZ DE LA PAZ M F, HANN A J, et al. Porous biomaterials for tissue engineering: a review[J]. J Mater Chem B,2022,10(40):8111-8165.
[43] SHOLL D S, STECKEL J A. Density functional theory: a practical introduction[M]. Hoboken: John Wiley amp; Sons,2011.
[44] KUMAR H, MAITI P K. Introduction to molecular dynamics simulation[M]//Computational Statistical Physics. Cambridge: Cambridge University Press,2019:161-197.
[45] MAHESH B. Machine learning algorithms: a review[J]. Int J Sci Res,2020,9(1):381-386.
[46] DEMIR H, DAGLAR H, GULBALKAN H C, et al. Recent advances in computational modeling of MOFs: from molecular simulations to machine learning[J]. Coordin Chem Rev,2023,484:215112.
[47] FREYSOLDT C, GRABOWSKI B, HICKEL T, et al. First-principles calculations for point defects in solids[J]. Rev Mod Phys,2014,86(1):253-305.
[48] KOHN W, SHAM L J. Self-consistent equations including exchange and correlation effects[J]. Phys Rev,1965,140(4A): A1133-A1138.
[49] CHIATTI F, DELLE PIANE M, UGLIENGO P, et al. Water at hydroxyapatite surfaces: the effect of coverage and surface termination as investigated by all-electron B3LYP-D* simulations[J]. Theor Chem Acc,2016,135(3):54.
[50] LIU Q Y, XUE Z Y, XU D G. Molecular dynamics characterization of Sr-doped biomimetic hydroxyapatite nanoparticles[J]. J Phys Chem C,2020,124(36):19704-19715.
[51] BYSTROV V S, PARAMONOVA E V, AVAKYAN L A, et al. Effect of magnesium substitution on structural features and properties of hydroxyapatite[J]. Materials (Basel),2023,16(17):5945.
[52] THIYAGARAJAN P, SHANMUGHARAJ A M, ALAGESAN T, et al. DFT theoretical and experimental studies unraveling the structural and electronic properties of niobium doped calcium apatite ceramics[J]. Mater Today Commun,2023,35:105873.
[53] KLINKLA R, KAEWMARAYA T, BOOTCHANON A, et al. Effects of Sr and Mg doping on elastic, mechanical, and optical properties of hydroxyapatite: a first-principles study[J]. Results Phys,2024,57:107352.
[54] ASTALA R, STOTT M J. First principles investigation of mineral component of bone: CO3 substitutions in hydroxyapatite[J]. Chem Mater,2005,17(16):4125-4133.
[55] MAKSHAKOVA O N, GAFUROV M R, GOLDBERG M A. The mutual incorporation of Mg2+and CO2-3 into hydroxyapatite: a DFT study[J]. Materials (Basel),2022,15(24):9046.
[56] MENNDEZ-PROUPIN E, CERVANTES-RODRGUEZ S, OSORIO-PULGAR R, et al. Computer simulation of elastic constants of hydroxyapatite and fluorapatite[J]. J Mech Behav Biomed Mater,2011,4(7):1011-1020.
[57] HOSPITAL A, GOI J R, OROZCO M, et al. Molecular dynamics simulations: advances and applications[J]. Adv Appl Bioinform Chem,2015,8:37-47.
[58] DE LEEUW N H. A computer modelling study of the uptake and segregation of fluoride ions at the hydrated hydroxyapatite (0001) surface: introducing a Ca10(PO4)6(OH)2 potential model[J]. Phys Chem Chem Phys,2004,6(8):1860-1866.
[59] HAUPTMANN S, DUFNER H, BRICKMANN J, et al. Potential energy function for apatites[J]. Phys Chem Chem Phys,2003,5(3):635-639.
[60] HEINZ H, LIN T J, MISHRA R K, et al. Thermodynamically consistent force fields for the assembly of inorganic, organic, and biological nanostructures: the INTERFACE force field[J]. Langmuir,2013,29(6):1754-1765.
[61] LIN T J, HEINZ H. Accurate force field parameters and pH resolved surface models for hydroxyapatite to understand structure, mechanics, hydration, and biological interfaces[J]. J Phys Chem C,2016,120(9):4975-4992.
[62] HU C F, XUE Z Y, WANG X, et al. Molecular dynamics exploration of the amorphous surface structures and properties of the biomimetic β-tricalcium phosphate[J]. Appl Surf Sci,2019,484:72-82.
[63] ZHANG Q, XUE Z Y, WANG X, et al. Molecular dynamics dimulation of biomimetic biphasic calcium phosphate nanoparticles[J]. J Phys Chem B,2022,126(46):9726-9736.
[64] WU H, XU D G, YANG M L, et al. Surface structure of hydroxyapatite from simulated annealing molecular dynamics simulations[J]. Langmuir,2016,32:4643-4652.
[65] XIE Q, XUE Z Y, GU H J, et al. Molecular dynamics exploration of ordered-to-disordered surface structures of biomimetic hydroxyapatite nanoparticles[J]. J Phys Chem C,2018,122(12):6691-6703.
[66] ZHANG Q, WANG X, YANG M L, et al. Effects of void defects on the mechanical properties of biphasic calcium phosphate nanoparticles: a molecular dynamics investigation[J]. J Mech Behav Biomed Mater,2024,151:106385.
[67] ZHAO W L, XU Z J, YANG Y, et al. Surface energetics of the hydroxyapatite nanocrystal-water interface: a molecular dynamics study[J]. Langmuir,2014,30(44):13283-13292.
[68] PHAM T T, LEMAIRE T, CAPIEZ-LERNOUT E, et al. Properties of water confined in hydroxyapatite nanopores as derived from molecular dynamics simulations[J]. Theor Chem Acc,2015,134(5):59.
[69] DI TOMMASO D, PRAKASH M, LEMAIRE T, et al. Molecular dynamics simulations of hydroxyapatite nanopores in contact with electrolyte solutions: the effect of nanoconfinement and solvated ions on the surface reactivity and the structural, dynamical, and vibrational properties of water[J]. Crystals,2017,7(2):57.
[70] PRAKASH M, LEMAIRE T, CARUEL M, et al. Anisotropic diffusion of water molecules in hydroxyapatite nanopores[J]. Phys Chem Miner,2017,44(7):509-519.
[71] PRAKASH M, LEMAIRE T, DI TOMMASO D, et al. Transport properties of water molecules confined between hydroxyapaptite surfaces: a molecular dynamics simulation approach[J]. Appl Surf Sci,2017,418:296-301.
[72] HONRIO T, LEMAIRE T, TOMMASO D D, et al. Anomalous water and ion dynamics in hydroxyapatite mesopores[J]. Comp Mater Sci,2019,156:26-34.
[73] GU H J, XUE Z Y, WANG M H, et al. Effect of hydroxyapatite surface on BMP-2 biological properties by docking and molecular simulation approaches[J]. J Phys Chem B,2019,123(15):3372-3382.
[74] ZHAO X Y, XUE Z Y, WANG K F, et al. Molecular docking and molecular dynamics simulation studies on the adsorption/desorption behavior of bone morphogenetic protein-7 on the beta-tricalcium phosphate surface[J]. Phys Chem Chem Phys,2020,22(29):16747-16759.
[75] XUE Z, YANG M, XU D. Nucleation of biomimetic hydroxyapatite nanoparticles on the surface of type I collagen: molecular dynamics investigations[J]. J Phys Chem C,2019,123(4):2533-2543.
[76] TAN X H, XUE Z Y, ZHU H, et al. How charged amino acids regulate nucleation of biomimetic hydroxyapatite nanoparticles on the surface of collagen mimetic peptides: molecular dynamics and free energy investigations[J]. Cryst Growth Des,2020,20(7):4561-4572.
[77] WANG W T , XUE Z Y, WANG R H, et al. Molecular dynamics exploration of the growth mechanism of hydroxyapatite nanoparticles regulated by glutamic acid[J]. J Phys Chem B,2021,125(19):5078-5088.
[78] XUE Z Y, WANG X, XU D G. Molecular investigations of the prenucleation mechanism of bone-like apatite assisted by type I collagen nanofibrils: insights into intrafibrillar mineralization[J]. Phys Chem Chem Phys,2022,24(31):18931-18942.
[79] XUE Z Y, WANG X, XU D G. Molecular dynamic simulation of prenucleation of apatite at a type I collagen template: ion association and mineralization control[J]. Phys Chem Chem Phys,2022,24(18):11370-11381.
[80] QIN D X, XUE Z Y, DU M, et al. Molecular dynamics exploration of ion association mechanism of apatite controlled by a nanogrooved hydroxyapatite surface[J]. Appl Surf Sci,2023,617:156580.
[81] STOKES J M, YANG K, SWANSON K, et al. A deep learning approach to antibiotic discovery[J]. Cell,2020,181(2):475-483.
[82] CHEN G, SHEN Z Q, IYER A, et al. Machine-learning-assisted De Novo design of organic molecules and polymers: opportunities and challenges[J]. Polymers (Basel),2020,12(1):163.
[83] YAO Z P, LUM Y, JOHNSTON A, et al. Machine learning for a sustainable energy future[J]. Nat Rev Mater,2023,8(3):202-215.
[84] HORIKAWA S, SUZUKI K, MOTOJIMA K, et al. Material design of porous hydroxyapatite ceramics via inverse analysis of an estimation model for bone-forming ability based on machine learning and experimental validation of biological hard tissue responses[J]. Materials (Basel),2024,17(3):571.
[85] YU J W, WANG Y, DAI Z Q, et al. Structural features modeling of substituted hydroxyapatite nanopowders as bone fillers via machine learning[J]. Ceram Int,2021,47(7):9034-9047.
[86] GREENER J G, KANDATHIL S M, MOFFAT L, et al. A guide to machine learning for biologists[J]. Nat Rev Mol Cell Biol,2022,23(1):40-55.
[87] WANG J, WANG R H, YANG M L, et al. Understanding zinc-doped hydroxyapatite structures using first-principles calculations and convolutional neural network algorithm[J]. J Mater Chem B,2022,10(8):1281-1290.
[88] HARTNETT T Q, AYYASAMY M V, BALACHANDRAN P V. Prediction of new iodine-containing apatites using machine learning and density functional theory[J]. MRS Commun,2019,9(3):882-890.
[89] WANG J, YAN X R, WANG X, et al. Selective activation of methane on hydroxyapatite surfaces: insights from machine learning and density functional theory[J]. Nano Energy,2024,127:109762.
[90] BEHLER J. Perspective: machine learning potentials for atomistic simulations[J]. J Chem Phys,2016,145(17):170901.
[91] WANG J, WANG X, ZHU H, et al. Investigating the hydroxyl reorientation in hydroxyapatite using machine learning potentials[J]. J Phys Chem C,2023,127(23):11369-11377.
The Progress and Challenges in Computational Simulation of Calciumphosphorus-based Bioceramics
ZHANG Qiao, XU Dingguo
(College of Chemistry, Sichuan University, Chengdu 610064, Sichuan)
Calciumphosphorus-based (CaP) bioceramic materials demonstrate significant potential in the biomedical field, particularly for bone repair and replacement. Traditional experimental methods are often constrained by long durations, high costs, and stringent conditions. The introduction of computational simulation technology plays a crucial role in understanding and optimizing the performance of CaP bioceramic materials. The progress in the computational simulation of CaP bioceramic materials is reviewed in this paper, drawing on both domestic and international research as well as recent work from our group. The numerous challenges currently faced in this area are highlighted. Finally, the future development of this field is anticipated, and the importance of advanced computational methods combined with experimental verification is emphasized. This is expected to further promote the application and development of CaP bioceramic materials in biomedicine.
bioceramic materials; computational simulation; bone tissue engineering; hydroxyapatite
(编辑 郑月蓉)
